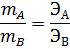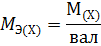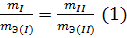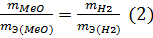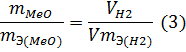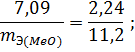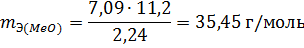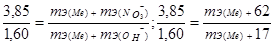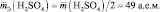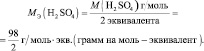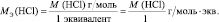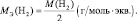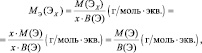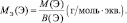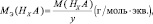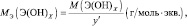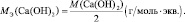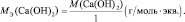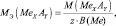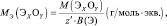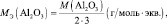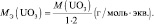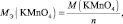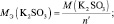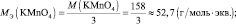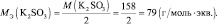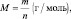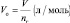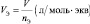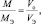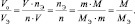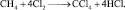в чем измеряется масса эквивалента
ЭКВИВАЛЕНТНАЯ МАССА
Полезное
Смотреть что такое «ЭКВИВАЛЕНТНАЯ МАССА» в других словарях:
эквивалентная масса — 4.1.3 эквивалентная масса: Масса условного ударника, вычисленная путем деления на ускорение свободного падения измеренного значения силы (в ньютонах), направленной вдоль вертикально расположенной оси ударника и необходимой для удержания плеча… … Словарь-справочник терминов нормативно-технической документации
эквивалентная масса — lygiavertė masė statusas T sritis Standartizacija ir metrologija apibrėžtis Daugiadalelės sistemos arba iš kelių dalių sudaryto kūno masė, apskaičiuota pagal tam tikras taisykles arba formules. atitikmenys: angl. equivalent mass vok. äquivalente… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
эквивалентная масса — ekvivalentinė masė statusas T sritis fizika atitikmenys: angl. equivalent mass vok. äquivalente Masse, f rus. эквивалентная масса, f pranc. masse équivalente, f … Fizikos terminų žodynas
ЭКВИВАЛЕНТНАЯ ПЛОТНОСТЬ — масса глаза на единицу площади зрения, спроецированной на оптическую поверхность … Словарь понятий и терминов, сформулированных в нормативных документах российского законодательства
приведенная масса — lygiavertė masė statusas T sritis Standartizacija ir metrologija apibrėžtis Daugiadalelės sistemos arba iš kelių dalių sudaryto kūno masė, apskaičiuota pagal tam tikras taisykles arba formules. atitikmenys: angl. equivalent mass vok. äquivalente… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
Приведённая масса — условная характеристика распределения масс в движущейся механической или смешанной (например, электро механической) системе, зависящая от физических параметров системы (масс, моментов инерции, индуктивности и др.) и от её закона движения[1].… … Википедия
Эквивалент вещества — Эквивалент вещества или Эквивалент это реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в ионообменных реакциях или электрону в окислительно восстановительных… … Википедия
ГОСТ Р 52762-2007: Методы испытаний на стойкость к механическим внешним воздействующим факторам машин, приборов и других технических изделий. Испытания на воздействие ударов по оболочке изделий — Терминология ГОСТ Р 52762 2007: Методы испытаний на стойкость к механическим внешним воздействующим факторам машин, приборов и других технических изделий. Испытания на воздействие ударов по оболочке изделий оригинал документа: 4.1.2 высота… … Словарь-справочник терминов нормативно-технической документации
Фактор эквивалентности — Эквивалент реальная или мнимая частица вещества, которая может присоединять, высвобождать или быть каким либо иным образом эквивалентна (то есть равноценна) одному иону H+ в обменных реакциях или одному электрону в окислительно восстановительных … Википедия
Эквивалент (химия) — Эквивалент реальная или мнимая частица вещества, которая может присоединять, высвобождать или быть каким либо иным образом эквивалентна (то есть равноценна) одному иону H+ в обменных реакциях или одному электрону в окислительно… … Википедия
зМБЧБ 1. пУОПЧОЩЕ ЪБЛПОЩ ИЙНЙЙ

1.1 уФЕИЙПНЕФТЙЮЕУЛЙЕ ЪБЛПОЩ
оБЙВПМЕЕ ЧБЦОПЕ РТБЛФЙЮЕУЛПЕ ЪОБЮЕОЙЕ ЙНЕАФ УМЕДХАЭЙЕ ЪБЛПОЩ ИЙНЙЙ: УФЕИЙПНЕФТЙЮЕУЛЙЕ Й ЗБЪПЧЩЕ.
лБЦДЩК ИЙНЙЮЕУЛЙК ЬМЕНЕОФ ПФМЙЮБЕФУС ПФ ДТХЗЙИ ОЕ ФПМШЛП ИЙНЙЮЕУЛЙН УЙНЧПМПН (ЛБЮЕУФЧЕООБС ИБТБЛФЕТЙУФЙЛБ), ОП ОЕЛПФПТЩНЙ ЛПМЙЮЕУФЧЕООЩНЙ РБТБНЕФТБНЙ. л ОЙН ПФОПУСФУС, РТЕЦДЕ ЧУЕЗП, БФПНОБС НБУУБ ЬМЕНЕОФБ Й ЪБТСД ЕЗП СДТБ (ЙМЙ РПТСДЛПЧЩК ОПНЕТ ЬМЕНЕОФБ). ьФЙ ИБТБЛФЕТЙУФЙЛЙ ДМС ЛБЦДПЗП БФПНБ ЬМЕНЕОФБ РТЙЧЕДЕОБ Ч рЕТЙПДЙЮЕУЛПК УЙУФЕНЕ ЬМЕНЕОФПЧ д. й. нЕОДЕМЕЕЧБ. пДОБЛП УМЕДХЕФ ПФНЕФЙФШ, ЮФП РТЙЧЕДЕООЩЕ НБУУЩ БФПНПЧ СЧМСАФУС ПФОПУЙФЕМШОЩНЙ ЧЕМЙЮЙОБНЙ (ФБЛ ОБЪЩЧБЕНЩНЙ, БФПНОЩНЙ ЕДЙОЙГБНЙ НБУУЩ ЙМЙ Б.Е.Н.). нПМЕЛХМСТОБС НБУУБИЙНЙЮЕУЛПЗП УПЕДЙОЕОЙС ФБЛЦЕ МЕЗЛП ПРТЕДЕМЙНБ, ФБЛ ЛБЛ ПОБ ТБЧОБ УХННЕ БФПНОЩИ НБУУ УПУФБЧМСАЭЙИ ДБООХА НПМЕЛХМХ БФПНПЧ.
фБЛЙН ПВТБЪПН, МАВПЕ ИЙНЙЮЕУЛПЕ УПЕДЙОЕОЙЕ ИБТБЛФЕТЙЪХЕФУС НБУУПК ПДОПЗП НПМС ЙМЙ НПМШОПК (НПМСТОПК) НБУУПК н, ЧЩТБЦБЕНПК Ч З/НПМШ. ъОБЮЙФ, н(H2O) = 18 З/НПМШ, Б н(H2SO4) = 98 З/НПМШ.
уЧСЪШ НЕЦДХ ЛПМЙЮЕУФЧПН n (Ч НПМСИ) Й НБУУПК m (Ч ЗТБННБИ) ЧЕЭЕУФЧБ ЧЩТБЦБЕФУС ЖПТНХМПК:
чПЪОЙЛБЕФ ЪБЛПОПНЕТОЩК ЧПРТПУ П ОЕПВИПДЙНПУФЙ ЧЧЕДЕОЙС ФЕТНЙОБ «НПМШОБС НБУУБ ЧЕЭЕУФЧБ» Й ЕЗП РТЙНЕОЕОЙС, ЧЕДШ ДМС ЙЪНЕТЕОЙС НБУУЩ ЧЕЭЕУФЧБ ХЦЕ ЙНЕАФУС ЧЕМЙЮЙОЩ, ЧИПДСЭЙЕ Ч УЙУФЕНХ уй: ЛЙМПЗТБНН, ЗТБНН, ФПООБ Й Ф.Д. чПРТПУ ПФРБДБЕФ, ЕУМЙ ТБУУНПФТЕФШ РТЙНЕОЕОЙЕ ДБООЩИ ЧЕМЙЮЙО РТЙ БОБМЙЪЕ ИЙНЙЮЕУЛЙИ ХТБЧОЕОЙК.
ч ПВЭЕН УМХЮБЕ ХТБЧОЕОЙЕ ИЙНЙЮЕУЛПК ТЕБЛГЙЙ ЪБРЙУЩЧБАФ Ч ЧЙДЕ

ч ЛБЮЕУФЧЕ РТЙНЕТБ ТБУУНПФТЙН РТПУФПЕ ИЙНЙЮЕУЛПЕ ЧЪБЙНПДЕКУФЧЙЕ:
дБООБС ЪБРЙУШ РПЛБЪЩЧБЕФ, ЮФП РТЙ ЧЪБЙНПДЕКУФЧЙЙ ДЧХИ НПМЕЛХМ ЗБЪППВТБЪОПЗП ЧПДПТПДБ о 2 Й ПДОПК НПМЕЛХМЩ ЗБЪППВТБЪОПЗП ЛЙУМПТПДБ п2 ПВТБЪХЕФУС ДЧЕ НПМЕЛХМЩ ЧПДЩ.
йЪ ДБООПЗП РТЙНЕТБ ЧЙДОП, ЮФП ЛПМЙЮЕУФЧП НПМШ ТЕБЗЙТХАЭЙИ Й ПВТБЪХАЭЙИУС Ч ТЕЪХМШФБФЕ ИЙНЙЮЕУЛПК ТЕБЛГЙЙ ЧЕЭЕУФЧ РТСНПРТПРПТГЙПОБМШОП ЛПЬЖЖЙГЙЕОФБН Ч ХТБЧОЕОЙЙ ИЙНЙЮЕУЛПК ТЕБЛГЙЙ.
ьФП РПЪЧПМСЕФ РТПЧПДЙФШ ЛПМЙЮЕУФЧЕООЩЕ ТБУЮЕФЩ, ЙУРПМШЪХС ХТБЧОЕОЙС ЪБДБООЩИ ИЙНЙЮЕУЛЙИ ТЕБЛГЙК.
рТЙНЕТ: ПРТЕДЕМЙФШ НБУУХПВТБЪХАЭЕКУС ЧПДЩ РТЙ УЦЙЗБОЙЙ 16 ЗТБННПЧ ЧПДПТПДБ Ч ЙЪВЩФЛЕ ЛЙУМПТПДБ.
йУРПМШЪХЕН ХЦЕ ЪОБЛПНПЕ ОБН ХТБЧОЕОЙЕ ТЕБЛГЙЙ Й ТБУУФБЧЙН Ч ОЕН ФТЕВХЕНЩЕ ЧЕМЙЮЙОЩ.
РТЙ УЗПТБОЙЙ 4 ЗТБННПЧ о2 ПВТБЪПЧБМПУШ 36 ЗТБННПЧ о2п
РТЙ УЗПТБОЙЙ 16 ЗТБННПЧ о2 ПВТБЪПЧБМПУШ и ЗТБННПЧ о2п
1.1.2 ьЛЧЙЧБМЕОФОБС НБУУБ (НПМСТОБС НБУУБ ЬЛЧЙЧБМЕОФБ ЧЕЭЕУФЧБ)
mЬЛЧ(ПЛУЙДБ) = нПЛУЙДБ/(ЮЙУМП БФПНПЧ ЛЙУМПТПДБ·2);
mЬЛЧ(ПУОПЧБОЙС) = нПУОПЧБОЙС/ЛЙУМПФОПУФШ ПУОПЧБОЙС;
mЬЛЧ(ЛЙУМПФЩ) = нЛЙУМПФЩ/ПУОПЧОПУФШ ЛЙУМПФЩ;
mЬЛЧ(УПМЙ) = нУПМЙ/(ЮЙУМП БФПНПЧ НЕФБММБ·ЧБМЕОФОПУФШ НЕФБММБ).
нПЦОП ПФНЕФЙФШ, ЮФП Ч ВПМШЫЙОУФЧЕ УМХЮБЕЧ ЛЙУМПФОПУФШ ПУОПЧБОЙС ТБЧОБ ЮЙУМХ ЗЙДТПЛУЙМШОЩИ ЗТХРР Ч ЖПТНХМЕ ПУОПЧБОЙС, Б ПУОПЧОПУФШ ЛЙУМПФЩ ТБЧОБ ЮЙУМХ БФПНПЧ ЧПДПТПДБ Ч ЖПТНХМЕ ЛЙУМПФЩ.
ьЛЧЙЧБМЕОФОЩЕ НБУУЩ ЧЕЭЕУФЧ ЙУРПМШЪХАФ ДМС ЛПМЙЮЕУФЧЕООЩИ ТБУЮЕФПЧ РТЙ ИЙНЙЮЕУЛЙИ ЧЪБЙНПДЕКУФЧЙСИ НЕЦДХ ЧЕЭЕУФЧБНЙ. пЗТПНОЩН РТЕЙНХЭЕУФЧПН РТЙ ЬФПН СЧМСЕФУС ФП, ЮФП ДМС ЬФПЗП ОЕ ОХЦОП ЙУРПМШЪПЧБФШ ХТБЧОЕОЙЕ ИЙНЙЮЕУЛПК ТЕБЛГЙЙ (ЛПФПТПЕ ЧП НОПЗЙИ УМХЮБСИ ОБРЙУБФШ ЪБФТХДОЙФЕМШОП), ОХЦОП ФПМШЛП ЪОБФШ, ЮФП ДБООЩЕ ИЙНЙЮЕУЛЙЕ ЧЕЭЕУФЧБ ЧЪБЙНПДЕКУФЧХАФ НЕЦДХ УПВПК ЙМЙ ЧЕЭЕУФЧП СЧМСЕФУС РТПДХЛФПН ИЙНЙЮЕУЛПК ТЕБЛГЙЙ.
дМС ЛПМЙЮЕУФЧЕООЩИ ТБУЮЕФПЧ ЙУРПМШЪХЕФУС ЪБЛПО ЬЛЧЙЧБМЕОФПЧ: НБУУЩ ТЕБЗЙТХАЭЙИ Й ПВТБЪХАЭЙИУС ЧЕЭЕУФЧ ПФОПУСФУС ДТХЗ Л ДТХЗХ, ЛБЛ ЙИ ЬЛЧЙЧБМЕОФОЩЕ НБУУЩ.
нБФЕНБФЙЮЕУЛПЕ ЧЩТБЦЕОЙЕ ЪБЛПОБ ЬЛЧЙЧБМЕОФПЧ ЙНЕЕФ УМЕДХАЭЙК ЧЙД:
| m1/m2 = mЬЛЧ(1)/mЬЛЧ(2) | (1.2) |
рТЙНЕТ: ПРТЕДЕМЙФШ НБУУХ УПДЩ (ЛБТВПОБФБ ОБФТЙС) Na2CO3, ОЕПВИПДЙНХА ДМС РПМОПК ОЕКФТБМЙЪБГЙЙ 1,96 ЛЗ УЕТОПК ЛЙУМПФЩ H2SO4.
чПУРПМШЪХЕНУС ЪБЛПОПН ЬЛЧЙЧБМЕОФПЧ
пРТЕДЕМСЕН ЬЛЧЙЧБМЕОФОЩЕ НБУУЩ ЧЕЭЕУФЧ, ЙУИПДС ЙЪ ЙИ ИЙНЙЮЕУЛЙИ ЖПТНХМ:
Закон эквивалентов. Понятие эквивалент. Молярная масса эквивалента



Одним из основных законов химии является закон эквивалентов, открытый в конце 18 века: массы элементов, соединяющихся друг с другом, пропорциональны их эквивалентам:
где mA, mВ – массы взаимодействующих веществ А и В;
ЭА и ЭВ – эквиваленты этих веществ.
Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях ионного обмена равноценна одному атому или одному иону водорода, а в окислительно-восстановительных реакциях одному электрону.
Массу одного моля эквивалента элемента называют молярной массой эквивалента MЭ(X). Значение эквивалента веществ зависит от того, в какой конкретной реакции участвует это вещество.
Молярная масса эквивалента химического элемента (MЭ(X)), а также простых или сложных веществ рассчитывается по формуле
где M(X) – молярная масса; вал – суммарная валентность.
Молярные массы эквивалента сложных веществ вычисляются по их химическим формулам с учетом происходящих химических реакций.
К сложным веществам относятся оксиды, гидроксиды, соли.
Суммарная валентность оксидов равна произведению валентности кислорода (2) на количество атомов кислорода в молекуле. Суммарная валентность гидроксидов определяется их кислотностью, которая равняется числу замещенных гидроксильных групп. Суммарная валентность кислот равняется основности данных соединений, которая определятся числом замещенных атомов водорода. Суммарная валентность соли равняется произведению валентности катиона и количества катионов в молекуле, или валентности аниона и количества анионов в молекуле.
Молярная масса эквивалентов сложных веществ может быть определена как сумма молярных масс эквивалентов элементов или условных частиц, образующих данное вещество.
Мэ (соли) = Мэ (катиона) + Мэ (кислотного остатка).
Пример 1. Выразите в молях: а) 6,0210 21 молекул CO2; б) 1,2010 24 атомов кислорода; в) 2,0010 23 молекул воды. Чему равна мольная (молярная) масса указанных веществ?
Решение. Моль – это количество вещества, в котором содержится число частиц любого определенного сорта, равное постоянной Авогадро (6,02 10 23 ). Отсюда:
Так как молекулярные массы СО2 и H2O и атомная масса кислорода соответственно равны 44; 18 и 16 а.е.м., то их мольные (молярные) массы равны: а) 44 г/моль; б) 18 г/моль; в) 16 г/моль.
Решение. Масса вещества и количество вещества – понятия неидентичные. Масса выражается в килограммах (граммах), а количество вещества – в молях.
В данных соединениях с 1 моль атомов водорода соединяется 1/3 моль азота,1/2 моль серы и 1 моль хлора. Отсюда Э(N) = 1/3 моль, Э(S) = 1/2 моль, Э(Cl) = 1 моль. Исходя из мольных масс этих элементов определяем их эквивалентные массы:
Пример 3. На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 л водорода (н.у.). Вычислите эквивалентную массу оксида и эквивалентную массу металла. Чему равна атомная масса металла? Нормальные условия по Международной системе единиц (СИ): давление 1,013 10 5 Па (760 мм рт. ст. = 1 атм), температура 273 К или 0 0 С.
Решение. Согласно закону эквивалентов массы (объемы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объемам):
Объем, занимаемый при данных условиях мольной или эквивалентной массой газообразного вещества, называется мольным или, соответственно, эквивалентным объёмом этого вещества. Мольный объём любого газа при н.у. равен 22,4 л. Отсюда эквивалентный объём водорода VmЭ (Н2) = 22,4/2 = 11,2 л, а эквивалентный объём кислорода равен 5,6 л.
Из уравнения (3) находим эквивалентную массу оксида металла mЭ (МеО):
Согласно закону эквивалентов mЭ (МеО) = mЭ (Ме) + mЭ (О2), отсюда
Пример 4. Вычислите эквиваленты и эквивалентные массы H2SО4 и Аl(OH)3 в реакциях, выраженных уравнениями:
Решение. Эквивалент (эквивалентная масса) сложного вещества, как и эквивалент (эквивалентная масса) элемента, может иметь различные значения и зависит от того, в какую реакцию обмена вступает это вещество. Эквивалентная масса кислоты (основность) равна мольной массе (М), деленной на число атомов водорода, замещенных в данной реакции на металл (на число вступающих в реакцию гидроксильных групп).
Пример 5. Сколько металла, эквивалентная масса которого 12,16 г/моль, взаимодействует с 310 см 3 кислорода (н.у.)?
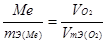
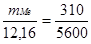
Пример 6. Из 3,85 г нитрата металла получено 1,60 г его гидроксида. Вычислите молярную массу эквивалента металла (тЭ(Ме) ).
Решение. При решении задачи следует иметь в виду:
а) молярная масса эквивалента гидроксида равна сумме молярных масс эквивалентов металла и гидроксильной группы;
б) молярная масса эквивалента соли равна сумме молярных масс эквивалентов металла и кислотного остатка. Вообще молярная масса эквивалента химического соединения равна сумме молярных масс эквивалентов составляющих его частей.
Учитывая сказанное, подставляем соответствующие данные в уравнение (1) примера 3:
Пример 7. В какой массе Са(ОН)2 содержится столько же эквивалентных масс, сколько в 312 г А1(ОН)3?
Решение. Молярная масса эквивалента А1(ОН)3 равна 1/3 его молярной массы, т.е. 78/3 = 26 г/моль. Следовательно в 312 г А1(ОН)3 содержится 312/26 =12 эквивалентов. Молярная масса эквивалента Са(ОН)2 равна ½ его молярной массы, т.е. 37 г/моль. Отсюда 12 эквивалентов составляют 37 г/моль? 12 моль = 444 г.
Пример 8. Вычислите абсолютную массу молекулы серной кислоты в граммах.
Научная электронная библиотека
§ 2.1.2. Эквивалент
Эквивалент молекулы сложного вещества – это условная часть молекулы, являющаяся носителем одной функциональной связи или одного электрона, участвующего в окислительно-восстановительном процессе.
Эквивалентная масса 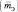
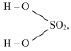
Например, если серная кислота (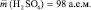
М (Н2 SO4) = 98 г/моль), имеющая структурную формулу:
взаимодействует с NaOH по реакции:
Н2SO4 + 2NaOH = Na2SO4 + 2Н2О, (2.1),
то у неё функциональны две связи Н – О. Вся молекула оказывается носительницей двух функциональных связей, а, значит, двух эквивалентов. Поэтому эквивалентом в данном случае является половина молекулы Н2SO4. Следовательно,
Молярная масса эквивалента (МЭ) – это масса одного моля эквивалента. В данном случае (MЭ(Н2SO4)) для приведённой реакции рассчитывается по формуле:
В аналогичной реакции взаимодействия NaOH с НСl молярная масса эквивалента соляной кислоты численно совпадает с молярной массой НСl:
НСl + NaOH = NaСl + Н2О;
Эквивалент молекулы простого вещества – это условная часть молекулы, являющаяся носителем одной валентности.
Например, молекула водорода состоит из двух атомов, каждый из которых обладает валентностью, равной единице. Поэтому, суммарная валентность молекулы этого простого вещества равна двум. Вся молекула оказывается носительницей двух валентностей, а, значит, согласно последнему определению, двух эквивалентов. Эквивалентом водорода оказывается половина молекулы. Молярная масса эквивалента ((MЭ(Н2)) рассчитывается по формуле:
Следует подчеркнуть, что хотя молекула водорода, также как и молекула соляной кислоты, содержит только одну функциональную связь, однако формулы для расчёта молярных масс эквивалентов этих веществ существенно различаются, потому что одно из них является простым, а другое сложным.
В общем случае, молярные массы эквивалентов (МЭ) рассчитываются следующим образом.
Для простых веществ:
где МЭ(ЭХ) – молярная масса эквивалента простого вещества, состоящего из х атомов элемента Э; М(ЭХ) – молярная масса этого вещества; М(Э) – молярная масса элемента; В(Э) – валентность элемента.
Для элементов (Э), входящих в состав сложного вещества:
То есть, молярные массы эквивалентов простых веществ и молярные массы эквивалентов элементов, входящих в состав сложного вещества, могут рассчитываться по одной и той же формуле.
Для кислот НХА, где А – кислотный остаток:
где y – основность кислоты, т. е. количество ионов H+, принимающих участие в процессе (y ≤ х).
Например, в реакции (2.1) основность серной кислоты равна двум. А для процесса:
Н2SO4 + NaOH = NaНSO4 + Н2О,
основность кислоты равна единице и не совпадает с общим количеством ионов Н+, принимающих участие в процессе.
Для оснований (Э(ОН)Х):
где у’ – кислотность основания, т. е. количество гидроксогрупп, принимающих участие в процессе. (y’ ≤ х).
Например, для реакции:
Са(ОН)2 + 2НСl = СаСl2 + 2Н2О;
Са(ОН)2 + НСl = СаОНСl + Н2О;
Для солей (МеХАу, где Ме – металл):
где В(Ме) – валентность металла; z – количество атомов металла, принимающих участие в процессе (z ≤ х).
где Э – элемент или фрагмент молекулы, неизменяемый в реакции; z′ – количество Э, принимающее участие в процессе.
Например, для реакции:
Аl2O3 + 6HCl = 2АlCl3 + 3H2O;
Э ≡ Al;
UO3 + 2HCl = UO2Cl2 + H2O;
Э ≡ UO2;
Из приведённых примеров видно, что значение молярной массы эквивалента сложных веществ зависит от конкретной реакции, в которой они принимают участие. А значение молярной массы эквивалента элементов, входящих в состав сложного вещества – не зависит от реакции.
Следует подчеркнуть, что рассмотренные выше формулы для нахождения молярных масс эквивалентов сложных веществ, справедливы только в том случае если эти вещества не участвуют в окислительно – восстановительном процессе. Например, в реакции
2КMnO4 + 3 K2SO3 + H2O = 2MnO2 + 3 K2SO4 + 2KOH;
где n – количество электронов, получаемых перманганатом калия
n′ – количество электронов, отдаваемых сульфитом калия. В данном случае
Обобщив, приведённые выше равенства, можно утверждать, что молярную массу эквивалента любого вещества (МЭ) рассчитывают по формуле (2.2):
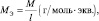
где M – молярная масса вещества, измеряемая в г/моль; l – количество эквивалентов, приходящееся на одну молекулу, численно равное количеству:
– валентностей (для простых веществ);
– функциональных связей (для сложных веществ, не участвующих в окислительно-восстановительном процессе);
– электронов, получаемых или отдаваемых молекулой (для сложных веществ, участвующих в окислительно-восстановительном процессе).
Подобно тому, как молярная масса вещества (М) представляет собой отношение массы (m) к количеству этого вещества (n)
а молярный объём газа (Vo) – отношение объёма (V), занимаемого им при нормальных условиях (p ≈ 105 Па; t °C ≈ 0 °C)[19] к количеству газа (nг):
молярный объём эквивалента газообразного вещества (VЭ) представляет собой отношение V к количеству молярных масс эквивалента nЭ:
из последних двух равенств вытекает соотношение
в котором все величины являются параметрами одного и того же газа.
Задачи для самостоятельного решения
1. Определить молярные массы эквивалентов соединения Н3РО4 в реакциях:
Н3РО4 + 3КОН = К3РО4 + 3Н2О;
Н3РО4 + 2КОН = К2НРО4 + 2Н2О;
Н3РО4 + КОН = КН2РО4 + Н2О.
Рассчитать молярные массы эквивалентов каждого из атомов в Н3РО4.
2. Определить эквивалентную массу Na2SO4 в реакциях:
Na2SO4 + ВаСl2 = ВаSO4 + 2NaСl;
Na2SO4 + H2SO4 = 2NaHSO4.
3. Определить молярную массу эквивалента Na2O в реакциях:
Na2O + 2НСl = 2NaСl + Н2О;
4. Определить эквивалентную массу Аl(OH)3 в реакциях:
2Аl(OH)3 + 3H2SO4 = Аl2(SO4)3 + 6Н2О;
Аl(OH)3 + H2SO4 = АlOHSO4 + 2Н2О.
5. Рассчитать молярную массу эквивалента кислорода и определить объём, занимаемый молярной массой эквивалента кислорода при н.у.
6. Определить эквивалентные массы, молярные массы эквивалента метана (СН4) и хлора в реакции
1. Дайте определения эквиваленту молекулы сложного вещества и эквиваленту молекулы простого вещества?
2. По какой формуле можно рассчитать молярную массу эквивалента любого вещества?
3. Какое уравнение связывает молярную массу, молярный объём, молярную массу эквивалента и молярный объём эквивалента одного и того же газа.