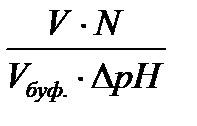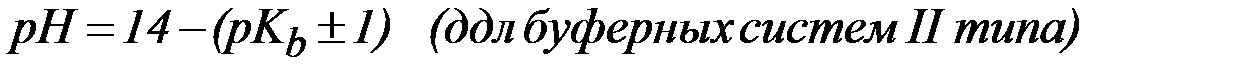в чем измеряется буферная емкость
Буферная емкость



Способность буферного раствора сохранять рН по мере прибавления сильной кислоты или щелочи приблизительно на постоянном уровне далеко не беспредельна и ограничена величиной так называемой буферной емкости.
Буферная емкость раствора – это величина, характеризующая способность буферного раствора противодействовать смещению реакции среды при добавлении сильных кислот или щелочей. Это мера буферного действия.
Буферная емкость измеряется количеством моль эквивалентов кислоты или щелочи, добавление которых к 1 л буферного раствора изменяет рН на единицу. Обозначается В и измеряется в моль/л.
Различают буферную емкость по кислоте и по щелочи.
Буферная емкость по кислоте:
Вк =
численно равна количеству моль-эквивалентов сильной кислоты, которое нужно добавить к 1 л буферного раствора, чтобы рН изменился на единицу.
Буферная емкость по щелочи:
Вщ =
численно равна количеству моль-эквивалентов щелочи, которое нужно добавить к 1 л буферного раствора, чтобы рН изменился на единицу.
Буферная емкость раствора возрастает по мере увеличения концентрации его компонентов (буферная емкость по кислоте определяется концентрацией акцептора протона, а буферная емкость по щелочи определяется концентрацией донора протона) и приближения соотношения компонентов к единице.
При разбавлении буферного раствора величина буферной емкости уменьшается вследствие снижения концентрации всех компонентов раствора.
Важным показателем для физиологических сред является буферная емкость по кислоте, т.к. в результате метаболизма (совокупность химических реакций, протекающих в живых клетках) в человеческом организме образуется больше кислотных продуктов, чем основных.
Буферная емкость. Количественное определение буферной емкости. Зона буферного действия.



Буферная ёмкость (В) выражается количеством моль-эквивалентов сильной кислоты или щелочи, которое следует добавить к одному литру буфера, чтобы сместить рН на единицу.
В =
В – буферная ёмкость,
nЭ – количество моль-эквивалента сильной кислоты или щелочи,
рНН – начальное значение рН ( до добавления кислоты или щелочи)
рНК – конечное значение рН (после добавления кислоты или щелочи)
На практике буферная ёмкость рассчитывается по формуле:
В =
V – объём кислоты или щелочи,
N – эквивалентная концентрация кислоты или щелочи,
Vбуф.— объём буферного раствора,
Δ рН – изменение рН.
Интервал значений рН, выше и ниже которого буферное действие прекращается, называется зоной буферного действия.
Она равна рН = рК ± 1
(Буферная ёмкость зависит от концентрации электролитов и соотношения компонентов буфера. Наибольшей буферной ёмкостью обладают растворы с большей концентрацией компонентов и соотношением компонентов, равным единице.)
Буферная емкость измеряется количеством г-эквивалентов или моль/л сильной кислоты или сильного основания
Буферная емкость измеряется количеством г-эквивалентов или моль/л сильной кислоты или сильного основания
Фосфатный буферный раствор (NаН2РО4 + NаНРО4) поддерживает рН 6,8. Т. о. варьируя концентрации слабой кислоты и её соли, можно получить буферные растворы с разными значениями рН.
Однако, реакции водных растворов
Для большинства солей гидролиз процесс обратимый.
Когда продукты гидролиза уходят из сферы реакции, гидролиз протекает необратимо, например: Al2 S3 + 6H2O=2Al(OH)3↓ + 3H2S (в уравнения необратимого гидролиза ставится знак равенства). Гидролиз, в р-те которого образ-ся малорастворимые или газообразные продукты, удаляющиеся из сферы реакции, являются необратимыми. Степень гидролиза, смещение равновесия гидролиза. Влияние различных факторов на смещение равновесия гидролиза используется в аналитической химии для обнаружения отдельных ионов, регулирования кислотности и щелочности анализируемых р-ов, разделения ионов при систематическом качественном анализе.
Гидролиз солей происходит тогда, когда их ионы, образующиеся в процессе электролитической диссоциации, способны образовывать с водой слабые (малодиссоцированные) электролиты. Гидролизом называется реакция обменного разложения между водой и соответствующим соединением.
Разложение воды в этом случае не происходит: Na + + HOH ↔ реакция не идет. 2-х и 3-х зарядные катионы
. Гидролиз приводит к образованию кислой среды, если соль при ионизации образует среднеполяризующиеся катионы и малополяризующиеся анионы:
. Гидролиз приводит к образованию щелочной среды, если соль при ионизации образует слабополяризующиеся катионы и среднеполяризующиеся анионы:
. Полный гидролиз с образованием малорастворимых оснований и слабых кислот происходит, если соль при диссоциации образует среднеполяризующиеся катионы и анионы: А1(СО3)3+6Н2О↔2А1(ОН)3+ 3Н2СО3.
Процесс гидролиза при необходимости можно подавлять введением реагента, имеющего одноименные ионы с продуктами гидролиза или изменяя температуру:
Хлорид сурьмы в воде гидролизуется с образованием малорастворимого оксохлорида сурьмы, выпадающего в осадок. Для подавления гидролиза в этом случае в раствор добавляют НС1, которая смещает равновесие гидролиза влево, что позволяет избежать выпадения осадка и сурьма в растворе присутствует в виде растворимых хлоридных комплексов. Иногда необходимо увеличить глубину гидролиза. Степенью гидролиза h называется величина, равная отношению прогидролизовавшихся ионов nh к общему числу n исходных ионов h=nh/n, (в долях единицы или в процентах), она увеличивается с уменьшением концентрации раствора и с ростом температуры. В растворах солей, при гидролитических процессах устанавливается гидролитическое равновесие и константа гидролитического равновесия Кh наз-ся концентрационной константой гидролиза и выражается в общем случае реакции
Буферная емкость. От каких факторов зависит.



Буферная емкость(В) измеряется количеством кислоты или щелочи (моль или ммоль эквивалента), добавление которого к 1 л буферного раствора изменяет рН на единицу.
Буферная емкость зависит от ряда факторов:
1. Чем больше абсолютное содержание компонентов пары основание/сопряженная кислота, тем выше буферная емкость буферного раствора.
2. Буферная емкость зависит от соотношения количеств компонентов буферного раствора, а следовательно, и от рН буфера. Буферная емкость максимальна при равных количествах компонентов буферной системы и уменьшается с отклонением от этого соотношения.
3. При различном содержании компонентов буферные емкости раствора по кислоте и по щелочи отличаются.
Расчет величины рН буферных растворов.
Область (зона) буферного действия отличается от 

Понятие растворимости. Какие факторы влияют на растворимость твердых веществ.
Растворимость вещества (Р)– молярная концентрация вещества в насыщенном растворе.
Растворимость твердых веществ зависит от:
· природы растворенного вещества и растворителя
Растворимость газов зависит от:
Произведение растворимости малорастворимого сильного электролита. Расчет ПР.
В насыщенном растворе малорастворимого сильного электролита при данной температуре произведение молярных концентраций его ионов, возведенных в степени их стехиометрических коэффициентов, есть величина постоянная и называется произведением растворимости.
Буферная емкость и факторы на нее влияющие. Зона буферного действия.
Буферная емкость(В)– величина, характеризующая способность БС противодействовать изменению рН, при добавлении щелочей или сильных кислот. В= n(1/zX)/ ΔpH*Vб.= С(1/z X)*Vx/ ΔpH*Vб.В-буферная емкость, n-кол-во вещества (ммоль), z-число эквивалентов, X- формула сильной кислоты или щелочи, n(1/z X)- кол-во эквивалентного в-ва X(ммоль), ΔpH=pHкон.-рНнач. (по модулю), С(1/z X)- молярная концентрация эквивалентного в-ва X(ммоль/л), Vx-объем растворенного в-ва X (л), Vб.- объем БР (л)
[B]-ммоль/л- ммоль эквивалентов сильной кислоты или щелочи на 1л БР. Вx-буферная емкость по кислоте, Вщ- буферная емкость по щелочи.
23. Буферные системы крови:состав, распределение в плазме и эритроцитах, иеханизм действия гидрокарбонатной, фосфатной, белковой буф. Систем. pH в крови в норме, pH артериальной и венозной крови
Постоянство pH внутренней среды организма обусловлено совместным действием буферных систем и ряда физиологических механизмов (деятельность легких, выделительная функция почек).
Ph во в артериальной крови 7,4 (7,36-7,46), в венозной крови 7,38. Колебание pH в этих водных сегментах совместимо с жизнью (6,9-7,8). На их долю 44% буферной емкости крови.
В эритроцитах- гемоглобиновая 35%, гидрокарбонатная 18%, фосфатная(органических фосфатов) 3%. На их долю приходится 56% буферное емкости крови.
Поддержание pH крови является важнейшей физиологической задачей. Если бы не существовало механизма поддержки pH, то огромное количество кислотных продуктов, образовавшихся в результате метаболизма, вызывали бы закисление (ацидоз). В меньшей степени в организме накапливаются в процессе метаболизма щелочные продукты, которые могут сместить pH среды в щелочную сторону ( алкалоз ).
Постоянство pH во внеклеточном сегменте поддерживается сильными буферными системами крови, дыхательной и почечной регуляцией. Важными буферными системами являются: бикарбонатная, фосфатная, гемоглобиновая, белковая
Бикарбонатная буферная система.
Эта система представлена бикарбонатом натрия (гидрокарбонатом) и угольной кислотой.
Механизм действия.
При накоплении в организме кислых продуктов они вступают в реакцию нейтрализации с бикарбонатом Na с образованием NaCl и H2CO3 (который диссоциирует на CO2 и H2O) CO2 с помощью гемоглобиновой буферной системы переносится в легкие, а оттуда выводится из организма. Таким образом существует связь между этими двумя буферными системами.
NaHCO3 + НCl NaCl + H2CO3 (диссоциирует на)
При появлении в крови избытка щелочных продуктов в реакцию вступает второй компонент буферной системы H2CO3, в результате чего образуется бикарбонат Na и вода. Избыток NaHCO3 удаляется через почки.
Таким образом, благодаря легким и почкам соотношение между NaHCO3 и H2CO3 поддерживается на постоянном уровне равном 20:1 (это соотношение свидетельствует о том, что щелочной компонент буфера должен быть больше кислотного резерва т.к. вероятность образования в организме кислого продукта намного выше).
Фосфатная буферная система.
Принцип действия теплоаккумулятора
Буферный бак имеет второе название — теплоаккумулятор, так как он накапливает тепловую энергию, расходуя ее для дальнейшего рационального использования. Таким образом, обогрев помещения происходит более равномерно.
В общей схеме системы отопления агрегат занимает место непосредственно между котлом и радиаторами. Если он отсутствует, то для того чтобы процесс проходил равномерно, необходимо постоянно подкладывать дрова в топку. Иногда эту процедуру невозможно выполнить вследствие конструктивных особенностей котлов.
Если при использовании газовых и электрических аппаратов процесс генерации тепловой энергии можно сгладить, то в твердотопливных агрегатах это сделать очень затруднительно. Принцип действия буферного резервуара очень схож с работой аккумулятора в автомобиле.
Пока двигатель работает, вращается и генератор, вырабатывая электрический ток, который накапливается в аккумуляторе.
Как только двигатель останавливают, электричество начинает поступать непосредственно из батареи к потребителям. В основу работы теплового аккумулятора заложена высокая теплопроводность воды.
Например, при остывании 1 л воды на 1°C можно нагреть 1 м³ воздуха на 4°C. Поэтому если в определенный момент передать энергию некоторому объему воды, то в дальнейшем ее хватит для обогрева помещения в течение длительного времени.
Практическое значение pH буферов
Буферные системы существуют внутри всех живых клеток, так как большинство из химических превращений, происходящих в них зависящие от pH. С этой же причине в лабораториях при исследовании свойств белков, особенно ферментов, нуклеиновых кислот и других биомолекул всегда используют pH буфера.
pH буфера широко используются во многих отраслях промышленности и в лабораторной практике. Например, один из первых этапов пивоварения — измельчение солода — должен происходить при pH от 5,0 до 5,2. С изготовлением пива связано и само открытие шкалы pH, поскольку ее изобретатель Сорен Соренсон работал исследователем на пивоварне.
Буферные системы крови человека
pH крови человека в среднем составляет 7,4, изменение этого значения даже на одну десятую единицы приводит к тяжелым нарушениям (ацидоза или алкалоза). Когда водородный показатель выходит за пределы диапазона 6,8 ÷ 7,8, это обычно ведет к гибели. Важнейшее буферная система крови — угольная (HCO-3 / H 2 CO 3), вторая по значению — фосфатный (HPO2-4 / H 2 PO-4), также определенную роль в поддержании pH играют белки.
PH буфера в биологических лабораториях
Значение pK a некоторых буферных агентов
| Буферный агент | pK a |
| Трис | 8,3 |
| TES | 7,55 |
| HEPES | 7,55 |
| MOPS | 7,2 |
| PIPES | 6,8 |
В экспериментах с биохимии и молекулярной биологии первично использовались обычные буфера на основе слабых кислот и их сопряженных оснований, такие как цитратные, ацететни, фосфатные. Однако они имели ряд недостатков, таких как довольно значительное изменение pH при разведении или изменении температуры, проникновения их компонентов через клеточные мембраны и влияние на физиологические процессы. Поэтому на смену им стали применять буферы на основе других веществ, например основы трис (гидроксиметил) аминометану (сокращенно трис), цвиттер-ионной соединения MOPS и тому подобное.
Норман Гуд разработал серию буферов на основе соединений, молекулы которых могут находиться в состоянии цвиттерионив, таких как HEPES, PIPES, MES. Гуд отбирал буферные агенты на основе таких желательных признаков как: значение pK a в диапазоне 6 ÷ 8, соответствует физиологическим значением pH, высокая растворимость в воде, нерастворимость в полярных соединениях, непроницаемость через мембраны, малое влияние на ионную силу раствора, максимальная независимость диссоциации от температуры и концентрации, стабильность, легкость в приготовлении. Также буферные агенты не должны поглощать видимый и ультрафиолетовый свет с длиной волны более 230 нм, чтобы не препятствовать стандартным методам спектрофотометрии. Ни одна из известных соединений не подходит идеально под все описанные признаки, однако имеющийся выбор буферных агентов позволяет выбрать нужный для каждой конкретной задачи.
Конструкция буферной емкости
В настоящее время многие теплоаккумуляторы представляют собой довольно сложные конструкции. Каждая из деталей выполняет в ней определенную роль. В самую простую конструкцию входят следующие элементы:
К баку подходят 4 патрубка: 2 – от котла, 2 – от контура отопительной системы. Обязательно вверху емкости встроен предохранительный клапан для сброса лишнего давления. Для слива жидкости внизу бака находится кран. В трубопроводы встроены 2 насоса для циркуляции воды в прямом и обратном контуре системы отопления.
Когда начинают разжигать дрова в котле, охлажденная жидкость из теплового аккумулятора с помощью насоса поступает в контур печи, где происходит ее нагрев. Горячая вода, поступая назад в бак, перемещается в его верхнюю часть, так как она легче холодного теплоносителя.
В начальный период работа системы отопления проходит по малому кругу, между котлом и резервуаром. Когда в буферной емкости для системы отопления вся вода будет горячей, она начинает поступать по трубопроводам к радиаторам.
С обратного контура остывшая вода поступает в нижнюю часть теплоаккумулятора. Вся эта процедура с начала отопления может занимать 2-4 часа, что является существенным недостатком этой конструкции.
Теплоаккумулятор или Буферная емкость:










Расчет рН буферного раствора
⇐ ПредыдущаяСтр 9 из 16Следующая ⇒
Расчета рН буферных растворов осуществляется по уравнению Гендерсона – Гассельбаха:
– для кислотного буфера уравнение имеет вид
– для основного буфера
Уравнения показывают, что рН буферного раствора данного состава определяется отношением концентраций кислоты и соли или основания и соли, поэтому не зависит от разбавления. При изменении объема раствора концентрация каждого компонента изменяется в одинаковое число раз.
Буферная емкость
Способность буферных растворов сохранять постоянство рН ограничена. Т.е. прибавлять кислоту или щелочь, существенно не меняя рН буферного раствора, можно лишь в ограниченных количествах.
Величину, характеризующую способность буферного раствора противодействовать смещению реакции среды при добавлении кислот и щелочи, называют буферной ёмкостью раствора (В).
Буферная ёмкость измеряется количеством молей эквивалентов сильной кислоты или щелочи, добавление которой к 1 л буферного раствора изменяет рН на единицу.
Математически буферная ёмкость определяется следующим образом:
В по кислоте (моль/л ил ммоль/л):
где n(1/z HA) – количество моль эквивалентов кислоты, рН0 и рН – рН буферного раствора до и после добавления кислоты, VБ – объем буферного раствора.
В по щелочи (моль/л или ммоль/л):
где n (1/z ВОН) – количество моль эквивалентов щелочи, остальные обозначения те же.
Буферная ёмкость зависит от ряда факторов:
1. От природы добавляемых веществ и компонентов буферного раствора. Т.к. некоторые вещества могут образовывать нерастворимые соединения или комплексы или давать другие нежелательные реакции с компонентами буферной системы, тогда понятие буферной ёмкости теряет смысл.
2. От исходной концентрации компонентов буферной системы.
Чем больше количества компонентов кислотно-основной пары в растворе, тем больше буферная ёмкость этого раствора.
Предел соотношения концентраций компонентов буферного раствора, при котором система все еще сохраняет свои свойства. Интервал рН = рК ± 1, называется зоной буферного действия системы. Это соответствует интервалу соотношения Ссоли/Ск-ты от 1/10 до 10/1.
Вк (крови) = 0,05моль/л; Вк (плазмы) = 0,03 моль/л; Вк (сыв.крови) = 0,025 моль/л
Буферные системы крови
Особенно большое значение буферные системы имеют в поддержании кислотно-основного равновесия организмов. Значение рН большей части внутриклеточных жидкостей находится в интервале от 6,8 до 7,8.
Кислотно – основное равновесие в крови человека обеспечивается гидрокарбонатной, фосфатной, белковой и гемоглобиновой буферными системами. Нормальное значение рН плазмы крови 7,40 ± 0,05.
Карбонатная буферная система:
по своей мощности занимает первое место. Она представлена угольной кислотой (Н2СО3) и бикарбонатом натрия или калия (NaНСО3, КНСО3) в пропорции 1/20. Бикарбонатный буфер широко используется для коррекции нарушений кислотно-основного состояния организма.
Фосфатная буферная система .
Дигидрофосфатобладает свойствами слабой кислоты и взаимодействует с поступившими в кровь щелочными продуктами. Гидрофосфат имеет свойства слабой щелочи и вступает в реакцию с более сильными кислотами.
Белковая буферная системаосуществляет роль нейтрализации кислот и щелочей благодаря амфотерным свойствам: в кислой среде белки плазмы ведут себя как основания, в основной – как кислоты:
Буферные системы имеются и в тканях, что способствует поддержанию рН тканей на относительно постоянном уровне. Главными буферами тканей являются белки и фосфаты. Поддержание рН осуществляется также с помощью легких и почек. Через легкие удаляется избыток углекислоты. Почки при ацидозе выделяют больше кислого одноосновного фосфата натрия, а при алкалозе – больше щелочных солей: двухосновного фосфата натрия и бикарбоната натрия.
Примеры решения задач
Пример 1.
Рассчитать рН буферного раствора, приготовленного смешением 10 мл 0,1М раствора уксусной кислоты и 100 мл 0,1М раствора ацетата натрия (рК(сн3 соон) =4,76).
Пример 2.
Рассчитать буферную емкость по кислоте, если на титрование 10 мл сыворотки крови пошло 5 мл 0,1 моль/л соляной кислоты, если при титровании рН изменился от 7,36 до 5,0.
Рассчитываем буферную емкость по формуле:
Пример 3.
Буферный раствор состоит из 100 мл 0,1моль/л уксусной кислоты и 200 мл 0,2моль/л ацетата натрия. Как изменится рН этого раствора, если к ней добавить 30 мл 0,2моль/л раствора гидроксида натрия.
Рассчитываем рН буферного раствора по формуле:
При добавлении к буферному раствору NaOH увеличивается количество соли и уменьшается количество кислоты в буферном растворе:
СH3COOH + NaOH = CH3COONa + H2O
Рассчитываем n(NaOH) = 0,03 л · 0,2 моль/л = 0,006 моль, следовательно в буферном растворе количество кислоты уменьшается на 0,006 моль, а количество соли увеличится на 0,006 моль.
Рассчитываем рН раствора по формуле:
Отсюда: рН2 – рН1 = 5,82 – 5,3 = 0,52
изменение рН буферного раствора = 0,52.
Задачи для самостоятельного решения
2. Рассчитать молярную концентрацию уксусной кислоты, если на приготовление ацетатного буфера с рН= 5,76 к 100 мл 0,1М раствора ацетата натрия прилили 10 мл уксусной кислоты (рК(сн3 соон) =4,76).
3. Рассчитать Рн желудочного сока, если концентрация НС1 0,365%, плотность 1г/мл.
4. На титрование 2 мл крови для изменения рН от начального значения (7,36) до конечного значения (7,0) потребовалось добавить 1,6 мл 0,01 М раствора HCl. Рассчитайте буферную емкость по кислоте.
8. Рассчитать Рн ацетатного буферного раствора, состоящего из 60 мл 0,2М раствора уксусной кислоты и 120 мл 0,01М раствора ацетата натрия при рК(сн3соон) = 4,76.
9. Рассчитать рН 0,01М раствора уксусной кислоты, если степень диссоциации кислоты равна 0,1.
10. Рассчитать объем 5% раствора гидрокарбоната натрия, необходимого для коррекции метаболического ацидоза, если сдвиг буферных оснований (ВЕ) составляет — 10 ммоль/л при массе больного 68 кг.
Тестовые задания
Основные разновидности резервуаров
Очень часто тепловой аккумулятор называют гидрораспределителем, так как кроме накопления тепловой энергии он осуществляет распределение жидкости по системе отопления. Кроме простой конструкции буферной емкости для котлов существует ряд разновидностей:
Некоторые буферные баки могут совмещать в себе несколько дополнительных конструктивных изменений одновременно.
Буферная ёмкость.Где нужна,а где нет:
Другие типы буферных систем
В химическом анализе применяют и другие буферные системы: окислительно-восстановительные буферные растворы для образования и сохранения окислительно-восстановительного потенциала, например, на основе смеси солей Fe (II) и Fe (III); кальциевый буферный раствор для образования и сохранения активности катионов кальция, например на основе смеси эквимолярной количества дигликоляту натрия и кальция или натриевой и кальциевой солей нитрилацетатнои кислоты. В ионометрии широко используются буферные растворы для образования общей ионной силы раствора (БРЗИС).
Популярные модели баков
В настоящее время существует довольно широкий выбор буферных емкостей. Большое количество таких конструкций производят как отечественные, так и зарубежные предприятия. Самыми популярными являются:

Существует 3 популярные модели баков
При этом совсем необязательно покупать теплоаккумулятор в магазине. Вполне можно изготовить буферную емкость своими руками, если есть сварочный аппарат, соответствующие материалы и некоторые навыки сварщика.
Котельная, буферная емкость, электро котёл, тёплый пол, отопления: Буферная ёмкость и твердотопливный котёл. Как Подключить:
Общее описание
Иногда понятие «буферный раствор» используется в более широком смысле: для растворов, имеющих любой постоянный параметр (окислительно-восстановительный потенциал, активность ионов кальция и т.д.), почти не меняется при незначительном изменении состава системы, например при концентрирования, разбавления, добавлении небольших количеств посторонних соединений. Стабильность достигается благодаря тому, что компоненты буферной системы находятся в состоянии химического равновесия.
Буферы широко используются в химических, биологических и медицинских лабораториях для поддержания устойчивого pH среды, в которой происходят химические реакции. Они также входят в состав большого количества промышленных товаров, таких как некоторые медицинские препараты (например забуференный аспирин), средства для ухода за кожей и волосами и тому подобное. Буферные растворы необходимы для обеспечения гомеостаза живых организмов, например pH крови человека поддерживается на постоянном уровне, оптимальном для транспорта кислорода (около 7,4), благодаря нескольким буферным системам.
Для обеспечения устойчивого pH буфер должен содержать два соединения: одну, которая бы препятствовала уменьшению концентрации ионов H 3 O— (или упрощенно — H +), а другая — которая препятствовала ее увеличению, при этом они не должны нейтрализовать друг друга. По используется пара слабая кислота (донор протонов) / ее сопряженная основа (акцептор протонов) в примерно одинаковых концентрациях, и значительно реже — слабое основание / сопряженная с ней кислота. Буферные растворы часто делают на основе пар уксусная кислота / ацетат, дигидрогенфосфат / моногидрогенфосфат, угольная кислота / гидрокарбонат и др.
Теплоаккумулятор S-Tank AT Prestige 500л
Их ставят в домах с популярными котлами до 20 кВт (на 1 кВт 30л бака). Теплообменник тут лишний. Чистая холоднокатаная сталь. Изоляция 70мм полиэфирного волокна снижает теплопотери (
250 ватт/сутки) и не выделяет запах. Делают буферную ёмкость давно, по евро технологиям для нас и экспорта, потому хороши и отзывы, и цена шоу-рум Отзывы (2)
Где применяются буферные ёмкости
Буферные ёмкости применяются в следующих системах:
Стоит отметить, что наша компания может изготовить для Вас буферную ёмкость по индивидуальному спецзаказу, учитывая все Ваши нужды и пожелания. После изготовления буферной ёмкости, вся продукция проходит проверку качества и контроль герметичности резервуара.
Также, кроме изготовления ёмкостей и резервуаров, мы можем осуществить поставку буферов-накопителей производства Viessmann, Buderus, De Dietrich, Vaillant, Zani, Unical.