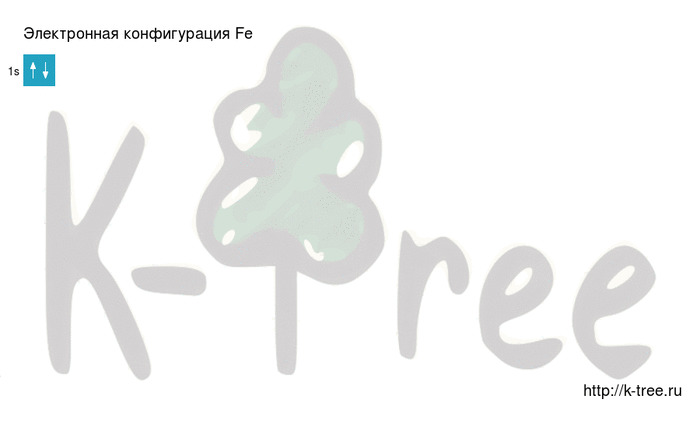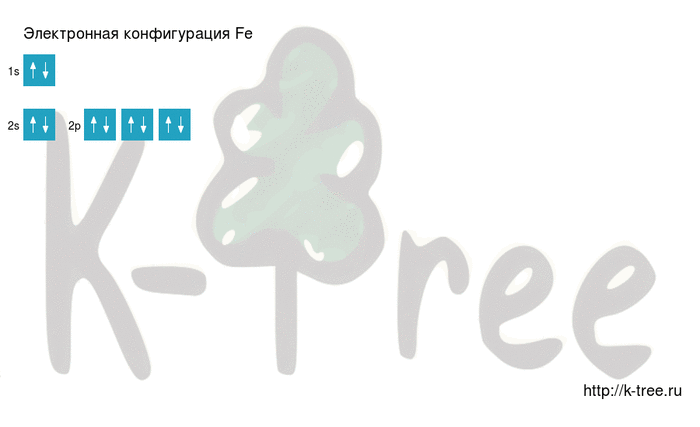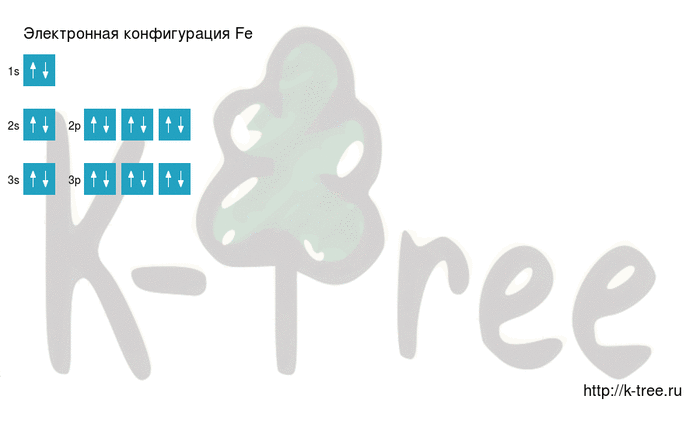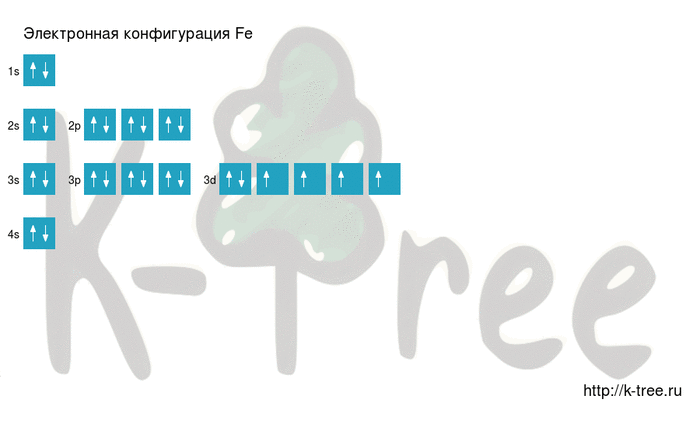таблица менделеева железо порядковый номер
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА МЕНДЕЛЕЕВА
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.

На первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.
Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий K 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Франций Fr 87 | Радий Ra 88 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
| Лантаниды | Актиниды |
| Лантан La 57 | Актиний Ac 89 |
| Церий Ce 58 | Торий Th 90 |
| Празеодимий Pr 59 | Протактиний Pa 91 |
| Неодимий Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Кюрий Cm 96 |
| Тербий Tb 65 | Берклий Bk 97 |
| Диспрозий Dy 66 | Калифорний Cf 98 |
| Гольмий Ho 67 | Эйнштейний Es 99 |
| Эрбий Er 68 | Фермий Fm 100 |
| Тулий Tm 69 | Менделевий Md 101 |
| Иттербий Yb 70 | Нобелий No 102 |
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
| Галогены | Благородные газы |
| Фтор F 9 | Гелий He 2 |
| Хлор Cl 17 | Неон Ne 10 |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Kr 36 |
| Астат At 85 | Ксенон Xe 54 |
| — | Радон Rn 86 |
Переходные металлы
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Te 52 |
| Полоний Po 84 |
Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий In 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Неметаллы
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
| Неметаллы |
| Водород H 1 |
| Углерод C 6 |
| Азот N 7 |
| Кислород O 8 |
| Фосфор P 15 |
| Сера S 16 |
| Селен Se 34 |
| Флеровий Fl 114 |
| Унунсептий Uus 117 |
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке
Химический элемент Железо
Использование и свойства элемента Железо
Это изображение алхимического символа железа. Символ отображается на ржавой пластине из мягкой стали.
Блестящий сероватый металл, ржавеющий на влажном воздухе.
Железо является важным элементом для всех форм жизни и не токсично. В среднем человек содержит около 4 граммов железа. Многое в гемоглобине, в крови. Гемоглобин переносит кислород из наших легких в клетки, где он необходим для тканевого дыхания.Людям необходимо 10–18 миллиграммов железа каждый день. Недостаток железа вызывает развитие анемии. Такие продукты, как печень, почки, патока, пивные дрожжи, какао и лакрица, содержат много железа.
Железо является четвертым по массе элементом земной коры. Считается, что ядро Земли в основном состоит из железа с никелем и серой.Наиболее распространенной железосодержащей рудой является гематит, но железо широко распространено в других минералах, таких как магнетит и таконит. В промышленных масштабах железо получают в доменной печи путем нагревания гематита или магнетита с коксом (углерод) и известняком (карбонат кальция). При этом образуется передельный чугун, который содержит около 3% углерода и других примесей, но используется для производства стали. Ежегодно во всем мире производится около 1,3 миллиарда тонн сырой стали.
История химического элемента Железо
Железные предметы были найдены в Египте примерно с 3500 г. до н.э. Они содержат около 7,5% никеля, что указывает на их метеоритное происхождение.
Древние хетты Малой Азии, нынешняя Турция, были первыми, кто выплавлял железо из своих руд около 1500 г. до н.э., и этот новый, более прочный металл дал им экономическую и политическую власть. Начался железный век. Некоторые виды железа явно превосходили другие в зависимости от содержания углерода, хотя это не ценилось. Некоторая железная руда содержала ванадий, из которого производилась так называемая дамасская сталь, идеальная для изготовления мечей.
Первым, кто объяснил различные типы железа, был Рене Антуан Фершо де Реомюр, который написал книгу на эту тему в 1722 году. Это объяснило, как сталь, кованое и чугунное железо следует различать по количеству древесного угля (углерода). они содержались. Промышленная революция, начавшаяся в том же веке, широко использовала этот металл.
Железо Fe
Железо в таблице менделеева занимает 26 место, в 4 периоде.
| Символ | Fe |
| Номер | 26 |
| Атомный вес | 55.8450000 |
| Латинское название | Ferrum |
| Русское название | Железо |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
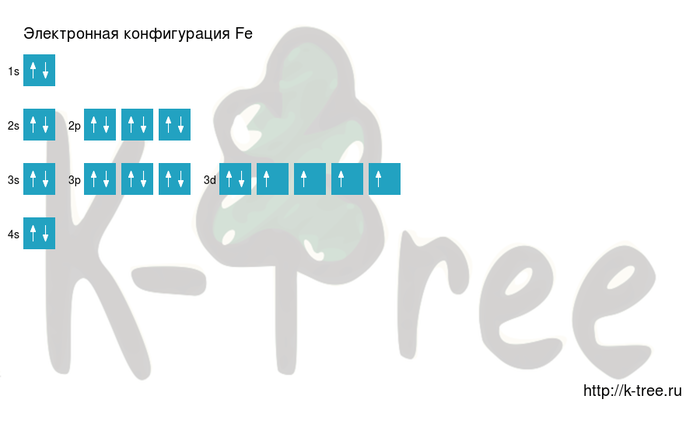
Электронная схема железа
Fe: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6
Короткая запись:
Fe: [Ar]4s 2 3d 6
Порядок заполнения оболочек атома железа (Fe) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Железо имеет 26 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
6 электронов на 3d-подуровне
Степень окисления железа
Ионы железа
Валентность Fe
Атомы железа в соединениях проявляют валентность VI, V, IV, III, II, I.
Валентность железа характеризует способность атома Fe к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Fe
Квантовые числа определяются последним электроном в конфигурации, для атома Fe эти числа имеют значение N = 3, L = 2, Ml = 3, Ms = ½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Перейти к другим элементам таблицы менделеева
Таблица менделеева железо порядковый номер
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Универсальная таблица растворимости
Коллекция таблиц к урокам по химии
Железо. Положение железа в периодической системе и строение его атома. Нахождение в природе. Физические и химические свойства железа
Данный урок посвящен изучению темы «Свойства железа». Вы познакомитесь со свойствами химического элемента железа, строением его атома и характерными степенями окисления. Также в уроке будут рассмотрены физические и химические свойства простого и сложных веществ, образованных железом.
I. Фильм: “Физические и химические свойства железа”
II. «Появление железа»
Появление железа в человеческой цивилизации положило начало железному веку.
Откуда же древние люди брали железо в то время, когда еще не умели добывать его из руды? Железо в переводе с шумерского языка – это металл, “капнувший с неба, небесный”. Первое железо, с которым столкнулось человечество, было железом из метеоритов. Впервые доказал, что “железные камни падают с неба”, в 1775 г. русский ученый П.С. Палас, который привез в Петербург глыбу самородного железного метеорита весом 600 кг. Самым крупным железным метеоритом является найденный в 1920 г. в Юго-Западной Африке метеорит “Гоба” весом около 60 т. Вспомним гробницу Тутанхамона: золото, золото. Великолепная работа восхищает, блеск слепит глаза. Но вот что пишет К.Керрам в книге “Боги, гробницы, ученые” о маленьком железном амулете Тутанхамона: “Амулет относится к числу наиболее ранних изделий Египта, и …в гробнице, наполненной чуть ли не до отказа золотом, именно эта скромная находка имела наибольшую с точки зрения истории культуры ценность”. Всего несколько железных изделий было найдено в гробнице фараона, среди них железный амулет бога Гора, небольшой кинжальчик с железным клинком и золотой рукояткой, маленькая железная скамеечка “Урс”.
Ученые предполагают, что именно страны Малой Азии, где проживали племена хеттов, были местом возникновения черной металлургии. В Европу железо пришло из Малой Азии уже в I тыс. до н.э.; так в Европе начался железный век.
Знаменитую булатную сталь (или булат) делали на Востоке еще во времена Аристотеля (IV в. до н.э.). Но технология ее изготовления держалась в секрете много веков.
Мне приснилась иная печаль
Про седую дамасскую сталь.
Я увидел, как сталь закалялась,
Как из юных рабов одного
Выбирали, кормили его,
Чтобы плоть его сил набиралась.
Выжидали положенный срок,
А потом раскаленный клинок
В мускулистую плоть погружали,
Вынимали готовый клинок.
Крепче стали, не видел Восток,
Крепче стали и горше печали.
Поскольку булат – это сталь с очень большой твердостью и упругостью, изготовленные из нее изделия обладают способностью не тупиться, будучи остро заточенными. Раскрыл секрет булата русский металлург П.П. Аносов. Он очень медленно охлаждал раскаленную сталь в специальном растворе технического масла, подогретого до определенной температуры; в процессе охлаждения сталь ковалась.
III. Положение железа в периодической таблице химических элементов и строение его атома
Схема строения атома:
Электронная формула: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2
Металл средней активности, восстановитель:
Основные степени окисления: +2, +3
IV. Распространённость железа
Железо – один из самых распространенных элементов в природе. В земной коре его массовая доля составляет 5,1%, по этому показателю оно уступает только кислороду, кремнию и алюминию. Много железа находится и в небесных телах, что установлено по данным спектрального анализа. В образцах лунного грунта, которые доставила автоматическая станция “Луна”, обнаружено железо в неокисленном состоянии.
Близ г. Дели в Индии стоит железная колонна без малейшего пятнышка ржавчины, хотя ее возраст почти 2800 лет.
Это знаменитая Кутубская колонна высотой около семи метров и массой 6.5 т. Надпись на колонне говорит о том, что она была поставлена в IX в. До н. э. Ржавление железа – образование метагидроксида железа – связано с взаимодействием его с влагой и кислородом воздуха.
Однако эта реакция при отсутствии в железе различных примесей, и прежде всего углерода, кремния и серы, не протекает. Колонна была изготовлена из очень чистого металла: железа в колонне оказалось 99,72%. Этим и объясняется ее долговечность и коррозионная устойчивость.
Железные руды довольно широко распространены на Земле. Названия гор на Урале говорят сами за себя: Высокая, Магнитная, Железная. Агрохимики в почвах находят соединения железа.
Железо входит в состав большинства горных пород. Для получения железа используют железные руды с содержанием железа 30-70% и более.
Основными железными рудами являются:
Магнетит (магнитный железняк) – Fe3O4 содержит 72% железа, месторождения встречаются на Южном Урале, Курской магнитной аномалии:
Как сообщал римский ученый Плиний, магнетит назван в честь греческого пастуха Магнеса. Магнес пас стадо возле холма над р. Хинду в Фессалии. Неожиданно посох с железным наконечником и подбитые гвоздями сандалии притянула к себе гора, сложенная сплошным серым камнем. Минерал магнетит дал в свою очередь название магниту, магнитному полю и всему загадочному явлению магнетизма, которое пристально изучается со времен Аристотеля и по сей день.
Магнитные свойства этого минерала и сегодня используются, прежде всего для поиска месторождений. Именно так были открыты уникальные месторождения железа на площади Курской магнитной аномалии (КМА). Минерал тяжелый: образец магнетита размером с яблоко весит 1,5 кг.
В древности магнетит наделяли всевозможными лечебными свойствами и способностью творить чудеса. Его использовали для извлечения металла при ранениях, а Иван Грозный среди своих сокровищ наравне с другими камнями хранил его непримечательные кристаллы.
Гематит (железный блеск, кровавик) – Fe2O3содержит до 65% железа, такие месторождения встречаются в Криворожском районе:
Гематит известен с давних пор. В Вавилоне и Древнем Египте он использовался в украшениях, для изготовления печатей, наряду с халцедоном служил излюбленным материалом в качестве резного камня. У Александра Македонского был перстень с вставкой из гематита, который, как он полагал, делал его неуязвимым в бою. В древности и в Средние века гематит слыл лекарством, останавливающим кровь. Порошок из этого минерала издревле использовали для золотых и серебряных изделий.
Название минерала происходит от греческого дета – кровь, что связано с вишневым или сургучно-красным цветом порошка этого минерала.
Важной особенностью минерала является способность стойко хранить цвет и передавать его другим минералам, в которые попадает хотя бы небольшая примесь гематита. Розовый цвет гранитных колонн Исаакиевского собора – это цвет полевых шпатов, которые в свою очередь окрашены тонкораспыленным гематитом.
Живописные узоры яшмы, используемой при отделке станций столичного метро, оранжевые и розовые сердолики Крыма, кораллово-красные прослойки сильвина и карналлита в соляных толщах – все обязаны своим цветом гематиту.
Издавна из гематита делали красную краску. Все известные фрески, выполненные 15-20 тыс. лет назад, – замечательные бизоны Альтамирской пещеры
и мамонты из знаменитой Капской пещеры – выполнены и коричневыми оксидами и гидроксидами железа.
Лимонит (бурый железняк) – Fe2O3*nH2O содержит до 60% железа, месторождения встречаются в Крыму:
Пирит (серный колчедан, железный колчедан, кошачье золото) – FeS2 содержит примерно 47% железа, месторождения встречаются на Урале.
Пирит получил свое название от греческого слова «пирос» – огонь, что связано с его свойством искрить при ударе стальными предметами. Этот красивый минерал поражает золотистым цветом, ярким блеском на почти всегда четких гранях. Благодаря своим свойствам пирит известен с глубокой древности, а во время эпидемий золотой лихорадки пиритовые блестки в кварцевой жиле вскружили не одну горячую голову. Да и сейчас начинающие любители камня нередко принимают пирит за золото.
Пирит – минерал вездесущий: он образуется из магмы, из паров и растворов, и даже из осадков, каждый раз в специфических формах и сочетаниях. Известен случай, когда за несколько десятилетий в пирит превратилось тело упавшего в шахту рудокопа. Железа в пирите немало – 46,5%, но извлекать его дорого и невыгодно.
V. Роль железа в жизни человека и растений
Биохимики открыли важную роль железа в жизни растений, животных и человека. Входя в состав чрезвычайно сложно построенного органического соединения, называемого гемоглобином, железо обусловливает красную окраску этого вещества, от которого в свою очередь, зависит цвет крови человека и животных. В организме взрослого человека содержится 3 г чистого железа, 75% которого входит в состав гемоглобина. Основная роль гемоглобина – перенос кислорода из легких к тканям, а в обратном направлении – CO2.
Железо необходимо и растениям. Оно входит в состав цитоплазмы, участвует в процессе фотосинтеза. Растения, выращенные на субстрате, не содержащем железа, имеют белые листья. Маленькая добавка железа к субстрату – и они приобретают зеленый цвет. Больше того, стоит белый лист смазать раствором соли, содержащей железо, и вскоре смазанное место зеленеет.
Так от одной и той же причины – наличия железа в соках и тканях – весело зеленеют листья растений и ярко румянятся щеки человека.
VI. Физические свойства железа
Железо – это серебристо-белый металл с температурой плавления 1539 о С. Очень пластичный, поэтому легко обрабатывается, куется, прокатывается, штампуется. Железо обладает способностью намагничиваться и размагничиваться, поэтому применяется в качестве сердечников электромагнитов в различных электрических машинах и аппаратах. Ему можно придать большую прочность и твердость методами термического и механического воздействия, например, с помощью закалки и прокатки.
VII. Получение железа
Восстановлением из оксидов углём или оксидом углерода (II), а также водородом:
VIII. Химические свойства железа
Как элемент побочной подгруппы железо может проявлять несколько степеней окисления. Мы рассмотрим только соединения, в которых железо проявляет степени окисления +2 и +3. Таким образом, можно говорить, что у железа имеется два ряда соединений, в которых оно двух- и трехвалентно.
1) На воздухе железо легко окисляется в присутствии влаги (ржавление):
Это интересно:
“Может ли коррозия приносить пользу?!”
Ржавчина обладает хорошей сорбционной способностью к различным органическим веществам. После выкапывания ржавое железо вместе с органическими веществами нагревали в горнах, ковали, а затем охлаждали водой — закаливали. Углерод и азот появлялись в поверхностном слое откованного металла, упрочняя его и сообщая ему особую твердость. В слое при термической обработке образуется очень твердое соединение: карбид железа Fe3С — цементит. Впоследствии для получения твердой стали вместо длительного пребывания железа в земле перешли к плавке железа под слоем древесного угля.
Источник: Химия в школе
3) При высокой температуре (700–900°C) железо реагирует с парами воды:
4) Железо реагирует с неметаллами при нагревании:
5) Железо легко растворяется в соляной и разбавленной серной кислотах при обычных условиях:
6) В концентрированных кислотах – окислителях железо растворяется только при нагревании
На холоде концентрированные азотная и серная кислоты пассивируют железо!
7) Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей.
8) Качественные реакции на
IX. Применение железа
Основная часть получаемого в мире железа используется для получения чугуна и стали — сплавов железа с углеродом и другими металлами. Чугуны содержат около 4% углерода. Стали содержат углерода менее 1,4%.
Чугуны необходимы для производства различных отливок — станин тяжелых машин и т.п.
Стали используются для изготовления машин, различных строительных материалов, балок, листов, проката, рельсов, инструмента и множества других изделий. Для производства различных сортов сталей применяют так называемые легирующие добавки, которыми служат различные металлы: Мn, Сr, Мо и другие, улучшающие качество стали.
X. Тренажеры
XI. Задания для закрепления
Задание №1. Составьте уравнения реакций получения железа из его оксидов Fe2O3 и Fe3O4, используя в качестве восстановителя:
а) водород;
б) алюминий;
в) оксид углерода (II).
Для каждой реакции составьте электронный баланс.