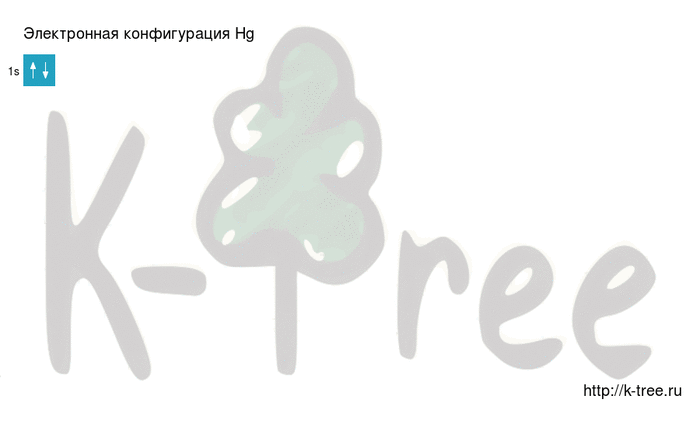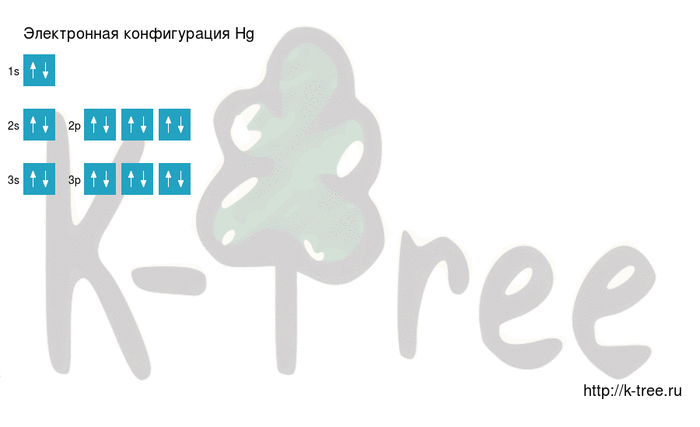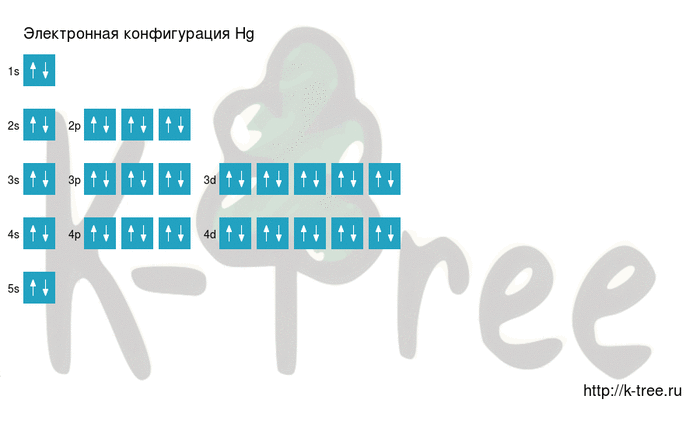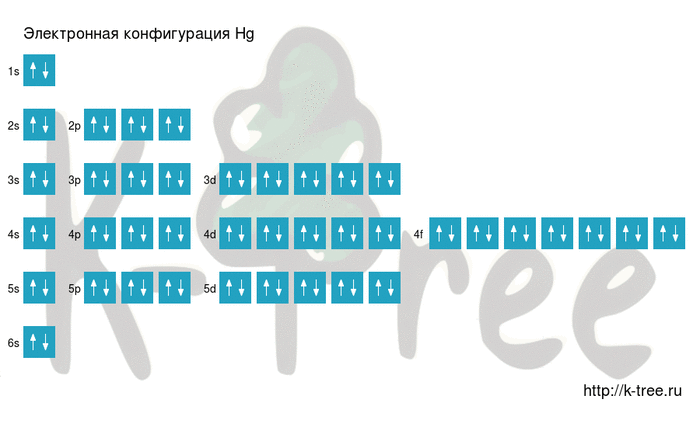ртуть в таблице менделеева номер
Описание выбранного элемента: Ртуть
Природная ртуть состоит из смеси 7 стабильных изотопов: 196 Hg (распространённость 0,155 %), 198 Hg (10,04 %), 199 Hg (16,94 %), 200 Hg (23,14 %), 201 Hg (13,17 %), 202 Hg (29,74 %), 204 Hg (6,82 %). Искусственным путём получены радиоактивные изотопы ртути с массовыми числами 171—210.
| Символ нуклида | Z ( p ) | N( n ) | Масса изотопа ( а. е. м. ) | Период полураспада (T1/2) | Спин и чётность ядра |
|---|---|---|---|---|---|
| Энергия возбуждения | |||||
| 171 Hg | 80 | 91 | 171,00376 | 80 мкс | 3/2- |
| 172 Hg | 80 | 92 | 171,99883 | 420 мкс | 0 |
| 173 Hg | 80 | 93 | 172,99724 | 1,1 мс | 3/2- |
| 174 Hg | 80 | 94 | 173,992864 | 2,0 мс | 0+ |
| 175 Hg | 80 | 95 | 174,99142 | 10,8 мс | 5/2- |
| 176 Hg | 80 | 96 | 175,987355 | 20,4 мс | 0+ |
| 177 Hg | 80 | 97 | 176,98628 | 127,3 мс | 5/2- |
| 178 Hg | 80 | 98 | 177,982483 | 269 мс | 0+ |
| 179 Hg | 80 | 99 | 178,981834 | 1,09 с | 5/2- |
| 180 Hg | 80 | 100 | 179,978266 | 2,58 с | 0+ |
| 181 Hg | 80 | 101 | 180,977819 | 3,6 с | 1/2- |
| 181m Hg | 210 кэВ | 13/2+ | |||
| 182 Hg | 80 | 102 | 181,97469 | 10,83 с | 0+ |
| 183 Hg | 80 | 103 | 182,974450 | 9,4 с | 1/2- |
| 183m1 Hg | 198 кэВ | 13/2+ | |||
| 183m2 Hg | 240 кэВ | 5 с | 13/2+ | ||
| 184 Hg | 80 | 104 | 183,971713 | 30,6 с | 0+ |
| 185 Hg | 80 | 105 | 184,971899 | 49,1 с | 1/2- |
| 185m Hg | 99,3 кэВ | 21,6 с | 13/2+ | ||
| 186 Hg | 80 | 106 | 185,969362 | 1,38 мин | 0+ |
| 186m Hg | 2,2173 МэВ | 82 мкс | 8- | ||
| 187 Hg | 80 | 107 | 186,969814 | 1,9 мин | 3/2- |
| 187m Hg | 59 кэВ | 2,4 мин | 13/2+ | ||
| 188 Hg | 80 | 108 | 187,967577 | 3,25 мин | 0+ |
| 188m Hg | 2,7243 МэВ | 134 | ns (12+ | ||
| 189 Hg | 80 | 109 | 188,96819 | 7,6 мин | 3/2- |
| 189m Hg | 80 кэВ | 8,6 мин | 13/2+ | ||
| 190 Hg | 80 | 110 | 189,966322 | 20,0 мин | 0+ |
| 191 Hg | 80 | 111 | 190,967157 | 49 мин | 3/2- |
| 191m Hg | 128 кэВ | 50,8 мин | 13/2+ | ||
| 192 Hg | 80 | 112 | 191,965634 | 4,85 ч | 0+ |
| 193 Hg | 80 | 113 | 192,966665 | 3,80 ч | 3/2- |
| 193m Hg | 140,76 кэВ | 11,8 ч | 13/2+ | ||
| 194 Hg | 80 | 114 | 193,965439 | 444 года | 0+ |
| 195 Hg | 80 | 115 | 194,966720 | 10,53 ч | 1/2- |
| 195m Hg | 176,07 кэВ | 41,6 ч | 13/2+ | ||
| 196 Hg | 80 | 116 | 195,965833 | стабилен | 0+ |
| 197 Hg | 80 | 117 | 196,967213 | 64,14 ч | 1/2- |
| 197m Hg | 298,93 кэВ | 23,8 ч | 13/2+ | ||
| 198 Hg | 80 | 118 | 197,9667690 | стабилен | 0+ |
| 199 Hg | 80 | 119 | 198,9682799 | стабилен | 1/2- |
| 199m Hg | 532,48 кэВ | 42,66 мин | 13/2+ | ||
| 200 Hg | 80 | 120 | 199,9683260 | стабилен | 0+ |
| 201 Hg | 80 | 121 | 200,9703023 | стабилен | 3/2- |
| 201m Hg | 766,22 кэВ | 94 мкс | 13/2+ | ||
| 202 Hg | 80 | 122 | 201,9706430 | стабилен | 0+ |
| 203 Hg | 80 | 123 | 202,9728725 | 46,595 сут | 5/2- |
| 203m Hg | 933,14 кэВ | 24 мкс | 13/2+ | ||
| 204 Hg | 80 | 124 | 203,9734939 | стабилен | 0+ |
| 205 Hg | 80 | 125 | 204,976073 | 5,14 мин | 1/2- |
| 205m Hg | 1,55640 МэВ | 1,09 мс | 13/2+ | ||
| 206 Hg | 80 | 126 | 205,977514 | 8,15 мин | 0+ |
| 207 Hg | 80 | 127 | 206,98259 | 2,9 мин | 9/2+ |
| 208 Hg | 80 | 128 | 207,98594 | 42 мин | 0+ |
| 209 Hg | 80 | 129 | 208,99104 | 37 с | 9/2+ |
| 210 Hg | 80 | 130 | 209,99451 | 10 мин | 0+ |
Понравился сайт? Разместите у себя его баннер!
Ртуть Hg
Ртуть в таблице менделеева занимает 80 место, в 6 периоде.
| Символ | Hg |
| Номер | 80 |
| Атомный вес | 200.5920000 |
| Латинское название | Hydrargyrum |
| Русское название | Ртуть |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема ртути
Hg: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10
Короткая запись:
Hg: [Xe]6s 2 4f 14 5d 10
Порядок заполнения оболочек атома ртути (Hg) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Ртуть имеет 80 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
10 электронов на 3d-подуровне
6 электронов на 4p-подуровне
2 электрона на 5s-подуровне
10 электронов на 4d-подуровне
6 электронов на 5p-подуровне
2 электрона на 6s-подуровне
14 электронов на 4f-подуровне
10 электронов на 5d-подуровне
Степень окисления ртути
Атомы ртути в соединениях имеют степени окисления 2, 1.
Ионы ртути
Валентность Hg
Атомы ртути в соединениях проявляют валентность II, I.
Валентность ртути характеризует способность атома Hg к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Hg
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Перейти к другим элементам таблицы менделеева
Ртуть в таблице Менделеева.
Ртуть, как важный элемент в таблице Менделеева.
Затронем такие темы как:
1. Что такое ртуть и когда она попала в таблицу менделеева?
2. Что такое атомарная ртуть?
3. История ртути.
4. Численные параметров ртути.
5. С какими элементами реагирует ртуть.
6. Физико-химические свойства ртути.
1. Что такое ртуть?
Ртуть, это металл относящийся к шестому периоду таблицы Менделеева и имеющий порядковый номер 80.
Hg имеет отношение к тяжёлым металлам, по этой причине имеет соответствующий класс ( 1-ый класс ) экологической опасности по ГОСТ 12.1.007.
Появление в таблице Менделеева.
В 1869 году Д.И. Менделеев открыл первые вариант своего периодического закона.
Именно тогда ртуть попала в его первую публикацию.
Более привычный нам вид таблицы Менделеева дополнило нам то время, когда научный мир обнаружил радиацию.
То есть в период 1898 по 2000 годы.
2. Атомарная ртуть. (Изотопы ртути)
Атомарная ртуть это ртуть состоящая из изотопов атомов ртути.
Изотопы ртути— это атомы ртути, которые имеют один и тот же атомарный номер, но разные атомные массы.
Это так называемая смешанная ртуть, где есть атомы с разными числами атомарной массы.
Атомная масса складывается из числа нейтронов и протонов в ядре.
Таким образом молекулярную ртуть можно представить, как атомарную ртуть и поделить на 7 видов атомов ртути.
Эти атомы (точнее изотопы) будут различимы по атомной массе.
Процент содержания каждого из изотопов ртути в основной массе ртути указан в скобках.
196Hg ( 0, 146%),
198Hg (10, 02%),
199Hg (16, 84%),
200Hg (23, 13%),
201Hg (13, 22%),
202Hg (29, 80%),
Изотопы ртути.
Существуют радиоактивные изотопы ртути.
Существование многих из этих изотопов характерно не природное появление а из задеятельности человека.
Ртуть в нашей жизни
3. история использования ртути
Древние греки и египтяне называли ртуть скифской водой.
Арабы вывели ртутно-серную теорию о происхождении металла, в которой ртуть была в роли матери металлов, а сера в качестве отца.
С этим металлом делали разные алхимические операции.
Арабские и западноевропейские алхимики хотели сделать ртуть твердой.
Они считали, что из полученного чистого серебра можно создать золото.
Ртуть имеет порядковый номер в таблице Менделеева – 80.
По латыни она называется Hydrargyrum (Hg).
Этот химический элемент является единственным металлом, который при обычных внешних условиях ( температура и давление) имеет жидкое агрегатное состояние.
Из истории относительно современной науки известно, что твердую ртуть впервые удалось получить Ломаносову в 1759 году, заморозив ее с помощью азотной кислоты.
Задолго до 20-го века, а так же до эксперемента Ломаносова люди уже умели получать этот металл в жидком виде.
Точные даты получения первой жидкой ртути и работы с ней не установлены.
В свое время, когда не было газоразрядных ламп с содержанием ртути и других технологических изобретений человечества, ртуть была, как важнейшее исходное вещество, из которого изготавливали препараты для продления жизни.
То есть ртуть использовалась знахарями для изготовления лекарства.
В 16-17-ом веке ртуть считалась основным металлом, ближайшим к золоту, еще до открытия Д.И Менделеевым его знаменитой таблицы.
Ртуть называли «меркурий», потому что она также близко находится от золота, как эта планета от солнца.
В медицине использовали этот металл вообще с глубокой древности.
Об этом было известно китайцам, индусам и египтянам.
Мавританский король соорудил в свое время фонтан с чистой ртутью, а не водой.
Речь идет о свойстве этого металла испаряться при нормальных условиях температуры и давления в окружающую среду.
Потому многим ученным пришлось пострадать от токсичности паров ртути.
Надо отметить, что как правило, при таких отравлениях ртутными парами речь шла о десятках граммов этого жидкого металла.
В наши дни существуют некоторые способы обнаружить ртуть в бытовых условиях, не прибегая к газовым анализаторам.
Например И.Ньютон, когда делал опыты с ртутью, надышался ее парами и изрядно отравился.
Тем не менее, и сегодня в некоторых современных лекарственных средствах имеется в составе ртуть в небольших количествах.
Пользоваться такими лекарствами ими нужно осторожно и ни в коем случае не превышать дозы.
4. ртуть в химии
Современная химия знает, что ртуть Hg расположена в шестом периоде и второй группе таблицы Менделеева.
5. вступает в реакции
Ртуть является достаточно нейтральным элементом, с которым способны взаимодействовать не так много других химических элементов и соединений.
Вот почему демеркуризация ртути требует специальных средств.
Тем не менее:
Необычные свойства ртути.
йод и хлор.
С этой точки зрения есть научное подтверждение того, что демеркуризация йодом вполне работоспособна.
6. физико-химические свойства ртути.
Ртуть является не единственным жидким металлом.
Так же есть жидкий металл, как Галлий.
Из-за лопнувшей энергосберегающей лампочки или разбившегося термометра возможно отравиться при определённых условиях, так как освободившаяся ртуть начинает испаряться.
Одним из таких условий интенсивного испарения ртути является случаи, когда небольшая капля ртути разбивается на множество мелких осколков.
Создается большая площадь испарения металла.
Происходит также разделение серебристого металла по мелким шарикам так же, если появится мельчайшее сотрясение, при повышенном поверхностном натяжении.
Особенно нежелательно разливать ртуть в помещении, так как трудно будет его найти.
При восьми градусной температуре начинается интенсивное испарение ртути, и ее пары расходятся по воздушному пространству.
ПДК ртути
ПДК ртути для жилых и не жилых помещений:
Ртуть
(молярная масса)
(первый электрон)
Содержание
История
Ртуть известна с древних времён. Нередко её находили в самородном виде (жидкие капли на горных породах), но чаще получали обжигом природной киновари. Древние греки и римляне использовали ртуть для очистки золота (амальгамирование), знали о токсичности самой ртути и её соединений, в частности сулемы. Много веков алхимики считали ртуть главной составной частью всех металлов и полагали, что если жидкой ртути возвратить твёрдость при помощи серы или мышьяка, то получится золото. Выделение ртути в чистом виде было описано шведским химиком Георгом Брандтом в 1735 году. Для представления элемента как у алхимиков, так и в настоящее время используется символ планеты Меркурий. Но принадлежность ртути к металлам была доказана только трудами Ломоносова и Брауна, которые в декабре 1759 года смогли заморозить ртуть и установить её металлические свойства в твёрдом состоянии: ковкость, электропроводность и др.
Происхождение названия
Нахождение в природе
Ртуть — относительно редкий элемент в земной коре со средней концентрацией 83 мг/т. Однако ввиду того, что ртуть слабо связывается химически с наиболее распространёнными в земной коре элементами, ртутные руды могут быть очень концентрированными по сравнению с обычными породами. Наиболее богатые ртутью руды содержат до 2,5 % ртути. Основная форма нахождения ртути в природе — рассеянная, и только 0,02 % её заключено в месторождениях. Содержание ртути в различных типах изверженных пород близки между собой (около 100 мг/т). Из осадочных пород максимальные концентрации ртути установлены в глинистых сланцах (до 200 мг/т). В водах Мирового океана содержание ртути — 0,1 мкг/л. Важнейшей геохимической особенностью ртути является то, что среди других халькофильных элементов она обладает самым высоким потенциалом ионизации. Это определяет такие свойства ртути, как способность восстанавливаться до атомарной формы (самородной ртути), значительную химическую стойкость к кислороду и кислотам.
Ртуть присутствует в большинстве сульфидных минералов. Особенно высокие её содержания (до тысячных и сотых долей процента) устанавливаются в блёклых рудах, антимонитах, сфалеритах и реальгарах. Близость ионных радиусов двухвалентной ртути и кальция, одновалентной ртути и бария определяет их изоморфизм во флюоритах и баритах. В киновари и метациннабарите сера иногда замещается селеном или теллуром; содержание селена часто составляет сотые и десятые доли процента. Известны крайне редкие селениды ртути — тиманит (HgSe) и онофрит (смесь тиманита и сфалерита).
Ртуть является одним из наиболее чувствительных индикаторов скрытого оруденения не только ртутных, но и различных сульфидных месторождений, поэтому ореолы ртути обычно выявляются над всеми скрытыми сульфидными залежами и вдоль дорудных разрывных нарушений. Эта особенность, а также незначительное содержание ртути в породах, объясняются высокой упругостью паров ртути, возрастающей с увеличением температуры и определяющей высокую миграцию этого элемента в газовой фазе.
В обычных условиях киноварь и металлическая ртуть не растворимы в воде, но в присутствии некоторых веществ (Fe2(SO4)3, озон, пероксид водорода) растворимость в воде этих минералов достигает десятков мг/л. Особенно хорошо растворяется ртуть в сульфидах щелочных металлов с образованием, например, комплекса HgS•nNa2S. Ртуть легко сорбируется глинами, гидроксидами железа и марганца, глинистыми сланцами и углями.
В природе известно около 20 минералов ртути, но главное промышленное значение имеет киноварь HgS (86,2 % Hg). В редких случаях предметом добычи является самородная ртуть, метациннабарит HgS и блёклая руда — шватцит (до 17 % Hg). На единственном месторождении Гуитцуко (Мексика) главным рудным минералом является ливингстонит HgSb4S7. В зоне окисления ртутных месторождений образуются вторичные минералы ртути. К ним относятся, прежде всего, самородная ртуть, реже метациннабарит, отличающиеся от таких же первичных минералов большей чистотой состава. Относительно распространена каломель Hg2Cl2. На месторождении Терлингуа (Техас) распространены и другие гипергенные галоидные соединения — терлингуаит Hg2ClO, эглестонит Hg4Cl.
Месторождения
Ртуть считается редким металлом.
Одно из крупнейших в мире ртутных месторождений находится в Испании (Альмаден). Известны месторождения ртути на Кавказе (Дагестан, Армения), в Таджикистане, Словении, Киргизии (Хайдаркан — Айдаркен), Донбассе (Горловка, Никитовский ртутный комбинат).
В России находятся 23 месторождения ртути, промышленные запасы составляют 15,6 тыс. тонн (на 2002 год), из них крупнейшие разведаны на Чукотке — Западно-Палянское и Тамватнейское.
В окружающей среде
До индустриальной революции осаждение ртути из атмосферы составляло около 4 нанограммов на 1 кубический дециметр льда. Природные источники, такие, как вулканы, составляют примерно половину всех выбросов атмосферной ртути. Причиной появления остальной половины является деятельность человека. В ней основную долю составляют выбросы в результате сгорания угля (главным образом в тепловых электростанциях) — 65 %, добыча золота — 11 %, выплавка цветных металлов — 6,8 %, производство цемента — 6,4 %, утилизация мусора — 3 %, производство соды — 3 %, чугуна и стали — 1,4 %, ртути (в основном для батареек) — 1,1 %, остальное — 2 %.
Одно из тяжелейших загрязнений ртутью в истории случилось в японском городе Минамата в 1956 году, что привело к более чем трём тысячам жертв, которые либо умерли, либо сильно пострадали от болезни Минамата.
Изотопы
Природная ртуть состоит из смеси 7 стабильных изотопов: 196 Hg (распространённость 0,155 %), 198 Hg (10,04 %), 199 Hg (16,94 %), 200 Hg (23,14 %), 201 Hg (13,17 %), 202 Hg (29,74 %), 204 Hg (6,82 %). Искусственным путём получены радиоактивные изотопы ртути с массовыми числами 171—210.
Получение
Ртуть получают обжигом киновари (сульфида ртути II) или металлотермическим методом:
HgS + O2 ⟶ Hg + SO2↑ HgS + Fe ⟶ FeS↓ + Hg
Пары ртути конденсируют и собирают. Этот способ применяли ещё алхимики древности.
На протяжении многих столетий в Европе основным и единственным месторождением ртути был Альмаден в Испании. В Новое время с ним стала конкурировать Идрия во владениях Габсбургов (современная Словения). Там же появилась первая лечебница для поражённых отравлением парами ртути рудокопов. В 2012 г. ЮНЕСКО объявило промышленную инфраструктуру Альмадена и Идрии памятником Всемирного наследия человечества.
В надписях во дворце древнеперсидских царей Ахеменидов (VI—IV века до н. э.) в Сузах упоминается, что ртутную киноварь доставляли сюда с Зеравшанских гор и использовали в качестве краски.