хром в таблице менделеева номер
Хром в таблице менделеева номер
| Название, символ, номер | Хром / Chromium (Cr), 24 |
|---|---|
| Атомная масса (молярная масса) | 51,9961(6) а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d 5 4s 1 |
| Радиус атома | 130 пм |
| Ковалентный радиус | 118 пм |
| Радиус иона | (+6e)52 (+3e)63 пм |
| Электроотрицательность | 1,66 (шкала Полинга) |
| Электродный потенциал | −0,74 |
| Степени окисления | 6, 3, 2, 0 |
| Энергия ионизации (первый электрон) | 652,4 (6,76) кДж/моль (эВ) |
| Плотность (при н. у.) | 7,19 г/см³ |
| Температура плавления | 2130 K |
| Температура кипения | 2945 K |
| Уд. теплота плавления | 21 кДж/моль |
| Уд. теплота испарения | 342 кДж/моль |
| Молярная теплоёмкость | 23,3 Дж/(K·моль) |
| Молярный объём | 7,23 см³/моль |
| Структура решётки | кубическая объёмноцентрированая |
| Параметры решётки | 2,885 Å |
| Температура Дебая | 460 K |
| Теплопроводность | (300 K) 93,9 Вт/(м·К) |
| Номер CAS | 7440-47-3 |
Содержание
История
Происхождение названия
Название элемент получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
История
Открыт на Среднем Урале, в Березовском золоторудном месторождении. Впервые упоминается в труде М. В. Ломоносова «Первые основания металлургии» (1763 год), как красная свинцовая руда, PbCrO4. Современное название — крокоит. В 1797 году французский химик Л. Н. Воклен выделил из него новый тугоплавкий металл (скорее всего, Воклен получил карбид хрома).
Нахождение в природе
Хром является довольно распространённым элементом в земной коре (0,012 % по массе). Основные соединения хрома — хромистый железняк (хромит) FeO·Cr2O3. Вторым по значимости минералом является крокоит PbCrO4.
Месторождения
Самые большие месторождения хрома находятся в ЮАР (1-е место в мире), Казахстане, России, Зимбабве, Мадагаскаре. Также есть месторождения на территории Турции, Индии, Армении, Бразилии, на Филиппинах.
Главные месторождения хромовых руд в РФ известны на Урале (Донские и Сарановское).
Разведанные запасы в Казахстане составляют свыше 350 миллионов тонн (2-е место в мире).
Геохимия и минералогия
Среднее содержание хрома в различных изверженных породах резко непостоянно. В ультраосновных породах (перидотитах) оно достигает 2 кг/т, в основных породах (базальтах и др.) — 200 г/т, а в гранитах десятки г/т. Кларк хрома в земной коре 83 г/т. Он является типичным литофильным элементом и почти весь заключен в минералах типа хромшпинелидов. Хром вместе с железом, титаном, никелем, ванадием и марганцем составляют одно геохимическое семейство.
Различают три основных минерала хрома: магнохромит (Mg, Fe)Cr2O4, хромпикотит (Mg, Fe)(Cr, Al)2O4 и алюмохромит (Fe, Mg)(Cr, Al)2O4. По внешнему виду они неразличимы, и их неточно называют «хромиты». Состав их изменчив:
Собственно, хромит, то есть FeCr2O4 сравнительно редок. Помимо различных хромитов, хром входит в состав ряда других минералов — хромовой слюды (фуксита), хромового хлорита, хромвезувиана, хромдиопсида, хромтурмалина, хромового граната (уваровита) и др., которые нередко сопровождают руды, но сами промышленного значения не имеют. В экзогенных условиях хром, как и железо, мигрирует в виде взвесей и может накапливаться в глинах. Наиболее подвижной формой являются хроматы.
Получение
Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 (хромит железа). Из него получают феррохром восстановлением в электропечах коксом (углеродом):
Fe(CrO2)2 + 4C → Fe + 2Cr + 4CO
Феррохром применяют для производства легированных сталей.
Чтобы получить чистый хром, реакцию ведут следующим образом:
1) сплавляют хромит железа с карбонатом натрия (кальцинированная сода) на воздухе:
4Fe(CrO2)2 + 8Na2CO3 + 7O2 → 8Na2CrO4 + 2Fe2O3 + 8CO2
2) растворяют хромат натрия и отделяют его от оксида железа;
3) переводят хромат в дихромат, подкисляя раствор и выкристаллизовывая дихромат;
4) получают чистый оксид хрома восстановлением дихромата натрия углём:
Na2Cr27 + 2C → Cr2O3 + Na2CO3 + CO
5) с помощью алюминотермии получают металлический хром:
Cr2O3 + 2Al → Al2O3 + 2Cr + 130kcal
6) с помощью электролиза получают электролитический хром из раствора хромового ангидрида в воде, содержащего добавку серной кислоты. При этом на катодах совершаются в основном 3 процесса:
Физические свойства
В свободном виде — голубовато-белый металл с кубической объёмноцентрированной решёткой, a = 0,28845 нм. Ниже температуры 38 °C является антиферромагнетиком, выше переходит в парамагнитное состояние (точка Нееля).
Хром имеет твёрдость по шкале Мооса 5, один из самых твёрдых чистых металлов (уступает только иридию, бериллию, вольфраму и урану). Очень чистый хром достаточно хорошо поддаётся механической обработке.
Изотопы
Природный хром состоит из четырех стабильных изотопов ( 50 Cr (изотопная распространённость 4,345 %), 52 Cr (83.789 %), 53 Cr (9.501 %), 54 Cr (2.365 %)).
Химические свойства
Характерные степени окисления
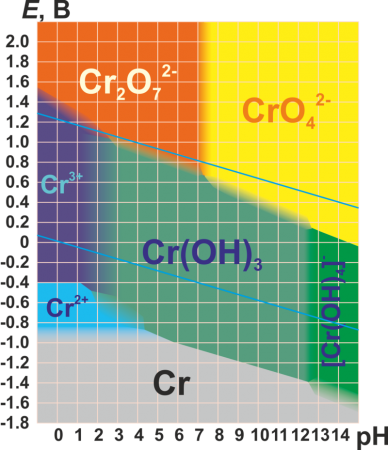
Для хрома характерны степени окисления +2, +3 и +6 (см. табл.). Практически все соединения хрома окрашены.
| Степень окисления | Оксид | Гидроксид | Характер | Преобладающие формы в растворах | Примечания |
|---|---|---|---|---|---|
| +2 | CrO (чёрный) | Cr(OH)2 (жёлтый) | Основный | Cr 2+ (соли голубого цвета) | Очень сильный восстановитель |
| +3 | Cr2O3 (зелёный) | Cr(OH)3 (серо-зелёный) | Амфотерный | Cr 3+ (зелёные или лиловые соли) | |
| +4 | CrO2 | не существует | Несолеобразующий | — | Встречается редко, малохарактерна |
| +6 | CrO3 (красный) | H2CrO4 | Кислотный | CrO4 2− (хроматы, желтые) | Переход зависит от рН среды. Сильнейший окислитель, гигроскопичен, очень ядовит. |
Простое вещество
Устойчив на воздухе за счёт пассивирования. По этой же причине не реагирует с серной и азотной кислотами. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами.
Синтезированы соединения хрома с бором (бориды Cr2B, CrB, Cr3B4, CrB2, CrB4 и Cr5B3), с углеродом (карбиды Cr23C6, Cr7C3 и Cr3C2), c кремнием (силициды Cr3Si, Cr5Si3 и CrSi) и азотом (нитриды CrN и Cr2N).
Соединения Cr(+2)
Степени окисления +2 соответствует основный оксид CrO (чёрный). Соли Cr 2+ (растворы голубого цвета) получаются при восстановлении солей Cr 3+ или дихроматов цинком в кислой среде («водородом в момент выделения»):
Все эти соли Cr 2+ — сильные восстановители вплоть до того, что при стоянии вытесняют водород из воды. Кислородом воздуха, особенно в кислой среде, Cr 2+ окисляется, в результате чего голубой раствор быстро зеленеет.
Коричневый или жёлтый гидроксид Cr(OH)2 осаждается при добавлении щелочей к растворам солей хрома(II).
Синтезированы дигалогениды хрома CrF2, CrCl2, CrBr2 и CrI2
Соединения Cr(+3)
Степени окисления +3 соответствует амфотерный оксид Cr2O3 и гидроксид Cr(OH)3 (оба — зелёного цвета). Это — наиболее устойчивая степень окисления хрома. Соединения хрома в этой степени окисления имеют цвет от грязно-лилового (в водных растворах ион Cr 3+ существует в виде аквакомплексов [Cr(H2O)6] 3+ ) до зелёного (в координационной сфере присутствуют анионы).
Cr 3+ склонен к образованию двойных сульфатов вида M I Cr(SO4)2·12H2O (квасцов)
Гидроксид хрома (III) получают, действуя аммиаком на растворы солей хрома (III):
Можно использовать растворы щелочей, но в их избытке образуется растворимый гидроксокомплекс:
Сплавляя Cr2O3 со щелочами, получают хромиты:
Непрокаленный оксид хрома(III) растворяется в щелочных растворах и в кислотах:
При окислении соединений хрома(III) в щелочной среде образуются соединения хрома(VI):
То же самое происходит при сплавлении оксида хрома (III) со щелочью и окислителями, или со щелочью на воздухе (расплав при этом приобретает жёлтую окраску):
Соединения хрома (+4)
При осторожном разложении оксида хрома(VI) CrO3 в гидротермальных условиях получают оксид хрома(IV) CrO2, который является ферромагнетиком и обладает металлической проводимостью.
Среди тетрагалогенидов хрома устойчив CrF4, тетрахлорид хрома CrCl4 существует только в парах.
Соединения хрома (+6)
Степени окисления +6 соответствует кислотный оксид хрома (VI) CrO3 и целый ряд кислот, между которыми существует равновесие. Простейшие из них — хромовая H2CrO4 и двухромовая H2Cr2O7. Они образуют два ряда солей: желтые хроматы и оранжевые дихроматы соответственно.
Оксид хрома (VI) CrO3 образуется при взаимодействии концентрированной серной кислоты с растворами дихроматов. Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую H2CrO4, дихромовую H2Cr2O7 и другие изополикислоты с общей формулой H2CrnO3n+1. Увеличение степени полимеризации происходит с уменьшением рН, то есть увеличением кислотности:
Но если к оранжевому раствору K2Cr2O7 прилить раствор щёлочи, как окраска вновь переходит в жёлтую, так как снова образуется хромат K2CrO4:
До высокой степени полимеризации, как это происходит у вольфрама и молибдена, не доходит, так как полихромовая кислота распадается на оксид хрома(VI) и воду:
Растворимость хроматов примерно соответствует растворимости сульфатов. В частности, жёлтый хромат бария BaCrO4 выпадает при добавлении солей бария как к растворам хроматов, так и к растворам дихроматов:
Образование кроваво-красного малорастворимого хромата серебра используют для обнаружения серебра в сплавах при помощи пробирной кислоты.
Известны пентафторид хрома CrF5 и малоустойчивый гексафторид хрома CrF6. Также получены летучие оксигалогениды хрома CrO2F2 и CrO2Cl2 (хромилхлорид).
Соединения хрома(VI) — сильные окислители, например:
Добавление к дихроматам перекиси водорода, серной кислоты и органического растворителя (эфира) приводит к образованию синего монопероксида хрома(VI) CrO5 (CrO(O2)2), который экстрагируется в органический слой; данная реакция используется как аналитическая.
Применение
Хром — важный компонент во многих легированных сталях (в частности, нержавеющих), а также и в ряде других сплавов. Добавка хрома существенно повышает твердость и коррозийную стойкость сплавов.
Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование).
Хром применяется для производства сплавов: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности.
Биологическая роль и физиологическое действие
Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
В чистом виде хром довольно токсичен, металлическая пыль хрома раздражает ткани лёгких. Соединения хрома(III) вызывают дерматиты.
Соединения хрома в степени окисления +6 особо токсичны. Практически вся хромовая руда обрабатывается через преобразование в дихромат натрия. В 1985 году было произведено примерно 136 000 тонн шестивалентного хрома. Другими источниками шестивалентного хрома являются триоксид хрома и различные соли — хроматы и дихроматы. Шестивалентный хром используется при производстве нержавеющих сталей, текстильных красок, консервантов для дерева, при хромировании и пр.
Шестивалентный хром является признанным канцерогеном при вдыхании. На многих рабочих местах сотрудники подвержены воздействию шестивалентного хрома, например, при гальваническом хромировании или сварке нержавеющих сталей. В Европейском союзе использование шестивалентного хрома существенно ограничено директивой RoHS.
Шестивалентный хром транспортируется в клетки человеческого организма с помощью сульфатного транспортного механизма благодаря своей близости к сульфатам по структуре и заряду. Трёхвалентный хром, более часто встречающийся, не транспортируется в клетки.
Внутри клетки Cr(VI) восстанавливается до метастабильного пятивалентного хрома (Cr(V)), затем до трехвалентного хрома (Cr(III)). Трехвалентный хром, присоединяясь к протеинам, создает гаптены, которые включают иммунную реакцию. После их появления чувствительность к хрому не пропадает. В этом случае даже контакт с текстильными изделиями, окрашенными хромсодержащими красками или с кожей, обработанной хромом, может вызвать раздражение кожи. Витамин C и другие агенты реагируют с хроматами и образуют Cr(III) внутри клетки.
Продукты шестивалентного хрома являются генотоксичными канцерогенами. Хроническое вдыхание соединений шестивалентного хрома увеличивает риск заболеваний носоглотки, риск рака лёгких. (Лёгкие особенно уязвимы из-за большого количества мелких капилляров). Видимо, механизм генотоксичности запускается пяти- и трёхвалентным хромом.
В США предельно допустимая концентрация шестивалентного хрома в воздухе составляет 5 мкг/м³ (0,005 мг/м³). В России предельно допустимая концентрация хрома (VI) существенно ниже — 1,5 мкг/м³ (0,0015 мг/м³).
Одним из общепризнанных методов избежания шестивалентного хрома является переход от технологий гальванического хромирования к газотермическому и вакуумному напылению.
Основанный на реальных событиях фильм «Эрин Брокович» режиссёра Стивена Содерберга рассказывает о крупном судебном процессе, связанном с загрязнением окружающей среды шестивалентным хромом, в результате которого у многих людей развились серьёзные заболевания.
Фото соединений хрома:

Хром окись пигментная

Паста ГОИ (содержит Окись хрома)
Калий хромовокислый (калий хромат)

Хромовой ангидрид (Хрома (VI) окись
Хром (III) окись
Хром азотнокислый
Хромокалиевые квасцы
Соединения двухвалентного хрома.
Оксид хрома (II) CrO
Гидроксид хрома (II) Cr(OH)2
Фторид хрома (II) CrF2
Хлорид хрома (II) CrCl2
Бромид хрома (II) CrBr2
Йодид хрома (II) CrI2
Сульфид хрома (II) CrS
Сульфат хрома (II) CrSO4
Соединения трехвалентного хрома.
Оксид хрома (III) Cr2O3
Гидроксид хрома (III) Cr(OH)3
Фторид хрома (III) CrF3
Хлорид хрома (III) CrCl3
Бромид хрома (III) CrBr3
Иодид хрома (III) CrI3
Оксифторид хрома (III) CrOF
Сульфид хрома (III) Cr2S3
Сульфат хрома (III) Cr2(SO4)3
Ортофосфат хрома (III) CrPO4
Соединения четырехвалентного хрома.
Оксид хрома (IV) CrO2
Фторид хрома (IV) CrF4
Хлорид хрома (IV) CrCl4
Хром – полезные свойства и особенности металла
Этот металл любят все. Промышленники – за отличные полезные характеристики. Эстеты и любители шикарных авто – за красоту и практичность. Хром востребован военными и ядерщиками.
Что представляет собой
Хром – это металл, элемент таблицы Менделеева №24.
Международное обозначение и формула – Chromium, Cr.
Серебристо-голубоватое блестящее вещество – одно из самых твердых (5,5 по Моосу) и тугоплавких металлов, но хрупко. Относится к чёрным металлам.
Структура, свойства роднят его с железом, марганцем, титаном, никелем. Эти элементы объединены в одно семейство.
Уникальная особенность элемента – ярко-радужная окраска соединений: голубизна, фиолет, зелень до изумрудности, желтизна, оранж, пурпур. Они обусловили название, благодаря им легко отличить хром от других металлов.
По-древнегречески χρῶμα (хрома) – краска, цвет.
История открытия
Хром как самостоятельный элемент впервые в истории упомянут Михаилом Ломоносовым (1763 год). Великий русский ученый обнаружил его, исследуя золотую руду с Урала (Березовский рудник).
Это был минерал крокоит. Первооткрыватель нарек его красной свинцовой рудой.
Спустя тридцать лет его французский коллега Луи Николя Воклен выделил из «сибирского красного свинца» металл с примесью карбида.
Месторождения и добыча
Первое и второе место по запасам у ЮАР и Казахстана.
Россия третья. Ее месторождения – на Среднем Урале.
Хромовые руды есть также у Зимбабве, Турции, Армении, Индии, на Филиппинах, Мадагаскаре.
Добыча ведется традиционными способами – карьерным либо шахтным.
Физико-химические характеристики
Физические и химические свойства хрома типичны для металлов:
Применение хрома затрудняют недостатки:
Однако они компенсируются достоинствами металла: тугоплавкостью, твердостью (пятый среди металлов), стойкостью к коррозии.
| Свойства атома | |
|---|---|
| Название, символ, номер | Хром / Chromium (Cr), 24 |
| Атомная масса (молярная масса) | 51,9961(6) а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d5 4s1 |
| Радиус атома | 130 пм |
| Химические свойства | |
| Ковалентный радиус | 118 пм |
| Радиус иона | (+6e)52 (+3e)63 пм |
| Электроотрицательность | 1,66 (шкала Полинга) |
| Электродный потенциал | −0,74 |
| Степени окисления | 6, 3, 2, 0 |
| Энергия ионизации (первый электрон) | 652,4 (6,76) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 7,19 г/см³ |
| Температура плавления | 2130 K (1856,9 °C) |
| Температура кипения | 2945 K (2671,9 °C) |
| Уд. теплота плавления | 21 кДж/моль |
| Уд. теплота испарения | 342 кДж/моль |
| Молярная теплоёмкость | 23,3 Дж/(K·моль) |
| Молярный объём | 7,23 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объёмноцентрированая |
| Параметры решётки | 2,885 Å |
| Температура Дебая | 460 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 93,9 Вт/(м·К) |
| Номер CAS | 7440-47-3 |
Нахождение в природе
В природе отмечено два десятка хромовых минералов. Основные – хромит и крокоит.
Изверженные породы содержат разную концентрацию элемента (г/т):
Каждая тонна земной коры содержит в среднем 83 г хрома.
Промышленный интерес представляет один класс – хромшпинелиды.
Металл содержат драгоценные камни – хромтурмалин, уваровит (хромовый гранат), другие.
Технология получения
Традиционное сырье для получения хрома – хромшпинелиды.
Главные способы получения металла – обогащение руды методом электролиза либо восстановлением.
Для повышения степени чистоты конечного продукта сырье сплавляют в электропечи с содой, добавляя кислород.
Производство металлического хрома почти абсолютной чистоты ведется методом электролиза концентрированных хромовых растворов либо восстановлением оксида хрома алюминием в вакуумных печах (при 1500°C).
Где используется
Металл используется по двум направлениям: как лигатура к другим металлам и как покрытие.
Металлургия
Отрасль, забирающая три четверти объемов металла. Хромом легируют стали для улучшения кондиций.
Такие достоинства сталей обусловили их применение как материала стволов артиллерии, корпусов субмарин, сейфов, металлорежущего, медицинского, химического инструментария. Из них выполнены двигатели космических кораблей, начинка плазмотронов.
Даже незначительное количество хрома в составе кратно улучшает механические свойства материала.
Самые известные хромсодержащие сплавы – с никелем (нихром) и железом (фехраль). Это прецизионные материалы с повышенным электрическим сопротивлением. Используются для работы при экстремальных температурах.
Другие отрасли промышленности
Продукция из металла и сплавов с ним выпускается для разных сегментов рынка:
Краски из перетертых хромовых руд применяли еще иконописцы Древней Руси.
Хром закупают фармацевтические гиганты, производители биодобавок, препаратов для похудения.
Декор
Хромированное покрытие корпуса часов либо деталей авто – не только маркер статусности. Такая обработка защищает от износа, коррозии, механических повреждений.
Толщина покрытия металлом зависит от назначения изделия: от 2 мкм (декоративный ассортимент) до 0,1 мм (детали байков, велосипедов, авто).
Процесс покрытия хромом называется хромированием. Он технологически прост и недорог.
На мировых биржах реализуют хромовую руду (Cr – 42%) в основном из Китая.
Значение для человека
Хром присутствует в организме человека изначально.
Здоровье
Он – участник ряда биологических процессов:
Достаточное содержание хрома в организме критично важно для людей с лишним весом, диабетом, заболеваниями щитовидной железы, сердца, сосудов.
Питание
Хромом богаты продукты всех основных групп:
Металлом насыщены сыры, бобовые, кукурузное масло, фрукты, хлеб из муки крупного помола, пивные дрожжи.
Дозировка
Ежесуточная потребность в хроме (мкг):
При беременности у женщин, активном образе жизни, физических нагрузках у мужчин потребность удваивается.
Предостережение
Опасность представляет чистый металл. Особенно попадание его пыли в дыхательную систему.
Это провоцирует онкологию, раздражение кожи.
По стандартам РФ, предельно допустимая концентрация хрома – 1,5 мкг на кубометр.
Люди, работающие на металлургических предприятиях, пользуются респираторами, другими средствами защиты.
Хромовая «пудра» самовоспламеняется на воздухе.