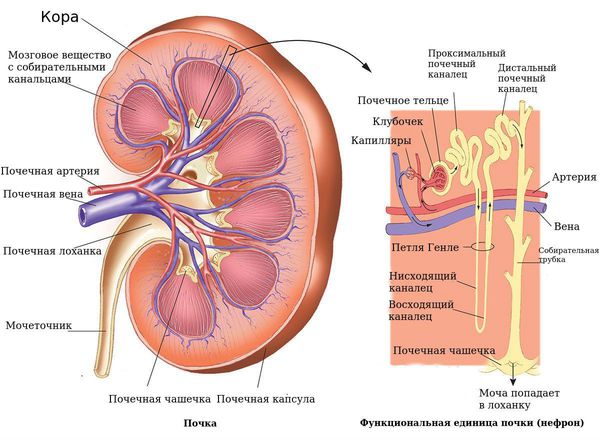
газы в почках что это
Эмфизематозный пиелонефрит
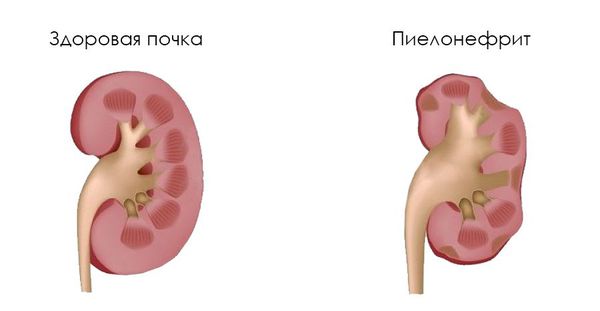
Эмфизематозный пиелонефрит (ЭП) — тяжелое инфекционное заболевание, поражающее почечную паренхиму, при котором газообразующие бактерии за счет спиртового брожения глюкозы превращают ее в газ, накапливающийся в некротизированных очагах и распространяющийся в околопочечную и забрюшинную клетчатку.
Этиология
Причиной заболевания является инфекция мочеполовых путей (ИМП) у пациентов с плохо контролируемым сахарным диабетом (СД) (90 % случаев), но ряд авторов описывают случаи возникновения ЭП без сопутствующего СД. Пациенты без СД имели ряд других серьезных патологий: различные виды иммунодефицитов, лучевая болезнь, милиарный туберкулез, алкоголизм и гипоальбуминемия. Около 30 % случаев сопровождались обструкцией мочевыводящих путей камнями, однако каким образом нарушенный пассаж мочи влияет на развитие заболевания неизвестно [1]. Основными возбудителями ИМП у лиц с ЭП являются: Escherichia coli в 60–70 % случаев, Klebsiella pneumoniae в 20–30 % случаев, в остальных случаях выделялись бактерии семейства: Acinetobacter, Proteus, Streptococcus и Pseudomonas. Помимо этого имеются сообщения инфицирования анаэробными микроорганизмами (Bacteroides fragilis и Clostridium septicum) и грибами (Candida и Aspergillus) [4–10].
Факторы риска, обусловливающие высокую летальность пациентов:
– тромбоцитопения;
– острая почечная недостаточность;
– нарушения сознания;
– обструкция мочевыводящих путей (мочекаменная болезнь и др.);
– иммунокомпрометированные лица;
– шок;
– гиперкреатининемия > 140 мкмоль/л.
Патогенез
Исследования Huang и Tseng выявили неотъемлемые звенья патогенеза заболевания:
– наличие бактерий, способных образовывать газ;
– высокий уровень тканевой глюкозы;
– нарушение иммунного ответа;
– ишемия паренхимы почек.
Классификация
Существуют две основные классификации ЭП, основанные на данных компьютерной томографии. Первая классификация Вана и соавт. [1] включает в себя два различных типа заболевания:
– поражается более одной трети почки;
– пузыреобразные или линейные скопления газа, располагающиеся от мозгового до коркового слоя;
– полное отсутствие скоплений жидкости в некротизированных полостях (отсутствует эффективный иммунный ответ);
– более агрессивная быстро прогрессирующая форма с крайне неблагоприятным прогнозом (летальность
– патологический процесс затрагивает менее одной трети почки;
– те же газовые полости, но меньшего размера и с экссудативной жидкостью;
– более благоприятный прогноз (летальность
Другая классификация, предложенная Huang и Tseng [2], все формы заболевания делит на 5 классов:
– класс I: газ в собирательной системе почек (эмфизематозный пиелит);
– класс II: газ в внутрипочечной паренхиме;
– класс IIIa: выход газа в околопочечное пространство;
– класс IIIb: выход газа в паранефральное пространство;
– класс IV: двусторонний эмфизематозный пиелонефрит.
Клинические проявления
– Симптомы тяжелого пиелонефрита (озноб, лихорадка, вялость сознания, боль с напряжением в проекции почек спереди и в реберно-позвоночном углу), неподдающиеся лечению
– Позитивные бактериологические тесты крови и мочи
– Уросепсис
– Шок
Часто имеются тяжелые сопутствующие нарушения:
– неконтролируемая гипергликемия;
– ацидоз;
– обезвоживание;
– электролитный дисбаланс.
Диагностика
Самые ценные методы для установления диагноза — это компьютерная томография органов брюшной полости (ОБП) с бактериологическим исследованием мочи и крови. Обзорная урограмма и УЗИ ОБП также могут помочь в верификации диагноза.
Компьютерная томография
Основные задачи КТ диагностики: выявление наличия, объема и расположения газа (внутрипочечное или в окружающих почки пространствах). Определение степени поражения паренхимы почки и степени распространения в окружающие ткани может быть полезно для выбора тактики лечения. Хотя и бесконтрастные снимки дают отличные результаты, возможно использование контраста, если нет противопоказаний, для лучшего описания внутриренального расположения газа. Основные диагностические находки у лиц с ЭП:
– увеличенные почки с разрушенной паренхимой;
– маленькие пузырьковидные или линейные радиально направленные вдоль пирамид скопления газа;
Рисунок 1 | Компьютерная томограмма органов брюшной полости в аксиальной проекции без контрастирования. В паренхиме и околопочечном прострастве обеих почек массивные скопления газа, больше справа.
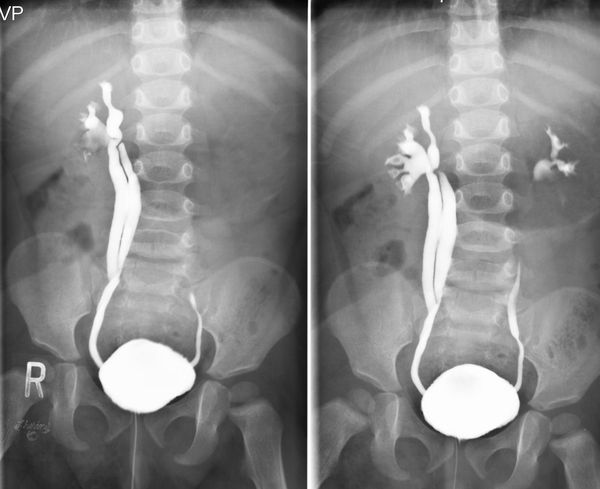
Обзорная урография (ОУ)
Полученная урограмма отлично визуализирует наличие газа в паренхиме или околопочечном пространстве, причем с увеличением объема газа увеличивается чувствительность метода. На обзорной урограмме иногда наблюдается искривление позвоночника в сторону пораженной почки и отсутствие тени поясничной мышцы на этой стороне. Обструкция рентген-позитивными камнями тоже легко поддается диагностике при при помощи ОУ. При отсутствии КТ возможно проведение экскреторной урографии, но с осторожностью, так как у многих пациентов имеется почечная недостаточность.
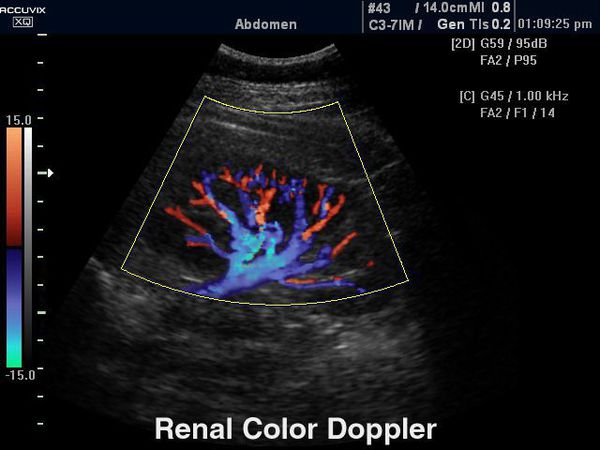
Ультразвуковая диагностика
Использование УЗИ у лиц с ЭП затруднена рядом факторов: большинство пациентов страдают ожирением, многие имеют вздутие живота, из-за чего бывает трудно дифференцировать газ из кишечника с газом в некротизированных почках. Несмотря на все трудности диагностики, ЭП может быть заподозрен у пациентов со следующими находками:
– увеличенные в размерах почки;
– высокоамплитудные эхо-сигналы в почечном синусе и/или почечной паренхиме, связанные с «грязным» затемнением;
– почка вообще может и не визуализироваться из-за деструкции и замещении газом, следует дифференцировать с кишечными газами.
В целом ультразвуковая диагностика с вероятностью 50 % может дать неправильные диагнозы у пациентов с 1 и 2 классами заболевания.
Рисунок 3 | УЗИ левой почки пациентки 50 лет с СД и ЭП. Увеличенная левая почка с нарушенной кортикомедуллярной дифференцировкой и линейными воздушными тенями в нижнем сегменте.
Дифференциальный диагноз
– Эмфизематозный пиелит
– Ятрогенные повреждения мочевыводящих путей
– Свищевые сообщения с почкой и ЧЛС
Лечение
Все пациенты должны быть госпитализированы в реанимационное отделение. Основное лечение на первоначальном этапе включает в себя стабилизацию гемодинамики, нормализацию уровня глюкозы и внутривенную антибиотикотерапию. В ходе лечения может понадобиться вентиляционная поддержка и постоянный контроль сахара крови и функции почек. После стабилизации состояния пациента следует решить, требуется ли чрескожное дренирование или экстренная нефрэктомия.
Антибиотикотерапия (АБТ)
В связи с тем, что наиболее частыми возбудителями ЭП являются грам-отрицательные микроорганизмы, начинать АБТ следует начинать с ингибиторов бета-лактамаз, фторхинолонов, цефалоспоринов и аминогликозидов. Аминогликозиды следует применять с осторожностью по отношению к пациентам с нарушенной почечной функцией. После получении данных антибиотикограммы, следует провести коррекцию лечения согласно резистентности возбудителей. При получении из проб более 1 микроорганизма возможно применение комбинированных или 2-х и более антибиотиков с учетом чувствительности каждого возбудителя.
Чрескожное дренирование (ЧД)
Впервые ЧД был предложен, как альтернативный нефрэктомии метод у клинически трудных пациентов, которые не перенесли бы операцию. На сегодняшний день ЧД наиболее распространенный метод лечения ЭП. ЧД показано при локализованных формах с сохраненной функционирующей тканью почки. Для процедуры лучше всего использовать дренажные трубки диаметром более 14 Fr и проводить ее под контролем КТ. При использовании трубок 14+ Fr промывание не требуется, но при необходимости орошения следует его проводить раствором антибиотика [11]. Дренажи должны быть установлены до тех пор, пока на контрольном снимке КТ не будет полного исчезновения газа и разрешения очагов воспаления. После установки дренажа пациентам в 13 % случаев требовалась нефрэктомия. Это были пациенты, у которых лекарственная терапия была неэффективна и по результатам радиоизотопных исследований обнаруживались нефункционирующие почки. Ряд авторов предлагают проводить дренирование всем пациентам перед удалением почки.
Нефрэктомия
Согласно исследованиям 1898–1982 гг. использование только медикаментозного лечения сопровождалось высоким процентом смертности (75–78 %), в то время как при использовании хирургических методов (ЧД и нефрэктомия) в 1898–1970 гг. смертность составила 42 %, а в 1970–1982 гг. вовсе 11 %. На этапе современной медицины нефрэктомия является методом выбора, но как и у любого оперативного вмешательства для ее проведения имеются четкие показания. Показания к нефрэктомия включают в себя:
– полная утрата почкой своей функции;
– обширная деструкция почечной паренхимы;
– класс IIIa и IIIb по классификации Huang и Tseng;
– наличие двух или более факторов риска (см. факторы риска для пациентов).
Нефрэктомия может быть простой или радикальной, из открытого или лапароскопического доступа.
Рисунок 4 | Лечебный алгоритм для типичных и особых групп пациентов с симптомами ЭП.
Симптомы, причины и лечение почечной инфекции (пиелонефрит)
Каковы симптомы почечной инфекции?
Симптомы почечной инфекции варьируются в зависимости от возраста. Симптомы могут включать
У ребенка младше 2 лет с почечной инфекцией может быть только высокая температура.
Взрослый старше 65 лет с почечной инфекцией может не иметь никаких типичных симптомов. У пожилого человека могут быть проблемы с мышлением, такие как:
Немедленно обратитесь за помощью
Немедленно обратитесь за помощью, если у вас есть симптомы почечной инфекции. Инфекция почек иногда может привести к опасному заболеванию, которое называется сепсис, что может быть опасно для жизни. Симптомы сепсиса включают жар, озноб, учащенное дыхание и частоту сердечных сокращений, сыпь и спутанность сознания.
Инфекция почек, которая становится хронической или продолжительной, может привести к необратимому повреждению почек.
Что вызывает инфекцию почек?
Инфекции почек вызваны бактериями или вирусами.
Ученые считают, что большинство инфекций почек начинаются с инфекции мочевого пузыря, которая перемещается вверх по течению, чтобы заразить одну или обе ваши почки. Чаще всего инфекция вызывается бактериями, которые обычно живут в кишечнике. Мочевыводящие пути имеют несколько способов предотвратить проникновение инфекции вверх по мочевыводящим путям. Например, мочеиспускание чаще всего вымывает бактерии, прежде чем оно достигнет мочевого пузыря. Иногда ваше тело не может бороться с бактериями, и бактерии вызывают ИМП. Если вы не получите медицинской помощи, чтобы остановить инфекцию, бактерии могут заразить ваши почки.
В некоторых случаях ваша кровь может переносить бактерии или вирусы из другой части вашего тела в почки.
Диагностика почечной инфекции (пиелонефрит)
Как медицинские работники диагностируют почечную инфекцию?
Медицинские работники используют Вашу историю болезни, медицинский осмотр и анализы для диагностики почечной инфекции.
Врач спросит, есть ли у вас в анамнезе состояния здоровья, которые повышают вероятность развития почечной инфекции. Во время медицинского осмотра медицинский работник спросит вас о ваших симптомах.
Какие тесты используют врачи для диагностики почечной инфекции?
Врачи могут использовать лабораторные или визуальные тесты для диагностики почечной инфекции.
Лабораторные тесты
Анализ мочи. Для анализа мочи вы будете собирать образец мочи в специальный контейнер в кабинете врача или в лаборатории. Медицинский работник осмотрит образец под микроскопом на наличие бактерий и лейкоцитов, которые организм вырабатывает для борьбы с инфекцией. Бактерии также могут быть обнаружены в моче здоровых людей, поэтому почечная инфекция диагностируется на основании симптомов и лабораторного анализа.
Культура мочи. Медицинский работник может посеять мочу, чтобы выяснить, какие бактерии вызывают инфекцию. Медицинский работник может увидеть, как размножаются бактерии, обычно в течение и затем определить оптимальное лечение.
Диагностические тесты
Лечение почечной инфекции (пиелонефрита)
Как медицинские работники лечат почечные инфекции?
Если у вас инфекция почек, медицинский работник назначит антибиотики. Даже до того, как будут получены результаты вашего теста, медицинский работник может назначить антибиотик, который борется с наиболее распространенными типами бактерий. Хотя вы можете чувствовать облегчение от своих симптомов, обязательно принимайте все антибиотики, которые назначает ваш лечащий врач.
Как только результаты лабораторных исследований будут получены, медицинский работник может переключить антибиотик на тот, который лучше лечит тип вашей инфекции. Вы можете принимать эти антибиотики перорально, через вену на руке, называемую внутривенно, или обоими способами.
Если вы сильно заболели почечной инфекцией, вы можете отправиться в клинику на постельный режим.
Если что-то, такое как почечный камень или увеличенная простата, блокирует ваши мочевыводящие пути, врач может решить проблему с помощью операции или другой процедуры.
Как я могу убедиться, что моя почечная инфекция полностью прошла?
Если у вас недавно была инфекция почек, медицинский работник будет часто повторять посев мочи после окончания лечения, чтобы убедиться, что ваша инфекция полностью прошла и не вернулась. Если повторный тест показывает инфекцию, вы можете принять еще один раунд антибиотиков. Если ваша инфекция вернется снова, он или она может назначить антибиотики на более длительный период времени.
Если ваш лечащий врач назначает антибиотики, принимайте все назначенные антибиотики и следуйте советам врача. Даже если вы начинаете чувствовать себя лучше, вы должны закончить полный курс лекарств.
Как я могу предотвратить инфекцию почек?
Многие инфекции почек начинаются с инфекции мочевого пузыря, поэтому профилактика инфекций мочевого пузыря может помочь предотвратить инфекции почек. Ученые все еще пытаются понять, как лучше всего предотвратить инфекции мочевого пузыря, но эти небольшие изменения в ваших повседневных привычках могут помочь:
Пейте много жидкости, особенно воды
Жидкости могут помочь вывести бактерии из мочевыделительной системы. Большинство здоровых людей должны стараться выпивать 200 гр жидкости каждый день. Если вам нужно пить меньше воды из-за других заболеваний, таких как проблемы с мочевым пузырем, почечная недостаточность или сердечные заболевания, спросите у своего врача, сколько жидкости полезно для вас.
Протрите спереди назад после использования туалета
Женщинам следует протирать спереди назад, чтобы бактерии не попали в уретру. Этот шаг наиболее важен после дефекации.
Мочитесь часто и когда возникает позыв
Старайтесь мочиться, по крайней мере, каждые Бактерии, более вероятно, будут расти в мочевом пузыре, когда моча остается в мочевом пузыре слишком долго.
Мочиться после секса
Как женщины, так и мужчины должны мочиться вскоре после секса, чтобы смыть бактерии, которые могли проникнуть в уретру во время секса.
Эмфизематозный пиелонефрит: эпидемиология, современные подходы к диагностике и лечению
Новинский А.А., Зинухов А.Ф.
Сведения об авторах:
ВВЕДЕНИЕ
Эмфизематозный пиелонефрит (ЭП) является редкой формой острого гнойного пиелонефрита, для которой характерно стремительное и тяжелое течение, обусловленное патогенным действием газообразующей бактериальной флоры. Развитие ЭП возможно как в молодом, так и в пожилом возрасте. Однако большинство пациентов с ЭП находятся в возрасте от 30 до 50 лет. Процесс чаще всего носит односторонний характер. У женщин ЭП развивается гораздо чаще, что объясняется более высоким риском развития у них инфекции мочевых путей по сравнению с мужчинами. До 90% больных ЭП страдают сахарным диабетом (СД), при этом зависимости от потребности в инсулинотерапии выявлено не было. Основной причиной развития ЭП у лиц, не страдающих СД, является нарушение оттока мочи из почки. Однако даже при наличии фактора обструкции распространенность гнойно-деструктивного процесса, как правило, меньше по сравнению с больными СД [1]. Другими факторами риска развития ЭП являются алкоголизм, наркомания, поликистоз почек, мочекаменная болезнь и состояния иммунодепрессии различной этиологии 1. ЭП – это смертельно опасное заболевание, требующее немедленного начала лечения. Тяжелым осложнением и основной причиной смерти является развитие уросепсиса. Смертность при ЭП может достигать 80% в зависимости от вида лечения и распространенности гнойно-деструктивного процесса. В настоящее время при использовании современных подходов к диагностике и лечению, адекватной антибиотикотерапии смертность составляет около 20-30% [4].
Впервые газообразующее инфекционное поражение почки было описано H.A. Kelly и W.G. MacCullum в 1898 году [5]. С тех пор в публикациях встречались различные названия этой болезни, например, эмфизема почки, пневмонефрит и др. Термин «эмфизематозный пиелонефрит» появился гораздо позже. Только в 1962 году E.H. Schultz и E.H. Klorfein предложили так обозначать ряд патологических процессов, которые приводят к деструкции почечной паренхимы с образованием газа [6].
В настоящее время в литературе описано всего несколько сот клинических случаев ЭП. Среди публикаций в основном встречаются описания отдельных клинических случаев. Крупных обзоров литературы, обобщающих всю текущую информацию об ЭП, мало в последние годы. Опубликованные клинические случаи, как правило, малочисленны, что делает менее валидными полученные результаты. Также сравнение наиболее крупных выборок затруднительно ввиду разных подходов к лечению больных ЭП. Малое количество опубликованных клинических случаев объясняется низкой заболеваемостью ЭП. Так, за 10 лет в крупном лечебном учреждении регистрируется всего около 20 случаев ЭП. Страны Азии сообщают о большей встречаемости ЭП, что, возможно, объясняется более низким уровнем доступности здравоохранения для населения [2].
Возбудителями ЭП являются факультативные анаэробные грамотрицательные ферментирующие бактерии, которые перерабатывают глюкозу и лактат с образованием углекислого газа и водорода, накапливающихся в зоне воспаления. Повышенный уровень глюкозы и лактата в крови наряду со снижением защитных сил организма у больных сахарным диабетом обеспечивают благоприятные условия для активации ферментирующих бактерий. Наиболее часто встречающимися возбудителями ЭП являются Escherichia coli (60%), Klebsiella pneumoniae (26%), бактерии рода Рroteus и Pseudomonas [4]. Микробные ассоциации встречаются в 10% случаев [7].
МАТЕРИАЛЫ И МЕТОДЫ
При написании обзора литературы были использованы данные о случаях эмфизематозного пиелонефрита в клинической практике, опубликованные в базах PubMed (https://www.ncbi.nlm.nih.gov/pubmed/), MEDLINE, Embase, Научной электронной библиотеки Elibrary.ru (https://elibrary.ru/). Поиск в базах данных проводили по ключевым словам: «эмфизематозный пиелонефрит», «классификация», «газообразующая бактериальная флора», «сахарный диабет», «консервативное лечение», «нефрэктомия», «чрескожное дренирование» («emphysematous pyelonephritis», «classification», «diabetes mellitus», «percutaneous drainage», «nephrectomy», «conservative treatment», «аntimicrobial therapy»). На первом этапе были найдены 754 источника, которые имели отношение к теме обзора. Из них были исключены тезисы конференций, короткие сообщения, дублирующиеся публикации. После чего, исходя из актуальности данных, достоверности источников, импакт-факторов журналов и последовательности изложения материала в рукописи, непосредственно для цитирования в обзоре были отобраны 25 статей из научных международных рецензируемых журналов.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Клинические проявления и диагностика
Для ЭП характерно стремительное развитие клинической симптоматики и тяжелое течение с развитием гнойно-деструктивных процессов в почке. Клиническая картина ЭП может варьировать от незначительных проявлений в виде тянущих болей в поясничной области до септического шока, но в целом повторяет симптомы острого пиелонефрита. Размытая клиническая картина вначале сменяется резким ухудшением самочувствия пациента в связи с быстрым развитием сепсиса и полиорганной недостаточности.
Естественной реакцией на воспалительный процесс бактериальной природы является лейкоцитоз с нейтрофильным сдвигом влево. При сочетании ЭП и СД, как правило, наблюдается умеренная выраженность лейкоцитоза или даже его отсутствие, что связано со снижением функциональной активности лейкоцитов и иммунной реактивности организма при СД [8]. Развитие именно мочевой инфекции подтверждается наличием лейкоцитов и бактерий в моче. Пневматурия встречается редко, в случае распространения инфекции на собирательную систему почки при эмфизематозном цистите. Вследствие разложения глюкозы на газ и кислоту моча имеет резко кислую реакцию. При нарушении функции почек в крови определяется повышенный уровень креатинина и мочевины. Лабораторными признаками развития сепсиса являются тромбоцитопения и соответствующие изменения коагулограммы (увеличение тромбинового времени, снижение концентрации фибриногена и увеличение D-димера), характерные для начала синдрома диссеминированного внутрисосудистого свертывания (ДВС-синдрома). Для подтверждения септицемии и идентификации возбудителя производится посев крови и мочи. Совпадение положительных результатов посева крови и посева мочи отмечается у 54% больных [9]. Однако результат может быть получен не ранее, чем через 24 часа даже при наличии современно оснащенной лаборатории, позволяющей выделять культуру в такие короткие сроки. Более быстрым способом подтверждения развития сепсиса и контроля эффективности его лечения является определение уровня прокальцитонина крови. Диагностическая точность прокальцитонинового теста составляет 75,4% [10]. Уровень прокальцитонина выше 2 нг/мл с высокой вероятностью свидетельствует об инфекционном процессе с системным воспалением.
Отличительной особенностью ЭП наряду с общими проявлениями острого гнойного пиелонефрита, такими как боль в поясничной области и гектическая лихорадка с потрясающими ознобами, является наличие газа в почке, паранефральных тканях и собирательной системе по данным визуализационных методов исследования. В случае распространения газа на околопочечную клетчатку и забрюшинное пространство возможно появление крепитации в поясничной области при пальпации.
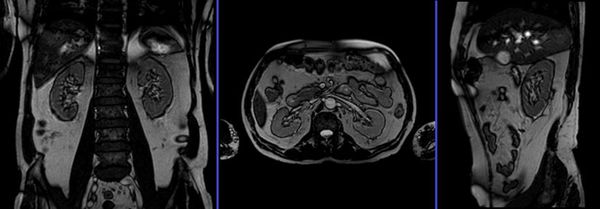
Таким образом, с учетом неспецифичности и вариабельности клинической симптоматики основным объективным методом диагностики ЭП является радиологический. На обзорной рентгенограмме брюшной полости и мочевых путей при ЭП можно увидеть скопление газа в проекции пораженной почки и интрапаренхиматозно. Однако скопление газа в петлях кишечника ввиду отсутствия подготовки пациентов к исследованию и/или наличие ожирения могут затруднять визуализацию почек на снимке. Экскреторная урография редко бывает информативной при ЭП, так как пораженная почка обычно не функционирует или функционирует плохо. При ультразвуковом исследовании (УЗИ) органов мочевой системы возможны сильные фокальные эхо-сигналы, предполагающие наличие газа в почечной паренхиме. Для подтверждения диагноза ЭП и оценки распространенности гнойнодеструктивного процесса в почке следует выполнять компьютерную томографию (КТ), которая также позволяет определить прогноз течения заболевания и тактику лечения. Для определения функции пораженной и контралатеральной почки применяют сцинтиграфию почек.
Скопления пузырьков газа при ЭП могут обнаруживаться в почечной паренхиме, окружающей клетчатке, собирательной системе почки и мочевыводящих путях. Для стандартизации оценки распространенности процесса при ЭП предложено две классификации, описание которых будет представлено ниже.
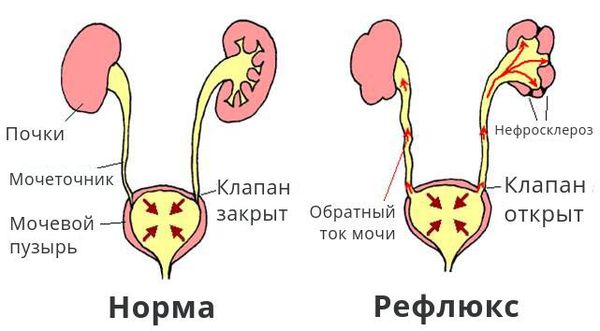
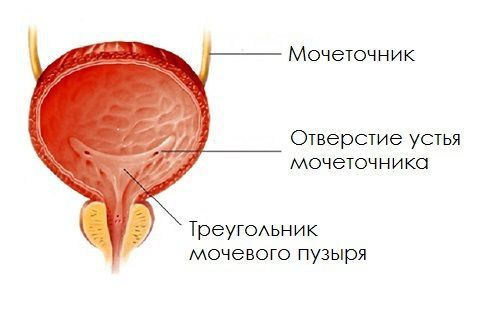
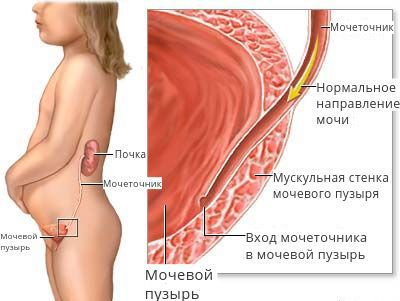
Что такое пузырно-мочеточниковый рефлюкс? Причины возникновения, диагностику и методы лечения разберем в статье доктора Батаевой Елены Петровны, нефролога со стажем в 25 лет.
Определение болезни. Причины заболевания
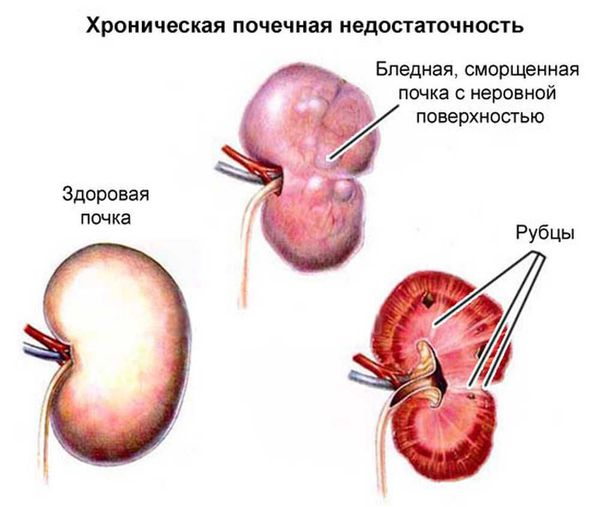
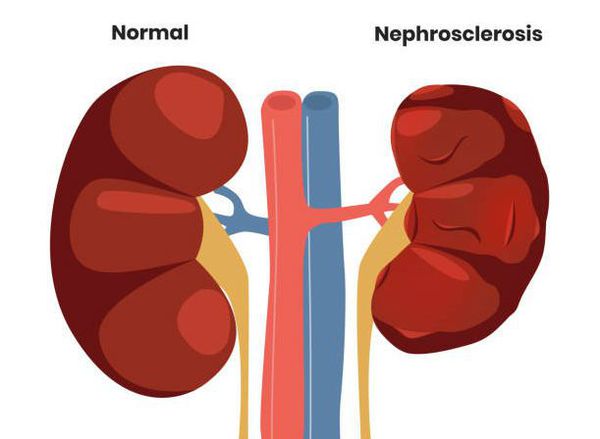
Обратный ток мочи впоследствии приводит к рефлюкс-нефропатии (нефросклерозу, фиброзу). Суть патологии в том, что структурно-функциональные единицы почки (нефроны) погибают и их замещает соединительная ткань. В результате почки уплотняются, сморщиваются, уменьшаются в размерах и перестают выполнять свои функции, вплоть до развития терминальной почечной недостаточности.
ПМР у детского населения чаще всего является результатом врождённой аномалии развития анатомических образований (мочеточников, УВС), вовлечённых в процесс физиологической динамики мочи. В этом случае рефлюкс считается первичным и иногда сочетается с другими пороками органов мочевой системы.
Нарушение резервуарной и эвакуаторной функции мочевого пузыря (нейрогенная дисфункция мочевого пузыря — НДМП), сопровождающееся повышением внутрипузырного давления, является достаточно частой причиной появления пузырно-мочеточникового рефлюкса у детей и взрослых.
Причиной ПМР могут стать врождённые аномалии развития органов мочевой системы:
Также пузырно-мочеточниковый рефлюкс может выступить в составе серьёзных генетических синдромов:
У взрослых пациентов затруднённый поток мочи с последующим забросом её в вышележащие отделы мочевыделительного тракта является результатом множества причин:
Симптомы пузырно-мочеточникового рефлюкса
Наиболее вероятными признаками пузырно-мочеточникового рефлюкса являются эпизоды повышения температуры, чаще до фебрильных цифр (от 38 до 39 °С), без установленной причины. При этом объективный осмотр пациента не выявляет каких-либо признаков инфекционного процесса. Однако коварство рассматриваемого патологического состояния заключается в его способности маскироваться под другие заболевания, либо в некоторых случаях протекать бессимптомно. В таких случаях своевременная диагностика затруднена, что увеличивает вероятность и скорость развития нефросклероза.
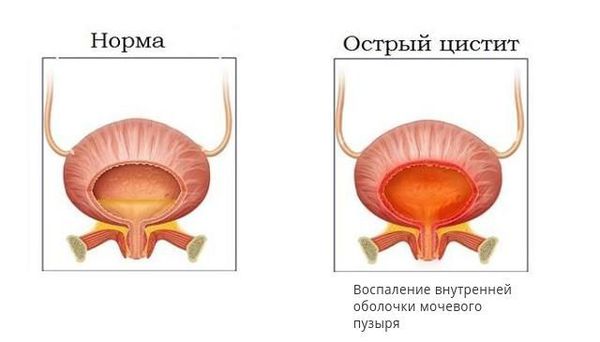
Клиника острого цистита также является «тревожным звонком» в пользу возможного рефлюкса. При этом самыми характерными оказываются симптомы расстройства процесса мочеиспускания: поллакиурия (учащённое мочеиспускание), олигакиурия (редкие мочеиспускания), странгурия (болезненность при произвольном извержении мочи), ложные позывы к акту мочеиспускания, чувство неполного опорожнения мочевого пузыря и др. Вместе с этим происходит изменение мочевого осадка, для которого характерно повышение количества лейкоцитов и эритроцитов и особенно капля алой крови в конце акта мочеиспускания.
Ещё до постановки диагноза больные нередко обращают внимание на помутнение мочи, неприятный запах, изменение консистенции. В первую очередь это свидетельствует о наличии инфекции мочевыводящих путей, осложнившей пузырно-мочеточниковый рефлюкс. Среди изолированных нарушений акта мочеиспускания особенное значение придают двух-, трёхфазным мочеиспусканиям, которые являются результатом истечения мочи, скопившейся в вышележащих отделах мочевыделительной системы при активном рефлюксе. Иногда единственным признаком заболевания может выступить непроизвольное мочеиспускание в ночное время, появившиеся случаи дневного недержания, либо неудержания мочи в сочетании с мочевым синдромом (изменением объёма, состава и структуры мочи) или без него.
Повторные случаи инфекции мочевой системы неустановленной локализации, бессимптомная бактериурия (повышенное содержание бактерий в моче) также позволяют заподозрить пузырно-мочеточниковый рефлюкс. А иногда могут быть его единственным проявлением, что, несомненно, диктует необходимость наблюдения за пациентом.
Нередко допустить наличие ПМР позволяет длительный постоянный, либо повторяющийся болевой синдром. Дети старшего возраста и взрослые, как правило, жалуются на боли в поясничной области, самостоятельные и после мочеиспускания. Боль также может локализоваться в крестце, а у пациентов раннего дошкольного возраста — в животе. При этом не представляется возможным связать её возникновение с приёмом пищи или актом дефекации, что исключает болезни желудочно-кишечного тракта.
Некоторые клинические признаки: пастозность (отёчность) лица, отёки на ногах, периодическое или постоянное повышение артериального давления, астения, остеопороз и др., к сожалению, иногда являются первыми проявлениями болезни. Также они свидетельствуют о латентном хроническом пиелонефрите, разрастании соединительной ткани с образованием рубцов (фиброзировании почек/рефлюкс-нефропатии) и хронической почечной недостаточности.
В некоторых случаях в результате длительного субклинического инфекционно-воспалительного процесса в мочевыделительной системе с развитием рефлюкс-нефропатии и почечной недостаточности выявляется задержка физического развития. Это может стать отправным критерием для дальнейшей диагностики и выявления дополнительных симптомов пузырно-мочеточникового рефлюкса. Клинико-лабораторные признаки анемии без обнаружения её причин и стойкости к стандартной терапии также могут указывать на длительно-существующий ретроградный ток мочи с развитием воспаления и выраженного нарушения почечных функций.
Патогенез пузырно-мочеточникового рефлюкса
Формирование физиологически полноценного пузырно-мочеточникового соустья с достаточным количеством мышечных и элластических структур начинается с эмбрионального периода развития и заканчивается в школьном возрасте. К 9-14 годам снаружи от циркулярного слоя начинает формироваться третий слой из продольных пучков гладкомышечных волокон.
Этот слой завершает процесс формирования физиологических сфинктеров, или гидравлических жомов, что препятствует обратному забросу мочи из мочевого пузыря в вышерасположенные отделы мочевыделительной системы. В этом случае внутрипузырная часть мочеточника, заключаясь между слизистым и мышечным слоями мочевого пузыря, становится сомкнутой при наполнении последнего мочой. При правильном формировании замыкательных механизмов эластичность и мышечный тонус помогают неизменённому мочеточнику адаптироваться к меняющемуся объёму мочевого пузыря и давлению в нём.
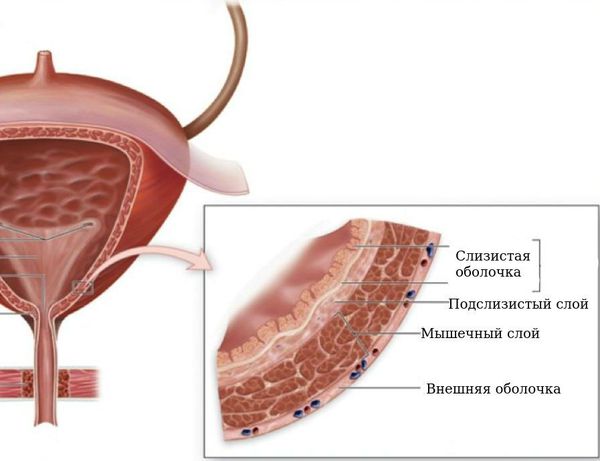
Если подслизистый отдел мочеточника уменьшен или практически отсутствует, если в мочепузырном треугольнике недостаточно гладкомышечных и соединительнотканных клеток, если давление в мочевом пузыре повышается по ряду ранее перечисленных причин, то формируется уретеротригональный дефект и происходит обратный заброс мочи, что способствует инфицированию вышерасположенных отделов мочевого тракта.
При этом микроорганизмы (чаще кишечная палочка, протей, клебсиелла и др.) благодаря наличию жгутиков и ворсинок более легко, чем в случае нормальной нисходящей уродинамики, адгезируются (прилипают) на уроэпителии, подавляя его местную иммунную защиту (макрофаги, лимфоциты, иммуноглобулин А, цитокины, белок Тамма — Хорсфалла и др.). Далее бактерии размножаются и выделяют продукты своей жизнедеятельности, вызывая общеинтоксикационные симптомы, а также расстройства мочеиспускания, болевые ощущения и т. п. Запускается каскад защитных реакций организма:
Высокая эпизодическая лихорадка в случае ПМР является отражением синтеза первичных и вторичных пирогенов — факторов, вызывающих подъём температуры тела (IL-1, IL-6, FNО – фактора некроза опухоли и др.). Они активизируются в результате растяжения лоханки и давления на почечную ткань или вследствие течения инфекционного процесса в мочевых путях.
Болевой синдром при течении рефлюкса может появиться по разным причинам:
Классификация и стадии развития пузырно-мочеточникового рефлюкса
В зависимости от причины выделяют два типа пузырно-мочеточникового рефлюкса:
По частоте возникновения пузырно-мочеточниковый рефлюкс бывает двух видов:
По тяжести протекания, согласно данным рентгеноурологического исследования (микционной цистографии), различают следующие формы рефлюкса:
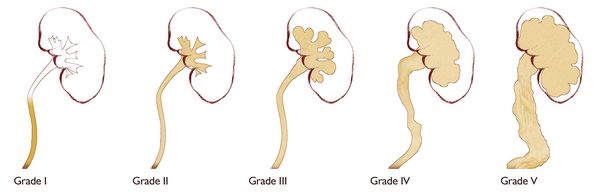
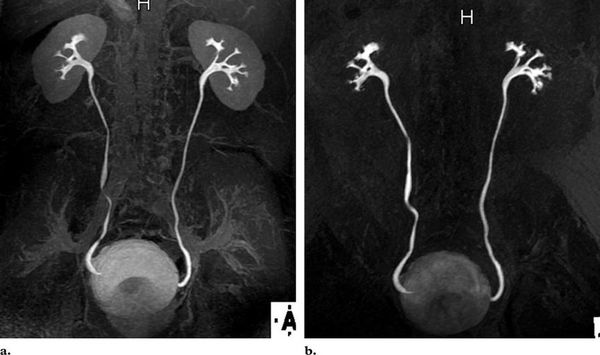
По физиологической выраженности различают пять степеней рефлюкса, выявляемые при микционной цистоуретерографии:
I степень — забрасывание рентгеноконтрастного вещества в дистальный отдел мочеточника без изменения его диаметра.
II степень — заполнение рентгеноконтрастным веществом мочеточника и чашечно-лоханочной системы без их расширения.
III степень — полостная система заполнена, мочеточник и лоханка расширены, но контуры чашечек не деформированы.
IV степень — расширенный мочеточник несколько извит, чашечки значительно уплощены, происходит умеренное истончение паренхимы почек.
Следует отметить, что помимо указанных критериев классификации при постановке диагноза необходимо учитывать осложнение рефлюкса, факт наличия рефлюкс-нефропатии, степень нарушения почечных функций.
Осложнения пузырно-мочеточникового рефлюкса
Диагностика пузырно-мочеточникового рефлюкса
Своевременное выявление пузырно-мочеточникового рефлюкса, качественное лечение и мониторинг позволяют предотвратить серьёзные осложнения с разрушительными последствиями для органа и организма в целом.
Тщательно собранный анамнез (включая семейный) составляет основу диагностики. Необходимо выяснить:
Физикальное обследование имеет не последнее значение в постановке диагноза. При этом обращают внимание на физическое развитие ребёнка, цвет кожи и слизистых, эластичность и влажность. Их патологические изменения могут быть признаком скрытого воспалительного процесса в мочевой системе, в том числе хронической почечной недостаточности. Наличие отёков различной локализации предоставляет возможность заподозрить снижение водовыделительной функции почек, сопутствующей ПМР. Необходимы осмотр и пальпация живота и поясничной области с оценкой болезненности в рёберно-позвоночных, рёберно-поясничных, мочеточниковых точках. Обязательным при любом виде объективного обследования является измерение артериального давления, частоты дыхательных движений, сердечных сокращений. Больному или его законному представителю необходимо в течение 2-3 суток регистрировать ритм спонтанных мочеиспусканий. Это поможет выявить картину функционального состояния мочевого пузыря.
Общий анализ крови косвенно указывает на какое-либо почечное страдание (анемию, лейкоцитоз, ускоренное СОЭ). Биохимичекий анализ крови с изменением нормальных показателей креатинина, мочевины, мочевой кислоты, электролитов свидетельствует о нарушенных канальцевых и клубочковых функциях. Проба Реберга, либо расчёт показателя скорости клубочковой фильтрации (очищения крови от продуктов обмена), рассчитанной по формуле Шварца, уточняет степень нарушения в почках.
Общий анализ мочи помимо воспалительных изменений, характерных для ПМР, может показать стойкую изолированную протеинурию (увеличение количества белка в моче), которая отражает присутствие рубцового процесса в почках при рефлюкс-нефропатии. Факт нарушения процессов концентрирования мочи при получении результатов диагностических проб (пробы Зимницкого) свидетельствует о снижении канальцевых функций. Регулярный посев мочи при установленном рефлюксе (не менее одного раза в шесть месяцев) помогает уточнить этиологию и стадию течения воспалительного процесса.
Из инструментальных методов исследования самым доступным является УЗИ органов мочевой системы, при котором обнаруживают косвенные признаки рефлюкса:
Доплерография (дуплексное сканирование почечного кровотока) позволяет определить состояние интраренальной гемодинамики, что ранее других методик визуализирует начало рефлюкс-нефропатии.
Первостепенным рентгеноконтрастным методом диагностики является микционная цистоуретрография (МЦУГ), позволяющая подтвердить, либо исключить заподозренный пузырно-мочеточниковый рефлюкс, а также установить его степень.
При радиоизотопной цистографии (РЦ) воздействие радиации значительно меньше, чем при МЦУГ, однако анатомические детали отражаются несколько слабее.
Всем больным с установленным ПМР ΙIΙ-IV степени показано проведение экскреторной урографии. Исследование осуществляется путём внутривенного введения рентгеноконтрастного препарата с последующим выполнением рентгенологических снимков. Данный метод позволяет визуализировать верхние мочевые пути и оценить их функциональность.
Иногда выполняется уродинамическое исследование:
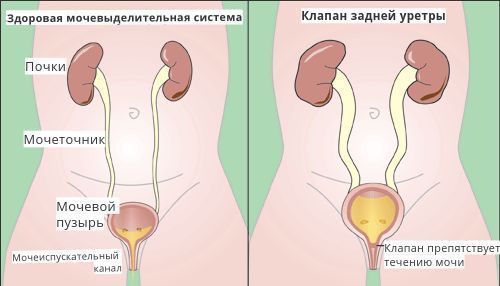
Такое тестирование особенно важно для пациентов, у которых подозревается вторичный рефлюкс (при спинномозговой грыже или у мальчиков с клапанами задней уретры). Но в большинстве случаев у пациентов с нейрогенными дисфункциями мочеиспускания диагностика и оценка состояния в отдалённом периоде должна ограничиться неинвазивными методами (УЗИ мочевого пузыря, ритм спонтанных мочеиспусканий).
Статическая и динамическая нефросцинтиграфия (введение и регистрация выведения радиоизотопа) с последующей оценкой на сцинтиграмме послойной структуры, размеров почек при уже установленном ПМР проводиться регулярно. Радиоизотопная ренография оценивает работу почек и скорость выведения мочи из организма справа и слева в отдельности, частота исследований определяется индивидуально. Магнитно-резонансная томография, позволяющая подробно оценить паренхиму, наличие рубцов и аномалий, является нечастой альтернативой экскреторной урографии.
Обязательным является наблюдение специалистов: терапевта/педиатра, нефролога, уролога, стоматолога, оториноларинголога, по показаниям — невролога, офтальмолога, ортопеда. Целью наблюдения должна быть профилактика инфекций и перманентного повреждения почечной паренхимы, а также его поздних осложнений. Для этого назначается антибиотикопрофилактика, ренопротективная терапия и/или хирургическая коррекция рефлюкса.
Лечение пузырно-мочеточникового рефлюкса
В настоящее время не существует чётких представлений о выборе и эффективности способов и методов лечения в каждой конкретной клинической ситуации. Лечебные варианты представлены консервативной терапией и оперативными вмешательствами (эндоскопические, лапароскопические и открытые операции), изолированно или в комбинации.
Индивидуальный выбор и успех лечения пузырно-мочеточникого рефлюкса зависит от идентификации его степени, возраста больного, стадии течения воспалительного процесса, наличия почечных рубцов, функционального состояния поражённой почки, ёмкости и функции мочевого пузыря, наличия сочетанных аномалий мочевого тракта, сопутствующей патологии, длительности течения болезни и возраста пациента.
Консервативная терапия подразумевает комплекс мероприятий, целью которых является:
В состав консервативной терапии входят соблюдение достаточного питьевого режима, диеты с ограничением поваренной соли, жирной, жареной пищи, копчёностей, маринадов, консервантов, пряностей. В рацион стоит включить пищу, богатую витаминами, обладающую оптимальной калорийностью. Рекомендован достаточный уровень физической активности, ежедневное опорожнение кишечника. Обязателен режим принудительных мочеиспусканий (один раз в 1,5-2,0 часа), при этом иногда прибегают к временной, либо постоянной катетеризации мочевого пузыря.
Антибиотикотерапия проводится с учётом выявленной, либо природной чувствительности препарата к инфекционному агенту, рост которого определён при бактериальном посеве мочи. В качестве лечения выбирают «защищённые» пенициллины, цефалоспорины IΙ-IΙI поколения, фторхинолоны в возрастных дозировках. При снижении функции почек проводится коррекция дозы, либо кратности применения в зависимости от степени нарушения. Для лечения артериальной гипертензии и профилактики нефросклероза используют ингибиторы АПФ, ангиотензина ΙI, кальциевых каналов, бета-блокаторы. При этом выбор препарата осуществляется с учётом ведущих патогенетических механизмов, степени выраженности, сопутствующей патологии, возраста больного.
Коррекция дискоординации мочевого пузыря проводится в зависимости от источника нарушения (уровня регуляции нормального акта мочеиспускания), формы (гиперрефлекторной, гипорефлекторной, арефлекторной, норморефлекторной). Используются лекартсвенные препараты: М-холиноблокаторы, антагонисты мускариновых рецепторов, ингибиторы ацетилхолинэстеразы, ноотропы, седативные средства, витамины группы В.
Физиолечение представлено лекарственным электрофорезом, диадинамометрией, амплипульс-, лазеротерапией. Разработан комплекс лечебной физкультуры, направленный на укрепление мышц промежности. Противорецидивные курсы продолжаются в течение долгих месяцев с использованием уроантисептиков нитрофуранового ряда в дозах 1/5-1/15 от нормальных.
Показаниями к оперативному лечению являются:
Лапароскопическое вмешательство является альтернативой открытой операции, отличается меньшими инвазивностью и временем, затраченным на коррекцию. При лапароскопии вероятность и выраженность послеоперационных осложнений сведена к минимуму, восстановление проходит гораздо быстрее.
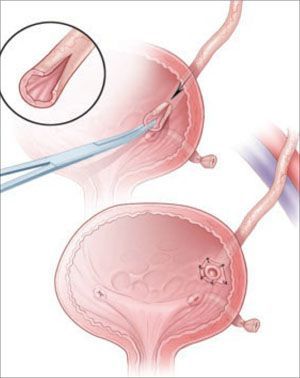
Эндоскопическое лечение подразумевает трансуретральное внедрение в подслизистый слой биоимплантов на основе тифлона, коллагена, силикона, геля для формирования состоятельности (замкнутости) пузырно-мочеточникового сегмента. При неэффективности вмешательства могут повторяться с вариациями вида операции.
При лечении вторичного ПМР на начальных этапах предлагается устранение причины, вызвавшей заболевание. Например, лечение нейрогенной дисфункции мочевого пузыря или хирургическое разрушение клапана задней уретры, ликвидация стенотического (суженного) участка мочеиспускательного канала у мальчиков, меатотомия (рассечение наружного отверстия уретры при её сужении) у девочек.
При потере функции почкой или выраженном её нарушении, проводится нефруретерэктомия (удаление почки с мочеточником).
Прогноз. Профилактика
Профилактика пузырно-мочеточникового рефлюкса заключается в планировании, правильном ведении беременности, внимательном физикальном осмотре пациента вне зависимости от возраста и клинической ситуации, своевременном опорожнении мочевого пузыря и кишечника. Широко распространено медико-генетическое консультирование. Рекомендуется не пренебрегать регулярной диспансеризацией, лечением на ранних стадиях любой патологии мочеполового тракта.
Для профилактики возможных тяжёлых и опасных для жизни осложнений пузырно-мочеточникого рефлюкса большое значение имеет выбор оптимальных методов оперативного лечения, консервативной терапии, в первую очередь антибактериальной. Мультидисциплинарный подход, грамотное ведение документации, внимательное наблюдение за пациентом позволяют предупредить возникновение и развитие серьёзных последствий.
Прогноз заболевания во многом зависит от своевременной диагностики и адекватности терапии, а также от степени рефлюкса и скорости развития рефлюкс-нефропатии.
Возможно спонтанное разрешение рефлюкса, чаще всего за счёт созревания корковых и спинальных механизмов регуляции произвольных микций и пузырно-мочеточникового сегмента. Вероятность самоизлечения тем выше, чем меньше степень рефлюкса и возраст ребёнка.
Ранняя постановка диагноза, особенно при ПМР невысокой степени, правильный выбор способа лечения в большинстве случаев позволяет избавиться от рефлюкса без тяжёлых последствий. В противном случае формируются грозные осложнения — вторичное сморщивание почки (почек) с последующей утратой их функций. Последнее приводит к почечной недостаточности, которая со временем может грозить трансплантацией органа, что значительно снизит качество жизни больного, а также может привести к гибели от различных осложнений.