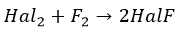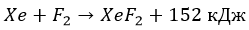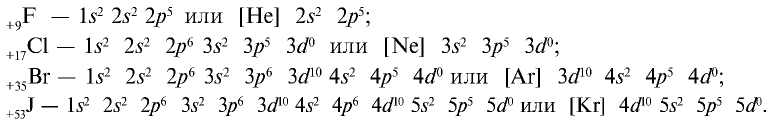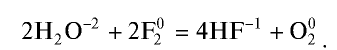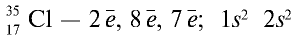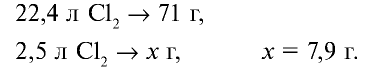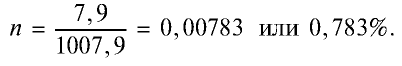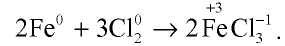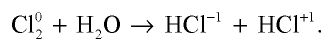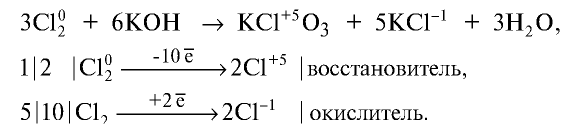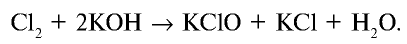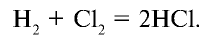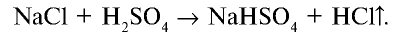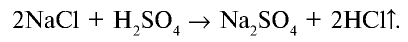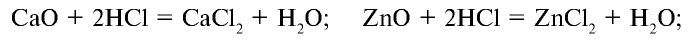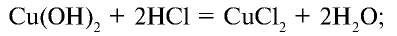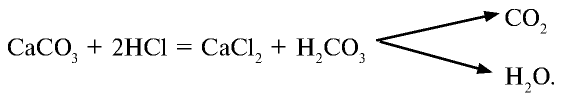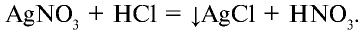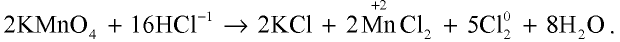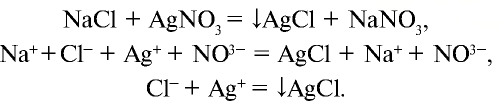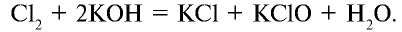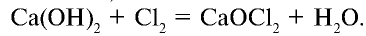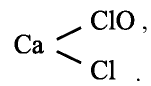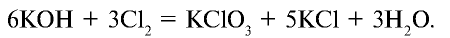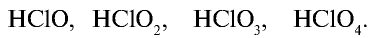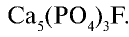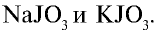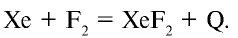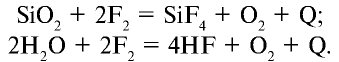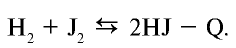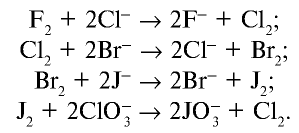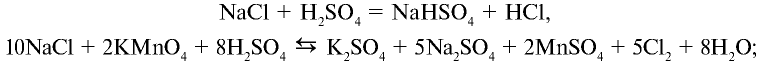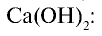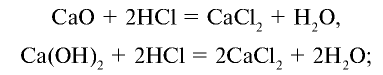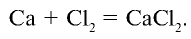галоген в химии что это
Галогены в химии: что это, их характеристики и свойства, примеры
Содержание:
Галогены – элементы, находящиеся в VIIA группе. Они взаимодействуют со многими неорганическими и органическими соединениями. К ним относятся:
Галогены широко распространены в природных условиях.
Строение галогенов
На наружном уровне галогенов располагается шесть спаренных и один неспаренный электрон. До устойчивого состояния элементам недостает одного электрона, поэтому они относятся к сильным окислителям. Молекулы галогенов состоят из двух атомов.
У галогенов в соединениях, как правило, отрицательная степень окисления:
В некоторых соединениях для них характерна положительная степень окисления:
Фтор – самый электроотрицательный элемент, который окисляет даже кислород. Таким образом, существует фторид кислорода OF2.
Закономерности галогенов
В ряду F-Cl-Br-I уменьшается электроотрицательность. Следовательно, фтор – самый активный элемент. У него самый маленький атомный радиус, поэтому он активно притягивает к себе электроны.
Физические свойства
В ряду химических элементов F-Cl-Br-I повышается плотность вещества. В нормальных условиях галогены выглядят следующим образом:
Галогены ядовиты и издают неприятный аромат. Они практически не растворимы в воде. Только фтор может реагировать с водой.
Способы получения
Получение хлора
В промышленности хлор получают путем электролиза.
В лаборатории хлор получают при реакции соляной кислоты и сильных окислителей.
Получение фтора
Фтор получают с помощью электролиза расплава.
Получение брома
Бром получают с помощью окисления.
Получение йода
Йод получают с помощью окисления.
Химические свойства
Галогены – окислители, которые реагируют с металлами и неметаллами.
В реакциях со сложными веществами галогены ведут себя как окислители.
Применение галогенов
Костная ткань и зубная эмаль включают соединения фтора. При недостатке фтора зубная эмаль разрушается. В состав плазмы крови входят различные хлориды. Соединения брома регулируют процессы торможения и возбуждения нервной системы. Йод регулирует работу щитовидной железы, а также контролирует обмен веществ.
Фторид кислорода используется в производстве ракетного топлива. Соединения фтора входят в состав зубных паст. С помощью молекулярного хлора обеззараживают воду, а также используют для отбеливания тканей, бумаги, древесины. Поваренная соль – хлорид натрия, который добавляется в пищу. А хлорид калия применяется в качестве удобрения.
Галогены
К галогенам относятся фтор F, хлор Cl, бром Br, иод I, астат At, а также (формально) искусственный элемент унунсептий Uus.
| Фтор F | Хлор Cl | Бром Br | Иод I |
|---|---|---|---|
 |  |  |
Все галогены — неметаллы. На внешнем энергетическом уровне 7 электронов, являются сильными окислителями. При взаимодействии с металлами возникает ионная связь, и образуются соли. Галогены, (кроме F) при взаимодействии с более электроотрицательными элементами, могут проявлять и восстановительные свойства вплоть до высшей степени окисления +7.
Содержание
Распространённость элементов и получение простых веществ
Как уже было сказано выше, галогены имеют высокую реакционную способность, поэтому встречаются в природе обычно в виде соединений.
Их распространённость в земной коре уменьшается при увеличении атомного радиуса от фтора к иоду. Количество астата в земной коре измеряется граммами, а унунсептий в природе отсутствует. Фтор, хлор, бром и иод производятся в промышленных масштабах, причем хлор производится в гораздо больших количествах.
В природе эти элементы встречаются в основном в виде галогенидов (за исключением иода, который также встречается в виде иодата натрия или калия в месторождениях нитратов щелочных металлов). Поскольку многие хлориды, бромиды и иодиды растворимы в воде, то эти анионы присутствуют в океане и природных рассолах. Основным источником фтора является фторид кальция, который очень малорастворим и находится в осадочных породах (как флюорит CaF2).
Основным способом получения простых веществ является окисление галогенидов. Высокие положительные стандартные электродные потенциалы Eo(F2/F − ) = +2,87 В и Eo(Cl2/Cl − ) = +1,36 В показывают, что окислить ионы F − и Cl − можно только сильными окислителями. В промышленности применяется только электролитическое окисление. При получении фтора нельзя использовать водный раствор, поскольку вода окисляется при значительно более низком потенциале (+1,32 В) и образующийся фтор стал бы быстро реагировать с водой. Впервые фтор был получен в 1886 г. французским химиком Анри Муассаном при электролизе раствора гидрофторида калия KHF2 в безводной плавиковой кислоте.
В промышленности хлор в основном получают электролизом водного раствора хлорида натрия в специальных электролизёрах. При этом протекают следующие реакции:
полуреакция на аноде: 
полуреакция на катоде:
Окисление воды на аноде подавляется использованием такого материала электрода, который имеет более высокое перенапряжение по отношению к O2, чем к Cl2 (таким материалом оказался катодное и анодное пространства разделены полимерной ионообменной мембраной. Мембрана позволяет катионам Na + переходить из анодного пространства в катодное. Переход катионов поддерживает электронейтральность в обеих частях электролизёра, так как в течение электролиза отрицательные ионы удаляются от анода (превращение 2Cl − в Cl2) и накапливаются у катода (образование OH − ). Перемещение OH − в противоположную сторону могло бы тоже поддерживать электронейтральность, но ион OH − реагировал бы с Cl2 и сводил на нет весь результат.
Физические свойства галогенов
| Простое вещество | Температура плавления, °C | Температура кипения, °C |
| F2 | −220 | −188 |
| Cl2 | −101 | −34 |
| Br2 | −7 | 58 |
| I2 | 113,5 | 184,885 |
| At2 | 244 | 309 [2] |
Химические свойства галогенов
Все галогены проявляют высокую окислительную активность, которая уменьшается при переходе от фтора к астату. Фтор — самый активный из галогенов, реагирует со всеми металлами без исключения, многие из них в атмосфере фтора самовоспламеняются, выделяя большое количество теплоты, например:
2Al + 3F2 = 2AlF3 + 2989 кДж, 2Fe + 3F2 = 2FeF3 + 1974 кДж.
Без нагревания фтор реагирует и со многими неметаллами (H2, S, С, Si, Р) — все реакции при этом сильно экзотермические, например:
При нагревании фтор окисляет все другие галогены по схеме
где Hal = Cl, Br, I, At, причем в соединениях HalF степени окисления хлора, брома, иода и астата равны +1.
Наконец, при облучении фтор реагирует даже с инертными (благородными) газами:
Взаимодействие фтора со сложными веществами также протекает очень энергично. Так, он окисляет воду, при этом реакция носит взрывной характер:
Свободный хлор также очень реакционноспособен, хотя его активность и меньше, чем у фтора. Он непосредственно реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов. Для сравнения приведем уравнения реакций хлора с теми же простыми веществами, что и для фтора:
2Al + 3Cl2 = 2AlCl3(кр) + 1405 кДж, 2Fe + ЗCl2 = 2FeCl3(кр) + 804 кДж, Si + 2Cl2 = SiCl4(Ж) + 662 кДж, Н2 + Cl2 = 2HCl(г)+185кДж.
Особый интерес представляет реакция с водородом. Так, при комнатной температуре, без освещения хлор практически не реагирует с водородом, тогда как при нагревании или при освещении (например, на прямом солнечном свету) эта реакция протекает со взрывом по приведенному ниже цепному механизму:
Cl2 + hν → 2Cl, Cl + Н2 → HCl + Н, Н + Cl2 → HCl + Cl, Cl + Н2 → HCl + Н и т. д.
Возбуждение этой реакции происходит под действием фотонов ( hν ), которые вызывают диссоциацию молекул Cl2 на атомы — при этом возникает цепь последовательных реакций, в каждой из которых появляется частица, инициирующая начало последующей стадии.
Реакция между Н2 и Cl2 послужила одним из первых объектов исследования цепных фотохимических реакций. Наибольший вклад в развитие представлений о цепных реакциях внёс русский учёный, лауреат Нобелевской премии (1956 год) Н. Н. Семёнов.
Хлор вступает в реакцию со многими сложными веществами, например замещения и присоединения с углеводородами:
Хлор способен при нагревании вытеснять бром или иод из их соединений с водородом или металлами:
а также обратимо реагирует с водой:
Cl2 + Н2О = HCl + HClO — 25 кДж.
Хлор, растворяясь в воде и частично реагируя с ней, как это показано выше, образует равновесную смесь веществ, называемую хлорной водой.
Заметим также, что хлор в левой части последнего уравнения имеет степень окисления 0. В результате реакции у одних атомов хлора степень окисления стала −1 (в HCl), у других +1 (в хлорноватистой кислоте HOCl). Такая реакция — пример реакции самоокисления-самовосстановления, или диспропорционирования.
Хлор может таким же образом реагировать (диспропорционировать) со щелочами:
Cl2 + 2NaOH = NaCl + NaClO + Н2О (на холоде), 3Cl2 + 6КОН = 5KCl + KClO3 + 3Н2О (при нагревании).
Химическая активность брома меньше, чем у фтора и хлора, но все же достаточно велика в связи с тем, что бром обычно используют в жидком состоянии и поэтому его исходные концентрации при прочих равных условиях больше, чем у хлора.
Для примера приведем реакции взаимодействия брома с кремнием и водородом:
Si + 2Br2 = SiBr4(ж) + 433 кДж, Н2 + Br2 = 2HBr(г) + 73 кДж.
Являясь более «мягким» реагентом, бром находит широкое применение в органической химии.
Отметим, что бром, так же, как и хлор, растворяется в воде, и, частично реагируя с ней, образует так называемую «бромную воду», тогда как иод практически в воде не растворим и не способен её окислять даже при нагревании; по этой причине не существует «иодной воды». Но иод способен растворяться в растворах иодидов с образованием комплексных анионов:
Образующийся раствор называется раствором Люголя.
Иод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании. Взаимодействие же иода с водородом происходит только при сильном нагревании, реакция является эндотермической и сильно обратимой:
Таким образом, химическая активность галогенов последовательно уменьшается от фтора к астату. Каждый галоген в ряду F — At может вытеснять последующий из его соединений с водородом или металлами, то есть каждый галоген в виде простого вещества способен окислять галогенид-ион любого из последующих галогенов. Астат ещё менее реакционноспособен, чем иод. Но и он реагирует с металлами (например с литием):
2Li + At2 = 2LiAt — астатид лития.
Не все знают, что под пугающим названием «галогены» зачастую скрываются распространенные в быту вещества. Не в чистом виде, но все-таки. Отдельными представителями «семейства» ежедневно пользуется каждый человек.
На упаковке любой зубной пасты имеется словосочетание со словом «фтор». Полезен для зубной эмали.
Хлор знаком любой домохозяйке и сотруднику клининговой компании. А уж его запах знают все, кто посещал бассейн или лечебные учреждения России. Не пустой звук для советских школьников. Даже не из курса химии, а из уроков химзащиты в рамках начальной военной подготовки (НВП).
Про «бром» ходили легенды среди военнослужащих СССР. Насколько сведения достоверны – неизвестно.
Темно-коричневая бутылочка с «йодом» – постоянный спутник любителя поиграть с котенком и непоседливого ребенка. Распространенный антисептик.
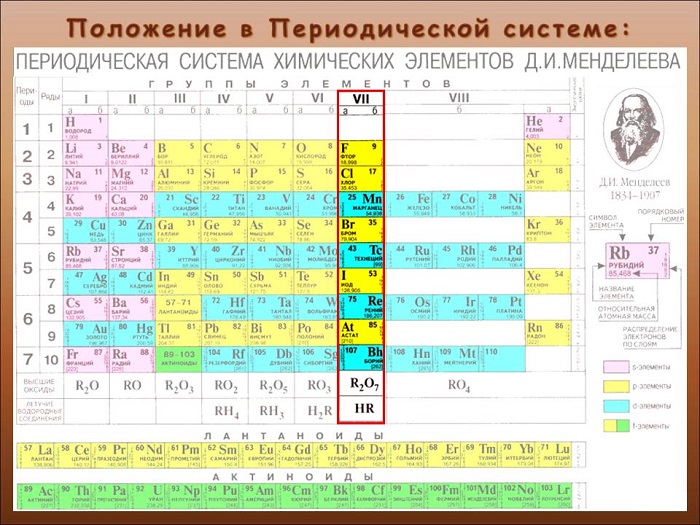
Что такое галогены
Определяют, как элементы 17-ой группы таблицы Менделеева. Сторонники «старой школы» выразились бы: «главной подгруппы VII группы».
Название представляет собой компиляцию греческих слов. Означает приблизительно «солерождающий». Такое определение было дано в XIX веке британским ученым Гэмфри Дэви.
Перечень и общая характеристика галогенов
С первыми четырьмя элементами из списка некоторое знакомство имеется. Надо заметить, что вещества хоть и достаточно распространенные, но в чистом виде в природе не встречаются. Только в составе соединений.
Астат – элемент не просто редкий, а самый редкий из всех встречающихся на планете. Его «запасы» оцениваются в 1 г. Свойства доподлинно не известны. Так как из-за радиоактивности и мизерной «продолжительности жизни» в достаточных количествах выделить не получилось.
Теннессин существует скорее теоретически. На Земле, по крайней мере, не нашли. Рекордное зафиксированное (и признанное) в лаборатории количество – 6 ядер. Включая изотоп.
Легко заметить, что до «идеальных» инертов не хватает всего-то электрончика. А так хочется. Не удивительно, что так агрессивны.
Физические свойства
Галогены – ярко выраженные неметаллы. Летучи, с характерно едким «ароматом». Причем для йода (I2) жидкое агрегатное состояние вообще не характерно. При разогреве просто испаряется фиолетовым дымком.
Хлор – настоящее боевое отравляющее вещество. И применялось в таком качестве. Попадая в незащищенные глаза и органы, образует кислоты. С соответствующими последствиями. Для летального исхода достаточно концентрации в воздухе 2 мг/л.
Насыщенность цветов с «утяжелением» ядер возрастает. Активность, напротив, падает.
В воде растворимость ограничена. Лучше ведёт себя с органическими растворителями. Растворы оригинально окрашены: от слабо желтого до фиолетового.
Химические свойства галогенов
Можно сказать, что F реагирует со всеми простыми субстанциями, кроме отдельных благородных газов. А так (с облучением):
Остальные элементы ряда не взаимодействуют с:
Содержание:
Понятие «галоген» было введено в науку в 1811 г. немецким химиком И. Швейгером и означало «образующий соль».
Галогенами называют фтор, хлор, бром, йод и астат. Все галогены являются неметаллами и в периодической таблице химических элементов занимают основную подгруппу седьмой группы.
На внешнем энергетическом уровне атомы галогенов имеют семь электронов и для заполнения этого уровня восемью электронами им недостает одного электрона. Поэтому они присоединяют по одному электрону от атомов водорода и металлов и проявляют степень окисления, равную —1:
Строение атомов галогенов
Распространение в природе
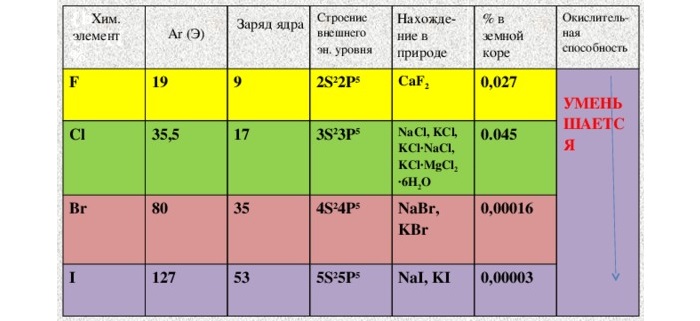
Так как галогены являются сильными окислителями, в свободном состоянии в природе они не встречаются и находятся в основном в виде химических соединений (табл. 23).
Таблица 23
Распространение галогенов в природе
| Химический элемент | Количество в земной коре, % | Природные соединения |
| Фтор | 0,027 | Плавиковый шпат  , апатит, фосфориты , апатит, фосфориты |
| Хлор | 0,045 | Хлориды: КС1, NaCl |
| Бром | 0,00016 | Бромиды: NaBr, KBr, MgBr, 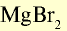 |
| 0,00003 | Йодиды: NaJ, KJ |
Получение галогенов
В связи с тем, что в природных соединениях галогены имеют в основном отрицательную (—1) степень окисления, выделение их в свободном состоянии проводится путем окисления ионов галогенидов.
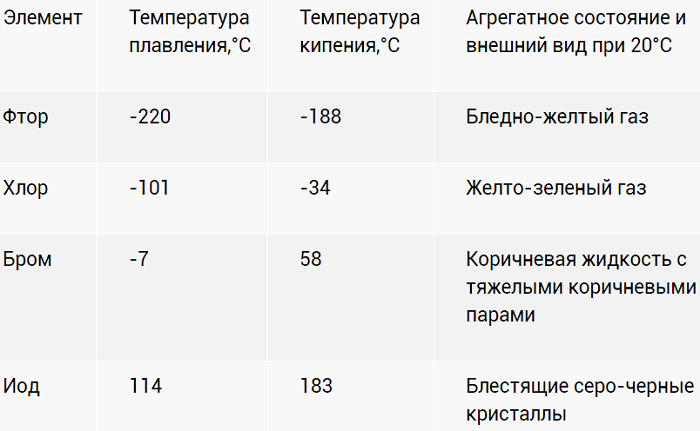
Физические свойства галогенов
О некоторых свойствах галогенов вы узнали при изучении природных семейств химических элементов. С возрастанием относительных атомных масс галогенов их физические свойства изменяются по определенной закономерности.
Агрегатные в обычных условиях состояния и цвет постепенно сгущаются.
Фтор — газ светло-зеленого цвета, хлор — тяжелый газ желто-зеленого цвета, бром — жидкость красновато-бурого цвета, йод — кристаллическое вещество темно-серого цвета. Температура кипения и плотность постепенно увеличиваются от фтора к йоду.
Водорастворимость галогенов относительно невелика. Так, в одном объеме воды в обычных условиях растворяется 2,5 объема хлора, водорастворимость йода составляет 0,02 на 100 г воды. Галогены хорошо растворяются в органических растворителях (керосин, бензин, ацетон, различные спирты, бензол и др.).
Йод обладает сублимирующим свойством, то есть при накаливании он превращается в газ фиолетового цвета.
— Явление перехода веществ из твердого состояния в газообразное, а из газообразного в твердое, минуя жидкое, называется сублимацией.
Химические свойства галогенов
Радиусы атомов галогенов увеличиваются от фтора к йоду (в ряду 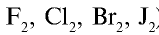
В ряду 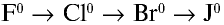
В ряду 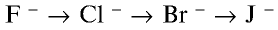
Фтор — самый активный среди галогенов. Под влиянием фтора окисляется даже кислород. При взаимодействии с водой он горит ярким пламенем:
Элементы знаний, умений и навыков: галогены, сублимация.
Хлор — ядовитый газ, натрий — щелочной металл.
Галогены и их соединения имеют большое значение в народном хозяйстве. Хлор и его соединения занимают важное место в ряду галогенов. Поэтому рассмотрим свойства хлора подробнее. Из предыдущих глав нам известно, что:
1) в периодической таблице химический элемент хлор расположен в основной подгруппе седьмой группы третьего периода под порядковым номером 17;
2) атом хлора имеет следующее строение:
3) молекула хлора имеет следующее строение: 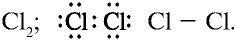
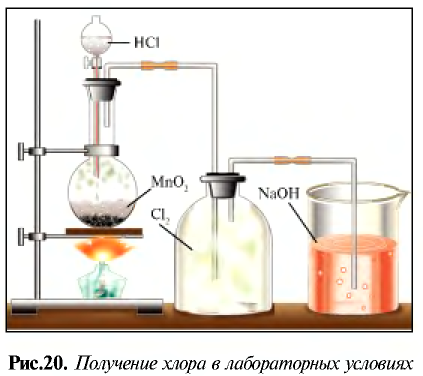
Получение:
В промышленности хлор получают путем электролиза.
В лабораторных условиях хлор получают при взаимодействии 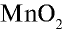
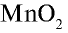
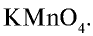
Физические свойства:
Хлор — таз желто-зеленого цвета с острым удушливым запахом, ядовит. Попадая в органы дыхания, хлор вызывает воспаление слизистой оболочки. Поэтому, работая с ним следует соблюдать осторожность. Примерно в 2,5 раза тяжелее воздуха. При температуре 20°С в одном объеме воды растворяется 2,5 объема хлора, в результате образуется раствор, называемый хлорной водой.
Определите массу хлора в хлорной воде.
Решение.
В одном объеме воды растворяется 2,5 объема хлора.
Значит, в 1 л воды растворяется 2,5 л
1. Масса 1 л воды: т — 1000 мл • 1 г/мл = 1000 г.
2. Масса 2,5 л 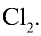
4. Масса раствора: 1000 + 7,9 = 1007,9 г.
5. Массовая доля хлора в растворе:
Химические свойства:
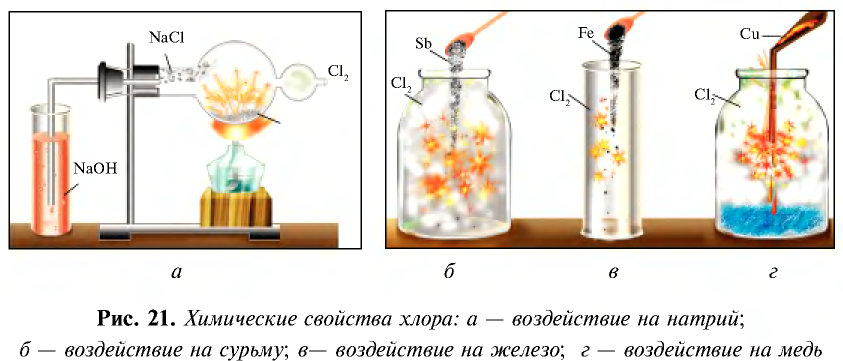
При взаимодействии с водородом, металлами, бромидами и йодидами хлор является окислителем. Например, реакция взаимодействия хлора с натрием выражается следующим уравнением (см. рис. 21, а).
Поскольку хлор сильный окислитель, то вступая в реакцию с железом, он окисляет его до степени окисления +3 (см. рис. 21, в).
Хлор взаимодействует также с сурьмой, медью и рядом простых веществ (рис. 21, б, г).
При взаимодействии с водой и щелочами один атом молекулы хлора является окислителем, второй—восстановителем:
Соединяясь с едким калием, хлор в зависимости от условий образует различные вещества. При взаимодействии хлора с нагретым едким калием образуются хлорид калия и бертолетова соль. Степень окисления хлора в хлориде калия равна —1, в бертолетовой соли +5:
При взаимодействии хлора с холодным едким калием образуются соли КС10 и КС1:
Уравняйте уравнение этой реакции методом электронного баланса.
Элементы знаний, умений и навыков: природные соединения хлора, получение, степени окисления хлора, хлор-окислитель, хлор-восстановитель, соляная кислота.
Хлорид водорода
Чем объясняются кислотные свойства водного раствора хлорида водорода?
Хлорид водорода — одно из самых важных соединений хлора. Его химическая формула НС1. Относительная молекулярная масса 36,5. Структурная формула Н—С1, атомы в молекуле связаны полярной ковалентной связью. Электронная формула 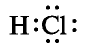
Получение:
1. В промышленности хлорид водорода получают в реакциях взаимодействия водорода и хлора:
2. В лабораторных условиях хлорид водорода получают путем воздействия на чистый сухой хлорид натрия концентрированной серной кислотой:
При сильном нагревании реакция заканчивается образованием сульфата натрия:
Физические свойства:
Хлорид водорода — бесцветный газ с острым удушливым запахом, немного легче воздуха 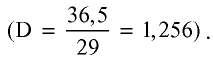
Химические свойства:
По химическим свойствам хлорид водорода схож с соляной кислотой, поэтому ее химические свойства рассмотрим подробнее ниже. Однако в отличие от соляной кислоты, сухой хлорид водорода не вступает в реакции с металлами и их оксидами.
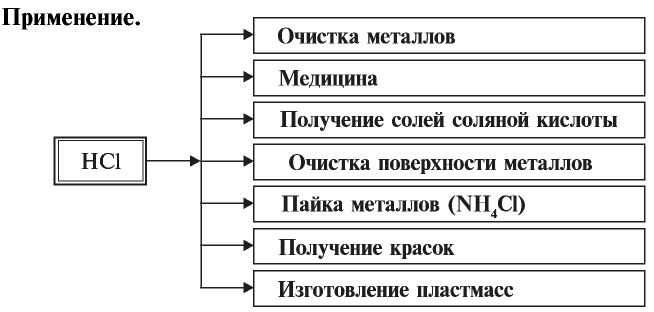
Применение:
Хлорид водорода используется в основном в производстве соляной кислоты.
Соляная кислота
Соляная кислота представляет собой водный раствор хлорида водорода.
Получение:
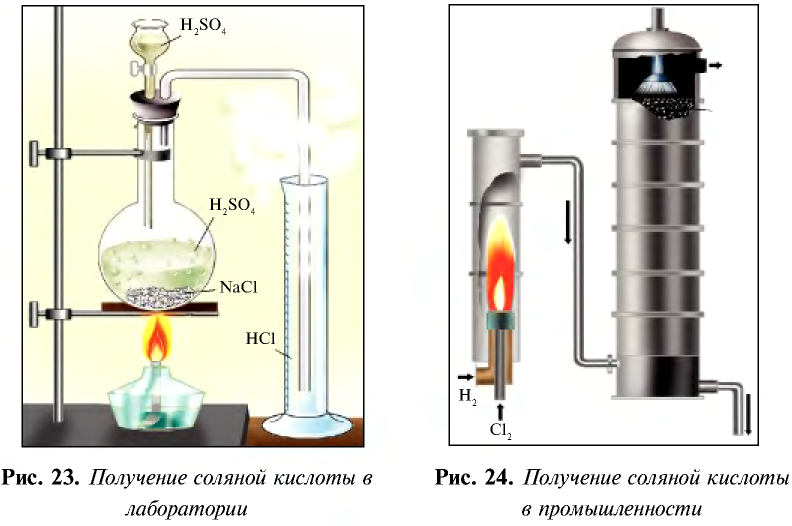
В лабораторных условиях соляную кислоту получают с помощью простой реакции. Выделяющийся в результате реакции газ направляется в воду, в которой он быстро растворяется и образует соляную кислоту (рис. 23).
В промышленности соляную кислоту получают путем сжигания водорода с хлором и растворения в воде полученного хлорида водорода (рис. 24).
Физические свойства:
Концентрированная соляная кислота — бесцветная жидкость с острым запахом (за счет выделения хлорида водорода), дымящаяся при влажном воздухе. Плотность концентрированной соляной кислоты 1,19 г/см3, содержание хлорида водорода в ней 37% (такая кислота называется также «дымящейся»).
Химические свойства:
1. Соляная кислота вступает в химические реакции, как и все сильные кислоты:
а) окрашивает фиолетовый цвет лакмуса в красный; обесцвечивает розовый цвет фенолфталеина в щелочной среде; изменяет оранжевый цвет метилоранжа в красный;
б) взаимодействует со всеми металлами, которые в ряду активности расположены перед водородом, с образованием соли и водорода:
в) взаимодействует с основными и амфотерными оксидами с образованием солей и воды:
г) взаимодействует с основаниями с образованием солей и воды:
д) взаимодействует с солями слабых кислот с образованием новой
2. Реакции, присущие соляной кислоте.
а) взаимодействует с нитратом серебра и образует белый осадок (AgCl), который не растворяется ни в воде, ни в кислоте:
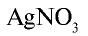
б) взаимодействует с окислителями, в результате чего ион хлора окисляется и образуется свободный хлор:
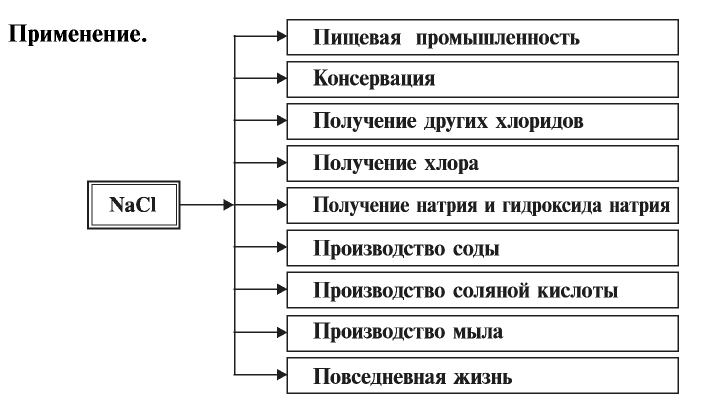
Соли соляной кислоты называют хлоридами. Хлориды имеют важное значение в народном хозяйстве.
Хлорид натрия (поваренная соль) — NaCl
Поваренная соль в природе встречается в большом количестве. Основная масса ее содержится в растворенном виде в воде морей и океанов. Поваренная соль встречается также в виде твердых кристаллов, называемых каменной солью. На территории Узбекистана каменная соль добывается на месторождениях Ходжаикан, Тубакат, Барса-Кельмес, Байбичакан, Аккала.
Температура кипения поваренной соли 1413°С, температура плавления 800,4°С, плотность 2,16 г/см3. Растворимость при 0°С — 35,6 г.
Поваренная соль имеет важное значение в жизни человека и в народном хозяйстве. Человек потребляет в сутки примерно 10 г, а в год — 3,6 кг поваренной соли. Значит, население Узбекистана в год потребляет примерно 90000 т поваренной соли. Население всего мира потребляет в год 25 млн т этого продукта.
Хлорид калия — КС1
Хлорид калия в природе встречается в виде минералов карналлита — 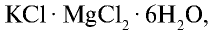
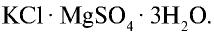
Хлорид калия имеет важное значение в производстве калийных удобрений для сельского хозяйства, а также для получения едкого кали, хлора и его соединений.
Почти все хлориды, кроме 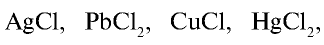
Для определения хлоридов и соляной кислоты используется раствор
Соль 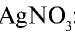
Кислородные соединения хлора
Галогены, в частности хлор, образуют ряд кислородных соединений, однако эти соединения получают косвенным путем, так как хлор непосредственно с кислородом не взаимодействует. В кислородных соединениях хлор проявляет степень окисления +1, +3, +5, +7.
Хлорноватистая кислота НСlO — неустойчивое вещество, которое существует только в разбавленных растворах.
НСlO — сильный окислитель. При медленном расщеплении ее выделяется атомарный кислород:
НСlO = НС1 + О.
Хлорноватистая кислота относится к очень слабым кислотам. Ее соли получают путем пропускания хлора через раствор щелочи:
При взаимодействии хлора с гашеной известью получают хлорную известь (отбеливающая известь):
Хлорная известь — 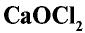
Хлористая кислота —
Хлорноватая кислота 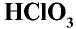
Хлорноватая кислота и ее соли — хлораты также являются сильными окислителями. При пропускании хлора через горячий гидроксид калия получается хлорат калия (бертолетова соль):
Бертолетова соль 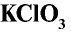
Хлорная кислота 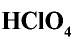
Элементы знаний, умений и навыков: хлорид водорода, соляная кислота, дымящаяся соляная кислота, реакции, присущие иону хлора, окисление хлор-иона, хлорноватистая кислота, хлорная известь, хлористая кислота, хлорноватая кислота, бертолетова соль, хлорная кислота.
Фтор, бром, йод
Какие соединения галогенов вы использовали? С какой целью?
Фтор, бром, йод являются представителями семейства галогенов и широко распространены в природе в виде различных соединений.
Фтор — в природе встречается в виде минералов флюорита (плавиковый шпат) 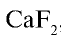
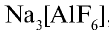
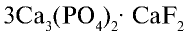
Бром — находится в виде минералов в морских и подземных водах и в качестве примеси во всех природных хлорсодержащих соединениях.
Йод — в природе встречается в составе морских водорослей, губок, морской воды в виде органических соединений и входит в состав чилийской селитры в качестве примеси в виде йодатов
Все галогены имеют острый запах и ядовиты. Молекулы 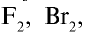
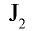
Фтор обладает очень высокой химической активностью и практически трудно растворим в растворителях. Бром и йод мало растворимы в воде и хорошо растворяются в органических растворителях.
При комнатной температуре фтор вступает во взаимодействие с щелочными металлами, свинцом и железом, а при накаливании реагирует также со всеми металлами, золотом и платиной. При низких температурах фтор взаимодействует с водородом, йодом, бромом, серой, фосфором, мышьяком, сурьмой, углеродом, кремнием и бором, при этом реакция сопровождается взрывом и воспламенением фтора. При накаливании фтор соединяется с хлором, криптоном и ксеноном:
Фтор не вступает непосредственно в реакцию с кислородом, азотом и алмазом, в атмосфере фтора стекло и вода сгорают:
Несмотря на относительно слабую химическую активность брома и йода, они также взаимодействуют со многими металлами и неметаллами.
Бром реагирует с водородом при небольшом нагреве, а с йодом при сильном нагревании, однако с повышением температуры нагрева
HJ начинает расщепляться и происходит обратная реакция, которая не доходит до конца:
Химические свойства галогенов ослабевают от фтора к астату, окислительные свойства снижаются поэтапно. Этим объясняется окисление легкими галогенами (в качестве простых веществ) ионов тяжелых галогенидов и восстановление оксидов легких галогенов ионами тяжелых галогенидов:
Так как фтор, бром, йод в природе встречаются в виде соединений и их ионы заряжены отрицательно, получение этих галогенов в свободном состоянии осуществляется через окисление их ионов путем воздействия окислителями и пропускания электрического тока через расплавы или водные растворы их солей.
Фтор используется для изготовления устойчивых к высоким температурам смазочных средств, стойких к химическим реагентам пластмасс (тефлон), охлаждающих жидкостей (фреон, хладон) и др.
Бром применяется при производстве различных лечебных средств, некоторых красок, при изготовлении бромида серебра. Недостаток брома в организме человека приводит к возникновению различных заболеваний нервной системы. При лечении этих заболеваний и при бессоннице применяются лекарственные средства на основе брома.
Пятипроцентный спиртовый раствор йода используется в медицине в качестве антисептического и кровоостанавливающего средства, а также при изготовлении ряда фармацевтических средств.
Пример №2
Как можно получить хлорид кальция с помощью поваренной соли и других необходимых веществ? Запишите соответствующие уравнения реакций.
Решение:
1) получение НС1 и 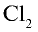
2) получение Са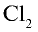
3) получение Ca 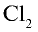
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.