габапентин или лирика что лучше
Актуальность
Оптимальная терапия для пациентов с хронической ишиалгией точно не определена. В настоящее время у пациентов используют габапентин и прегабалин. При этом в клинических исследованиях не сравниваются напрямую препараты, поэтому точно определить какой из них обладает большей эффективностью и лучшим профилем безопасности не возможно.
Исследователи из Австралии выполнили рандомизированное клиническое исследование по сравнению прегабалина и габапентина у больных хронической ишиалгией.
Методы
В исследование были включены пациенты 8 лет и старше с хронической ишиалгией, которые ранее не получали прегабалин или габапентин.
Пациентов рандомизировали в группу габапентина (400-800 мг 3 раза в день), затем прегабалина (150-300 мг 2 раза в день) или в обратной последовательности. Каждый курс терапии продолжался на протяжении 8 недель. Между терапией прегабалином и габапентином была 1 свободная неделя.
Первичной конечной точкой исследования являлась интенсивность боли (по 10ти бальной визуальной аналоговой шкале (ВАШ)) на 8 неделе терапии. В качестве вторичной конечной точки рассматривали инвалидизацию (Oswestry Disability Index) и частоту нежелательных явлений.
Результаты
Средний возраст пациентов составил 57 лет.
Заключение
Габапентин превосходит прегабалин по эффективности у пациентов с хронической ишиалгией и ассоциирован с меньшей частотой нежелательных явлений.
Источник: Kelvin Robertson, Laurence A. G. Marshman, David Plummer, et al. JAMA Neurol. Published online October 15, 2018.
Прегабалин и габапентин, риск опасного поведения
Актуальность
Габапентиноиды обладают противосудорожным, анальгетичесикм и анксиолитическим свойствами. В настоящее время используются 2 основных препарата: прегабалин и габапентин. Препараты одобрены для лечения эпилепсии, нейропатической боли, генерализованных тревожных расстройств и фибромиалгии.
Прегабалин и габапентин находятся в топ 15 самых назначаемых препаратов. Однако их безопасность не редко является предметом дискуссий. В частности, риск суицида.
Исследователи из Швеции инициировали новое исследование с целью определить риск нарушений координации, проблем с психичесим здоровьем.
Дизайн исследования
В регистре Swedish Prescribed Drug Register были найдены 191 973 индивидуумов, получавших прегабалин или габапентин с 2006 по 2013 год.
В качестве первичных конечных точек рассматривали суицидальное поведение, непреднамеренная передозировка, повреждения головы/шеи, дорожные происшествия и аресты, связанные с насильственными преступлениями.
Результаты
Заключение
Результаты исследования свидетельствуют о повышении риска суицидального поведения, дорожно-транспортных происшествий, повреждений головы/шеи и непреднамеренной передозировки на фоне терапии габапентиноидами.
Прегабалин ассоциирован с большим риском, чем габапентин.
Источник: Yasmina Molero, Henrik Larsson, Brian M D’Onofrio, et al. BMJ 2019;365:l2147.
Сравнительный анализ эффективности комплексной фармакотерапии боли при невралгии тройничного нерва
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Лицевые боли (прозопалгии) – одна из наиболее частых причин обращаемости больных к неврологам, стоматологам и врачам других специальностей.
Боли в области лица могут быть вызваны поражением нервного аппарата челюстно-лицевой области (системы тройничного, языкоглоточного нервов, вегетативных узлов и сплетений) или мышечно-суставной дисфункцией при артрозоартрите височно-нижнечелюстного сустава и нарушении соотношения зубных рядов. Кроме того, описаны рино- и офтальмогенные прозопалгии, патогенез которых сложен, однако в конечном итоге реализуется через неврогенные и мышечные механизмы.
В клинической практике среди краниальных невралгий наиболее часто встречается тригеминальная невралгия, или невралгия тройничного нерва (НТН). Распространенность НТН – 45–50 на 100 тыс. населения с пиком заболеваемости на 6-м десятилетии жизни. Патогенез заболевания сложен. Доказано, что пусковым моментом является корешково-сосудистый конфликт в области мостомозжечкового угла, приводящий к сегментарной демиелинизации корешка тройничного нерва. Сочетание демиелинизации корешка с функциональной и/или структурной дефектностью антиноцицептивных регуляторных систем у данного индивидуума может способствовать формированию так называемого «генератора патологической активности» в системе тройничного нерва и служить основой развития клинической картины НТН [5].
Клиническая картина невралгии тройничного нерва
Больные предъявляют жалобы на пароксизмальную боль, сравнимую с ударом электрического тока. Продолжительность болевого пароксизма не превышает 2 мин., хотя больные могут жаловаться на непрерывную боль. Однако при внимательном расспросе удается установить наличие «светлого» безболевого промежутка между приступами.
Характеристика болевого пароксизма:
1. Боль чрезвычайно сильная и при определении ее интенсивности по 10-балльной шкале боли соответствует 8–10 баллам.
2. Рисунок боли в период обострения не изменяется (боль не может перемещаться на противоположную сторону) и соответствует корешково-сегментарной зоне иннервации.
3. Между двумя отдельными приступами всегда имеется безболевой (рефрактерный) период.
4. Наличие триггерных зон – гиперсенситивных участков на коже лица или в полости рта, слабое раздражение которых вызывает типичный болевой приступ. Триггерные зоны наиболее часто локализуются в медиальных отделах лица или на альвеолярных отростках челюстей.
5. Наличие триггерных факторов – действий или условий, при которых возникают типичные болевые пароксизмы. Наиболее часто такими факторами являются: умывание, прием пищи, движения нижней челюсти.
6. Типичное болевое поведение – во время приступа больные «замирают» в той позе, в которой их застал приступ.
7. На высоте приступа могут быть подергивания лицевой мускулатуры.
8. Отсутствие сенсорного дефекта на лице в дебюте заболевания.
При клинико-неврологическом обследовании на стороне боли может быть отмечено снижение вибрационной чувствительности и корнеального рефлекса. Также во время обострения НТН при наличии активных триггерных зон положителен симптом Штернберга – указывая локализацию триггерной зоны, больной не касается лица из-за боязни вызвать приступ.
Течение заболевания хроническое. У 2/3 больных в дебюте отмечаются легкие пароксизмы боли в проекции зубов, что может быть поводом для их удаления, у 1/3 уже в начале заболевания развиваются пароксизмы интенсивной боли, которые продолжаются 2–3 нед. и проходят самостоятельно. Как правило, через полгода или год приступы возобновляются в более тяжелой форме. В развернутой стадии заболевания обострения (периоды интенсивной боли), развивающиеся чаще в холодное время года, продолжаются 4–8 нед., затем стихают, но без адекватного лечения полностью не проходят. В начале заболевания ремиссии (период стихания болей) могут быть спонтанными, однако, как показывает наш клинический опыт, с течением времени их удается достичь только при адекватной терапии.
По мере развития заболевания, вероятно в связи с нарастанием демиелинизирующего процесса в области корешка тройничного нерва, формируется невропатическая стадия невралгии, когда в клинической картине, наряду с пароксизмами боли, отмечается незначительная постоянная боль. В этой стадии при клинико-неврологическом обследовании выявляется постоянный или преходящий сенсорный дефект периферического типа в зоне иннервации второй и/или третьей ветвей тройничного нерва.
Диагностика типичной НТН не представляет значительных трудностей, однако следует помнить, что пароксизмальная прозопалгия может быть симптоматической, т. е. обусловленной патологическими процессами в области мостомозжечкового угла (опухоль вестибуло-кохлеарного нерва, слипчивый оболочечный процесс и др.). В этой связи больные с впервые выявленной НТН в возрасте до 50 лет, а также с наличием в неврологическом статусе симптомов очагового поражения нервной системы нуждаются в МРТ-обследовании головного мозга.
Лечение невралгии тройничного нерва
Лечение боли при НТН до настоящего времени представляет сложную задачу. В 1962 г. С. Блюм предложил лечить невралгию тройничного нерва карбамазепином. В настоящее время, наряду с карбамазепином, применяются и другие противоэпилептические препараты: габапентин, окскарбазепин, прегабалин (Лирика).
Лечение карбамазепином рекомендуется начинать с 50 мг (1/4 стандартной таблетки, содержащей 200 мг карбамазепина) 3 р./сут во время или после еды, запивая достаточным количеством жидкости [3]. Повышать дозу карбамазепина при хорошей переносимости можно на 50 мг ежедневно. Средняя эффективная доза составляет 600–800 мг/сут. Доза считается эффективной, если болевой синдром купирован полностью (раздражение триггерных зон и триггерные факторы не вызывают болевого пароксизма – больной может принимать пищу и безболезненно выполнять гигиенические процедуры умывания и чистки зубов).
Дальнейшее лечение в течение 3–4 нед. проводится с применением индивидуальной эффективной дозы препарата, что позволяет достичь медикаментозной ремиссии. Затем проводится обратное титрование со снижением суточной дозы на 50 мг в течение 5–7 дней. Целью обратного титрования является достижение индивидуальной поддерживающей дозы, которая может составлять от 100 до 400 мг/сут. В дебюте заболевания у части больных (40–60%) удается полностью отменить препарат. Возможно применение пролонгированных фармакологических форм карбамазепина, которые особенно удобны для проведения поддерживающей терапии.
При лечении препаратами карбамазепина следует помнить, что длительное применение больших доз может привести к развитию побочных явлений в виде головокружения, тошноты, атаксии. Описаны случаи апластической анемии. Поэтому, наряду с клиническим контролем развития возможных побочных эффектов препарата, необходимо следить за состоянием периферической крови и печени (общий анализ крови и содержание АСТ и АЛТ каждые 3 мес.).
Примерно у 15% больных карбамазепин неэффективен. Таким больным подбирают противоэпилептические препараты других групп.
В настоящее время сформулированы основные принципы рациональной полифармакотерапии, предполагающие воздействие на основные патогенетические механизмы нейропатической боли при НТН: периферическую и центральную сенситизацию с одновременной активизацией антиноцицептивной системы [5]. В схемах лечения нейропатической боли применяются местные анестетики, блокирующие проведение болевых импульсов на периферическом уровне, что при НТН технически невыполнимо; опиоидные анальгетики, оказывающие центральное действие, и адъювантные анальгетики, к которым можно отнести антидепрессанты, усиливающие ингибирующее влияние антиноцицептивных систем, и противоэпилептические препараты, тормозящие проведение ноцицептивных стимулов на сегментарном и супрасегментарном уровнях. Эффективность препаратов, применяемых в различных комбинациях в предлагаемых схемах, различна [3]. В этой связи изучение эффективности и безопасности применения прегабалина (Лирика) и карбамазепина в комплексном лечении НТН представляется своевременным и актуальным.
Целью настоящего исследования является совершенствование методов комплексного лечения пациентов, страдающих НТН в стадии обострения, посредством сравнительного анализа терапевтической эффективности прегабалина (Лирика) и карбамазепина в комплексном лечении.
Материалы и методы
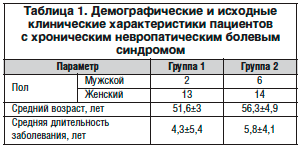
В настоящее исследование были включены 35 пациентов с НТН. Длительность заболевания – от 2 до 11 лет. Все наблюдаемые находились на амбулаторном лечении в консультативно-диагностическом центре Московского областного научно-исследовательского клинического института им. М.Ф. Владимирского. Возраст больных – от 48 до 63 лет. Критериями включения в исследование были: обострение хронического болевого синдрома не более 2-х нед.
В стандартное комплексное лечение входили витаминотерапия, антиоксиданты, анксиолитики, антидепрессанты и противоэпилептические препараты.
Научным обоснованием применения антидепрессантов являются данные о недостаточности (функциональной и/или морфологической) антиноцицептивных систем. Известно, что антиноцицептивные системы осуществляют ингибирующий контроль сегментарного ноцицептивного аппарата челюстно-лицевой области, расположенного в каудальной части ядра спинального тракта тройничного нерва. Указанные системы, к которым относится околоводопроводное серое вещество, крупноклеточное ядро ствола головного мозга, голубое пятно и др., являются серотонин- и норадреналинергическими и участвуют, наряду с антиноцицептивным контролем, в эмоциональных реакциях человека. Поэтому применение препаратов с агонистическими моноаминергическими свойствами при лечении хронической боли является вполне обоснованным.
Возможно использование антидепрессантов различных фармакологических групп: трициклические (амитриптилин), селективные ингибиторы обратного захвата серотонина (флуоксетин), селективные ингибиторы обратного захвата серотонина и норадреналина, агонисты мелатониновых рецепторов. В нашем наблюдении применялся пипофезин (атипичный трициклический антидепрессант) в дозе 75 мг/сут.
В программу комплексной фармакотерапии НТН были включены противоэпилептические препараты. В зависимости от применяемого комплекса лечения все пациенты были разделены на 2 группы.
Группа 1 (15 человек) получала карбамазепин (средняя суточная доза карбамазепина составила 700±230 мг), группа 2 (20 человек) получала прегабалин (Лирика): 8 пациентов в дозе 450 мг/сут, 12 – 600 мг/сут. В комплексную фармакотерапию пациентов обеих групп входил пипофезин 75 мг/сут.
В обеих группах не выявлено достоверных различий по возрастному и половому составу (табл. 1).
У наблюдаемых пациентов с НТН было типичное течение заболевания – обострение начиналось с простреливающих болей в проекции одного или двух зубов, активизации имевших место ранее триггерных зон, которые располагались в медиальной части лица (верхняя губа, крыло носа) или в пародонте зубов. В подавляющем большинстве случаев провоцирующим обострение фактором явились резкое изменение АД, стресс, перепады температур. Далее развивались приступы интенсивной боли. У пациентов имелись активные триггерные зоны, раздражение которых (умывание, еда, бритье) вызывало пароксизм боли.
Результаты
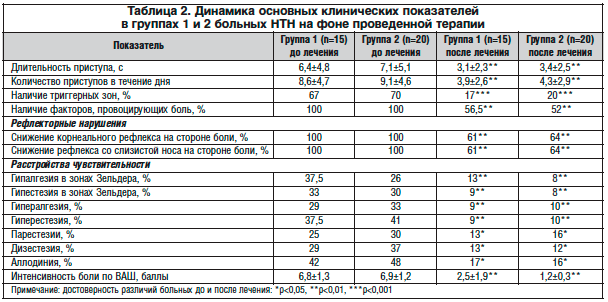
Динамика клинических показателей в группах наблюдения представлена в таблице 2.
Как следует из таблицы 2, в начале наблюдения интенсивность боли по ВАШ в группе 1, в комплексное лечение в которой входил карбамазепин, в среднем составила 6,8±1,3 балла, в группе 2, в комплексное лечение в которой входил прегабалин (Лирика), – 6,9±1,2 балла.
Исходный уровень депрессии по шкале Бека до лечения в обеих группах был достоверно высокий (27 и более баллов) (р 0,1).
Экстероцептивная супрессия произвольной активности височной и жевательной мышц. При регистрации экстероцептивной супрессии (ЭC) произвольной ЭМГ-активности жевательной и височной мышц с обеих сторон как в группе 1, так и в группе 2 достоверных изменений латентного периода (ЛП) и длительностей ЭС1 после лечения обнаружено не было (p>0,1). Основные изменения, выявленные у больных с НТН после курса проведенной терапии, касались параметров поздней ЭС2. В обеих группах больных после лечения наблюдалось достоверное уменьшение величины ЛП и увеличение длительности периода ЭС2 ЭМГ активности височной и жевательной мышц при регистрации как с больной, так и со здоровой стороны, которые, однако, не достигали значений этих параметров, зарегистрированных у здоровых испытуемых (p Литература
Только для зарегистрированных пользователей
Сравнительная характеристика габапентина и прегабалина
Проблема нейропатической боли приобретает все большую актуальность для клиницистов различного профиля, что связано с широкой распространенностью патологии и трудностями в достижении стойкого терапевтического эффекта. Нейропатическая боль может стать причиной страданий и разной степени утраты трудоспособности пациента, а также повлечь за собой существенные медико‑социальные последствия. Несмотря на большое количество фармакологических препаратов, которые рекомендованы для лечения нейропатической боли, выбор оптимальной схемы лечения часто вызывает трудности у клиницистов. Вашему вниманию представлен обзор статьи Jeffrey Fudin «How Gabapentin Differs From Pregabalin», опубликованной в Рharmacy Times (September 22, 2015), в которой проводится сравнительный анализ фармакокинетики и фармакодинамики прегабалина и габапентина, а также схемы смены приема препаратов.
Нейропатическая боль занимает одно из ведущих мест в структуре заболеваемости в Соединенных Штатах Америки. Так, заболеваемость периферической нейропатией составляет около 2,4% от общего числа населения (Toth, 2010). Среди 14 млн больных сахарным диабетом в США примерно 25% страдают диабетической нейропатией. Несмотря на успехи в вакцинации против вируса Varicella zoster, приблизительно у 25% пациентов с герпетической инфекцией развивается стойкая постгерпетическая невралгия (Blommel et. al., 2007). Более 85% пациентов с болью, обусловленной периферической нейропатией, нуждаются в фармакотерапии.
К сожалению, существует мало прямых сравнительных исследований эффективности препаратов для лечения нейропатической боли, поэтому выбор оптимального варианта во многих случаях может быть затруднен.
Прегабалин и габапентин часто рекомендуют в качестве препаратов первой лини для лечения нейропатической боли различного генеза (Toth, 2010).
Фармакокинетика прегабалина и габапентина
Прегабалин и габапентин относятся к группе противоэпилептических препаратов и являются структурными аналогами гамма-аминомасляной кислоты (ГАМК), хотя оба они не влияют на ГАМК-ергические системы.
Точный механизм действия до конца неизвестен, эффективность препаратов в лечении нейропатической боли объясняют их способностью связываться с потенциал-чувствительными кальциевыми каналами в центральной нервной системе (ЦНС), в частности с α2-дельта протеином. Это приводит к уменьшению высвобождения нейромедиаторов в ЦНС в результате уменьшения притока кальция через закрытые каналы (Bockbrader et. al., 2010).
Габапентин может быть назначан как вспомогательное средство для лечения парциальных судорожных припадков и постгерпетической невралгии. Прегабалин назначается в тех же случаях, что и габапентин, а также для лечения фибромиалгии и нейропатической боли, вызванной сахарным диабетом, в особенности диабетической нейропатии.
В целом, фармакокинетика обоих препаратов во многом схожа, но существуют и значительные отличия.
Например, оба препарата структурно схожи с аминокислотой лейцин. Поэтому они поступают в клетку за счет систем опосредованного транспорта L-аминокислот. Это основной способ абсорбции габапентина и прегабалина, за исключением медленно высвобождающегося предшественника габапентина, о котором речь пойдет ниже.
Однако подтверждено, что прегабалин практически полностью всасывается, в то время как для габапентина это не характерно. Причиной может бать наличие у прегабалина дополнительного пути абсорбции, либо он просто лучше транспортируется, чем габапентин. Кроме того, всасывание габапентина ограничивается тонким кишечником, а прегабалин всасывается на протяжении тонкого кишечника и далее, включая восходящую ободочную кишку.
Габапентин поступает в кровь медленнее и неравномерно, максимальная концентрация в плазме достигается через 3 часа после приёма. Пик концентрации прегабалина в плазме достигается в три раза быстрее, в среднем через час после приёма.
Абсорбция габапентина проходит с формированием пика насыщения, формируя при этом нелинейный фармакокинетический график. С увеличением дозы, соотношение концентрации в плазме, площадь под кривой «концентрация – время» (AUC) не возрастает пропорционально. В отличие от габапентина, абсорбция прегабалина проходит без формирования пиков насыщения и имеет линейный характер.
Биодоступность габапентина в таблетках и капсулах при дозах в 100 мг каждые 8 часов составляет порядка 80%, в то время как при дозах в 1600 мг каждые 8 часов – всего лишь 27% (Bockbrader et. al., 2010). Для прегабалина характерной особенностью является биодоступность более чем 90% при суточной дозе от 75 до 900 мг *, разделенной на несколько приемов.
Предполагаемые колебания биодоступности габапентина в популяции пациентов также более значительны, чем прегабалина. Они составляют 10–15% для прегабалина и 20–30% для габапентина (Bockbrader et. al., 2010).
Также было замечено, что приём пищи увеличивает AUC габапентина приблизительно на 10% без изменения времени, необходимого для достижения пиковой концентрации (tmax). Напротив, прием пищи не влияет на данный показатель у прегабалина, хотя время всасывания и увеличивается.
Распределение габапентина и прегабалина очень похоже. Оба препарата практически не связываются с белками плазмы крови, что уменьшает вероятность лекарственного взаимодействия. У обоих препаратов высокая степень гидрофильности, объем распределения составляет 0,8 л/кг для габапентина и 0,5 л/кг для прегабалина (Bockbrader et. al., 2010).
Для прегабалина и габапентина не характерно взаимодействие с другими лекарственными препаратами. Они оба не метаболизируюся ферментами системы цитохрома P и распадаются в организме практически полностью (остается меньше 1%).
Оба препарата в основном выводятся почками. Вещества, снижающие моторику тонкого кишечника, теоретически могут увеличивать абсорбцию габапентина. Тем не менее, поскольку прегабалин абсорбируется более чем на 90%, изменение моторики тонкого кишечника практически не влияет на его абсорбцию.
Фармакодинамика прегабалина и габапентина
Габапентин и прегабалин отличаются по силе связывания и степени сродства к рецепторам. Прегабалин имеет большее сродство с α2-дельта протеину и более выраженный анальгезирующий эффект при нейропатической боли, по сравнению с габапентином (Bockbrader et. al., 2010).
В одном из исследований была разработана популяционная фармакокинетическая модель сравнения прегабалина с габапентином (Bockbrader et. al., 2010). Авторы рассчитали значения концентрации препаратов, которые будут обеспечивать половину максимального фармакологического эффекта (EC50), и использовали эти значения для оценки силы действия двух препаратов.
На основании проведенных исследований по эпилепсии, значение EC50 для прегабалина составляет около 9,77 мг/мл, а для габапентина – 23,9 мг/мл (Bockbrader et. al., 2010). Согласно этим данным, прегабалин действует примерно в 2,4 раза сильнее. И он может быть еще более эффективным при нейропатической боли.
В исследованиях по посгерпетической невралгии, было выявлено, что значения EC50 для прегабалина и габапентина составляют 4,21 мг/мл и 11,7 мг/мл соответственно. Исходя из этого, активность прегабалина по сравнению с габапентином выше чем в 2,8 раза (Bockbrader et. al., 2010).
Прегабалин и габапентин несколько отличаются по кривым зависимости эффекта от дозы.
Целью одной из работ был анализ данных второй фазы клинических исследований габапентина и прегабалина, а также построение фармакодинамической модели (Bockbrader et. al., 2010). Авторы выявили, что снижение болевых ощущений у пациентов с постгерпетической невралгией коррелировало с увеличением дозы как габапентина, так и прегабалина.
Однако было обнаружено достижение плато в кривой зависимости дозозависимого эффекта для габапентина при дозе 3600 мг/сут. Для сравнения, обезболивающий эффект прегабалина продолжал расти вплоть до максимальной дозы – 450 мг/сут.
Использование прегабалина также продемонстрировало более быстрое возрастание кривой зависимости эффекта от дозы, чем у габапентина. Согласно результатам полученных данных, суточная доза прегабалина в 450 мг соответствует 3600 мг/сут габапентина.
Перевод с габапентина на прегабалин
Целью одного группового исследования было выявить эффективность замены габапентина прегабалином у пациентов с нейропатической болью, вызванной периферической нейропатией (Ifuku et. al., 2011). Под наблюдением находилась группа пациентов, которые были переведены с габапентина на прегабалин. Полученные результаты в дальнейшем сравнивали с контрольной группой, в которой применялся габапентин. Авторы также разделили группу приема прегабалина на подгруппы, в которых реакция на применение габапентина была выражена хорошо или незначительно. Последней дозой габапентина была вечерняя, а прегабалин назначался на следующее утро.
Дозировки менялись по такому алгоритму:
• габапентин ≤ 900 мг/сут на прегабалин 150 мг/сут;
• габапентин 901 мг/сут до 1500 мг/сут – прегабалин 225 мг/сут;
• габапентин 1501 мг/сут до 2100 мг/сут – прегабалин 300 мг/сут;
• габапентин 2101 мг/сут до 2700 мг/сут – прегабалин 450 мг/сут;
• габапентин > 2700 мг/сут – прегабалин 600 мг/сут.
Такая резкая смена препаратов в целом хорошо переносилась пациентами. Кроме того, у пациентов, принимавших прегабалин, улучшился контроль над болевыми ощущениями, по сравнению с контрольной группой.
Переход на прегабалин привел к более выраженному обезболиванию, а также уменьшению побочных явлений. Особенно заметно это проявлялось у пациентов, у которых раньше был хороший терапевтический ответ на приём габапентина.
Пациенты, страдающие от побочных эффектов при приёме габапентина, как правило, плохо переносили и прегабалин. Таким больным чаще приходилось прекращать приём прегабалина, чем тем, у кого и габапентин и прегабалин вызывали терапевтический эффект.
В другом небольшом исследовании сравнивалась степень снижения болевых ощущений при приёме габапентина и прегабалина у пациентов с постгерпетической невралгией с целью определения эквивалентных дозировок этих двух препаратов (Ifuku et. al., 2011).
Пациенты были переведены с габапентина на прегабалин в дозировке 1/6 от начальной дозы габапентина с неизменившейся частотой назначения. Пациенты отмечали схожий обезболивающий эффект и побочные действия, за исключением участившихся случаев возникновения периферических отеков при приёме прегабалина.
Авторы сделали вывод, что анальгетический эффект прегабалина приблизительно в 6 раз сильнее, чем у габапентина.
Другие исследования рассматривали методы перехода от габапентина к прегабалину. В одном из них были использованы популяционные фармакокинетические модели для проверки двух возможных схем перевода с габапентина на прегабалин в соотношении 6 к 1 (Bockbrader et. al., 2010).
Первая схема подразумевала полный переход от габапентина к прегабалину уже со следующего дня приёма. Вторая схема – поэтапный переход от одного препарата к другому.
Во второй схеме, дозировка габапентина уменьшалась на 50% и одновременно назначались 50% от терапевтической дозы прегабалина на протяжении 4 дней. После этого прием габапентина прекращался, а дозировка прегабалина увеличивалась до желаемой.
Такая модель рассматривала переход от габапентина к прегабалину при различных дозировках:
• габапентин 900 мг/сут – прегабалин 150 мг/сут;
• габапентин 1800 мг/сут – прегабалин 300 мг/сут;
• габапентин 3600 мг/сут – прегабалин 600 мг/сут.
Обе схемы перехода показали себя быстрыми и беспрепятственными, так что авторы полагают, что любая из схем является эффективной при переводе пациентов с одного препарата на другой.
Вывод
Несмотря на схожие фармакокинетические и фармакологические свойства, между прегабалином и габапентином есть значительные отличия. Так, прегабалин имеет более предсказуемую фармакокинетику, а также большее сродство к рецепторам, более высокую активность и более крутую кривую зависимости дозы от эффекта, которая не формирует плато при дозировках препарата, превышающих рекомендованные.
Несколько исследований показали, что прегабалин имеет меньше побочных эффектов и может быть более эффективным для купирования нейропатической боли, чем габапентин. Некоторые исследования выявили, что соотношение дозировок габапентина и прегабалина составляет приблизительно 6 к 1 при переходе с одного препарата на другой. Кроме того, быстрый перевод с габапентина на прегабалин хорошо переносится пациентами, что значительно повышает комплайнс.
Подготовила Лариса Калашник