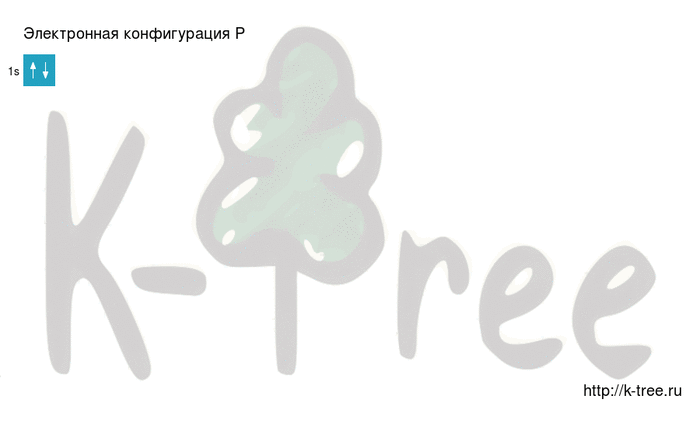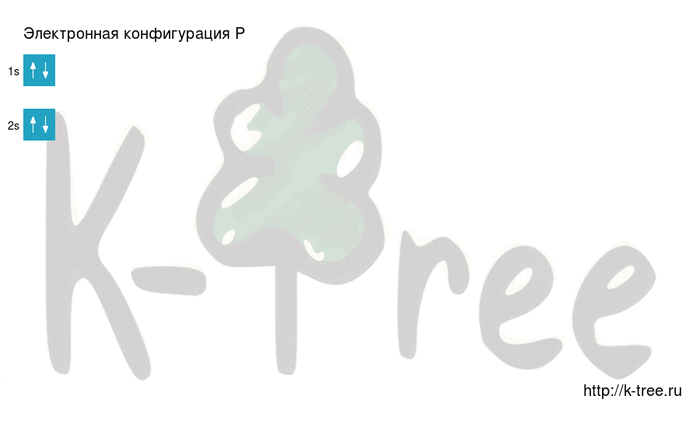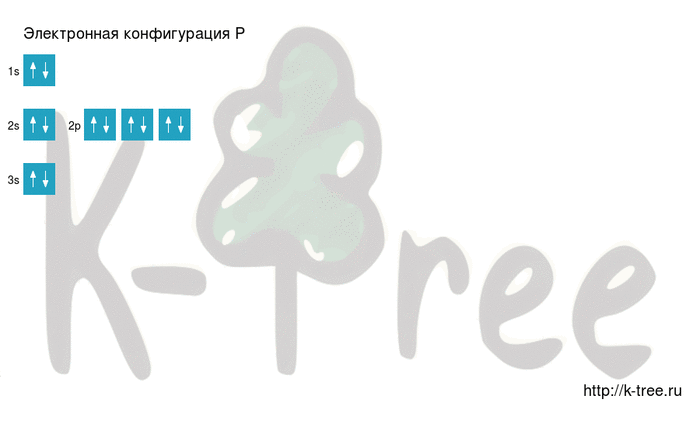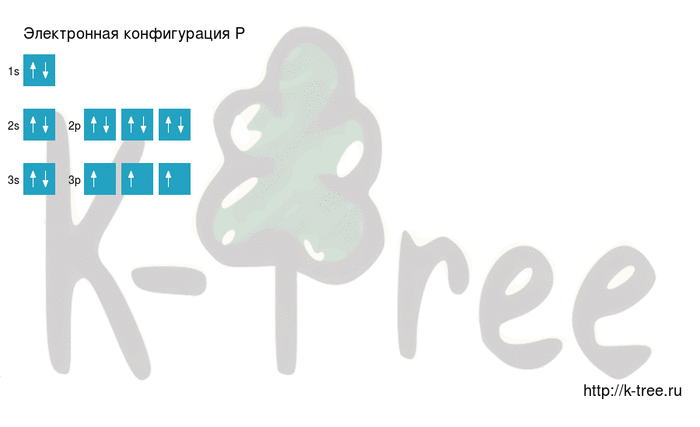фосфор номер в таблице менделеева
Введение
С фосфором знакомы все, кто хотя бы раз держал в руках коробку спичек. Более того, каждый из нас носит в себе довольно много (4,5 кг) этого элемента, но, конечно, в виде химических соединений. Фосфорсодержащие белки присутствуют в мышцах, мозговой ткани и нервах. Но особенно много фосфора содержат кости и зубы: их химический состав почти точно совпадает с формулой минерала фосфорита Ca3(PO4)2.
Название элемента фосфор (светоносец) происходит от латинского фосфорус (светящий) и связано с его открытием – получением белого фосфора. Это было первое точно датированное открытие нового химического элемента.
История открытия элемента
Картина Джозефа Райта «Алхимик, открывающий фосфор» (1771 год), предположительно описывающая открытие фосфора Хеннигом Брандом.
Несколько позже фосфор был получен другим немецким химиком – Иоганном Кункелем.
Независимо от Бранда и Кункеля фосфор был получен Р. Бойлем, описавшим его в статье «Способ приготовления фосфора из человеческой мочи», датированной 14 октября 1680 года и опубликованной в 1693 году.
Усовершенствованный способ получения фосфора был опубликован в 1743 году Андреасом Маргграфом.
Существуют данные, что фосфор умели получать ещё арабские алхимики в XII в.
То, что фосфор – простое вещество, доказал Лавуазье.
Характеристика элемента
Фосфор-химический элемент 15-й группы (по устаревшей классификации – главной подгруппы пятой группы) третьего периода периодической системы Д. И. Менделеева; имеет атомный номер 15. Элемент входит в группу пниктогенов. Фосфор – один из распространённых элементов земной коры: его содержание составляет 0,08–0,09 % её массы. Концентрация в морской воде 0,07 мг/л. В свободном состоянии не встречается из-за высокой химической активности. Образует около 190 минералов, важнейшими из которых являются апатит Ca5(PO4)3(F,Cl,OH), фосфорит и другие. Фосфор содержится во всех частях зелёных растений, ещё больше его в плодах и семенах (см. фосфолипиды). Содержится в животных тканях, входит в состав белков и других важнейших органических соединений (АТФ,ДНК), является элементом жизни.
Физические свойства
Элементарный фосфор при нормальных условиях существует в виде нескольких устойчивых аллотропических модификаций. Все возможные аллотропические модификации фосфора пока (2014 г.) до конца не изучены. Традиционно различают четыре его модификации: белый, красный, чёрный и металлический фосфор. Иногда их ещё называют главными аллотропными модификациями, подразумевая при этом, что все остальные описываемые модификации являются смесью этих четырёх. При стандартных условиях устойчивы только три аллотропических модификации фосфора (например, белый фосфор термодинамически неустойчив (квазистационарное состояние) и переходит со временем при нормальных условиях в красный фосфор). В условиях сверхвысоких давлений термодинамически устойчива металлическая форма элемента. Все модификации различаются по цвету, плотности и другим физическим и химическим характеристикам, особо, по химической активности. При переходе состояния вещества в более термодинамически устойчивую модификацию снижается химическая активность, например, при последовательном превращении белого фосфора в красный, потом красного в чёрный (металлический).
Белый фосфор
Белый фосфор представляет собой белое вещество (из-за примесей может иметь желтоватый оттенок). По внешнему виду он очень похож на очищенный воск или парафин, легко режется ножом и деформируется от небольших усилий.
Белый фосфор имеет молекулярную кристаллическую решётку, формула молекулы белого фосфора –P4, причём атомы расположены в вершинах тетраэдра. Отливаемый в инертной атмосфере в виде палочек (слитков), он сохраняется в отсутствии воздуха под слоем очищенной воды или в специальных инертных средах.
Плохо растворяется в воде, но легкорастворим в органических растворителях. Растворимостью белого фосфора в сероуглероде пользуются для промышленной очистки его от примесей. Плотность белого фосфора из всех его модификаций наименьшая и составляет около 1823 кг/м³. Плавится белый фосфор при 44,1 °C. В парообразном состоянии происходит диссоциация молекул фосфора.
Химически белый фосфор чрезвычайно активен. Например, он медленно окисляется кислородом воздуха уже при комнатной температуре и светится (бледно-зелёное свечение). Явление такого рода свечения вследствие химических реакций окисления называется хемилюминесценцией (иногда ошибочно фосфоресценцией). При взаимодействии с кислородом белый фосфор горит даже под водой.
Белый фосфор не только активен химически, но и весьма ядовит: летальная доза белого фосфора для взрослого человека составляет 0,05–0,15 г, а при хроническом отравлении поражает кости, например, вызывает омертвение челюстей. При контакте с кожей легко самовоспламеняется, вызывая серьёзные ожоги.
Под действием света, при нагревании до не очень высоких температур в безвоздушной среде, а также под действием ионизирующего излучения белый фосфор превращается в красный фосфор.
Жёлтый фосфор
Неочищенный белый фосфор обычно называют «жёлтый фосфор». Сильно ядовитое (ПДК в атмосферном воздухе 0,0005 мг/м³), огнеопасное кристаллическое вещество от светло-жёлтого до тёмно-бурого цвета. Удельный вес 1,83 г/см³, плавится при +43,1 °C, кипит при +280 °C. В воде не растворяется, на воздухе легко окисляется и самовоспламеняется. Горит ослепительным ярко-зеленым пламенем с выделением густого белого дыма – мелких частичек декаоксида тетрафосфора P4O10.
Так как фосфор реагирует с водой лишь при температуре свыше 500 градусов по цельсию, то для тушения фосфора используют воду в больших количествах (для снижения температуры очага возгорания и перевода фосфора в твердое состояние) или раствор сульфата меди (медного купороса), после гашения фосфор засыпают влажным песком. Для предохранения от самовозгорания жёлтый фосфор хранится и перевозится под слоем воды (раствора хлорида кальция).
Красный фосфор
Красный фосфор – это более термодинамически стабильная модификация элементарного фосфора. Впервые он был получен в 1847 году в Швеции австрийским химиком А. Шрёттером при нагревании белого фосфора при 500 °С в атмосфере угарного газа (СО) в запаянной стеклянной ампуле.
Красный фосфор имеет формулу Рn и представляет собой полимер со сложной структурой. В зависимости от способа получения и степени дробления, красный фосфор имеет оттенки от пурпурно-красного до фиолетового, а в литом состоянии – тёмно-фиолетовый с медным оттенком, имеет металлический блеск. Химическая активность красного фосфора значительно ниже, чем у белого; ему присуща исключительно малая растворимость. Растворить красный фосфор возможно лишь в некоторых расплавленных металлах (свинец и висмут), чем иногда пользуются для получения крупных его кристаллов. Так, например, немецкий физико-химик И. В. Гитторф в 1865 году впервые получил прекрасно построенные, но небольшие по размеру кристаллы (фосфор Гитторфа). Красный фосфор на воздухе не самовоспламеняется, вплоть до температуры 240–250 °С (при переходе в белую форму во время возгонки), но самовоспламеняется при трении или ударе, у него полностью отсутствует явление хемилюминесценции. Нерастворим в воде, а также в бензоле, сероуглероде и других, растворим в трибромиде фосфора. При температуре возгонки красный фосфор превращается в пар, при охлаждении которого образуется в основном белый фосфор.
Ядовитость его в тысячи раз меньше, чем у белого, поэтому он применяется гораздо шире, например, в производстве спичек (составом на основе красного фосфора покрыта тёрочная поверхность коробков). Плотность красного фосфора также выше, и достигает 2400 кг/м³ в литом виде. При хранении на воздухе красный фосфор в присутствии влаги постепенно окисляется, образуя гигроскопичный оксид, поглощает воду и отсыревает («отмокает»), образуя вязкую фосфорную кислоту; поэтому его хранят в герметичной таре. При «отмокании» – промывают водой от остатков фосфорных кислот, высушивают и используют по назначению.
Чёрный фосфор
Чёрный фосфор – это наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Впервые чёрный фосфор был получен в 1914 году американским физиком П. У. Бриджменом из белого фосфора в виде чёрных блестящих кристаллов, имеющих высокую (2690 кг/м³) плотность. Для проведения синтеза чёрного фосфора Бриджмен применил давление в 2·10 9 Па (20 тысяч атмосфер) и температуру около 200 °С. Начало быстрого перехода лежит в области 13 000 атмосфер и температуре около 230 °С.
Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, и с полностью отсутствующей растворимостью в воде или органических растворителях. Поджечь чёрный фосфор можно, только предварительно сильно раскалив в атмосфере чистого кислорода до 400 °С. Чёрный фосфор проводит электрический ток и имеет свойства полупроводника. Температура плавления чёрного фосфора 1000 °С под давлением 18·10 5 Па.
Металлический фосфор
При 8,3·10 10 Па чёрный фосфор переходит в новую, ещё более плотную и инертную металлическую фазу с плотностью 3,56 г/см³, а при дальнейшем повышении давления до 1,25·10 11 Па – ещё более уплотняется и приобретает кубическую кристаллическую решётку, при этом его плотность возрастает до 3,83 г/см³. Металлический фосфор очень хорошо проводит электрический ток.
Химические свойства
Химическая активность фосфора значительно выше, чем у азота. Химические свойства фосфора во многом определяются его аллотропной модификацией. Белый фосфор очень активен, в процессе перехода к красному и чёрному фосфору химическая активность снижается. Белый фосфор в воздухе при окислении кислородом воздуха при комнатной температуре излучает видимый свет, свечение обусловлено фотоэмиссионной реакцией окисления фосфора.
В жидком и растворенном состоянии, а также в парах до 800 °С фосфор состоит из молекул Р4. При нагревании выше 800 °С молекулы диссоциируют: Р4 = 2Р2. При температуре выше 2000 °С молекулы распадаются на атомы.
Взаимодействие с простыми веществами
Фосфор легко окисляется кислородом:
(с избытком кислорода)
(при медленном окислении или при недостатке кислорода)
Взаимодействует со многими простыми веществами – галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства:
с металлами – окислитель, образует фосфиды:
фосфиды разлагаются водой и кислотами с образованием фосфина
с неметаллами – восстановитель:
С водородом фосфор практически не соединяется. Однако разложением некоторых фосфидов водой по реакции, например:
может быть получен аналогичный аммиаку фосфористый водород (фосфин) – РH3
Взаимодействие с водой
Взаимодействует с водяным паром при температуре выше 500 °С, протекает реакция диспропорционирования с образованием фосфина и фосфорной кислоты:
Взаимодействие со щелочами
В холодных концентрированных растворах щелочей также медленно протекает реакция диспропорционирования:
Восстановительные свойства
Сильные окислители превращают фосфор в фосфорную кислоту:
Реакция окисления фосфора происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
Простое вещество
Получение
Фосфор получают восстановлением фосфоритов или апатита коксом в присутствии SiO2 в электропечах при 1300-1500 0 C по реакции:
Красный фосфор получают нагреванием белого без доступа воздуха в течение нескольких часов при 375-400 0 C.
Очищают белый фосфор отстаиванием или фильтрованием расплава, переплавкой под слоем разбавленной хромовой смеси, обработкой 10-20%-ным раствором KOH при 90-100 0 C, 50%-ной H2SO4 и деионизированной водой при 41-50 0 C,сублимацией или перегонкой в вакууме либо перегонкой с водяным паром в атмосфере CO2, высокотемпературной обработкой паров (900-1200 0 C) на кварцевой насадке, зонной плавкой. Кристаллы белого фосфора получают испарением растворителя из его растворов в CS2 или бензоле.
Нахождение в природе
Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Са3(РО4)3·Ca(OH)2. В состав зубной эмали входит фторапатит. Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. При недостатке фосфора в организме развиваются различные заболевания костей.
Суточная потребность в фосфоре составляет:
для взрослых 1,0–2,0 г
для беременных и кормящих женщин 3–3,8 г
для детей и подростков 1,5–2,5 г
При больших физических нагрузках потребность в фосфоре возрастает в 1,5–2 раза.
Усвоение происходит эффективнее при приеме фосфора вместе с кальцием в соотношении 3:2 (P:Ca).
Токсикология элементарного фосфора
-Красный фосфор практически нетоксичен (токсичность ему придают примеси белого фосфора). Пыль красного фосфора, попадая в легкие, вызывает пневмонию при хроническом действии.
Острые отравления фосфором проявляются жжением во рту и желудке, головной болью, слабостью, рвотой. Через 2–3 суток развивается желтуха. Для хронических форм характерны нарушение кальциевого обмена, поражение сердечно-сосудистой и нервной систем. Первая помощь при остром отравлении – промывание желудка, слабительное, очистительные клизмы, внутривенно растворы глюкозы. При ожогах кожи обработать пораженные участки растворами медного купороса или соды. ПДК паров фосфора в воздухе производственных помещений – 0,03 мг/м³, временно допустимая концентрация в атмосферном воздухе – 0,0005 мг/м³, ПДК в питьевой воде – 0,0001 мг/дм³.
Токсикология соединений фосфора
Некоторые соединения фосфора (фосфин) очень токсичны. Боевые отравляющие вещества – зарин, зоман, табун, V-газы являются соединениями фосфора.
Использование
Фосфор является важнейшим биогенным элементом и в то же время находит очень широкое применение в промышленности. Красный фосфор применяют в производстве спичек. Его вместе с тонко измельчённым стеклом и клеем наносят на боковую поверхность коробки. При трении спичечной головки, в состав которой входят хлорат калия и сера, происходит воспламенение.
Элементарный фосфор
Пожалуй, первое свойство фосфора, которое человек поставил себе на службу, – это горючесть. Горючесть фосфора очень велика и зависит от аллотропической модификации.
Наиболее активен химически, токсичен и горюч белый («жёлтый») фосфор, потому он очень часто применяется (в зажигательных бомбах и пр.).
Красный фосфор – основная модификация, производимая и потребляемая промышленностью. Он применяется в производстве спичек, взрывчатых веществ, зажигательных составов, различных типов топлива, а также противозадирных смазочных материалов, в качестве газопоглотителя в производстве ламп накаливания.
Соединения фосфора в сельском хозяйстве
Фосфор (в виде фосфатов) – один из трёх важнейших биогенных элементов, участвует в синтезе АТФ. Большая часть производимой фосфорной кислоты идёт на получение фосфорных удобрений –суперфосфата, преципитата, аммофоски и др.
Соединения фосфора в промышленности
Фосфаты широко используются:
-в качестве комплексообразователей (средства для умягчения воды),
-в составе пассиваторов поверхности металлов (защита от коррозии, например, т. н. состав «мажеф»).
Фосфатные связующие
Способность фосфатов формировать прочную трёхмерную полимерную сетку используется для изготовления фосфатных и алюмофосфатных связок.
Заключение
Фосфор – шестой по содержанию элемент в организме человека после кислорода, водорода, углерода, азота и кальция.
Список литературы
1. Фосфор // Википедия
2. Фосфор и его свойства // school-collection.edu.ru
3. Фосфор // xumuk.ru
4. Фосфор // school-collection.edu.ru
5. Фосфор как элемент и вещество // festival.1september.ru
Фосфор P
Фосфор в таблице менделеева занимает 15 место, в 3 периоде.
| Символ | P |
| Номер | 15 |
| Атомный вес | 30.9737620 |
| Латинское название | Phosphorus |
| Русское название | Фосфор |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема фосфора
Порядок заполнения оболочек атома фосфора (P) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Фосфор имеет 15 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
3 электрона на 3p-подуровне
Степень окисления фосфора
Ионы фосфора
Валентность P
Атомы фосфора в соединениях проявляют валентность V, IV, III, II, I.
Валентность фосфора характеризует способность атома P к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа P
Квантовые числа определяются последним электроном в конфигурации, для атома P эти числа имеют значение N = 3, L = 1, Ml = 1, Ms = ½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Перейти к другим элементам таблицы менделеева
Химический элемент Фосфор
Использование и свойства элемента Фосфор
Белый фосфор используется в факелах и зажигательных устройствах. Красный фосфор находится в материале, наклеенном на бок спичечных коробок, который используется для зажигания предохранительных спичек.Безусловно, наибольшее количество соединений фосфора используется для производства удобрений. Фосфат аммония производится из фосфатных руд. Руды сначала превращаются в фосфорную кислоту, а затем превращаются в фосфат аммония.Фосфор также важен при производстве стали. Фосфаты входят в состав некоторых моющих средств, но в некоторых странах их использование постепенно прекращается. Это связано с тем, что они могут привести к высокому уровню фосфатов в природных источниках воды, что приведет к росту нежелательных водорослей. Фосфаты также используются при производстве специальных стекол и изысканной фарфоровой посуды.
Фосфор необходим всем живым существам. Он образует сахарно-фосфатный остов ДНК и РНК. Он важен для передачи энергии в клетках как часть АТФ (аденозинтрифосфата) и содержится во многих других биологически важных молекулах. Мы потребляем около 1 грамма фосфата в день и храним около 750 граммов в нашем организме, поскольку наши кости и зубы в основном состоят из фосфата кальция. Чрезмерное использование фосфатов из удобрений и моющих средств может привести к загрязнению рек и озер, вызывая быстрый рост водорослей. Водоросли блокируют свет, останавливая дальнейший фотосинтез. Кислород, растворенный в воде, скоро иссякает, и озеро умирает.
В природе фосфор не встречается в несоединенном виде, но он широко присутствует в составе минералов. Важным источником является фосфатная руда, содержащая минералы апатита и обнаруженная в больших количествах в США и других странах. Есть опасения, что «пик фосфора» произойдет примерно в 2050 году, после чего наши источники истощатся.Белый фосфор производят в промышленных масштабах путем нагревания фосфоритов в печи в присутствии углерода и кремнезема. При этом образуется фосфор в виде пара, который затем собирается под водой. Красный фосфор получают путем осторожного нагревания белого фосфора примерно до 250 ° C в отсутствие воздуха.
История химического элемента Фосфор
Фосфор был впервые получен Хеннигом Брандтом в Гамбурге в 1669 году, когда он испарил мочу и нагрел остаток, пока он не стал докрасна, после чего пар фосфора перегонялся, который он собирал, конденсируя его в воде. Брандт держал свое открытие в секрете, полагая, что он обнаружил философский камень, который может превращать неблагородные металлы в золото. Когда у него кончились деньги, он продал фосфор Дэниелу Крафт, который выставлял его по всей Европе, включая Лондон, где Роберт Бойл был очарован им. Он обнаружил, как это было произведено, и систематически исследовал это. (Его помощник Амброуз Годфри основал свой бизнес по продаже и продаже фосфора и разбогател.)
Когда стало понятно, что кость представляет собой фосфат кальция и может быть использована для производства фосфора, она стала более доступной. Спрос со стороны производителей спичек в 1800-х годах обеспечил готовый рынок.
Фосфор как химический элемент таблицы Менделеева
Как был открыт Фосфор
История открытия фосфора является очень интересной. Вообще, кандидатов на открытие фосфора было очень много, так как несколько ученых объявили об открытии приблизительно одновременно. Само открытие было сделано 1669 году немецким алхимиком Хеннигом Брандом. Его желание создать легендарный «филосовский камень» и позволило свершиться этому открытию. Он ставил опыты над мочой в надежде из нее получить золото. Его предположение основывалось на том, что и то и другое одного цвета. Бранд держал мочу несколько дней пока та не начала издавать ужасный запах. После этого он сварил ее в пасту и нагрел до высокой температуры. Образовавшиеся пары он проводил через воду в надежде, что они сконденсируют в золото. Вместо этого он получил белое воскообразное вещество, которое светилось в темноте. Вот таким способом был открыт новый химический элемент.
Кстате, фосфор действительно является первым химическим элементом, который был по настоящему открыт. То есть об этом элементе не было известно вообще ничего и ни о каких его формах.
Где и как добывают Фосфор
Фосфор как отдельный химический элемент получают из фосфатных минералов, таких как фосфорит или апатит. Распространенность этих минералов довольно широкая. Ими в достаточных количествах обладают Россия, Китай, Индия, Канада, Бразилия и многие другие страны.
Получают элементарный фосфор нагревом фосфорита или апатита с кварцевым гравием при температуре около 1500°C. Необходимым условием является то, чтобы печь была выполнена в виде закрытой шахтной печи. Тепло должно передаваться через электроды Содерберга. Углеродная масса, содержащаяся в электроде действует как восстановитель, а диоксид кремния в этом случае служит в качестве генератора шлака. Газообразный фосфор конденсируется и собирается под водой в результате химичнских реакций.
Распространенность Фосфора
Распространенность фосфора является не полностью определенной. О распространенности фосфора во вселенной известно довольно немного. В 2013 году ученые выдвинули предположение, что фосфор в больших количествах вырабатывается при появлении сверхновых звезд. Не понятно из каких соображений сделаны такие выводы, но факт такого открытия присутствует.
Что касается Земли, то тут можно заметить, что ученые оценивают отношение содержания фосфора в земной коре как один грамм на один килограмм массы. В свободном виде из-за его высокой реакционной способности фосфор не встречается. Основные формы фосфора на Земле в виде соединений в минералах. К самым коммерчески важным относят апатит, вавеллит, вивианит и бирюзовый. На сегодняшний день дефицита фосфора не предвещается, но предположительно запасов хватит только на 400 лет.
Так же фосфор содержится в помете некоторых животных и птиц. В основном это касается морских животных и птиц. В пример можно привести гуано, которое является пометом птиц. Они могут содержать от 7 до 60% фосфатных соединений. Эти птицы были завиксированны на небольших островах принадлежащих современным Перу и Чили. Это свидетельствует о том, что океан является безграничным неизведанным запасом фосфора. Ежегодная добыча фосфоросодержащих минералов оценивается приблизительно в 180 миллионов.
Применение Фосфора
Что касается применения фосфора, то тут можно явно отметить, что на сегодняшний день оно является не очень широким. Сегодня 80% из 180 млн тонн добываемых фосфоросодержащих минералов перерабатывается до оксида фосфора(V), который является важнейшим сырьем для производства удобрений и различного рода средств защиты для растений. Таким образом большая часть переходит в пользование химической прлмышленности. Оставшаяся часиь фосфора тратится на металлургию, пищевую промышленность, медицину, изготовление фарфора и военное дело.
Интересные факты
Интересных фактов связанных с фосфором достаточно много. Стоит начать с того, что потенциал фосфора в полной мере еще не реализован. Это предположение выдвигается потому что он играет огромную роль в организме человека. В частности уже известно, что фосфор является составной частью цепей РНК и ДНК. На сегодняшний день ведуться исследования по воздействию на эти цепи. Вы только представьте, что в один прекрасный день можно будет избавиться от всех страшных болезней путем воздействия на цепь ДНК человека. Среднестатистический взрослый человек имеет около 700 грамм фосфора в составе своего организма. Большая его часть содержится в костях и зубах в виде аппатита. Недостаток фосфора в организме может пагубно влиять на здоровье человека.
Стоит отметить еще высокую токсичность этого элемента. Вернее не его самого, а именно его аллотропов. В пример можно привести белый фосфор. Раньше использование белого фосфора было очень широко. Чтобы было понятней его использовали даже в спичках, вместо привычной нам сегодня серы. От него пришлось отказаться из-за его высокой токсичности. Так же он имеет возможность самовоспламеняться. Температура самовоспламенения его пыли составляет 34°C, что очень приближено к комнатной. Поэтому он представляет опасность со всевозможных сторон безопасности.