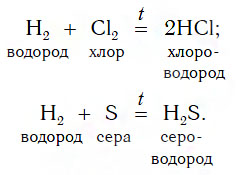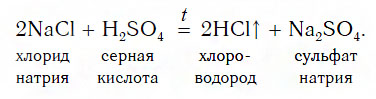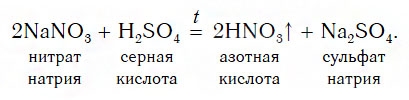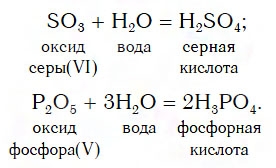что нужно чтобы сделать кислоту
Урок 36. Получение и применение кислот
В уроке 36 «Получение и применение кислот» из курса «Химия для чайников» изучим все возможные способы получения кислот в лабораторных условиях, а также узнаем о широком спектре применения серной кислоты.
Получение кислот
Для получения неорганических кислот используют реакции разных типов. Рассмотрим важнейшие из них.
Взаимодействие некоторых простых веществне — металлов с водородом
Образующиеся газообразные продукты реакций — HCl и H2S — растворяют в воде и получают соответствующие бескислородные кислоты — хлороводородную и сероводородную. Таким же образом можно получить и бромоводородную кислоту — раствор газа бромоводорода HBr в воде. К какому типу относятся рассмотренные реакции получения HCl и H2S?
Взаимодействие серной кислоты с твердыми солями
Этот способ основан на том, что нелетучая серная кислота H2SO4 при нагревании вытесняет летучие кислоты — HCl и HNO3— из их солей. Поэтому хлороводородную кислоту можно получить, нагревая смесь ее соли — твердого хлорида натрия с серной кислотой:
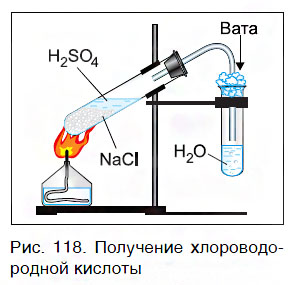
Газообразный хлороводород, выделяющийся в этой реакции, растворяют в воде и получают хлороводородную кислоту (рис. 118). Поскольку она образуется из хлорида натрия NaCl, называемого в быту просто «соль», то эту кислоту очень часто называют «соляной кислотой».
Для получения азотной кислоты нагревают смесь ее соли — нитрата натрия NaNO3 — с серной кислотой:
Пары азотной кислоты, образующиеся в результате этой реакции, охлаждают до комнатной температуры, и она переходит в жидкое состояние.
Взаимодействие кислотных оксидов с водой
Вы уже знаете, что кислотные оксиды, кроме SiO2, реагируют с водой. Это их свойство используют для получения некоторых кислородсодержащих кислот, например серной и фосфорной:
Поскольку оксид кремния SiO2 с водой не реагирует, то соответствующую ему кислоту H2SiO3 получают другими способами.
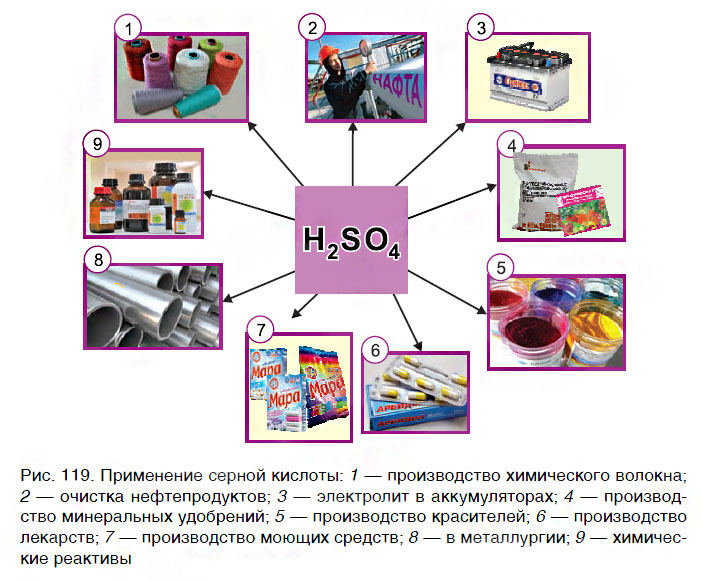
Применение кислот
Кислоты широко используются практически во всех сферах деятельности человека — в быту, в различных отраслях промышленности, в медицине. Наибольшее применение находит серная кислота (рис. 119). Так как кислоты оказывают разрушающее действие на кожу, бумагу, ткани, обращаться с ними следует осторожно, соблюдая правила безопасности.
Краткие выводы урока:
Надеюсь урок 36 «Получение и применение кислот» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Получение соляной кислоты в домашних условиях
Соляная кислота применяется в изготовлении некоторых ВВ. Сейчас
является перекурсором, и приобрести ее в Химмаге не получится. Но ее
достаточно просто изготовить в домашних условиях. Химически чистая
концентрированная соляная кислота бесцветная, дымящаяся на воздухе
жидкость (выделяется хлороводород) с резким запахом. Плотность соляной
кислоты составляет 1.19, при концентрации 37 %.
Реактивы:
NaCl – поваренная соль. В принципе подойдет любой хлорид, KCl например.
H2SO4 – серная кислота. Обязательно
концентрированная (обугливает спичку в холодном состоянии), вполне
подойдет выпаренный электролит.
Защитное снаряжение:
Соляная кислота – ЗЛО! При попадании на кожу вызывает химические
ожоги. На одежду ей тоже не следует попадать – разъедает мгновенно.
Хлороводород ядовит! Получение соляной кислоты лучше производить на
открытом воздухе или в хорошо проветриваемом помещении.
Минимум защитных средств:
1. Резиновые перчатки (лучше как на фото).
2. Противогаз ну или респиратор (поможет вам быстро ликвидировать последствия возможной аварии без вреда для здоровья).
Оборудование:
1. Электрическая плитка или другой источник тепла.
2. Весы.
3. Мерный стакан.
4. Реакционный сосуд, я использовал плоскодонную колбу на 250 мл.
5. Предохранительная склянка. Прекрасно подойдет любая колба, (главное,
чтобы объем склянки не был меньше объема получаемой кислоты).
6. Пара резиновых пробок.
7. Трубки, можно использовать трубки от капельниц.
В итоге должен получиться вот такой прибор.
Правда тут есть пара нюансов:
1. Трубки, используемые в приборе должны быть одного диаметра, лучше
отказаться от использования иголок от шприцов в качестве штуцеров. Это
создаст разность в давлении и аппарат рванет (у меня так и случилось при
использовании иглы от шприца).
2. Трубку, из которой идет HCl лучше не опускать в воду, так как вода
может быть засосана в систему из-за большой растворимости HCl.
3. Предохранительная склянка в принципе необязательна, можно и без нее,
но если воду засосет в реакционную колбу и она может лопнуть,
разбрызгивая горячую серную кислоту.
Изготовление:
1. Отвешиваем соль примерно 10-20 граммов. Кислоты возьмите примерно
столько же 10-15 миллилитров. Я написал примерно потому что количество
кислоты зависит от ее концентрации. Я брал 1 : 1 по объему. Если кислота
60-80%, то хлороводород сначала растворится в воде, а только потом
будет выделяться.
Короче говоря, МЕНЬШЕ ВОДЫ – Меньше ПРОБЛЕМ!
Так что лучше потратить побольше времени на выпаривание электролита.
2. Помещаем соль в реакционную колбу.
3. Собираем установку, проверяем все соединения, они должны быть герметичны.
4. Наливаем в мерный стакан 50-100 мл. воды (желательно дистиллированной) и вставляем в него трубку.
5. Надеваем противогаз.
6. Теперь главное быстро налить серную кислоту в реакционную колбу и
заткнуть горлышко газоотводной трубкой. Противогаз спасет вас от
хлороводорода, который начнет выделяться.
7. Сначала реакция идет сама, потом колбу нужно чуть-чуть нагреть.
NaCl + H2SO4 → Na2SO4 + 2HCl↑
Далее приведены фотографии прибора и всего процесса:
Таким способом можно получить кислоту максимальной концентрации
37-40%. В процессе получения вы увидите, как объем воды, которую вы
налили в стакан начнет увеличиваться. Продолжайте насыщать воду до тех
пор, пока газ не перестанет растворятся.
Хранить кислоту нужно в плотно закрытой таре, во избежании улетучивания HCl.
УДАЧИ!
Соляная кислота своими руками из электролита
Получение соляной кислоты в домашних условиях
Соляная кислота применяется в изготовлении некоторых ВВ. Сейчас является перекурсором, и приобрести ее в Химмаге не получится. Но ее достаточно просто изготовить в домашних условиях. Химически чистая концентрированная соляная кислота бесцветная, дымящаяся на воздухе жидкость (выделяется хлороводород) с резким запахом. Плотность соляной кислоты составляет 1.19, при концентрации 37 %.
Реактивы:
NaCl – поваренная соль. В принципе подойдет любой хлорид, KCl например.
H2SO4 – серная кислота. Обязательно концентрированная (обугливает спичку в холодном состоянии), вполне подойдет выпаренный электролит.
Защитное снаряжение:
Соляная кислота – ЗЛО! При попадании на кожу вызывает химические ожоги. На одежду ей тоже не следует попадать – разъедает мгновенно. Хлороводород ядовит! Получение соляной кислоты лучше производить на открытом воздухе или в хорошо проветриваемом помещении. Минимум защитных средств: 1. Резиновые перчатки (лучше как на фото). 2. Противогаз ну или респиратор (поможет вам быстро ликвидировать последствия возможной аварии без вреда для здоровья).
Оборудование: 1. Электрическая плитка или другой источник тепла. 2. Весы. 3. Мерный стакан. 4. Реакционный сосуд, я использовал плоскодонную колбу на 250 мл. 5. Предохранительная склянка. Прекрасно подойдет любая колба, (главное, чтобы объем склянки не был меньше объема получаемой кислоты). 6. Пара резиновых пробок. 7. Трубки, можно использовать трубки от капельниц.
В итоге должен получиться вот такой прибор.
Правда тут есть пара нюансов: 1. Трубки, используемые в приборе должны быть одного диаметра, лучше отказаться от использования иголок от шприцов в качестве штуцеров. Это создаст разность в давлении и аппарат рванет (у меня так и случилось при использовании иглы от шприца). 2. Трубку, из которой идет HCl лучше не опускать в воду, так как вода может быть засосана в систему из-за большой растворимости HCl. 3. Предохранительная склянка в принципе необязательна, можно и без нее, но если воду засосет в реакционную колбу и она может лопнуть, разбрызгивая горячую серную кислоту.
Изготовление:
1. Отвешиваем соль примерно 10-20 граммов. Кислоты возьмите примерно столько же 10-15 миллилитров. Я написал примерно потому что количество кислоты зависит от ее концентрации. Я брал 1 : 1 по объему. Если кислота 60-80%, то хлороводород сначала растворится в воде, а только потом будет выделяться.
Короче говоря, МЕНЬШЕ ВОДЫ – Меньше ПРОБЛЕМ! Так что лучше потратить побольше времени на выпаривание электролита.
Как правильно приготовить электролит в домашних условиях: техника безопасности
Приготовление раствора — работа с кислотами и щелочами, поэтому соблюдение мер предосторожности необходимо для самых опытных людей. Перед началом действия подготовьте средства защиты:
Оборудование
Для приготовления аккумуляторного электролита помимо самого источника питания потребуются следующие предметы:
Последовательность процесса: делаем электролит для кислотно-свинцового источника питания
Перед началом работ ознакомьтесь с информацией, приведённой в таблице 3. Она позволит выбрать необходимый объем жидкостей. В аккумуляторах залито от 2,6 до 3,7 литра кислотного раствора. Мы рекомендуем разводить примерно 4л электролита.
Делаем паяльную кислоту
Все люди, которые паяют и паяли когда-либо металлические изделия, знают, как сложно припаять к металлу олово. Конечно же, такую кислоту всегда можно купить в магазине, но всегда проще что-то сделать своими руками и понять процесс изготовления определенных вещей, чем покупать уже готовые продукты в магазине.
Если вы хотите попробовать сделать паяльную кислоту у себя дома, то смотрите видео
Для изготовления паяльной кислоты, нам понадобится: — соляная кислота, концентрированная; — цинк в гранулах или стаканчики от старых батареек; — баночка.
Если вы не нашли цинк в гранулах, вы можете использовать бочонки от старых батареек или обратится в пункт скупки цветного металла, там очень часто бывает цинк, который вы сможете приобрести. Если у вас дома не оказалось неиспользованных батареек, а в пункте цветных металлов не оказалось лишнего цинка, то просто пройдитесь по рынку, там можно очень часто найти людей, которые продают цинк.
Паяльная кислота получается, когда в соляной кислоте растворяется цинк из расчета 412 грамм цинка на 1 литр соляной кислоты.
Насыпаем цинк и аккуратно заливаем все соляной кислотой, но ее уровень не должен превышать ¾ глубины посуды. Когда цинк полностью растворится, то прекратится полностью растворение пузырьков водорода.
Важно! При изготовлении паяльной кислоты всегда соблюдайте технику безопасности. Надевайте защитные перчатки, а защитные очки на глаза.
Когда зальем цинк соляной кислотой, у нас будет огромное количество пузырьков и пара. Пар – это жидкий водород, а пузырьки – это происходит реакция, при которой полностью растворяется наш цинк.
Реакция будет достаточно продолжительная, но вам придется дождаться, пока растворится весь цинк.
Дождитесь того момента, когда поверхность соляной кислоты будет без газообразований. На низу остатки от цинка должны перестать выпускать газы и только тогда соляной кислотой можно начинать пользоваться.
Рецепты паяльной кислоты
При проведении пайки для предварительной обработки поверхности деталей во многих случаях используют флюсы кислотного характера. Степень активности материала подбирают в зависимости от типа металла и меры его загрязнения.
В продаже есть различные средства, состав которых подобран с учетом специфики предстоящей работы. Можно сделать паяльную кислоту в домашних условиях самостоятельно.
Для этого потребуется определенные знания, элементарное умение делать химические составы и небольшая сумма денег для приобретения компонентов.
Меры безопасности
Приготовление электролита представляет собой опасность из-за использования очень агрессивных веществ. Концентрированные растворы кислоты и щелочей способны вызвать труднозаживающие кислотные ожоги, а при попадании в глаза вызывают слепоту.
Перед работой следует приготовить нейтрализующий раствор для смывки случайно попавших на тело капель электролита:
Работать следует в резиновых перчатках и обязательно в защитных очках или маске. При попадании электролита на кожу нужно обильно промыть место попадания нейтрализующим раствором, а после промывки глаз немедленно обратиться к врачу.
Все работы производятся на открытом воздухе или хорошо вентилируемом помещении. Пары кислоты, выделяющиеся при приготовлении раствора (особенно в горячем состоянии) вызывают раздражение верхних дыхательных путей, выраженные сильным кашлем и отеком слизистых оболочек.
В качестве одежды в домашних условиях можно использовать ту, которую не сильно жалко, поскольку даже после промывки нейтрализующим раствором между волокнами ткани останется часть агрессивного вещества и вещи будут безнадежно испорчены.
Зачем нужен кислотный флюс
К металлам относятся вещества большой активности. Многие из них легко и быстро окисляются в присутствии воздуха. Образующиеся оксиды под действием атмосферной влаги превращаются в гидроксиды.
Смесь продуктов окисления хорошо заметна на железных изделиях после хранения на воздухе. Называется она ржавчиной. Другие металлы также покрываются оксидным слоем, который не позволяет ничего припаять к изделию.
Справиться с проблемой помогают кислотные флюсы, самым простым их которых является паяльная кислота. Под этим названием собраны несколько разных однокомпонентных или сложных составов, многие из которых можно приготовить своими руками.
Что можно сделать дома
Степень кислотности флюсов отличается. К активным смесям относятся композиции с хлоридом цинка. Из школьного курса, возможно, кто-то запомнил свойства солевых растворов.
Соли в присутствии воды склонны претерпевать гидролиз. Хлорид цинка при обменных реакциях с водой образует сильную кислоту и слабую щелочь. Поэтому раствор имеет активный кислотный характер. Соляная кислота быстро удаляет оксидные вещества.
Обычно паяльную кислоту делают прибавлением 412 г цинка к 1 литру концентрированной соляной (гидрохлоридной) кислоты. Процедура это не совсем приятна и безопасна. При работе выделяются летучие кислые пары.
Работать с концентрированной солянкой следует только под вытяжкой или в респираторе, находясь в хорошо проветриваемой комнате.
С соляной кислотой
Популярностью пользуется несколько составов с хлористым цинком. Соединения цинка используются в процессе цинкования для защиты металлов от коррозии. Этот химический элемент известен устойчивостью к процессам окисления. Сделать паяльные кислоты своими руками несложно.
Для продукции из черных и цветных металлов подойдет следующее соотношение:
Оба компонента нужно быстро растворить в воде. Следует учесть, что соляная кислота – сильно летучее вещества. Работать с ней желательно под вытяжкой. Склянку с исходным реактивом нужно держать только в закрытом состоянии.
С вазелином и спиртом
Для деталей из черных и цветных металлов иногда вместо паяльной кислоты удобнее использовать пасту с кислотными свойствами.
Для ее приготовления нужно смешать насыщенный раствор хлорида цинка – 3,7 % и технический вазелин – 85 %. Для придания требуемой консистенции в смесь добавляют немного воды.
Особенности технологии приготовления электролита
При самостоятельном приготовлении следует помнить следующее:
Из перечисленного следует, что посуда для приготовления электролита должна быть из материала, стойкого к действию агрессивных веществ и температуры. Наиболее соответствует этим требованиям посуда из стекла и керамики. Использование пластиковой посуды возможно при условии недопускания ее нагрева до высоких температур. Нельзя использовать эмалированную посуду, поскольку при наличии незаметных трещин в эмали будет происходить загрязнение электролита солями металлов. То же самое относится к изделиям из нержавеющей стали. Такие материалы не вступают в реакцию с водой, но производители не гарантируют ее нейтральность по отношению к агрессивным веществам.
Важно! Перед тем, как сделать электролит, заранее отмеряют необходимое количество компонентов.
Приготовление кислотного электролита
Высокая плотность кислоты и способность разогрева при смешивании с водой обусловили специфику приготовления раствора: кислоту нужно вливать в воду. Если поступить наоборот, то вода, оказавшись сверху, нагреется до температуры закипания и выплеснется наружу вместе с каплями кислоты.
Чтобы уменьшить нагрев, кислоту целесообразно разбавить в два этапа. На первом готовится раствор плотностью 1.40, а затем, после остывания, делают электролит необходимой концентрации. Раствор с плотностью 1.40 называют корректирующим. Он применяется для коррекции плотности электролита в рабочих аккумуляторах. После добавления кислоты в воду смесь аккуратно перемешивают стеклянной палочкой. Приготовленный электролит необходимо оставить на некоторое время (от половины до суток) для его равномерного смешивания и полного остывания.
Внимание! Срок хранения кислотного раствора неограничен.
Приготовление щелочного электролита
Необходимое количество щелочи высыпают в отмеренное количество воды и перемешивают до полного растворения. Также необходимо выдержать время, пока осадок не растворится полностью и температура не опустится до нормальной.
Раствор щелочи нужно хранить в герметично закрытой таре, не допуская попадания воздуха. Углекислый газ легко вступает в реакцию со щелочами с образованием карбонатов – солей угольной кислоты. В результате содержание активного вещества в растворе с течением времени падает.
Растворы кислоты и щелочи должны быть прозрачными или иметь легкий желтоватый оттенок. Наличие мутности отстоявшегося раствора говорит о низкой чистоте исходных компонентов и для использования в аккумуляторах непригодны.
Растворы кислот
Приблизительные растворы. В большинстве случаев в лаборатории приходится пользоваться соляной, серной и азотной кислотами. Кислоты имеются в продаже в виде концентрированных растворов, процентное содержание которых определяют по их плотности.
Кислоты, применяемые в лаборатории, бывают технические и чистые. Технические кислоты содержат примеси, а потому при аналитических работах не употребляются.
Концентрированная соляная кислота на воздухе дымит, поэтому работать с ней нужно в вытяжном шкафу. Наиболее концентрированная соляная кислота имеет плотность 1,2 г/см3 и содержит 39,11%’ хлористого водорода.
Разбавление кислоты проводят по расчету, описайному выше.
Пример. Нужно приготовить 1 л 5%-ного раствора соляной кислоты, пользуясь раствором ее с плотностью 1,19 г/см3. По справочнику узнаем, что 5%,-ный раствор нмеет плотность 1,024 г/см3; следовательно, 1 л ее будет весить 1,024*1000 = 1024 г. В этом количестве должно содержаться чистого хлористого водорода:
Кислота с плотностью 1,19 г/см3 содержит 37,23% HCl (находим также по справочнику). Чтобы узнать, сколько следует взять этой кислоты, составляют пропорцию:
или 137,5/1,19 = 115,5 кислоты с плотностью 1,19 г/см3, Отмерив 116 мл раствора кислоты, доводят объем его до 1 л.
Так же разбавляют серную кислоту. При разбавлении ее следует помнить, что нужно приливать кислотук воде
, а не наоборот. При разбавлении происходит сильное разогревание, и если приливать воду к кислоте, то возможно разбрызгивание ее, что опасно, так как серная кислота вызывает тяжелые ожоги. Если кислота попала на одежду или обувь, следует быстро обмыть облитое место большим количеством воды, а затем нейтрализовать кислоту углекислым натрием или раствором аммиака. При попадании на кожу рук или лица нужно сразу же обмыть это место большим количеством воды.
Особой осторожности требует обращение с олеумом, представляющим моногидрат серной кислоты, насыщенный серным ангидридом SO3. По содержанию последнего олеум бывает нескольких концентраций.
Следует помнить, что при небольшом охлаждении олеум закристаллизовывается и в жидком состоянии находится только при комнатной температуре. На воздухе он дымит с выделением SO3, который образует пары серной кислоты при взаимодействии с влагой воздуха.
Большие трудности вызывает переливание олеума из крупной тары в мелкую. Эту операцию следует проводить или под тягой, или на воздухе, но там, где образующаяся серная кислота и SO3 не могут оказать какого-либо вредного действия на людей и окружающие предметы.
Если олеум затвердел, его следует вначале нагреть, поместив тару с ним в теплое помещение. Когда олеум расплавится и превратится в маслянистую жидкость, его нужно вынести на воздух и там переливать в более мелкую посуду, пользуясь для этого способом передавлива-ния при помощи воздуха (сухого) или инертного газа (азота).
При смешивании с водой азотной кислоты также происходит разогревание (не такое, правда, сильное, как в случае серной кислоты), и поэтому меры предосторожности должны применяться и при работе с ней.
В лабораторной практике находят применение твердые органические кислоты. Обращение с ними много проще и удобнее, чем с жидкими. В этом случае следует заботиться лишь о том, чтобы кислоты не загрязнялись чем-либо посторонним. При необходимости твердые органические кислоты очищают перекристаллизацией (см, гл. 15 «Кристаллизация»),
Точные растворы. Точные растворы кислот готовят так же, как и приблизительные, с той только разницей, что вначале стремятся получить раствор несколько большей концентрации, чтобы после можно было его точно, по расчету, разбавить. Для точных растворов берут только химически чистые препараты.
Нужное количество концентрированных кислот обычно берут по объему, вычисленному на основании плотности.
Пример. Нужно приготовить 0,1 и. раствор H2SO4. Это значит, что в I л раствора должно содержаться:
Кислота с плотностью 1,84 г\смг содержит 95,6% H2SO4 н для приготовления 1 л 0,1 н. раствора нужно взять следующее количество (х) ее (в г):
Соответствующий объем кислоты составит:
Отмерив из бюретки точно 2,8 мл кислоты, разбавляют ее до 1 л в мерной колбе и затем титруют раствором щелочи п устанавливают нормальность полученного раствора. Если раствор получится более концентрированный), к нему добавляют из бюретки рассчитанное количество воды. Например, при титровании установлено, что 1 мл 6,1 н. раствора H2SO4 содержит не 0,0049 г H2SO4, а 0,0051 г. Для вычисления количества воды, которое необходимо для приготовления точно 0,1 н. раствора, составляем пропорцию:
Расчет показывает, что этот объем равен 1041 мл раствор нужно добавить 1041 — 1000 = 41 мл воды. Следует еще учесть то количество раствора, которое взято для титрования. Пусть взято 20 мл, что составляет 20/1000 = 0,02 от имеющегося объема. Следовательно, воды нужно добавить не 41 мл, а меньше: 41 — (41*0,02) = = 41 —0,8 = 40,2 мл.
Исправленный раствор следует снова проверить на содержание вещества, взятого для растворения. Точные растворы соляной кислоты готовят также ионообменным способом, исходя из точной рассчитанной навески хлористого натрия. Рассчитанную и отвешенную на аналитических весах навеску растворяют в дистиллированной или деминерализованной воде, полученный раствор пропускают через хроматографическую колонку, наполненную катионитом в Н-форме. Раствор, вытекающий из колонки, будет содержать эквивалентное количество HCl.
Как правило, точные (или титрованные) растворы следует сохранять в плотно закрытых колбах, В пробку сосуда обязательно нужно вставлять хлоркальциевую трубку, заполненную в случае раствора щелочи натронной известью или аскаритом, а в случае кислоты — хлористым кальцием или просто ватой.
Для проверки нормальности кислот часто применяют прокаленный углекислый натрий Na2COs. Однако он обладает гигроскопичностью и поэтому не полностью удовлетворяет требованиям аналитиков. Значительно удобнее пользоваться для этих целей кислым углекислым калием KHCO3, высушенным в эксикаторе над CaCl2.
При титровании полезно пользоваться «свидетелем», для приготовления которого в дистиллированную или деминерализованную воду добавляют одну каплю кислоты (если титруют щелочь) или щелочи (если титруют кислоту) и столько капель индикаторного раствора, сколько добавлено в титруемый раствор.
Приготовление эмпирических, по определяемому веществу, и стандартных растворов, кислот проводят по расчету с применением формул, приведенных для этих и описанных выше случаев.