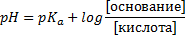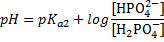буферный раствор для чего используют
Буферный раствор – химический реактив с постоянным pH
Буферный раствор – химический реактив с постоянным pH
Лабораторная посуда, лабораторное оборудование, приборы и химические 
В практике проведения лабораторных работ сотрудники часто сталкиваются с такими химическими растворами, которые имеют или должны обладать определенным показателем величины pH. Именно для этих целей изготавливают специальные буферные растворы.
Что представляет собой данный раствор?
Буферные растворы – химические реактивы с определенным стабильным показателем концентрации водородных ионов; смесь слабо концентрированной кислоты и ее соли. Данные растворы практически не изменяют свою структуру при концентрировании, разбавлении ее другими химическими реагентами или при добавлении в него в малом количестве высококонцентрированных щелочей или кислот. Чтобы получить буферный раствор с различным показателем pH, необходимо изменять концентрацию и соотношение используемых химических растворов.
Данный химический реактив способен сохранять определенный показатель pH до определенного уровня, в зависимости от конкретного количества агрессивных сред, щелочей и кислот. У каждой буферной смеси есть определенная буферная вместимость – эквивалентное соотношение количества элементов щелочи и кислоты.
К сожалению, сами кислоты и щелочи нельзя отнести к буферным смесям, так как при разбавлении их с водой уровень pH данных агрессивных сред изменяется.

Для работы как в лабораторных условиях, так и в частной практике, рекомендуется использование буферных смесей высокой стабильности, приготовленные в специализированных лабораториях с использованием лабораторной посуды из стекла на специальном лабораторном оборудовании и приборах. Самостоятельное приготовление данного химического реактива может быть получено с большой погрешностью.
Из чего состоит буферный раствор?
В состав этого химического реактива входит вода – растворитель и в равной степени 
Такие химические реактивы вместе с современным лабораторным оборудованием и приборами нашли широкое применение в исследованиях аналитической химии, биологии и микробиологии, генетике, медицине, фармацевтике, исследовательских центрах и других научных областях.
Важность буферного раствора для человека
Естественная буферная смесь очень важна и для нормальной жизнедеятельности организма, так как благодаря ей поддерживается постоянный уровень pH биологических жидкостей тканей, органов, лимфы и крови.
Хранить данный химический реактив необходимо в герметически закрытой емкости (стеклянных или пластиковых флаконах).
Где приобрести лабораторное оснащение высокого качества по доступной цене?
Химреактивы, приборы, оборудование, лабораторную посуду купить в Москве выгодно в современном специализированном магазине химических реактивов Москва розница и опт «Прайм Кемикалс Групп». Именно здесь Вы найдете широкий ассортимент товаров высокого качества от известных торговых марок по приемлемым ценам. Также у нас возможна доставка как по городу, так и по области.
“Prime Chemicals Group” –лабораторное оснащение от перчаток смотровых до весов электронных лабораторных со знаком качества.
Буферный раствор
Буферные растворы имеют большое значение для протекания процессов в живых организмах. Например, в крови постоянство водородного показателя рН поддерживается буферными смесями, состоящими из карбонатов и фосфатов. Известно большое число буферных растворов (ацетатно-аммиачный буферный раствор, фосфатный буферный раствор, боратный буферный раствор, формиатный буферный раствор и др.).
Значение pH буферного раствора можно рассчитать по формуле: 


См. также
Полезное
Смотреть что такое «Буферный раствор» в других словарях:
БУФЕРНЫЙ РАСТВОР — БУФЕРНЫЙ РАСТВОР, раствор, к которому можно добавить умеренное количество сильной кислоты или сильного основания без существенных изменений его рН (кислотности или щелочности). Обычно состоят из смеси либо слабой кислоты с одной из ее солей,… … Научно-технический энциклопедический словарь
Буферный раствор — Раствор с определенной устойчивой концентрацией водородных ионов, представляющий собой смесь слабой кислоты и ее соли или слабого основания и его соли и используемый для воспроизведения и поддержания числовых значений рН в растворах различного… … Словарь-справочник терминов нормативно-технической документации
буферный раствор — buffer буфер, буферный раствор. Pаствор, обеспечивающий сохранение показателя рН (или каких либо других его показателей) на постоянном уровне; Б. широко применяются в большинстве генетических и цитогистологических методик, имеющих дело с жидкими… … Молекулярная биология и генетика. Толковый словарь.
Буферный раствор — Buffer Буферный раствор. (1) Вещество, которое при добавлении или присутствии имеет тенденцию минимизировать физические и химические эффекты тех или иных количеств материалов в смеси. Часто свойства, оказывающие буферное действие, включают рН,… … Словарь металлургических терминов
буферный раствор — buferinis tirpalas statusas T sritis chemija apibrėžtis Tirpalas, palaikantis tam tikrą pH, redokso potencialą, metalo jono koncentraciją ar kitą terpės charakteristiką. atitikmenys: angl. buffer; buffer solution rus. буфер; буферный раствор… … Chemijos terminų aiškinamasis žodynas
БУФЕРНЫЙ РАСТВОР — поддерживает при изменении состава среды постоянство значения к. л. характеристики, напр. рН (кислотно основной Б. р.) или окислит. восстановит. потенциала (окислит. восстановит. Б. р.). Значение рН кислотно основного Б. р. зависит от… … Химическая энциклопедия
буферный раствор — буферная смесь, буфер … Cловарь химических синонимов I
буферный раствор для корректировки общей ионной силы — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN total ionic strength adjustment buffer solution … Справочник технического переводчика
буферный раствор, поддерживающий постоянную общую ионную силу (БРОИС) — 3.6 буферный раствор, поддерживающий постоянную общую ионную силу (БРОИС): Буферный раствор с высокой ионной силой, добавляемый к анализируемому и контрольным растворам для выравнивания их ионной силы. Примечание Для некоторых электродов состав… … Словарь-справочник терминов нормативно-технической документации
Буфер буферный раствор — Буфер, буферный раствор * буфер, буферны раствор * buffer раствор, содержащий смесь слабой кислоты и щелочи, который препятствует изменению концентрации ионов водорода (рН) в растворе при добавлении кислоты или щелочи, а также поддерживает… … Генетика. Энциклопедический словарь
СОДЕРЖАНИЕ
Принципы буферизации
и лишь немного расходуется в реакции нейтрализации (которая приводит к увеличению pH)
Емкость буфера
При любом определении буферная емкость для слабокислой HA с константой диссоциации K a может быть выражена как
Это уравнение показывает, что есть три области повышенной буферной емкости (см. Рисунок).
Применение буферов
Простые буферные агенты
| Буферный агент | p K a | Полезный диапазон pH |
|---|---|---|
| Лимонная кислота | 3,13, 4,76, 6,40 | 2,1–7,4 |
| Уксусная кислота | 4.8 | 3,8–5,8 |
| КН 2 ПО 4 | 7.2 | 6.2–8.2 |
| CHES | 9,3 | 8,3–10,3 |
| Борат | 9,24 | 8,25–10,25 |
«Универсальные» буферные смеси
| 0,2 М Na 2 HPO 4 (мл) | 0,1 М лимонная кислота (мл) | pH |
|---|---|---|
| 20,55 | 79,45 | 3.0 |
| 38,55 | 61,45 | 4.0 |
| 51,50 | 48,50 | 5.0 |
| 63,15 | 36,85 | 6.0 |
| 82,35 | 17,65 | 7.0 |
| 97,25 | 2,75 | 8.0 |
Общие буферные соединения, используемые в биологии
Расчет pH буфера
Монопротоновые кислоты
Сначала запишите выражение равновесия
Это показывает, что при диссоциации кислоты образуются равные количества иона водорода и аниона. Равновесные концентрации этих трех компонентов можно рассчитать в таблице ICE (ICE означает «начальное, изменение, равновесие»).
Замените концентрации значениями из последней строки таблицы ICE:
Полипротонные кислоты
Когда разница между последовательными значениями p K a меньше, чем примерно 3, существует перекрытие между диапазоном pH существования разновидностей в равновесии. Чем меньше разница, тем больше перекрытие. В случае лимонной кислоты перекрытие является обширным, и растворы лимонной кислоты забуфериваются во всем диапазоне pH от 2,5 до 7,5.
NB Нумерация кумулятивных общих констант является обратной нумерации ступенчатых констант диссоциации.
Связь между значениями совокупной константы ассоциации (β) и значениями
ступенчатой константы диссоциации (K) для трехосновной кислоты.
| Равновесие | Отношение |
|---|---|
| А 3− + H + ⇌ AH 2+ | Журнал β 1 = pk a3 |
| А 3− + 2H + ⇌ AH 2 + | Журнал β 2 = pk a2 + pk a3 |
| А 3− + 3H + ⇌ AH 3 | Журнал β 3 = pk a1 + pk a2 + pk a3 |
Кумулятивные константы ассоциации используются в компьютерных программах общего назначения, таких как та, которая используется для получения диаграммы видообразования выше.
Буферные растворы
См. также
Смотреть что такое «Буферные растворы» в других словарях:
БУФЕРНЫЕ РАСТВОРЫ — поддерживают при изменении состава среды постоянное значение какой либо характеристики, напр. водородного показателя pH (кислотно основный буферный раствор) или окислительно восстановительного потенциала (окислительно восстановительный буферный… … Большой Энциклопедический словарь
БУФЕРНЫЕ РАСТВОРЫ — БУФЕРНЫЕ растворы, поддерживают при изменении состава среды постоянное значение какой либо характеристики, например водородного показателя pH. Такие буферные растворы содержат слабую кислоту и ее соль или слабое основание и его соль. Многие… … Современная энциклопедия
Буферные растворы — БУФЕРНЫЕ РАСТВОРЫ, поддерживают при изменении состава среды постоянное значение какой либо характеристики, например водородного показателя pH. Такие буферные растворы содержат слабую кислоту и ее соль или слабое основание и его соль. Многие… … Иллюстрированный энциклопедический словарь
буферные растворы — поддерживают при изменении состава среды постоянное значение какой либо характеристики, например водородного показателя рН (кислотно основный буферный раствор) или окислительно восстановительного потенциала (окислительно восстановительный… … Энциклопедический словарь
БУФЕРНЫЕ РАСТВОРЫ — буферные системы, р ры, поддерживающие постоянный водородный показатель (рН) среды при разбавлении, концентрировании или добавлении к т или щелочей (не превышая нек рого предела). Примеры Б. р.: р р уксусной к ты и её натриевой соли, р р борной к … Большой энциклопедический политехнический словарь
Буферные растворы — см. Буферные системы … Большая советская энциклопедия
БУФЕРНЫЕ РАСТВОРЫ — поддерживают при изменении состава среды пост. значение к. л. характеристики, напр. водородного показателя рН (кислотно основный Б. р.) или окислит. восстановит. потенциала (окислит. восстановит. Б. р.). Кислотно основные Б. р. содержат слабую к… … Естествознание. Энциклопедический словарь
Буферные растворы Гуда — Good’s buffers (буферные растворы Гуда) двенадцать буферных растворов, разработанных Норманом Гудом с соавторами в 1966 году. Гуд отбирал буферы для биохимических исследований по нескольким критериям. Многие из буферов используются до… … Википедия
БУФЕРНЫЕ СВОЙСТВА — БУФЕРНЫЕ СВОЙСТВА, способность многих веществ ослаблять изменение активной реакции (см.) раствора, к рое без них произошло бы при прибавлении к раствору кислот или щелочей. Это стабилизирующее влияние на реакцию раствора называется буферным… … Большая медицинская энциклопедия
Буферные системы — буферные растворы, буферные смеси, системы, поддерживающие определённую концентрацию ионов водорода Н+, то есть определённую кислотность среды. Кислотность буферных растворов почти не изменяется при их разбавлении или при добавлении к ним … Большая советская энциклопедия
Тема 7. Буферные растворы.



Предисловие.
Будучи огорчен качеством преподавания химии в РНИИМУ, и тем более, способом последующего контроля качества образования – тестами, я решил оказать посильную помощь студентам в сдаче оных. Пособие представляет собой краткую, насколько возможно, инструкцию, как минимально загрузив голову таки сдать этот окаянный тест. Я исследовал большое их количество, обобщил результаты.
На каждый вид вопросов я постарался дать ответ, в меру научный, чтобы все-таки не слишком уйти от своих химических корней, но и достаточно ясный, чтобы он мог быть воспринят среднестатистическим студентом. Теперь я представляю свой труд для использования широкой общественностью, надеюсь, моё творение сможет послужить к чьей-нибудь пользе.
Тема несложная, и, что важно, она опирается на простую и красивую теорию. Очень рекомендуем вникнуть в теоретическое описание, приведённое перед разборами вопросов. На этот раз оно получилось кратким, содержательным и, хотелось бы надеяться, понятным. Тема имеет связи с настоящей медициной, еще и поэтому рекомендуется к подробнейшему изучению.
Конечно, многим хотелось бы иметь готовые ответы и не париться. Думаю, что за годы работы eois общественность накопила некоторый объем ответов, он постепенно совершенствуется, доля верных ответов растет, уже в 2016 она была больше 70%. Правда, обновление вопросов в 2017 добавило веселья. Однако, в отношении химии мне это кажется неудачным путем. Объясню, почему я так считаю. Во-первых, вопросов большое количество, и они, как назло, очень похожи. Это делает трудным списывание с правильных ответов, и, одновременно, делает тесты уязвимыми к методичкам вот такого плана, с разбором вопросов на группы и злой иронией по этому поводу. Во-вторых, некоторые персонажи, как Карина, например, почему-то борются со списыванием, что делает этот процесс не самым простым трюком. А глядя на всё это глобально, по-моему, все же лучше что-то понимать и мыслить, чем списывать.
Заранее благодарен за адекватные комментарии, дополнения и исправления к тексту. Текст создан исключительно из гуманных соображений и распространяется безвозмездно.
Удачи, ни пуха, ни пера, дорогие любители химии.
Алексей «Леша-химик» Федоров
Тема 7. Буферные растворы.
Тема, как мы уже заметили, устроена очень красиво. Будет много проще, если Вы поймете эту красоту, тогда не будет нужды (она всё равно будет) в делении на вопросы, каких-то хитростях, и тому подобной хуите. Если теория — это не ваше, можете спокойно дропнуть этот раздел (только таблица обязательно нужна), в вопросах тоже есть всё нужное, чтобы еле-еле пройти порог. Так что мы настоятельно рекомендуем остаться с нами.
Итак, буферные растворы. Скорее всего, вы знаете, что в человеческом желудке сильнокислая среда, и нужно это затем, чтобы расщеплять белки до аминокислот. Но, что если человек выпьет три литра воды? Кислота разбавится, да еще и всё это стечет в кишечник, а там среда щелочная, в итоге все нейтрализуется, человек не сможет усваивать ни белки, ни углеводы, и всё пойдёт по пизде, и подопытный сдохнет? Однако, точно известно, что три литра воды к смерти не приводит, хотя и весёлого мало. Желающие идут проверять, остальные продолжают курить теорию вместе с нами.
Буферный раствор — раствор, поддерживающий рН (кислотность, короче) постоянным при добавлении кислот и щелочей в небольших количествах и разбавлении. Организм человека — почти сплошные Буферные растворы. Оговоримся: у буферного раствора есть ёмкость, при которой он может поддерживать рН относительно постоянным. Бесконечное количество кислоты или щелочи, конечено, ни один буферный раствор не нейтрализует.
К таблице мы ещё вернемся чуть позже. А сейчас фишка БР-ов.
1) Если к нему добавили сильную кислоту, например HCl. Так как в БР есть основание (сопряженное), оно будет её нейтрализовывать.
А если сократить хлорид
Или, сократив одинаковое
В рот мне ноги, это же сопряжённое основание. Охренеть, из сопряженной кислоты получилось сопряженное основание! А щелочь нейтрализовалась. Сами Гендерсон и Гассельбах охренели бы от такого поворота. А рН остается примерно постоянным. Этот мелкий засранец снова выкрутился. Вот же ж!
Подобные реакции могут быть написаны для любого другого БР и называются механизмами буферного действия. Хотя напрямую это не касается тестов, это может быть в колке, если он будет устным, и, кроме того, половина вопросов тестов как бы подразумевает, что механизм работы БР понятен.
Квадратные скобки в записях означают концентрации, однако в принципе на это можно класть хер и подставлять моли, результат всё равно будет верным.
В конце списка лежат аминокислотные буферные системы. Аминокислоты это — глицин, аланин, валин, лейцин, изолейцин, серин, треонин, цистеин, метионин, аспарагиновая и глутаминовая кислоты, лизин и аргигнин, глутамин и аспарагин, фенилаланин и тирозин, гистидин и триптофан, пролин. Формулы не приводим за ненадобностью. Вам их всё равно скоро учить. Внимательно рассмотрите их, поймите, чем отличаются анионная/диполярная/катионная формы. Там выделено красным. Запомните, что у анионной рКа2, у катионной рКа1, объяснить это сложно, стоит запомнить.
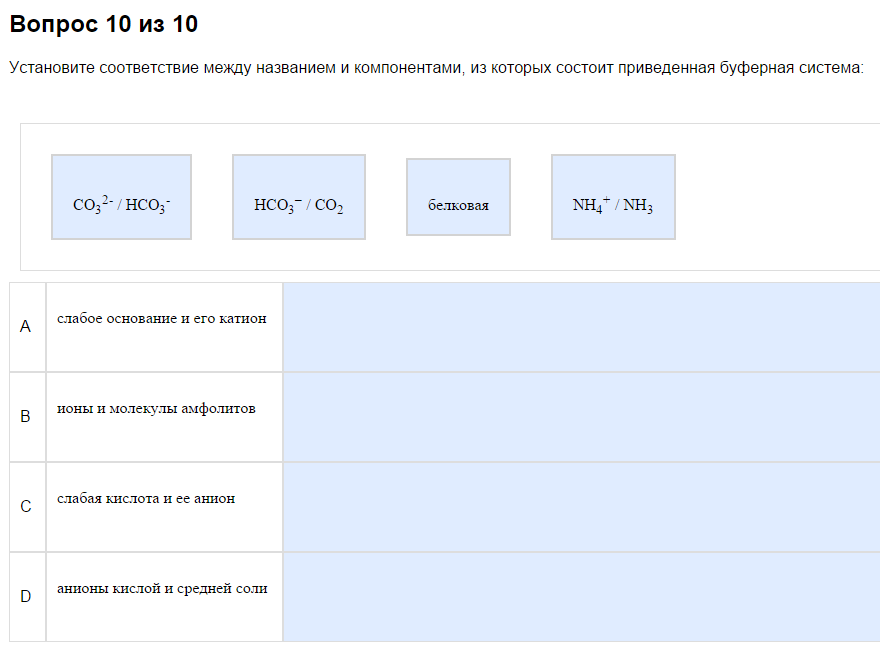
1. Типы буферных систем.
На первый взгляд путано, фактически несложно…
Как с этим бороться:
Всегда в наборе есть
1) Слабая кислота и её анион. Вспомните прошлую тему, найдите, какие кислоты слабые. Здесь то же самое. Чаще всего это что-то-СООН, но не обязательно. В примере это внезапно СО2, потому что обратимо превращается в Н2СО3 в растворе. Ориентир — один минус.
2) Слабое основание и его катион. См. прошлую тему про слабые основания. Чаще всего это амины и аммиак, что-то типа что-то там такое R-NHy. Катион — это один полюс.
2. Аминокислотные буфера.
Как с этим бороться:
Очень легкая задача. Сравниваем рН с рI. Если рН
pI, то в анионной и диполярной. Да, всё так просто. Нет, это не наёбка. Нет, ошибки в том, что диполярная использована два раза, нет, так и должно быть, см. таблицу. Осторожно! Во избежания повреждения мозга о том, что такое рI, задумываться не надо!
Как с этим бороться:
Например, может быть какая-то хрень нетабличная, NaHS+Na2S. Если подумать, то можно догадаться, что первое — кислота, второе — основание. Если сравнить с карбонтаной и гидрокарбонатной системой, можно догадаться, что тут нужна рКа2. Итого:
Самое жопошное — аминокислоты. Выучите или запишите, где рКа1, где рКа2, там это нельзя вывести. В примере ответ В.
4. Интервал буферного действия.
Как с этим бороться:
Тоже очень просто. Интервал буферного действия это область рН от рКа-1 до рКа+1. Например, если рКа=4,75, то интервал равен от 3,75 до 5,75. Подвох в том, что констант может быть дано несколько. Использовать надо ту же самую, по которой считали рН. Ту же самую, которая рКа кислоты в БР. Найти её можно в таблице. Например, если дана карбонатная буферная система (состоит из NaHCO3+Na2CO3), то её рН считается по рКа2 (см. таблицу БР) и следовательно, интервал тоже по ней же. В примере если в БР есть анионная форма, то рН считают по рКа2, следовательно интервал А.
5. Соотношение компонентов, рН и рКа.
Как с этим бороться:
Всего возможно три случая.
1) рН > pKa, тогда сопряженного основания больше, чем кислоты. Может быть, 10:1, а может просто c(CH3COOK) > c(CH3COOH).
С учетом добавления щелочи
Всё подставляем прямо, как есть переводить ничего никуда не нужно, прям хуярим моли:
Дальнейшие расчеты как в прошлой задаче, сначала под логарифмом, потом сам логарифм, потом всё остальное. Не приводим ввиду очевидности. Ответ рН=7,0, с точностью до десятых.
2) Добавили кислоту, например HCl. Всё то же самое, но формула:
Пример не приводим, он аналогичен прошлой задаче.
9. Задача про буферную ёмкость, Вк или Вщ.
Как с этим бороться:
Тоже по формулам, как ни странно. Буферная ёмкость определение можно посмотреть в методичке с САРСами, а формула:
Тут надо немного прокомментировать. Вк — буферная ёмкость по кислоте. Бывает еще и по щелочи, Вщ, считается почти так же. Ск и Vк — концентрация и объем добавленной кислоты (если считаем ёмкость по щелочи, то исправляем на щелочь). VБР — объем буферного раствора, ΔрН — изменение рН при добавлении кислоты или щелочи. Тонкость в том, что при добавлении щелочи рН увеличивется, а кислоты уменьшается. Чтобы не получить отрицательную ёмкость, правильнее писать
ёмкость по кислоте:
ёмкость по щелочи:
Вертикальные черты читаются как «модуль», это математический оператор, который убирает минус, если он есть.
Первая задача из скрина: всё подставить, посчитать, получить ответ. Заметьте, что концентрация в «М», то есть «моль/л», а ёмкость просят в «ммоль/л», то есть милимоль. Коварные, коварные. Перевод делается умножением на 1000. Получается
Прикиньте, какая фигня может привести к потере бала? EOIS же похер, что вы считаете правильно, но не видите перевод.
Вторая задача уже сложнее, там выводить надо. Вывод, не вдаваясь в тонкости, делается простой перестановкой.
10. Норма, ацидоз, алкалоз.
Как с этим бороться:
Норма — рН от 7,36 до 7,43.
Ацидоз — рН меньше 7,36
Алкалоз — рН больше 7,43
Больше нечего сказать.
11. Буферные системы крови.
Наконец-то что-то медицинское…
Как с этим бороться:
Буферные системы крови:
Аж три ответа, B, C, D.
Как с этим бороться:
Смиритесь, несчастные, химическая теория это не ваше. Никак, с этим невозможно ничего сделать. Нет, это не шутка. Поэтому мы просто приводим правильные ответы.
· рН буферного раствора зависит не только от соотношения концентраций сильного и слабого электролита в буферной системе, но и от константы диссоциации кислоты.
· Роль сопряженной кислоты в гидрокарбонатной буферной системе в условиях организма выполняет растворенный СО2
· Гидрокарбонатная буферная система состоит из слабой кислоты и ее аниона
· Анионная форма аминокислоты — частица, в виде которой аминокислота существует в растворах при рН >> pI
· Буферная емкость зависит от суммарной концентрации компонентов буферной системы в растворе
· Диполярный ион — частица, несущая две разноименно заряженных группы атомов
· Ацидоз — нарушение кислотно-основного состояния организма, обусловленное повышенным пониженным значением рН плазмы крови,
· Роль сопряженного основания в карбонатной буферной системе выполняет карбонат-ион
· Ацидоз — патологическое состояние, связанное с пониженной повышенной концентрацией ионов водорода
· Буферная емкость буферных систем организма по кислоте больше, чем по щелочи
· Изоэлектрическая точка α-аминокислоты не зависит от концентрации кислоты в растворе
· Ионы HCO3 – и HPO4 2– НЕ являются диполярными ионами
· Роль сопряженного основания в гидрокарбонатной буферной системе выполняет гидрокарбонат-ион
· Уравнение Гендерсона-Гассельбаха – уравнение, характеризующее зависимость рН буферного раствора только от концентрации от соотношения концентраций слабого электролита и его сопряженной кислоты (основания)
· Буферная емкость — количество кислоты или щелочи, которые нужно добавить к 1 л буферного раствора, чтобы значение его рН изменилось на единицу
· Изоэлектрическая точка – это значение рН раствора, при котором амфолит электронейтрален
· Буферный раствор способен поддерживать практически постоянное значение рН при разбавлении или при добавлении НЕ(!)больших количеств кислоты или щелочи
· Диполярная форма аминокислоты может выступать как в роли кислоты, так и в роли основания
· Изоэлектрическая точка α-аминокислоты НЕ(!)зависит от концентрации кислоты в растворе
· При добавлении к буферной системе щелочи ее буферная емкость по кислоте может увеличиться (в смысле «может»? увеличится)
· Интервал буферного действия определяется как рKа ± 1
· Ацидоз Алкалоз – нарушение кислотно-основного состояния организма, обусловленное повышением рН,
· Катионная форма аминокислоты — частица, в виде которой аминокислота существовует в растворах с рН