боль при переломе руки чем обезболить в домашних условиях
Послеоперационное обезболивание. Часть 4. Современные средства обеспечения послеоперационной анальгезии
Основными задачами применения анальгетических средств в послеоперационном периоде являются: устранение страдания, причиняемого болью, создание психологического комфорта и повышение качества жизни пациентов в послеоперационном периоде; ускорение послеоперационной функциональной реабилитации; снижение частоты послеоперационных осложнений; сокращение сроков госпитализации и стоимости лечения.
Нужно отметить, что в настоящее время в большинстве развитых стран неадекватное послеоперационное обезболивание рассматривается как нарушение прав человека и осуществляется в соответствии с принятыми национальными и международными стандартами. В нашей стране во многих клиниках внедрена формулярная система использования лечебных препаратов тех или иных групп, целесообразность применения которых подтверждена данными доказательной медицины, а также обусловлена потребностями и особенностями конкретного лечебного учреждения. Многие авторы полагают, что все хирургические подразделения, а также отделения анестезиологии, реанимации и интенсивной терапии должны иметь в своем арсенале только те анальгетики и анестетики, эффективность и безопасность назначения которых подтверждена доказательствами I (систематизированные обзоры и метаанализы) и II (рандомизированные контролируемые исследования с определенными результатами) уровня (табл. 1).
Таблица 1. Препараты, применение которых для послеоперационного обезболивания обосновано данными доказательной медицины (Acute Pain Management: Scientific Evidence, 2-nd edition, 2005).
Группа
Препараты
Дозы, путь введения
Неопиоидные анальгетики, НПВП
Диклофенак
Кетопрофен (Кетонал ®)
Кеторолак (Кеторол ®)
75 мг (150 мг суточная), в/м
50 мг (200 мг), в/м
30 мг (90 мг), в/м
Неопиоидные анальгетики, прочие
1 г (4 г), в/в инфузия в течение 15 минут
Опиоидные анальгетики, сильные
5-10 мг (50 мг), в/в, в/м
20 мг (160 мг), в/в, в/м
Опиоидные анальгетики, слабые
100 мг (400 мг), в/в, в/м
Лидокаин 2%
Бупивакаин (Маркаин®) 0, 25%, 0, 5%
Ропивакаин (Наропин®0, 2%, 0, 75%, 1%
(800 мг суточная) *
(400 мг суточная) *
(670 мг суточная) *
*инфильтрация краев раны, интраплевральное введение, продленная блокада периферических нервов и сплетений, продленная эпидуральная анальгезия.
Мировой опыт послеоперационного обезболивания позволяет выделить следующие основные современные тенденции в борьбе с ПБС:
— широкое применение неопиоидных анальгетиков – нестероидных противовоспалительных препаратов (НПВП) и парацетамола; в различных европейских клиниках частота назначения данных препаратов в качестве базиса послеоперационного обезболивания составляет от 45 до 99%;
— ограничение использования опиоидных анальгетиков, особенно внутримышечного варианта их введения, что обусловлено низкой эффективностью и значительным количеством побочных эффектов данной методики;
— мультимодальный характер послеоперационного обезболивания, т. е. одновременное назначение нескольких препаратов или методов обезболивания, способных воздействовать на различные механизмы формирования болевого синдрома.
Длительность проведения послеоперационного обезболивания является достаточно вариабельной величиной и зависит как от интенсивности болевой афферентации и, следовательно, от травматичности хирургического вмешателсьтва, так и от индивидуальной толерантности пациента к боли. Необходимость целенаправленного купирования ПБС возникает, как правило, в течение первых 4 суток послеоперационного периода (табл. 2).
Таблица 2. Потребность в обезболивании после различных по объему операций.
Хирургическое вмешательство
Продолжительность обезболивания, часы
Вмешательства на верхнем этаже брюшной полости и диафрагме
Вмешательства на нижнем этаже брюшной полости
Операции на тазобедренном суставе
Операции на конечностях
Лапароскопические операции среднего объема
Таблица 3. Методы и средства послеоперационного обезболивания.
1. Традиционное введение опиоидов: внутримышечные инъекции по требованию.
2. Опиоидные препараты агонисты/антагонисты:
а) парентеральное введение опиоидов: внутривенно болюсно, длительная внутривенная инфузия, контролируемая пациентом анальгезия.
б) непарентеральное введение опиоидов: щечное/подъязычное, пероральное, трансдермальное, назальное, ингаляционное, внутрисуставное
3. Неопиоидные анальгетики с системным введением:
а) нестероидные противоспалительные препараты
б) ацетаминофен (парацетамол)
4. Методы регионарной анестезии:
а) эпидуральное введение опиоидов;
б) нестероидные противовоспалительные препараты;
5. Нефармакологические методы:
6. Сочетанное использование представленных методов
Ниже приводятся основные используемые в современной хирургической клинике средства и методы обезболивания с позиций баланса их эффективности и безопасности.
Опиоидные анальгетики.
Данная группа лекарственных препаратов десятилетиями считалась средством выбора для купирования ПБС. Однако в настоящее время опиоидные анальгетики отнюдь не являются «золотым стандартом» в лечени пациентов с острой болью. Тем не менее, по оценкам целого ряда отечественных и зарубежных специалистов, эффективность обезболивания при традиционном назначении опиоидов в качестве монотерапии не превышает 25-30%. Однако постепенное отчуждение от чрезмерной приверженности опиоидам в послеоперационном периоде связана не столько с их недостаточной эффективностью, сколько с целым рядом серьезных побочных эффектов, возникающих при их использовании (табл. 4).
С точки зрения фармакодинамики опиоидные анальгетики являются агонистами или антагонистами различных видов опиоидных рецепторов ЦНС (мю-, дельта-, каппа-). Препараты опиоидной группы активируют эндогенную антиноцицептивную систему (центральная анальгезия), однако не влияют на периферические и сегментарные неопиоидные механизмы ноцицепции и не предотвращают центральную сенситизацию и гиперальгезию. Попытки увеличения эффективности обезболивания и снижения частоты побочных эффектов опиоидных анальгетиков основаны на варьировании способов их введения (в том числе и у одного пациента): внутривенный, внутримышечный, эпидуральный, трансдермальный, сублингвальный, ректальный. Наиболее распространенным, но при этом наиболее небезопасным и наименее эффективным способом введения опиоидов является внутримышечная инъекция. Данная методика наиболее часто приводит к неадекватному обезболиванию – более 60% пациентов отмечают неудовлетворительное качество послеоперационной анальгезии. Причины этого кроются в том, что всем пациентам вводятся фиксированные дозы через стандартные временные интервалы, без учета индивидуальной вариабельности фармакокинетики; часто инъекции опиоидов производятся с большими перерывами, то есть тогда, когда болевой синдром уже выражен и его купирование по определению становится малоэффективным. Именно при внутримышечном введении опиоидов наиболее часто развивается депрессия дыхания, связанная, возможно, с кумуляцией препарата.
Таблица 4. Опиоидные анальгетики при купировании послеоперационного болевого синдрома.
Препарат
Дозировка и пути введения
Относительная анальгетическая активность
Побочные эффекты
Возможны выраженные угнетение дыхания, тошнота, рвота, высокая степень привыкания и максимальный наркогенный потенциал
Угнетение дыхания, тошнота, рвота, высокая степень привыкания и наркогенный потенциал
Угнетение дыхания, тошнота, рвота, наличие привыкания и наркогенного потенциала
Необходимо отметить еще один важный аспект, ограничивающий применение опиоидных анальгетиков в отечественной клинической практике. Использование опиоидных анальгетиков для послеоперационного обезболивания в Российской Федерации строго регламентировано существующими приказами руководящих органов здравоозранения. Например, приказом № 257 Департамента здравоохранения г. Москвы от 2004 г. определяется, в частности, норматив потребления опиоидных препаратов в ампулах на 1 койку различных отделений хирургического профиля в год. Назначение опиоидного препарата как в хирургическом отделении, так и в отделении интенсивной терапии в большинстве ЛПУ сопровождается колоссальным количеством формальных сложностей, что нередко приводит к отказу медперсонала от использования ланных препаратов даже при необходимости назначения опиоидов. По тем же причинам самый современный метод применения опиоидов – контролируемая пациентом аналгезия, в наибольшей степени ориентированная на индивидуальные потребности пациента в обезболивании – в России не получила широкого распространения.
Неопиоидные анальгетики.
Термином «неопиоидные анальгетики» обозначается группа различных по химическому строению, фармакодинамике и, соответственно, механизму обезболивания лекарственных препаратов, применяемых для купирования ПБС с парентеральным, реже пероральным путем введения. Препараты данной группы, используемые как в моноварианте, так и в качестве средства адъювантной терапии, обладают различными анальгетическим потенциалом и совокупностью побочных эффектов (табл. 5).
Таблица 5. Неопиоидные анальгетики для купирования послеоперационной боли.
Класс
Препараты
Особенности терапии
Побочные эффекты
Антагонисты NMDA-рецепторов
Применяется как адъювант при введении опиоидов.
Малые дозы кетамина характеризуются опиоидсберегающим эффектом, повышением качества обезболивания
При использовании в малых дозах – не выражены. Сохраняют побочные эффекты опиоидов.
Антиконвульсанты
Используется как адъювантный препарат в комплексной терапии острой послеоперационной боли. Снижает потребность как в опиоидных, так и внеопиоидных анальгетиках.
Головокружение, сонливость, периферические отеки.
Ингибиторы протеаз
Ингибирование синтеза медиаторов боли на этапе трансдукции, используются как средство адъювантной терапии ПБС
Нерушения в системе гемостаза (гипокоагуляция) – послеоперационные кровотечения.
Центральные α-адреномиметики
Воздействие на трансмиссию и модуляцию боли. Адъювант при опиоидной анальгезии.
Гипотензия, брадикардия, психические нарушения.
Бензодиазепины
Комбинированная терапия с применением феназепама и тизанидина снижает выраженность фантомных болей.
Сонливость, головокружение, психические расстройства
Из приведенных данных становится очевидным, что перечисленные в таблице неопиоидные анальгетики используются лишь как возможное дополнение к базисной терапии опиоидами, использование данных препаратов для купирования ПБС в моноварианте не практикуется.
Формально к группе неопиоидных анальгетиков относятся также нестероидные противовоспалительные препараты (НПВП) и ацетаминофен (парацетамол). Однако вследствие значительной востребованности в современной хирургической клинике данные препараты рассматриваются сейчас как отдельные подклассы средств для купирования ПБС.
Парацетамол.
Несмотря на то, что ацетаминофен (парацетамол) имеет более чем полувековую историю применения в качестве анальгетика и антипиретика, точный механизм действия этого препарата до сих пор не известен. Предполагается наличие центрального механизма действия парацетамола, включающего: подавление активности циклооксигеназы 2 типа в ЦНС, с чем связана профилактика развития вторичной гиперальгезии; подавление активности циклооксигеназы 3 типа, существование которой предполагается и которая, видимо, обладает селективной чувствительностью к парацетамолу; усиление активности нисходящих тормозных серотонинергических путей на этапе модуляции боли.
Потенциально опасным побочным свойством парацетамола является гепатотоксическое и нефротоксическое действие, которое может проявляться при превышении дозы 4 г/сут, особенно при наличии у пациента исходного нарушения функции печени и почек. Ограничениями к применению парацетамола являются: печеночно-клеточная недостаточность с лабораторными проявлениями (повышение уровня трансаминаз), почечная недостаточность, алкоголизм, алиментарная недостаточность, дегидратация.
Местные анестетики.
Важнейшей задачей мультимодальной анальгезии является прерывание афферентного потока ноцицептивных стимулов от периферических болевых рецепторов в органах и тканях к сегментарным структурам ЦНС (задним рогам спинного мозга). Эта задача может быть успешно решена при помощи различных методов регионарной и местной анальгезии. Важную роль в расширении применения методов региональной анальгезии сыграло появление современных местных анестетиков (бупивокаин, ропивокаин), а также детальная отработка методики регионарных блокад.
Эпидуральная анальгезия занимает ключевую позицию среди всех регионарных методов послеоперационного обезболивания. В ходе данной процедуры в эпидуральное пространство на уровне грудного или поясничного отделов позвоночника устанавливается катетер, через который болюсно или путем непрерывной инфузии вводятся местные анестетики. Эпидуральная анестезия является как средством обеспечения анальгезии в ходе операции (в том числе и в моноварианте), так и средством купирования ПБС. Многочисленными исследованиями была доказана принципиально более высокая эффективность продленной послеоперационной эпидуральной анальгезии по сравнению с системным введением опиоидных анальгетиков. Как указывалось выше сами опиоидные анальгетики также могут быть использованы для проведения эпидуральной анестезии. Известно, что эпидуральное введение местных анестетиков и опиоидов достоверно превышает анальгетический эффект использования данных препаратов в отдельности. Тем не менее само по себе эпидуральное введение опиоидов чревато возникновением серьезных побочных эффектов от угнетения дыхания до выраженного кожного зуда. На сегодняшний день принято считать, что преимущества эпидурального введения опиоидных анальгетиков в абдоминальной хирургии не перевешивают риска осложнений самой методики эпидуральной анестезии по сравнению с парентеральным назначением аналогичных препаратов.
Помимо собственно анальгетического эффекта позитивное влияние прослеоперационной продленной эпидуральной анальгезии заключается в прерывании нисходящих симпатических эфферентных импульсов, следствием чего являются улучшение висцерального кровотока (активизация репаративных процессов в зоне вмешательства), повышение активности парасимпатической нервной системы (разрешение пареза пищеварительной трубки).
С точки зрения доказательной медицины (Acute Pain Management: Scientific Evidence, 2-nd edition, 2005) преимущества продленной эпидуралной анальгезии включают: более высокое качество обезболивания в сравнении с парентеральным введением опиоидов; улучшение показателей газообмена и снижение частоты послеоперационных легочных осложнений по сравнению с опиоидной анальгезией; ускорение восстановления функции желудочно-кишечного тракта после абдоминальных операций и снижение частоты местных осложнений.
Тем не менее и у эпидуральной анестезии есть ряд существенных ограничений. Сама по себе эпидуральная анестезия является сложной инвазивной процедурой, потенциально опасной в плане развития как местных (инфекционный процесс, повреждение нервных корешков, сосудов паутинной оболочки, твердой мозговой оболочки), так и системных осложнений (депрессия дыхания, кардиотоксические эффекты, артериальная гипотензия). В этой связи проведение эпидуральной анестезии требует наличия специальных навыков у врача-анестезиолога и постоянного мониторинга состояния пациента в отделении интенсивной терапии, реже – в хирургическом отделении.
В последние годы все большую популярность получает методика длительной инфузии местных анестетиков в полость операционной раны. В ходе ряда исследований было показано, что длительная инфузия местных анестетиков в течение 24-48 часов через катетер, установленный в ране, способна повысить качество обезболивания и снизить потребность в опиоидных анальгетиках. Работами отечественных авторов показано, что пролонгированная местная анестезия операционной раны за счет резорбции местного анестетика и присутствия его в плазме в низких концентрациях способна оказывать системный противовоспалительный эффект. Как и в случае эпидуральной анальгезии эффект местных анестетиков при этом обусловлен блокадой не только ноцицептивных путей, но и симпатической иннервации. Говоря о применении пролонгированной местной анестезии операционной раны, следует заметить, что данная методика в настоящее время находится на стадии клинической апробации и ее широкое внедрение изначально ограничивают очевидный риск экзогенного инфицирования раны и реальная опасность системных токсических эффектов местных анестетиков (артериальная гипотензия, аритмии, угнетение дыхания) вследствие их резорбции тканями.
Мультимодальная периоперационная анальгезия.
Из приведенных выше характеристик и, что важнее, недостатков средств и методов купирования ПБС следует очевидное заключение о том, что в настоящее время не существует идеального анальгетика или метода лечения острой послеоперационной боли. Однако приблизиться к решению проблемы адекватности послеоперационного обезболивания вполне возможно, реализуя в клинике концепцию мультимодальной периоперационной анальгезии, предусматривающей одновременное назначение двух и более анальгетиков и/или методов обезболивания, обладающих различными механизмами действия и позволяющих достичь адекватной анальгезии при минимизации побочных эффектов до, во время и после хирургического вмешательства (см. рис. ).
Таблица 6. Варианты схем мультимодальной периоперационной анальгезии, ориентированных на травматичность хирургических вмешательств.
Реабилитация дома после перелома
Содержание статьи:
Восстановление двигательных функций после перелома – это длительный процесс, который требует комплексного подхода и активного участия как самого пациента, так и узкопрофильных врачей. Комплекс реабилитационный процедур позволяет нормализовать кровоснабжение тканей, ускорить регенерацию поврежденных структур, повысить тонус мышц и вернуть свободу движений.
Чтобы лечение переломов дома принесло результат, крайне важно придерживаться рекомендаций врачей, использовать назначенные средства и методы восстановления. Процесс реабилитации должен проходить под контролем специалистов, а самолечение приводит к опасным последствиям – артриту, артрозу, ограниченной подвижности и сохранению болевого синдрома.
Этапы восстановления после перелома
Чтобы не усугубить ситуацию и не нанести еще больший вред организму, лечить перелом дома нужно в соответствии с четкой последовательной схемой. Она предусматривает такие основные восстановительные этапы:
Какой врач помогает в реабилитации
Чтобы процесс реабилитации после перелома на дому прошел максимально эффективно, к нему необходимо привлечь ряд узкопрофильных специалистов. Восстановительную программу и базовые назначения предоставляет травматолог-реабилитолог, можно также обратиться к терапевту при наличии сопутствующих жалоб. Среди других специалистов, которые помогут избежать опасных последствий травмы – массажист, диетолог, физиотерапевт, невролог, ортопед, инструктор по лечебной физкультуре.
Вспомогательные приспособления и дополнительные занятия
Повысить комфорт пациента в период восстановления после перелома ноги помогут простые дополнительные средства, которые можно использовать дома:
Реабилитационные меры предусматривают равномерное наращивание нагрузки на организм. Изначально врач назначает пациенту простые дыхательные упражнения, которые помогают насытить организм кислородом, разработать дыхательную систему. После добавляется зарядка, которая направлена на разработку общей подвижности тела. Примерно через месяц физические упражнения расширяют и разделяют на две группы:
Грамотно подобранная гимнастика и курс лечебной физкультуры восстанавливают кровообращение, укрепляют мышцы, возобновляют двигательную активность и предотвращают осложнения.
Восстановление в лежачем положении
При переломах конечностей восстановление нужно начинать еще когда пациент находится в лежачем положении и не может стоять. Только раннее начало реабилитации позволяет достичь максимального результата. В противном случае мышцы бездействуют и ослабевают, в результате чего кости срастаются неправильно.
Комплекс лечебной гимнастики для лежачего пациента включает:
На начальном этапе эти упражнения нужно выполнять под наблюдением специалиста и с его помощью. Со временем пациент сможет самостоятельно выполнять гимнастику.
Работа с походкой
В рамках реабилитации после травмы ног необходимо работать над восстановлением походки. Один из самых эффективных вариантов – это занятия на велотренажере, к которым пациента должен допустить врач при отсутствии противопоказаний.
Помимо занятий на тренажере, важно также выполнять специальные упражнения:
Занятия нужно продолжать до тех пор, пока у пациента полностью не восстановятся двигательные функции, уйдут отеки и боли.
Наружные средства
После снятия гипса пациента еще долго могут беспокоить болевые ощущения, отечность. Чтобы избавиться от этих неприятных проявлений травмы, врач может назначать мази и гели, которые снимают дискомфорт. Такие препараты обладают важными эффектами:
Наружные препараты приносят гораздо меньший негативный эффект, чем лекарства для перорального приема. Поэтому многие врачи отдают предпочтение именно мазям и гелям с местным действием.
Питание
Восстановительный этап обязательно должен сопровождаться правильной диетой. Организму в этот период необходимо большее количество витаминов и питательных веществ, которые нужно получать не только из пищи, но и с дополнительных витаминных добавок.
В период активного восстановления нужно насытить рацион:
На время восстановления после перелома нужно отказаться от алкоголя, сладких газированных напитков, кофе, шоколада, жирной и соленой пищи.
Массаж
Лечебный массаж после переломов предусматривает использование специфических техник:
Массажист подбирает лечебный курс с учетом особенностей травмы и точного расположения перелома. Курс лечебного массажа помогает избежать атрофии и слабости мышц, улучшить подвижность, снять отеки и боли.
Лечение при травмах запястья
Травмы запястья составляют около 40% в общей статистике травматизма верхних конечностей, при этом 50% из них приводят к пожизненному снижению функциональности кисти или даже инвалидности.
В большинстве случаев лечение при травмах запястья осуществляется в соответствии с общими принципами лечения травм, о чём подробнее будет рассказано далее. Высокий уровень посттравматических осложнений объясняется, в первую очередь, особенностями анатомического строения запястной зоны, оставляющем немного шансов на лёгкие формы переломов, вывихов или растяжений запястья.
Кратко об анатомии запястья
Запястье — это отдел кисти, располагающийся между пястью (пястными костями) и предплечьем (локтевой и лучевой костями). Запястье образовано восемью губчатыми костями, расположенными в два ряда: головчатая, гороховидная, крючковидная, ладьевидная, полулунная, трапеция, трапециевидная и трёхгранная.
Кости запястья прочно скреплены связками, благодаря чему энергия удара, нанесённого по одной из кости, равномерно распределяется по всему запястью. Это служит своеобразной системой защиты, в первую очередь — от переломов. Вместе с тем, если перелом или вывих запястья всё-таки случился, то из-за большой скученности костей и, соответственно, связок, травма всегда получается более обширной чем, например, при простом переломе лучевой кости.
Виды травм
Травмы запястья механической этиологии классифицируются по характеру повреждения:
Общие принципы лечения
При любых травмах запястья лечебно-терапевтические меры проводятся в следующей последовательности:
В случае размозжения тканей может быть поставлен вопрос о проведении эндопротезирования (замена кости имплантатом) или ампутации с последующим протезированием конечности.
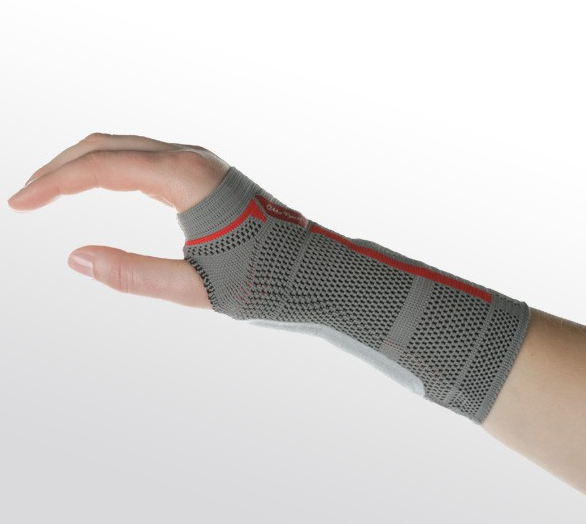
Роль бандажей и ортезов
Основным условием восстановления повреждённых тканей запястья является снижение нагрузки на указанную область или полная её иммобилизация. Современная травматология решает обе названные задачи при помощи специальных ортопедических изделий — бандажей и ортезов.
Бандажи
Мягкие или полужёсткие изделия, позволяющие стабилизировать запястье в анатомически правильном положении и ограничить движения кисти руки, без полной её иммобилизации. Главная задача лучезапястного бандажа заключается в максимальной разгрузке мышц и суставно-связочного аппарата запястья, чтобы не препятствовать процессам регенерации повреждённых тканей.
Ношение бандажей на кисть руки показано при сильных ушибах запястья, частичных разрывах связок, лёгких формах вывихов и подвывихов без повреждения суставной капсулы, а также поздних этапах реабилитации после переломов.
Преимущества
Ортезы
Полужёсткие или жёсткие изделия, гарантирующие полную иммобилизацию кисти для обеспечения повреждённым тканям максимального покоя на весь период реабилитации. Необходимость в ношении ортезов возникает при переломах, невправимых формах вывихов запястья или полном разрыве связок.
Отдельно рассматривается вопрос фиксации большого пальца руки. Необходимость ограничивать его подвижность возникает не всегда, а потому и сделать это позволяют не все модели ортезов.
Преимущества
Правила оказания первой помощи
При получении травмы запястье нужно максимально обездвижить, приложить на повреждённую область холод и как можно скорее доставить больного в травмпункт. При наличии сильного кровотечения накладывается жгут выше уровня раны.
Категорически не рекомендуется:
Ну и конечно же покупка ортеза или бандажа, при всех достоинствах этих ортопедических изделий, не может служить альтернативой посещению врача, поскольку результативное лечение травм кисти, и запястья в частности, требует точной диагностики и комплексной терапии.