взятие капиллярной крови что это у детей
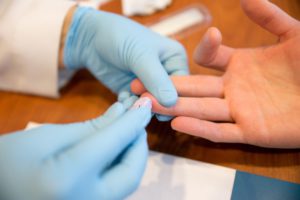
Алгоритм взятия капиллярной крови из пальца
Возможности метода
Клинический анализ капиллярной крови включает в себя определение концентрации гемоглобина, количества эритроцитов, лейкоцитов и тромбоцитов, величины гематокрита и эритроцитарных индексов (MCV, RDW, MCH, MCHC),формулу крови (процентное соотношение различных видов лейкоцитов (нейтрофилы, лимфоциты, эозинофилы, моноциты, базофилы)). Дополнительно, в случае необходимости, измеряется скорость оседания эритроцитов( СОЭ).
При проведении профосмотров и диспансеризаций по капиллярной крови измеряют содержание глюкозы и проводят экспресс-тесты уровня холестерина.
Подготовка к исследованию
Процедуру проводят в утренние часы, обычно с 8.00 – до 10:00, – натощак: предыдущий прием пищи накануне вечером должен быть минимум за 12 часов до взятия. С утра в день исследования можно только пить воду.
За несколько дней до анализа желательно исключить из рациона жирную пищу и алкоголь. Также рекомендуется временно ограничить физические нагрузки, по возможности высыпаться и избегать стрессов. Перед процедурой крайне не рекомендовано курить.
Правила взятия капиллярной крови
Инструмент
Палец прокалывают одноразовым стерильным скарификатором – это исключает риск инфицирования. Размер иглы или лезвия подбирается индивидуально, в зависимости от возраста и физических (физиологических) особенностей пациента. Современные автоматические скарификаторы снижают и болевые ощущения, и волнение пациента.
Выбор места взятия крови
Выбирают неохлажденный, не цианотичный, не отечный палец, Прокол лучше делать у кончика IV пальца левой руки (у правшей). Можно прокалывать II и III пальцы. Если руки у пациента холодные, то перед проведением прокола их нужно обернуть на 10—15 мин довольно горячим полотенцем. Чтобы усилить кровоток, нежно массируют палец от основания к кончику. Тампоном, смоченным спиртом, тщательно обрабатывают кончик пальца и дают поверхности просохнуть.
У новорожденных и детей до 1 года капиллярную кровь набирают из пятки. Методика взятия крови из пятки во многом схожа с методикой взятия крови из пальца. Глубокий укол пятки выполняют у дистального края пяточной кости, предварительно подогрев стопу в теплой воде
Что расскажет капля крови? Как брать кровь на анализ у маленьких детей
Анализ крови является важным диагностическим тестом, позволяющим объективно оценить многие процессы, происходящие в организме ребенка. Так, повышенные уровень лейкоцитов или скорость оседания эритроцитов (СОЭ) могут свидетельствовать о наличии воспалительного процесса. Если ребенок еще совсем маленький и не может рассказать, что у него болит, анализ крови становится незаменимым помощником врача в постановке диагноза и назначении необходимого лечения.
Подготовка к анализу
Поход в поликлинику пугает практически каждого ребенка, поэтому подготовиться к сдаче анализа нужно заранее. Кроме того, несоблюдение некоторых рекомендаций может повлиять на точность исследования.
За сутки до взятия крови ребенка нужно ограничить в физических нагрузках, занятиях спортом. За 12 часов до сдачи анализа нельзя принимать пищу.
В день анализа в поликлинику нужно прийти рано утром: сдавать кровь рекомендуется с 7 до 10 часов утра. Непосредственно перед анализом, за 10-15 минут, ребенок должен находиться в покое и тепле.
Перед процедурой нужно рассказать врачу или медсестре, какие лекарства принимает ребенок. В момент взятия крови родителям лучше оставаться рядом с ребенком. Максимальный объем крови, который единовременно может быть взят для лабораторных исследований, обязательно должен рассчитываться исходя из возраста и веса ребенка, его анатомических особенностей 1.
Капиллярная кровь: за и против
В случае необходимости исследования небольшого (до 0,5 мл) объема крови традиционно используется капиллярная кровь, поступающая из небольшого прокола на пальце или на пятке. Последний вариант подойдет самым маленьким пациентам в возрасте до 1 года и весом менее 9 кг2. В пятке много сосудов и мало нервных окончаний, что дает возможность быстро и безболезненно взять материал для исследования. Для этих целей рекомендуется использовать боковые поверхности пятки ребенка, а для улучшения кровотока пятку лучше нагреть до 34°С. Для этого можно использовать теплое полотенце или наполненную теплой водой резиновую перчатку. Но если у ребенка плохое кровоснабжение, плохая свертываемость крови, отек или повреждена кожа на пятке, то производить взятие крови из пятки не рекомендуется3.
У капиллярного взятия крови есть ряд недостатков. Связано это, прежде всего, с самим составом крови: капиллярная кровь имеет меньшую концентрацию кальция, калия и общего белка, но более высокую концентрацию глюкозы и гемоглобина4. Как правило, при взятии капиллярной крови на анализ в образец также может попасть остаток антисептика (спирта) и тканевой жидкости, что существенно снижает качество пробы и влияет на точность лабораторного исследования.
Недоверие к анализам капиллярной крови вызвано и тем, что вероятность ошибок в этом случае в три раза выше, чем при взятии венозной крови.5. В процессе взятия капиллярной крови у ребенка могут возникать болезненные ощущения при совершении пункции из-за укола иглы, надавливания на палец, повторных проколов или использования крупных ланцетов, особенно в случае слабого кровотока.
Капиллярную кровь у пациентов старше 1 года рекомендуется брать из боковых поверхностей среднего или безымянного пальцев. Как и при взятии крови из пятки, поверхность пальца перед совершением пункции необходимо немного нагреть. Это позволит повысить скорость кровотока и избежать чрезмерного надавливания на палец при взятии крови из пальца6.
Учитывая эти обстоятельства, медики стран Запада сегодня практически отказались от взятия капиллярной крови. Однако если врач считает проведение анализа капиллярной крови необходимым, есть возможность повысить его точность и уменьшить болевые ощущения. Так, с помощью скарификаторов, автоматических ланцетов можно сделать прокол на фиксированную глубину (от 0, 85 мм до 1 мм)7. Для этих анализов используют специальные микропробирки с реагентами и коллекторами для сбора крови8.
Что такое анализ венозной крови?
Кровь из вены позволяет получить более объективные данные о состоянии здоровья пациента. Венозную кровь у детей берут из срединной локтевой вены, латеральной подкожной вены руки, вен рук и ног, большой подкожной вены ноги, а также черепных вен (у самых маленьких). Сделать это можно двумя способами: открытым и закрытым.
Сегодня в большинстве случаев медсестры забирают кровь из вены шприцем, полой иглой или самотеком в пробирку. При этом были отмечены многочисленные случаи повторного использования игл и инфицирования пациентов и персонала. Сама технология открытого взятия крови также далека от совершенства – в этом случае происходит повышение риска разрушения клеток крови при ее переносе в пробирку. Кроме того, стеклянные пробирки могут разбиться, а кровь – впитаться в тампон, которым закрыта пробирка. Это небезопасная практика, которая чревата высоким риском инфицирования медицинской сестры и сотрудника лаборатории, а также распространения гемоконтактных инфекций.
Оптимальным вариантом получения крови для исследования сегодня является так называемый закрытый способ с использованием вакуумных систем. Это современное медицинское изделие, позволяющее избегать ошибок, нередко возникающих при использовании систем открытого типа. Закрытая система состоит из вакуумной пробирки, держателя и иглы. Пробирка позволяет набрать необходимый объем крови, а особым образом заточенная игла со специальным силиконовым покрытием легко проникает под кожу, не вызывая болевых ощущений.
После поступления в пробирку кровь будет надежно храниться в такой пробирке, что исключает возможность утраты материала и необходимость отправляться с ребенком на повторный анализ.
Для того, чтобы избежать взятия чрезмерных объемов крови и сделать процедуру взятия крови наиболее безболезненной, специалисты рекомендуют использовать педиатрические вакуумные пробирки, а также иглы-бабочки с катетером небольшой длины и небольшим диаметром иглы и с прозрачной камерой, которая позволяет визуализировать момент попадания иглы в вену.
Сама процедура взятия крови закрытым способом проста и не вызывает болевых ощущений. На анализ такого типа медсестре понадобится примерно 30 секунд – за это время ребенок даже не успеет испугаться, а значит, родителям и медицинскому персоналу в будущем не придется тратить время на разъяснения и уговоры: «Это совсем не больно». Таким образом, диагностика будет проведена быстро и точно, а маленький пациент – избавлен от страха, который порой сопровождает человека на протяжении всей его жизни.
1 Рекомендации по взятию крови венозной и капиллярной крови у детей и новорожденных // Вестник Ассоциации медицинских сестер России. 2014. С. 20-22.
2 Носкина Н.А. Рекомендации по взятию крови у новорожденных // Вестник Ассоциации медицинских сестер России. 2013. С. 36.
3 Сборник материалов для организации работы медицинской сестры отделения новорожденных // Санкт-Петербург: РАМС, 2013. С. 4.
4 Носкина Н.А. Рекомендации по взятию крови у новорожденных // Вестник Ассоциации медицинских сестер России. 2013. С. 36.
5 Скороходова Т. Г., Матушкина С. В., Грищенко Д. А. Современные технологии для качественного анализа капиллярной крови // Клинико-лабораторный консилиум. № 1 (45). февраль 2013. С. 34.
6 Рекомендации по взятию крови венозной и капиллярной крови у детей и новорожденных // Вестник Ассоциации медицинских сестер России. 2014. С. 20-22.
7 Рекомендации по взятию крови венозной и капиллярной крови у детей и новорожденных // Вестник Ассоциации медицинских сестер России. 2014. С. 20-22.
8 Рекомендации по взятию крови венозной и капиллярной крови у детей и новорожденных // Вестник Ассоциации медицинских сестер России. 2014. С. 20-22.
Иллюстрации
Рис 1.1_ Способы удержания ребенка при процедуре венепункции (материалы ВОЗ)

Рис 1.2_ Способы удержания ребенка при процедуре венепункции (материалы ВОЗ)

Рис 1.3_ Способы удержания ребенка при процедуре венепункции (материалы ВОЗ)

Рис 2.1_Техника взятия капиллярной крови у новорожденных

Рис 2.2_Техника взятия капиллярной крови у новорожденных

Рис 2.3_Техника взятия капиллярной крови у новорожденных

Рис 2.4_Техника взятия капиллярной крови у новорожденных

Рис 2_Область проведения пункции и техника взятия капиллярной крови у детей до 1 года

Рис 3_Область проведения пункции и техника взятия капиллярной крови у детей старше 1 года

Рис 3_Техника взятия венозной крови у новорожденных
«Детские» анализы крови: как избежать пересдачи
Почему на голодный желудок
В рекомендациях к большинству анализов крови можно увидеть слово «не менее, чем через 3 часа после еды». И вот почему.
1. Прием пищи запускает множество биохимических процессов, в том числе выброс иммунных клеток. Поэтому даже обычный общий анализ крови нужно сдавать не на полный желудок, чтобы не получить «ложно завышенных» лейкоцитов.
Не говоря уже о биохимических (глюкоза, холестерин, общий белок) и гормональных исследованиях.
2. Прием пищи, особенно жирной, жареной и копченой перед исследованием и накануне изменяет физико-химические свойства сыворотки, в частности ее прозрачность и оптическую плотность.
Повышенная мутность сыворотки:
По этой причине абсолютно все исследования рекомендовано сдавать с выдерживанием интервала после еды:
Как насчет воды
Мало кому известно, но чай, кофе или сок – для организма еда, а не вода. И потому легкая степень обезвоживания имеет довольно широкое распространение.
В тоже время даже незначительный дефицит жидкости в организме приводит к «сгущению» крови. Что не только осложняет саму процедуру взятия, но приводит к искажению некоторых результатов.
Так, все в том же общем анализе крови могут быть повышены эритроциты, гемоглобин и тромбоциты, что может маскировать легкую степень анемии и других заболеваний. А в некоторых случаях такие результаты могут потребовать пересдачи или дополнительных исследований для исключения серьезных патологий.
Таким образом питьевой режим перед анализами имеет не меньшее значение, чем пищевой. Поэтому воду можно и нужно пить в обычном режиме, особенно в условиях жаркой погоды и сухого микроклимата в доме.
Стресс – анализам «не товарищ»
Речь прежде всего о влиянии стресса на тонус сосудов и свертываемость крови.
Например, сильный крик ребенка во время взятия крови не только осложняют саму процедуру, за счет спазма мелких сосудов, но и может привести к образованию сгустков в материале и его непригодности к анализу.
Помимо прочего, кортизол (гормон стресса) значительно изменяет многие биохимические (особенно глюкозу) параметры. Поэтому максимальная психологическая поддержка ребенка как на этапе подготовки, так и во время взятия имеет такое же значение, как питьевой и пищевой режимы.
А чтобы минимизировать уровень стресса у ребенка, можно сдать анализы в привычной домашней обстановке, воспользовавшись услугой выезда медсестры на дом.
Технологический протокол забора проб капиллярной крови в клинико-диагностических лабораториях
ГОУ ВПО «Кемеровская государственная медицинская академия» РОСЗДРАВА
Кемеровская областная клиническая больница
Технологический протокол
забора проб капиллярной крови
в клинико-диагностических лабораториях
к.м.н., главный врач ГУЗ «Кемеровская областная клиническая больница» И.П. Рычагов,
д.м.н., профессор кафедры эпидемиологии ГОУ ВПО «Кемеровская государственная медицинская академия» Е.Б.Брусина
д.м.н., профессор кафедры эпидемиологии ГОУ ВПО «Кемеровская государственная медицинская академия» О.М.Дроздова
к.м.н, заведующая эпидемиологическим отделом ГУЗ «Кемеровская областная клиническая больница» Н.Б. Карпушкина
заведующая клинической лабораторией ГУЗ «Кемеровская областная клиническая больница» Л.И. Копытова.
Технологический протокол по регламенту забора проб капиллярной крови в клинико-диагностических лабораториях подготовлены для унификации работы лаборантов в целях обеспечения инфекционной безопасности медицинских технологий, как для пациента, так и для персонала.
Подлежат ежегодному пересмотру.
Рецензенты: д.м.н., проф. Е.В.Лишов, к.м.н. Л.С. Глазовская
Технологический протокол утвержден на заседании ученого совета ГОУ ВПО «Кемеровская государственная медицинская академия» Росздрава (протокол №__6__ от «__28_»______07_____2007г.), Департаментом охраны здоровья населения Кемеровской области «__ 30__» ____ 07___ 2007г.
© И.П. Рычагов, Е.Б. Брусина, О.М.Дроздова,Н.Б. Карпушкина, Л.И. Копытова.
© ГОУ ВПО КемГМА МЗ РФ
© ГУЗ Кемеровская областная клиническая больница
Требования,
предъявляемые к размещению кабинета для забора проб капиллярной крови в клинико-диагностической лаборатории
Расположение кабинета для забора проб капиллярной крови в лаборатории должно обеспечивать поточность поступающего на исследование материала и условий для выполнения правил санитарно-противоэпидемического режима.
Стены кабинета должны быть облицованы плиткой до потолка или покрыты влагостойкой краской. Потолок должен быть также покрыт влагостойкой краской. Допускается применение подвесных потолков при условии, что будут использованы конструкции и материалы, обеспечивающие герметичность, гладкость поверхности и возможность проведения их влажной очистки и дезинфекции.
Для покрытия полов должны быть использованы влагонепроницаемые материалы (линолеум, плитка и др. материалы). При использовании линолеумных покрытий края линолеума у стен должны быть плотно закреплены между стеной и полом, подведены под плинтуса. Швы примыкающих друг к другу листов линолеума должны быть тщательно пропаяны.
Кабинет для забора капиллярной крови должен быть оборудован:
секционной мойкой с подводкой горячей и холодной воды;
краном с локтевым или кистевым управлением;
дозаторами (локтевыми) с жидким (антисептическим) мылом и раствором антисептика;
устройством для салфеток;
емкостями для утилизации отходов в соответствии с требования биологической безопасности;
приточно-вытяжной вентиляцией с механическим побуждением и естественной вентиляцией через форточки, фрамуги и т.д., оборудованными системой фиксации;
системой кондиционирования воздуха.
Поверхности отопительных приборов должны иметь гладкую поверхность, устойчивую к ежедневному воздействию моющих и дезинфицирующих растворов, допускающую легкую очистку, исключающую адсорбирование пыли и скопление микроорганизмов. Отопительные приборы следует размещать у наружных стен под окнами, без ограждений.
Помещение кабинета должно иметь естественное, общее и локальное искусственное освещение. Искусственное освещение может осуществляться как люминесцентными, так и лампами накаливания. Светильники общего освещения кабинета должны быть со сплошными (закрытыми) рассеивателями. Рабочее место должно иметь дополнительное искусственное освещение.
Кабинет должен быть оборудован закрытыми, открытыми или комбинированными лампами ультрафиолетового бактерицидного излучения. Количество их рассчитывается в соответствии с Руководством Р 3.5.1904-04 «Использование ультрафиолетового бактерицидного излучения для обеззараживания воздуха в помещениях».
В кабинете для забора капиллярной крови выделяют асептическую, рабочую и хозяйственную зону и обеспечивают исключение перекреста чистого и «грязного» потоков.
Кабинет должен иметь:
стол с выдвижным ящиком для дезинфицирующих средств.
Мебель должна иметь влагостойкие поверхности, подлежащие дезинфекции.
В асептической зоне располагают медицинский шкаф со стерильными материалами, химическими препаратами. Стерильные материалы в упаковке должны храниться на отдельной полке. Укладки со стерильным материалом и подготовленные для стерилизации укладки хранят в разных отделениях шкафа.
В рабочей зоне выполняются все манипуляции пациенту и заполняется медицинская документация. В этой зоне располагаются рабочий и манипуляционный столы. На манипуляционном столе размещаются штативы с пробирками для крови. Все медицинские документы располагаются на рабочем столе.
В хозяйственной зоне располагается раковина, тумбочка с дезинфицирующими средствами. На тумбочке располагаются емкость с дезинфицирующим раствором «Для дезинфекции поверхностей». В тумбочке хранится трехдневный запас дезинфицирующего препарата, моющее и чистящее средства, чистая сухая ветошь, мерная посуда, перчатки для уборки помещения.
Раздел 2.
Защитная одежда
* Хлопчатобумажная сорочка или костюм: рубашка и брюки;
* шапочка или косынка;
* обувь, подлежащая мытью и дезинфекции;
* пластиковые очки или лицевая маска «Барьер».
Порядок снятия перчаток.
* сделать отворот на левой перчатке пальцами правой руки, касаясь только наружной стороны;
* снять перчатку с левой руки, выворачивая ее на изнанку и держа за отворот. Держите ее в правой руке;
* взять правую перчатку левой рукой за отворот с внутренней стороны;
* снять перчатку с правой руки, выворачивая ее на изнанку: левая перчатка оказалась внутри правой;
* поместить перчатки в дезинфицирующий раствор (раствор для обеззараживания по режиму вирусных гепатитов);
Порядок снятия халата.
* снять халат вначале с одной руки, касаясь только нижней части рукавов4
* снять халат со второй руки, прикасаясь к нему изнутри и выворачивая его наизнанку;
* поместить халат в емкость с маркировкой «Грязное белье»;
* смена халата производится ежедневно или чаще, если это необходимо.
Порядок снятия маски.
* снять маску, прикасаясь только к завязкам;
* поместить маску в емкость с крышкой для последующей дезинфекции кипячением;
* маску меняют каждые 4 часа.
Защитные очки и лицевую маску тщательно моют теплой водой с мылом в конце рабочего дня и протирают насухо стерильной салфеткой. Хранят в шкафу на полке вместе с аптечкой первой помощи.
Раздел 3.
Подготовка кабинета к работе
* антисептиков и жидкого мыла для рук в дозаторах;
* бумажных салфеток для рук;
* необходимого количества упаковок стерильных, одноразовых скарификаторов, шариков, капилляров, предметных часовых стекол или одноразовых пробирок;
* пакетов для отходов классов «А» и «Б»;
* комплектности аптечки для аварийных ситуаций;
* пробирок, капилляров, предметных стекол, штативов для подготовки проб крови для исследования;
пополнить все недостающее;
приготовить в емкости «Для дезинфекции поверхностей», контейнерах «Для колющих и режущих инструментов» и «Для дезинфекции стекол» раствор дезинфектанта, в концентрации, предусмотренной для инактивации вирусов гемоконтактных гепатитов;
взять большую марлевую салфетку;
смочить салфетку необходимым количеством дезинфектанта из емкости «Для дезинфекции поверхностей» или дозатора с готовой к применению формой дезинфектанта;
протереть рабочие горизонтальные поверхности;
выбросить салфетку в пакет «Отходы класса А»;
снять перчатки, сбросить их в пакет «Отходы класса А»;
если кабинет оборудован бактерицидным облучателем рециркуляционного типа – включить облучатель.
Раздел 4.
Обработка рук
* Снять кольца, перстни и другие украшения, так как они затрудняют эффективное удаление микроорганизмов; открыть кран;
* с помощью дозатора налить в ладонь жидкое мыло;
* под умеренной струей комфортно теплой воды энергично намылить руки жидким мылом из разового дозатора;
* тереть ладонью о ладонь;
* тереть правой ладонью по тыльной стороне левой руки;
* тереть левой ладонью по тыльной стороне правой руки;
* сложив ладони, тереть внутренние поверхности пальцев движениями вверх и вниз;
* тереть тыльной стороной пальцев по ладони другой руки;
* тереть пальцы круговыми движениями;
* поочередно круговыми движениями тереть ладони сжатыми пальцами;
Каждое движение следует повторять 5 раз!
* высушить руки двумя бумажными салфетками;
* салфетку сбросить в пакет «Отходы класса А»
* закрыть кран локтем или запястьем
Запрещается закрывать кран руками!
Раздел 5.
Подготовка рабочего места
Вымыть руки (раздел 4);
подготовить манипуляционный стол к работе, условно разделив рабочую поверхность стола на «чистую» и «грязную» половины;
на «чистой» половине поместить стерильные индивидуальные упаковки с капиллярами, ватными шариками, стерильные одноразовые скарификаторы, стерильные предметные часовые стекла либо одноразовые пробирки, чистые резиновые груши, перчатки, предметные стекла, емкость с 70 о спиртом или другим разрешенным спиртовым кожным антисептиком;
Раздел 6.
Технология забора капиллярной крови
Подготовить на манипуляционном столе набор для забора крови из пальца, проверив целостность упаковок и дату стерилизации: индивидуальное стерильное предметное часовое стекло или пробирку одноразового использования, чистое предметное стекло для приготовления мазка крови, грушу, перчатки.
на рабочем столе оформить сопроводительные документы;
помочь пациенту найти удобное положение;
разъяснить пациенту суть предстоящей процедуры, создавая атмосферу доверия, предоставляя возможность задать вопросы;
вымыть руки (раздел 4);
обработать руки спиртовым антисептиком;
надеть чистые перчатки;
обработать подушечку пальца стерильным ватным шариком, смоченным спиртовым антисептиком;
сбросить шарик в емкость для отходов «Класса Б»;
вскрыть одноразовый скарификатор и сделать прокол на подушечке безымянного пальца. Укол лучше производить
сбоку, где более густая капиллярная сеть, на глубину 2-3 мм в
зависимости от толщины кожи;
использованный скарификатор сбросить в контейнер «Для колющих и режущих инструментов»;
сухим стерильным марлевым шариком убрать каплю крови с пальца пациента, шарик сбросить в емкость для отходов «Класса Б»;
произвести забор крови из пальца с использованием стерильных капилляров или одноразовых пробирок;
Внимание! Кровь забирается только самотеком!
Кровь из ранки должна вытекать
свободно, т.к. при сильном надавливании на палец возможно примешивание тканевой жидкости, что приводит к искажению результата.
закрыть место прокола стерильным ватным шариком, смоченным спиртовым антисептиком и отпустить пациента;
Внимание! Груша используется только для подготовки пробы крови к клинико-диагностическому исследованию!
Внимание! Перчатки используются однократно!
Внимание! Перед забором крови следующему пациенту мытьё рук водопроводной водой с мылом не обязательно!
Обязательна обработка рук спиртовым антисептиком перед надеванием перчаток!
Раздел 7.
Технология забора капиллярной крови с помощью одноразовых стерильных пробирок на примере систем MiniCollect® или Microvette®
Системы состоят из двух основных компонентов:
пробирки объемом от 0,25мл до 1,0 мл с герметичной клапанной крышкой. В зависимости от назначения пробирка содержит реагент в необходимом количестве;
капилляры из пластика с различными наполнителями или универсальная воронка из полипропилена.
Процедура взятия капиллярной крови:
обработать руки спиртовым антисептиком;
надеть чистые перчатки;
вставить в крышку пробирки воронку или капилляр;
обработать подушечку пальца стерильным ватным шариком, смоченным спиртовым антисептиком;
сбросить шарик в емкость для отходов «Класса Б»;
вскрыть одноразовый скарификатор и сделать прокол на подушечке пальца, использованный скарификатор сбросить в емкость для отходов «Класса Б»;
собрать кровь в пробирку воронкой или через капилляр под действием капиллярного эффекта;
Внимание! Крышку с пробирки не снимать!
удалить капилляр или воронку из крышки (при этом клапан крышки автоматически закрывается) и сбросить в емкость «Для дезинфекции стекол»;
пробирку аккуратно перевернуть вокруг своей оси для лучшего смешивания с реагентом;
поместить пробирку с кровью в штатив;
снять перчатки и сбросить их в емкость для отходов «Класса Б».
Раздел 8.
Требования к организации забора крови в отделениях стационара
Для забора крови в отделении лаборант должен подготовить контейнер для транспортирования, в котором выделяются 3 отделения – чистое, рабочее и грязное:
в чистом отделении размещается необходимое количество стерильных укладок с ватными шариками, капиллярами, предметными часовыми стеклами или одноразовыми пробирками, чистыми перчатками.
в рабочем отделении располагают чистые предметные стекла; груши; штативы с пробирками для определения СОЭ, содержания гемоглобина; мазки крови и т.д.
в грязном отделении ставят контейнер «Для дезинфекции стекол», контейнер для отработанных скарификаторов.
Забор крови в отделении должно проводиться на специально отведенном манипуляционном столе. Поверхность манипуляционного стола должна иметь влагостойкое покрытие. Около рабочего места лаборанта должна размещаться раковина для мытья рук с локтевым или кистевым управлением.
На «чистой» половине манипуляционного стола поместить стерильные индивидуальные упаковки с капиллярами, ватными шариками, стерильные одноразовые скарификаторы, стерильные предметные часовые стекла либо одноразовые пробирки, чистые резиновые груши, перчатки, часовые предметные стекла, емкость с 70° спиртом или другим разрешенным спиртовым кожным антисептиком;
на «грязной» половине разместить емкость для отходов «Класса Б», контейнер для отработанных скарификаторов и емкость «Для текущей дезинфекции»;
Внимание! Дезинфицирующие растворы в контейнерах «Для дезинфекции поверхностей» готовятся заранее постовой сестрой отделения.
При заборе капиллярной крови у постели больного рабочее место лаборанта должно быть оснащено передвижным манипуляционным столом:
на верхней полке передвижного манипуляционного стола разместить необходимое количество стерильных укладок с капиллярами, микропипетками, ватными шариками, стерильными предметными часовыми стеклами или одноразовыми пробирками, емкость с антисептиком, чистые перчатки и груши, одноразовые влагонепроницаемые салфетки;
на нижней полке – емкости для отходов «Класса Б», «Для дезинфекции поверхностей», контейнеры «Для колющих и режущих инструментов» и «Для дезинфекции стекол» с дезинфицирующим раствором;
Технология забора капиллярной крови проводится в соответствии с разделом 6.
Рука больного перед процедурой укладывается на влагонепроницаемую одноразовую салфетку.
Раздел 9.
Требования к обработке и стерилизации лабораторного инструментария, посуды, мягкого материала
Лабораторные инструменты, капилляры, скарификаторы, предметные стекла, меланжеры, счетные камеры, резиновые груши, баллоны, лабораторная посуда и др. после каждого исследования должны подвергаться дезинфекции в соответствии с режимом для инактивации вирусов гемоконтактных гепатитов дезинфицирующими средствами, разрешенными в установленном порядке в Российской Федерации;
Емкости с растворами дезинфицирующих, моющих и стерилизующих средств должны быть снабжены крышками, иметь четкие надписи с указанием средства, его концентрации, назначения, даты приготовления.
Одноразовый лабораторный инструментарий после использования подвергается дезинфекции с последующей утилизацией в установленном порядке. Повторное использование одноразовых изделий категорически запрещено;
Отработанный мягкий материал (отходы «Класса Б») утилизируется в соответствии с требованиями СанПиН 2.1.7.728-99.
Контроль качества предстерилизационной очистки проводится ежедневно лаборантом. Старший лаборант клинико-диагностической лаборатории проводит самоконтроль 1 раз в неделю с записью результатов в журнале согласно установленной формы. Для контроля качества предстерилизационной очистки используются азопирамовая (на скрытую кровь) и фенолфталеиновая (на наличие остатков моющего средства) пробы.
После дезинфекции и предстерилизационной очистки предметные часовые стекла, капилляры:
упаковываются по 1 шт. в крепированную бумагу или по 5 шт. в пластиковые (полиамидные) или бумажные пакеты для воздушных стерилизаторов;
наклеиваются индикаторные полоски;
упаковки стерилизуются в воздушных стерилизаторах при 180 0 С 60 минут или при 160 0 С 150 минут.
Приготовленные ватные шарики нужных размеров:
упаковываются в необходимом количестве в упаковочные пакеты или бязь;
приготовленные пакеты упаковываются в упаковочную бумагу;
наклеиваются или вкладываются индикаторные полоски;
пакеты стерилизуются в паровых стерилизаторах при 132 0 С 20 минут.
Бактериологический контроль качества стерилизации мягкого материала и предметных часовых стекол проводится не реже 1 раза в месяц.
Раздел 10.
Уборка кабинета в конце рабочего дня
взять большую салфетку;
смочить салфетку необходимым количеством дезинфектанта из емкости «Для дезинфекции поверхностей» или дозатора с готовой к применению формой дезинфектанта;
применению формой дезинфектанта;
выбросить салфетку в пакет «Отходы класса Б»;
вылить использованный дезинфицирующий раствор;
слить дезинфектант из емкостей, контейнера «Для колющих и режущих инструментов», «Для дезинфекции стекол»;
утилизировать дезинфицированные скарификаторы по принятой в учреждении схеме;
в ведро для мытья полов набрать воды, добавить небольшое количество моющего средства;
прополоскать и отжать ветошь, вылить раствор в канализацию;
убрать ведро и ветошь в помещение, предназначенное для ее хранения;
снять халат и сбросить его в корзину с грязным бельем;
включить бактерицидный облучатель (время экспозиции зависит от типа облучателя).
после окончания экспозиции бактерицидного облучения выключить облучатель;
Раздел 11.
Генеральная уборка по типу заключительной дезинфекции.
* Заключительная дезинфекция кабинета проводится 1 раз в неделю;
* надеть рабочий халат;
* освободить поверхности рабочего и манипуляционного столов;
* освободить шкаф и ящики столов, оставив их открытыми или выдвинутыми;
* надеть защитные очки, перчатки, респиратор;
* приготовить в емкости гидропульта дезинфицирующий раствор;
* с помощью гидропульта нанести на стены, окна, двери, внутренние поверхности шкафа, тумбочек, столов и другие поверхности дезинфицирующий раствор в концентрации, предусмотренной для инактивации вирусов гемоконтатных гепатитов из расчета 0.2л на 1 м2. Если не используется гидропульт, то стены и потолок моют с помощью телескопической швабры;
* покинув помещение, плотно закрыть дверь;
* выдержать время экспозиции дезинфектанта;
* по окончании экспозиции приготовить в емкостях «Для дезинфекции поверхностей» и «Для мытья полов» 0.5% моющий раствор;
* вымыть стены на полную высоту и поверхности подоконника, шкафа, столов, холодильника, кушетки, тумбочки, стульев, пригласить электрика и протереть плафоны;
* прополоскать тщательно отжать ветошь;
* вылить остатки моющего раствора в канализацию;
* убрать ведро и ветошь в помещение, предназначенное для ее хранения;
* сбросить перчатки в пакет «Отходы класса А»;
* включить бактерицидный облучатель (время экспозиции зависит от типа облучателя).
* после окончания экспозиции бактерицидного облучения проветрить помещение;
* после окончания экспозиции бактерицидного облучения выключить облучатель.
Раздел 12.
Защита персонала от инфицирования.
Состав аптечки первой помощи при аварийной ситуации:
* 5% спиртовая настойка йода;
* 20 % раствор сульфацила-натрия;
* навески марганцевокислого калия для приготовления 0,05% раствора (50 мг на 100 мл воды);
* бинт, лейкопластырь, напальчники, перчатки.
При повреждении емкости, разливе биологических субстратов:
* использовать защитную одежду: перчатки, фартук, маску или щиток;
* ограничить место аварии ветошью и залить его дезинфицирующим раствором (0,1% раствором Жавелиона; 6% перекисью водорода и т.д.) на 1 час;
* через час собрать разбитую емкость с помощью совка, выбросить, поверхности вымыть водой;
* перчатки повторному использованию не подлежат.
При повреждении кожных покровов инструментами, загрязненными биологическими жидкостями пациента:
* выдавить кровь из ранки,
* обработать 700 спиртом,
* вымыть руки под проточной водой с двукратным намыливанием,
* обработать ранку 5% настойкой йода.
При попадании биологических жидкостей пациентов на слизистую глаз:
* промыть под проточной водой,
* закапать 20 % раствор сульфацила-натрия или промыть 0,05% раствором марганцевокислого калия (разведение 1 : 10000);
Внимание! Категорически запрещается тереть слизистые оболочки, загрязненные кровью или другими биологическими жидкостями.
При попадании биологических жидкостей пациентов на слизистую носа:
* промыть под проточной водой,
* промыть 0,05% раствором марганцевокислого калия;
* При попадании биологических жидкостей пациентов на неповрежденную кожу:
* обработать кожу 700 спиртом,
* вымыть руки под проточной водой с двукратным намыливанием,
* повторно обработать 700 спиртом,
При попадании биологических жидкостей пациентов на слизистую рта:
* прополоскать 0,05% раствором марганцевокислого калия или 700 спиртом;
В случае повреждения пробирки с кровью во время работы центрифуги:
* крышку открывать медленно, только через 40 минут после полной остановки,
* все центрифужные стаканы и разбитое стекло поместить в дезинфицирующий раствор на 1 час (3% раствором хлорамина, 0,1% раствором Жавелиона, 6% перекисью водорода и т.д.),
* внутреннюю и наружную поверхность центрифуги и крышки обработать дезинфицирующим раствором двукратным протиранием с интервалом в 15 минут.
Приказ МЗ СССР от 31.07.78г. №720 «Об улучшении медицинской помощи больным с гнойными хирургическими заболеваниями и усилении мероприятий по борьбе с внутрибольничной инфекцией».
Приказ МЗ СССР от 12.07.89г. № 408 «О мерах по снижению заболеваемости вирусными гепатитами в стране».
Приказ МЗ СССР от 03.09.91г. №254 «О развитии дезинфекционного дела в стране».
Приказ МЗ МП РФ от 16.08.94г. № 170 «О мерах по совершенствованию профилактики и лечения ВИЧ-инфекции в Российской Федерации».
Приказ ДОЗН КО от 23.06.03г. № 445 «О профилактике профессионального заражения ВИЧ-инфекцией».
ОСТ 42-21-2-85 «Стерилизация и дезинфекция и изделий медицинского назначения. Методы, средства и режимы».
СанПиН 2.1.7.728-99 «Правила сбора, хранения и удаления отходов лечебно-профилактических учреждений»
СанПиН 2.1.3.1275-03 «Гигиенические требования к размещению, устройству, оборудованию и эксплуатации больниц, родильных домов и других лечебных стационаров».
Уважаемые коллеги!
Все методические рекомендации, пособия и т.д. интеллектуальная собственность авторов, Ассоциации и являются архивными материалами разных лет!!