высокоэметогенная химиотерапия что это
Библиотека
ПРОФИЛАКТИКА РВОТЫ, ОБУСЛОВЛЕННОЙ ПРОВЕДЕНИЕМ ХИМИОТЕРАПИИ
И РАДИОТЕРАПИИ: РЕЗУЛЬТАТЫ ПЕРУДЖИЙСКОЙ МЕЖДУНАРОДНОЙ
ПРОТИВОРВОТНОЙ КОНСЕНСУСНОЙ КОНФЕРЕНЦИИ
The Antiemetic Subcommittee of the Multinational Association of Supportive Care in Cancer (MASCC)
Annals of Oncology 17: 20–28, 2006
Перевод – Жуков Н.В.
СТЕПЕНЬ ЭМЕТОГЕННОСТИ ХИМИОПРЕПАРАТОВ
Под степенью эметогенности понимается риск развития рвоты у больных, получающих тот или иной цитостатик без противорвотной терапии. Например, высокая степень эметогенности подразумевает, что более 90% больных, получающих терапию данным препаратом, будет иметь тошноту и рвоту в отсутствие адекватной противорвотной терапии.
Определение эметогенности химиопрепаратов имеет как минимум две цели. Во-первых, это позволяет систематизировать рекомендации по противорвотной терапии для различных видов цитостатиков. Во-вторых, более рационально организовывать последующие исследования по противорвотной терапии. До настоящего времени было предложено несколько классификаций эметогенности химиопрепаратов, разделявших их на несколько групп (от 3 до 5). [1, 2].
К сожалению, существовавшие до настоящего времени классификации были не лишены ряда существенных недостатков. Большинство классификаций не делали различия между различными типами рвоты: острой, отсроченной и предшествующей. Ни в одной из классификаций не оценивалась тошнота, и лишь некоторые из них обращали внимание на важность факторов, связанных с режимом лечения и/или специфическими особенностями пациента (доза химиопрепаратов, скорость введения, путь назначения, пол и возраст пациента, потребление алкоголя в анамнезе и т.д.)[1, 2].
Новую проблему для оценки степени эметогенности представляют и бурно развивающиеся в настоящее время направления – пероральная цитостатическая терапия и целевая (target) терапия, обычно предусматривающие длительное назначение препаратов. В такой ситуации (если препарат назначается перорально на протяжении нескольких дней или недель) различие между острой и отсроченной рвотой теряются. Hesketh et al. [3] предложили определять степень эметогенности исходя из риска развития острой рвоты после использования цитостатиков в монотерапии (с учетом дозы препаратов и пути их введения). Данная классификация с определенными изменениями была принята консенсусной конференцией в качестве рабочей.
По классификации, принятой консенсусной конференцией, внутривенные цитостатики разделены на 4 группы по риску развития рвоты: высокоэметогенные, среднеэметогенные, низкоэметогенные и минимально эметогенные (Таблица 1). Отдельно указываются препараты для перорального приема, которые также разделены на 4 группы (Таблица 2). В связи с тем, что пероральные препараты чаще назначаются в течение нескольких дней или даже недель, определение их эметогенности указано только по отношению к начальному периоду приема. Степень эметогенности и, соответственно, противорвотные режимы для пероральных цитостатиков могут различаться с рекомендованными для однократного внутривенного их использования.
Таблица 1.
Эметогенность внутривенных противоопухолевых препаратов при назначении в виде монотерапии однократно.
Профилактика рвоты, обусловленной проведением химиотерапии и радиотерапии: результаты перуджийской Международной противорвотной консенсусной конференции
The Antiemetic Subcommittee of the Multinational Association of Supportive Care in Cancer (MASCC)
Annals of Oncology 17: 20–28, 2006
Перевод – Жуков Н.В., к.м.н.
ФГУ Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии Росздрава
Степень эметогенности химиопрепаратов
Под степенью эметогенности понимается риск развития рвоты у больных, получающих тот или иной цитостатик без противорвотной терапии. Например, высокая степень эметогенности подразумевает, что более 90% больных, получающих терапию данным препаратом, будет иметь тошноту и рвоту в отсутствие адекватной противорвотной терапии.
Определение эметогенности химиопрепаратов имеет как минимум две цели. Во-первых, это позволяет систематизировать рекомендации по противорвотной терапии для различных видов цитостатиков. Во-вторых, более рационально организовывать последующие исследования по противорвотной терапии. До настоящего времени было предложено несколько классификаций эметогенности химиопрепаратов, разделявших их на несколько групп (от 3 до 5). [1, 2].
К сожалению, существовавшие до настоящего времени классификации были не лишены ряда существенных недостатков. Большинство классификаций не делали различия между различными типами рвоты: острой, отсроченной и предшествующей. Ни в одной из классификаций не оценивалась тошнота, и лишь некоторые из них обращали внимание на важность факторов, связанных с режимом лечения и/или специфическими особенностями пациента (доза химиопрепаратов, скорость введения, путь назначения, пол и возраст пациента, потребление алкоголя в анамнезе и т.д.)[1, 2].
Новую проблему для оценки степени эметогенности представляют и бурно развивающиеся в настоящее время направления – пероральная цитостатическая терапия и целевая (target) терапия, обычно предусматривающие длительное назначение препаратов. В такой ситуации (если препарат назначается перорально на протяжении нескольких дней или недель) различие между острой и отсроченной рвотой теряются. Hesketh et al. [3] предложили определять степень эметогенности исходя из риска развития острой рвоты после использования цитостатиков в монотерапии (с учетом дозы препаратов и пути их введения). Данная классификация с определенными изменениями была принята консенсусной конференцией в качестве рабочей.
По классификации, принятой консенсусной конференцией, внутривенные цитостатики разделены на 4 группы по риску развития рвоты: высокоэметогенные, среднеэметогенные, низкоэметогенные и минимально эметогенные (Таблица 1). Отдельно указываются препараты для перорального приема, которые также разделены на 4 группы (Таблица 2). В связи с тем, что пероральные препараты чаще назначаются в течение нескольких дней или даже недель, определение их эметогенности указано только по отношению к начальному периоду приема. Степень эметогенности и, соответственно, противорвотные режимы для пероральных цитостатиков могут различаться с рекомендованными для однократного внутривенного их использования.
Таблица 1. Эметогенность внутривенных противоопухолевых препаратов
при назначении в виде монотерапии однократно.
Профилактика рвоты при проведении многодневной химиотерапии
Лишь небольшое количество исследований посвящено профилактике тошноты и рвоты после многодневной химиотерапии. Внутривенная комбинация антагониста 5-НТ3 рецепторов и дексаметазона позволяет достигать полного контроля рвоты у 55–83% пациентов в течение 3-5 дней введения цисплатина и превосходит эффективность комбинации дексаметазона с метоклопрамидом или монотерапию антагонистами 5-НТ3 рецепторов [1].
При ежедневном назначении 5-HT3 антагонистов и дексаметазона в течение 5 последовательных дней цисплатин-содержащей химиотерапии у больных раком яичка в большинстве случаев отмечается незначительная частота развития тошноты и рвоты в первые 3 дня химиотерапии. Наиболее выраженная тошнота отмечается на 4-5 день химиотерапии, а также на 6-8 дни (1-3 дни после завершения химиотерапии). Является ли это проявлением отсроченной тошноты на ранее проведенную химиотерапию или имеет другой механизм развития до настоящего времени остается неясным.
Стратегия предотвращения тошноты и рвоты на фоне многодневного введения цисплатина должна быть аналогичной таковой, используемой для однодневного введения цисплатина. Настоящий консенсус рекомендует использовать пероральный дексаметазон в дозе 20 мг на протяжении всех дней введения цисплатина (дни 1-5), а в последующем дексаметазон 8 мг перорально два раза в день в дни 6 и 7, а в день 8 – дексаметазон 4 мг два раза в день. Таким образом, пациенты, получающие многодневную цисплатин-содержащую терапию, должны получать комбинацию 5-НТ3 антагониста и дексаметазона для профилактики острой рвоты и дексаметазон для профилактики отсроченной. Оптимальная доза антагонистов 5-НТ3 рецепторов и дексаметазона, а также роль апрепитанта у этих пациентов требует дальнейшего исследования.
Рефрактерная и прорывная рвота
Рефрактерная рвота обычно определяется как рвота, наблюдающаяся несмотря на использование адекватной противорвотной профилактики во время предшествующих циклов химиотерапии [1]. Прорывная рвота представляет собой рвоту, наблюдающуюся в любой из дней лечения, несмотря на проведение оптимальной противорвотной терапии. Прорывная рвота обычно лечится с использованием дополнительных антиэметиков. Подходы к лечению прорывной рвоты в рандомизированных исследованиях не оценивались, а вопросам рефрактерной рвоты посвящено лишь незначительное количество исследований.
Различные подходы были использованы для лечения этих видов рвоты: переход на другой антагонист 5-НТ3 рецепторов [23], добавление других противорвотных препаратов (антагонисты допаминовых рецепторов, бензодиазепины или нейролептики).
Палоносетрон – новый антагонист 5-НТ3 рецепторов может рассматриваться как возможная опция (учитывая данные предварительных исследований по сравнению палоносетрона с другими препаратами из этой группы), однако его роль в лечении данных видов рвоты остается неясной. Аналогичные вопросы возникают и в отношении апрепитанта.
Новые противорвотные препараты, такие как оланзапин [olanzapine] (блокатор допаминовых, серотониновых, мускариновых и гистаминовых рецепторов) также может рассматриваться как возможный вариант лечения рефрактерной и прорывной рвоты [24].
Небольшое количество исследований было посвящено лечению больных с рефрактерной рвотой, определяемой как рвота на предшествующих циклах химиотерапии. В двух рандомизированных исследованиях добавление метопомазина к комбинации ондансетрона и метилпреднизолона на последующих циклах химиотерапии было более эффективно у больных с рефрактерной рвотой [25, 26].
Профилактика и лечение предшествующей рвоты (рвота ожидания, anticipatory emesis)
Предшествующая тошнота и рвота представляет собой условный рефлекс на химиотерапию (и/или сопутствующие ей манипуляции, обстановку и т.д.). По данным ранних исследований до 20% больных к 4-му и более циклам химиотерапии имели предшествующую рвоту [1]. Более современные исследования показали, что частота предшествующей тошноты и рвоты гораздо меньше, чем отмечалось в предшествующих наблюдениях, в которых использовались менее эффективные режимы профилактики острой и отсроченной тошноты и рвоты (менее 10% предшествующей тошноты и менее 2% рвоты). Риск развития предшествующей тошноты и рвоты увеличивается с количеством циклов химиотерапии, полученных пациентом, и может сохраняться на протяжении длительного времени после окончания химиотерапии. В случае отсутствия острой или отсроченной тошноты и рвоты развитие предшествующей рвоты маловероятно. Другими факторами риска развития предшествующей тошноты и рвоты являются возраст менее 50 лет, тошнота и рвота после предыдущего курса химиотерапии, эпизоды потливости или генерализованной слабости после предшествующей химиотерапии [27, 28]. Также была показана связь предшествующей рвоты с эмоциональным дистрессом и ожиданиями [29].
Однажды развившись, предшествующая тошнота и рвота трудно поддается лечению медикаментозными средствами. В связи с этим лучшей профилактикой предшествующей тошноты и рвоты является наиболее эффективный контроль острой и отсроченной рвоты. Поведенческая психотерапия, включающая десенситизацию, может быть весьма эффективна для лечения этого осложнения, но, к сожалению, ее использование остается затрудненным, т.к. большинство пациентов получают лечение в областях, где нет возможности проводить такое лечение. Бензодиазепины также обладают активностью при предшествующей тошноте и рвоте, однако их эффективность уменьшается при продолжении химиотерапии.
Профилактика тошноты и рвоты, индуцируемых лучевой терапии
В зависимости от области облучения около 40-80% больных, получающих лучевую терапию, испытывают тошноту и рвоту. Многие пациенты могут получать длительные курсы радиотерапии (до 40 фракций на протяжении 6-8 недель) и, соответственно, длительное сохранение тошноты и рвоты, значительно нарушающих качество жизни. Более того, неконтролируемая тошнота и рвота могут приводить к задержке лечения или даже отказу от его продолжения. К сожалению, тошнота и рвота часто недооценивается радиологами. Частота и выраженность тошноты и рвоты зависит от ряда факторов, связанных с самой радиотерапией (разовая и суммарная доза, объем и область облучения, техника облучения) или особенностями пациента (возраст, общее состояние, пол, одновременно или ранее проведенная химиотерапия, психологический статус, стадия опухоли). В то же время, наблюдения Итальянской группы по исследованию антиэметиков при радиотерапии (Antiemetic Research in Radiotherapy) показали, что только область облучения (верхний этаж брюшной полости), размер поля облучения (более 400 см 2 ) и ранее проведенная химиотерапия являются значимыми факторами риска [30].
Предыдущие рекомендации по противорвотной терапии у больных, получающих лучевую терапию, значительно различались по классификации эметогенности и назначению противорвотных препаратов.
Данные расхождения в рекомендациях в основном недостаточное количество данных хорошо организованных рандомизированных исследований. Рекомендации данного консенсуса основаны на суммации дополнительных данных из литературных источников и предыдущих рекомендаций [31, 32].
Используя область облучения в качестве основного фактора для распределения лучевой терапии по степени эметогенности, было выделено 4 группы: высокоэметогенная, среднеэметогенная, низко и минимально эметогенная лучевая терапия. (Таблица 5). Данное разделение позволяет врачам более точно подбирать противорвотную терапию для пациентов, получающих лучевое лечение.
Таблица 5. Степень эметогенности лучевой терапии
и рекомендованные режимы профилактики тошноты и рвоты.
| Степень эметогенности | Область облучения | Рекомендации |
|---|---|---|
| Высокая (>90%) | Тотальное терапевтическое облучение всего тела | Профилактика 5-НТ3 антагонист + дексаметазон |
| Средняя (60-90%) | Верхний этаж брюшной полости | |
| Низкая (30-59%) | Нижние отделы грудной клетки и таз | Профилактика 5-НТ3 антагонист или назначение 5-НТ3 антагониста уже в случае развития тошноты/рвоты |
| Минимальная ( <30%) | Голова и шея, конечности, череп и молочная железа | Антагонист допаминовых рецепторов или 5-НТ3 антагонист уже в случае развития тошноты/рвоты |
Заключение
Настоящая консенсусная конференция обобщила наиболее новые данные по противорвотной терапии у онкологических пациентов, получающих различные химиопрепараты и радиотерапевтические режимы. Наибольшие изменения со времени первых консенсусов MASCC [1] и ASCO [2] прошедших в 1998/1999 годах представлены следующим:
Палоносетрон явился эффективным антагонистом 5-НТ3 рецепторов. Однако необходимы дальнейшие исследования для сравнения его с другими антиэметиками из этой группы при использовании в режимах рекомендованных консенсусными конференциями (в комбинации с дексаметазоном +/- апрепитант). Использование апрепитанта в настоящее время включено в стандарты профилактики рвоты у пациента, получающего высоко и среднеэметогенную химиотерапию.
Согласен Данный веб-сайт содержит информацию для специалистов в области медицины. В соответствии с действующим законодательством доступ к такой информации может быть предоставлен только медицинским и фармацевтическим работникам. Нажимая «Согласен», вы подтверждаете, что являетесь медицинским или фармацевтическим работником и берете на себя ответственность за последствия, вызванные возможным нарушением указанного ограничения. Информация на данном сайте не должна использоваться пациентами для самостоятельной диагностики и лечения и не может быть заменой очной консультации врача.
Сайт использует файлы cookies для более комфортной работы пользователя. Продолжая просмотр страниц сайта, вы соглашаетесь с использованием файлов cookies, а также с обработкой ваших персональных данных в соответствии с Политикой конфиденциальности.
Как перенести химиотерапию?
Первый курс химиотерапии – как проходит, с какими эффектами можно столкнуться, чего ожидать? Рассказывает специалист
Что ожидать от химиотерапии? Как легко перенести химиотерапию? Эти вопросы закономерно возникают при приближении первого курса химиотерапии вместе с беспокойством и тревогой, потому что, во-первых, пациент не знает, чего ожидать, а во-вторых, потому что тема лечения онкологических заболеваний все еще табуирована сегодня и окружена множеством мифов и страшных домыслов. Поэтому в данной статье мы попытаемся рассказать, как проходит первая химиотерапия, каким будет состояние после первой химиотерапии и как легче ее перенести.
Как назначается химиотерапия?
Химиотерапевт при выборе схемы и препаратов учитывает многие факторы – это локализация злокачественного процесса, морфологические, иммуногистохимические и молекулярно-генетические характеристики опухоли. А также состояние самого пациента.
Мы назначаем и применяем самые современные режимы химиотерапии как в качестве самостоятельного метода, так и в составе комбинированного лечения при любых злокачественных опухолях: рак молочной железы, рак легкого, рак желудка, рак кишечника, рак поджелудочной железы, рак предстательной железы, рак яичников, рак шейки матки, рак эндометрия, рак почки, рак мочевого пузыря, меланома, опухоли головного мозга, опухоли головы и шеи, рак пищевода, саркомы, герминогенные опухоли, тимома, гепатоцеллюлярный рак, рак желчного пузыря.
Также на первичном приеме мы обязательно сориентируем, будет ли эффективна в вашем случае таргетная или иммунотерапия, и подробно расскажем о предстоящем лечении.
Первый курс химиотерапии
Противоопухолевое лечение может проводиться одним лекарством (монотерапия) или несколькими лекарствами (комбинированная химиотерапия или полихимиотерапия). Комбинированное лечение часто эффективнее, так как многие лекарства при взаимодействии усиливают действие друг друга. При полихимиотерапии уменьшается и возможность того, что опухолевые клетки станут нечувствительными к препаратам.
Как правило, химиотерапия проводится регулярно по определенной схеме, например, один раз в неделю в течение нескольких недель или один раз через каждые 3–4 недели. За этим последует период отдыха без лечения (обычно от одной недели до 3–4 недель), затем лечебный цикл начинается снова. Период отдыха позволяет здоровым тканям восстанавливаться, а пациенту – набраться сил.
Как легко перенести химиотерапию
Каждое лекарственное средство имеет собственный профиль фармакологического действия, расчет дозировки и конкретный способ введения. Разовая дозировка химиопрепарата рассчитывается на площадь тела или на килограмм веса пациента.
Если же побочные действия химиопрепаратов и реакции у пациента выражены, то мы используем целый арсенал препаратов для проведения дезинтоксикации и снятия всех нежелательных явлений.
Курс химиотерапии состоит из нескольких циклов, где цикл предполагает введение определенной комбинации препаратов — схемы в определенной дозе и с определенными интервалами, если необходим набор суммарной дозы. Так циклом считается введение препарата гемцитабин в 1-й, 8-й, 15-й дни, пять введений раз в неделю винорельбина или введение за один день сразу двух препаратов — циклофосфамида и доксорубицина.
Несколько таких циклов составляют курс или одну линию химиотерапии. Оптимальная длительность курса с числом циклов определяется в клинических исследованиях, где учитывается не только процент наилучших результатов, но и накопление токсичности, то есть кумулятивный эффект.
Как в фильмах не будет: что должен знать о химиотерапии каждый пациент
Химиотерапия — страшно и невыносимо. Об этом говорит нам медиапространство, и неудивительно, что из-за такой гиперболизации многие пациенты боятся ее едва ли не больше, чем самого заболевания. Однако ни один фильм и ни один роман не рассказывает, что это такое, как работает и насколько оправдан страх лекарственного лечения. Вместе с химиотерапевтом клиники «Луч» и научным сотрудником СПбКнПЦСВМП(о) Марией Степановой мы составили инструкцию для пациентов и разобрались, что такое лекарственная терапия и от чего зависит схема лечения.
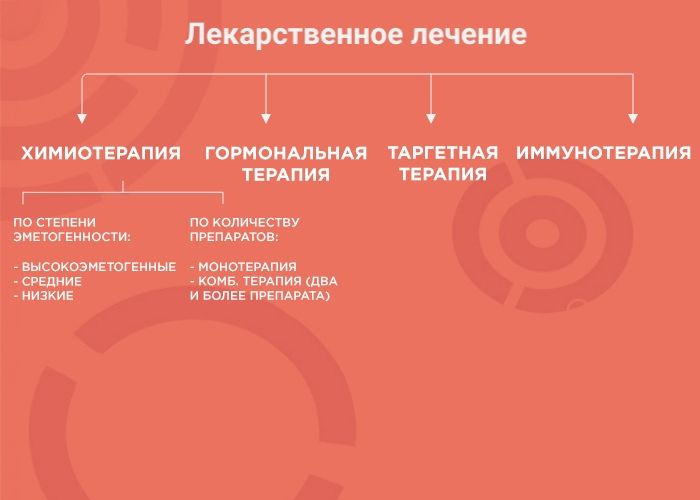
Что такое лекарственное лечение
Лекарственная терапия — один из вариантов лечения онкологических заболеваний. Ее возможности и эффективность зависят от типа злокачественного образования. В лекарственной терапии выделяется четыре вида: химиотерапия, наиболее изученный вид терапии; гормонотерапия; таргетная терапия (англ. target «цель, мишень») и иммунотерапия, самый молодой и мало изученный вид лечения. Чтобы понять, почему врач выбирает тот или иной вид терапии, давайте рассмотрим каждый из них более подробно.
Химиотерапия (ХТ)
Некоторые до сих пор ошибочно считают, что лекарственная терапия сводится исключительно к химиотерапии. Действительно, долгое время лекарственное лечение злокачественных опухолей отводилось цитостатикам, противоопухолевым препаратам, принцип действия которых — разрушение быстро делящихся клеток. В том числе — злокачественных.
— Для пациента, который беспокоится о выраженности тошноты важно знать, какие препараты входят в конкретно его схему лечения. Я всегда рассказываю об этом и при необходимости назначаю препараты для снижения побочных эффектов. Чаще всего это сочетание внутривенного и таблетированного вариантов противорвотных препаратов. Однако, плохое самочувствие может нагнать пациента уже дома, и тогда я обсуждаю это и назначаю препараты, которые он может принимать без надзора врача.
— Получается, как в фильмах бывает редко?
— Крайне редко! Конечно, мутить будет, и многие сравнивают это ощущение с токсикозом во время беременности. В таких случаях я рекомендую пить чай с имбирем, использовать жевательные резинки, карамель с кислым вкусом, соленые и кислые продукты.
При химиотерапии используют множество препаратов с разным механизмом действия, ориентированным под разные особенности опухоли. Поэтому врачи используют либо монотерапию (один препарат), либо комбинированное лечение (два и более препарата). Это позволяет усилить противоопухолевый эффект и уменьшить вероятность развития устойчивости опухоли к лечению.
Выделяют также чувствительные к ХТ опухоли (например, герминогенные опухоли, хорионкарциномы, лимфомы) и опухоли, малочувствительные к ХТ (меланома, некоторые виды сарком). Чтобы найти оптимальные варианты лечения для увеличения продолжительности жизни, сейчас активно ведутся клинические исследования о возможности комбинировать этот вид терапии с иммунотерапией.
Гормональная терапия (ГТ)
При гормональной терапии применяются препараты, подавляющие выработку в организме его естественных гормонов или их взаимодействие с рецепторами. Самый частый вариант опухоли, где применяется данный вариант лечения, — рак молочной железы (РМЖ). При выполнении иммуногистохимического (ИГХ) исследования и наличии положительных рецепторов эстрогена и/или прогестерона, оптимальной опцией лечения является гормонотерапия. С ее помощью, можно остановить опухолевый рост и даже добиться полного или частичного исчезновения опухоли.
— Особенность применения этих препаратов, в том что они в подавляющем случае в таблетированной форме и имеют приемлемую токсичность по сравнению с ХТ. Это позволяет пациентам совмещать лечение с работой, хобби и путешествиями.
Таргетная терапия (ТТ)
В отличие от ХТ таргетные (целенаправленные) препараты атакуют только опухолевые клетки. Опухоль для ТТ — своего рода мишень, уничтожение которой означает прекращение репликации (воспроизведения) клеток и метастазирования.
Все началось с того, что врачи отметили недостаточный эффект от цитостатиков и начали внедрять иммуногистохимические параметры. Иммуногистохимическое исследование (ИГХ) выявляет в образце ткани белки, специфичные для того или иного вида клеток. Это позволяет отличать один вид опухоли от другого и выявлять маркеры, которые отвечают за лекарственную чувствительность опухолевой ткани.
— Таргетная терапия начинается с немелкоклеточного рака легкого: в порыве клинических исследований врачи разработали препарат, который начали применять в рамках клинических исследований. Широкое использование Ирессы в клинической практике сопровождалось преимущественно разочарованиями, связанными с редкостью проявления лечебного эффекта. Загадка разрешилась достаточно быстро: анализ нуклеотидной последовательности гена EGFR, проведенный тремя независимыми исследовательскими коллективами, установил, что опухоли легких, характеризующиеся чувствительностью к Ирессе или Тарцеве, содержат мутированную форму этого рецептора. Таким образом, с 2009 года Ирессу внедрили в клиническую практику для пациентов имеющих мутацию в гене EGFR. Особенность механизма действия ТТ, заключается в блокировании мутации, в результате чего опухоль не может делиться, — поясняет Мария.
Побочные эффекты при таргетной терапии менее выражены, и пациенту чаще всего не нужно находиться в стационаре. Некоторые таргетные препараты используются в таблетированной форме, во время их приема качество жизни пациента значительно не страдает, и пациенты могут вести привычный образ жизни.
Иммунотерапия (ИТ)
Иммунотерапия — самая молодая отрасль лекарственного лечения. Существует несколько групп иммунопрепаратов с разными механизмами действия. Одни воздействуют на звено образования кровеносных сосудов в опухоли и блокируют их развитие (после чего опухоль перестает получать питание и погибает), а другие активируют и направляют иммунные силы организма на борьбу с опухолью. занимает много времени, имеет свой спектр побочных эффектов, а также требует внимания врачей и тщательной оценки динамики состояния пациента.
— По идее мы с помощью введения препаратов обучаем иммунную систему распознавать клетки опухоли и разрушать их. Это все равно что установить антивирус, — объясняет Мария.
Цели и оценка эффективности лекарственного лечения
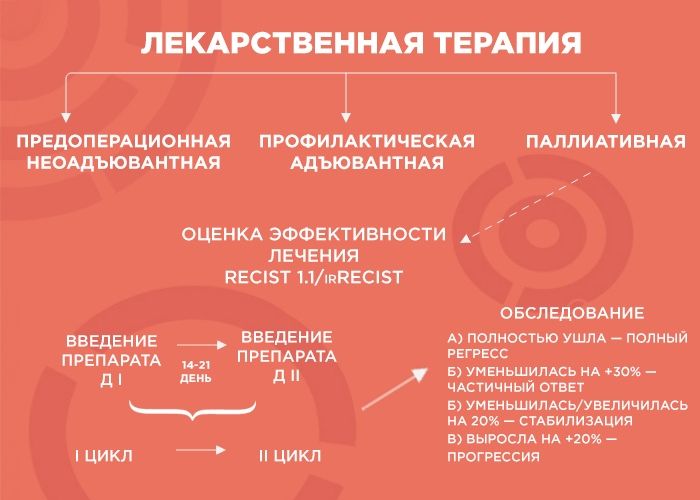
Лекарственная терапия бывает трех видов: предоперационная (неоадъювантная), профилактическая (адъювантная) и паллиативная (поддерживающая).
— Как проходит лечение в каждом из случаев?
— Начнем с предоперационной лекарственной терапии. Например, в отделение поступает пациент с диагнозом рак желудка. Результаты КТ показывают, что отдаленных метастатических очагов нет, однако в связи с распространением первичной опухоли операция на первом этапе невозможна. В этом случае лечение выглядит так: четыре курса терапии, затем — операция, а после нее — еще четыре курса адъювантной терапии. Зачем еще? Формально опухоль убрали, но есть риск возврата образования, и адъювантная терапия помогает его отсрочить.
Паллиативную терапию врач выбирает, когда хирургические методы бессильны (например, при отдаленных метастазах в легкие, печень, лимфоузлы и т.д.). Тогда лечение, в первую очередь, направлено на поддержание качества жизни пациента и контроль заболевания, и продолжительность лечения зависит от его эффекта. В химиотерапии врачи пользуются REСIST 1.1 — системой критериев оценки ответа опухоли на терапию, а в иммунотерапии — irRECIST.
— Объясню, как это работает, на примере пациента с опухолью толстой кишки и с множественными метастазами в печени и легких. Чтобы оценить серьезность ситуации, мы проводим обследование, выявляем наиболее измеряемые очаги и проводим два-три цикла химиотерапии. Большая часть курсов ХТ — введение препарата. Между первым введением и вторым — 14-21 дней — и этот временной промежуток называется циклом.
Далее мы смотрим и сравниваем. Если опухоль уменьшилась более чем на 30% — это частичный ответ, и нужно продолжать терапию до шести курсов. Если она ушла — это полный регресс, и тоже добавляем четыре курса, чтобы закрепить результат. Если опухоль увеличилась или уменьшилась на 20% — это стабилизация, мы делаем еще два курса и снова смотрим: если ситуация не изменилась, пациент отправляется на химиотерапевтические каникулы до прогрессирования заболевания, а потом схема повторяется.
Но если опухоль на фоне лечения выросла больше чем на 20% — мы имеем дело с прогрессией, вероятнее всего, это говорит нам об агрессивности опухоли. В этом случае я объясняю пациенту, что с ним происходит и почему мы меняем лечение.
— Как уговорить пациента на лечение?
— К каждому нужен индивидуальный подход. Я всегда говорю: «Химия может ухудшить ваше состояние, но бояться этого не стоит — мы попытаемся подобрать оптимальную симптоматическую терапию, которое уменьшит нежелательные явления». Если после этого во время лечения появятся данные о плохой переносимости, мы подумаем об уменьшении дозы цитостатика. Бывают случаи, когда я буквально уговариваю пациента пойти на терапию и объясняю ему, за что мы боремся. И объясняю это вне зависимости от серьезности случая — если при агрессивной опухоли человек настроен бороться до последнего, моя обязанность ему эту возможность дать.