высокая биодоступность что это
Биодоступность
Биодоступность (обозначают буквой F) в фармакокинетике и фармакологии — в широком смысле это количество лекарственного вещества, доходящее до места его действия в организме человека (способность препарата усваиваться). Биодоступность это главный показатель, характеризующий количество потерь, т.е. чем выше биодоступность лекарственного вещества, тем меньше его потерь будет при усвоении и использовании организмом.
Для изучения биодоступности лекарственных средств используют различные методы. Чаще всего проводят сравнительное изучение изменений концентраций лекарственного вещества в исследуемой и стандартной лекарственных формах в плазме крови и/или в моче.
Обычно биодоступность определяют по количеству лекарственного вещества в крови, то есть величине введенной дозы неизмененного лекарства, которая достигла системного кровообращения, и которая является одной из важнейших фармакокинетических характеристик лекарственного средства. При внутривенном введении биодоступность лекарства составляет 100 %. (Но и при этом биодоступность может быть уменьшена введением другого препарата). Если же данное вещество введено другими путями (например, перорально), то его биодоступность уменьшается, в результате его неполного всасывания и метаболизма, которому это лекарственное средство подвергается в результате первого прохождения.
Абсолютная биодоступность — это отношение биодоступности, определенной в виде площади под кривой «концентрация-время» (ППК) активного лекарственного вещества в системном кровотоке после введения путем, иным, чем внутривенный (перорально, ректально, чрезкожно, подкожно), к биодоступности того же самого лекарственного вещества, достигнутой после внутривенного введения. Количество лекарственного вещества, всосавшегося после невнутривенного введения, является лишь долей от того количества лекарства, которое поступило после его внутривенного введения.
Такое сравнение возможно лишь после проведения уподобления доз, если применяли разные дозы для разных путей введения. Из этого следует, что каждую ППК корректируют путем деления соответствующей дозы.
В целях определения величины абсолютной биодоступности некоторого лекарственного вещества проводят фармакокинетическое исследование с целью получения графика «концентрация лекарственного вещества по отношению ко времени» для внутривенного и невнутривенного введения. Другими словами, абсолютная биодоступность — это ППК для откорректированной дозы, когда ППК, полученное для невнутривенного введения, разделено на ППК после внутривенного введения (вв). Формула расчета показателя F для некоторого лекарственного вещества, введенного перорально(по), выглядит следующим образом.
Лекарство, введенное внутривенным путем, имеет величину биодоступности, равную 1 (F=1), тогда как лекарственное вещество, введенное другими путями, имеет величины абсолютной биодоступности меньше единицы.
Относительная биодоступность — это ППК определенного лекарства, сравнимая с другой рецептурной формой этого же лекарства, принятой за стандарт, или введенной в организм другим путем. Когда стандарт представляет внутривенно введенный препарат, мы имеем дело с абсолютной биодоступностью.
Для определения относительной биодоступности могут использоваться данные об уровне содержания лекарственного вещества в крови или же его экскреции с мочой после одноразового или многократного введения. Достоверность полученных результатов значительно увеличивается при использовании перекрестного метода исследования, так как при этом устраняются различия, связанные с влиянием физиологического и патологического состояния организма на биодоступность лекарственного вещества.
Факторы, которые влияют на биодоступность. Абсолютная биодоступность некоторого лекарственного средства, введенная несосудистым путем, обычно меньше единицы (F ‹ 1,0). Разные физиологические факторы уменьшают биодоступность лекарств до их попадания в системный кровоток. К числу таких факторов относятся:
Индуцирование ферментами проявляется в виде увеличения скорости метаболизма, напр., фенитоин (противоэпилептический препарат) индуцирует цитохромы CYP1A2, CYP2C9,CYP2C19 и CYP3A4.
Ингибирование ферментами характеризуется снижением скорости метаболизма. Напр., грейпфрутовый сок угнетает функцию CYP3A → это сопровождается повышением концентрации нифедипина.
Индивидуальные вариации различий в метаболизме
Каждый из перечисленных факторов может вариировать от больного к больному (межиндивидуальная вариабельность) и даже у одного и того же больного за определенный период времени (внутрииндивидуальная вариабельность). Существуют и другие влияния. Так, поступило ли лекарство во время приема пищи или вне его, повлияет на всасывание препарата. Лекарственные средства, принятые одновременно, могут изменить всасывание и метаболизм в результате первичного прохождения. Кишечная моторика меняет скорость растворения лекарства и влияет на темп его разрушения кишечной микрофлорой. Болезненные состояния, влияющие на метаболизм в печени или функцию желудочно-кишечного тракта, также привносят свой вклад.
Относительная биодоступность весьма чувствительна к характеру лекарственной формы и применяется для характеристики биоэквивалентности двух лекарственных препаратов, как это видно из соотношения Исследование/Стандарт в ППК. Максимальная концентрация лекарственного препарата, достигнутая в плазме или сыворотке (Cmax) обычно используется для характеристики биоэквивалентности.
Биодоступность железа и влияние ионов кальция на ее эффективность
Содержание железа в организме человека составляет в среднем 4,2 г. Около 75% от его общего количества входит в состав гемоглобина эритроцитов, которые переносят кислород от легких к тканям
Содержание железа в организме человека составляет в среднем 4,2 г. Около 75% от его общего количества входит в состав гемоглобина эритроцитов, которые переносят кислород от легких к тканям, 20% железа является резервным (костный мозг, печень, макрофаги), 4% входит в состав миоглобина, около 1% содержится в дыхательных ферментах, катализирующих процессы дыхания в клетках и тканях, а также в других ферментативных структурах. Железо осуществляет свою биологическую функцию, находясь в составе биологически активных соединений, преимущественно ферментов. Железосодержащие ферменты выполняют следующие основные функции:
Железо обладает несколькими особыми свойствами, которые отличают его от других биологически активных ионов и веществ.
В организме человека нет никаких специальных механизмов для выведения железа. В основном железо выделяется через кожу и кишечник (I. Guinote et al., 2006). Кроме этого, оно теряется также с волосами, ногтями, мочой и потом. Общее количество выделяемого железа у здорового человека (мужчины) составляет около 1 мг в сутки. Такое же количество в норме усваивается из потребляемой пищи (Linder, 1991). Отличие составляет менструальный период, когда потребление должно составлять около 4 мг железа в день. Таким образом, концентрация элемента в сыворотке крови зависит от его всасывания в желудочно-кишечном тракте, от накопления в селезенке, костном мозге и скелетных мышцах (миоглобин), а также от синтеза и распада гемоглобина и выделения его из организма. В пище железо может присутствовать в двух видах — гемовое и негемовое, которые характеризуются разными механизмами всасывания. Гемовое железо (порфириновое кольцо с атомом железа в центре, связанное с 4 атомами азота) в желудочно-кишечном тракте освобождается от белковых цепей и в виде металлопорфирина всасывается энтероцитами кишечника. Там происходит неспецифическое эндосомальное проникновение гема в клетку с последующим его разрушением. Далее, с помощью белковой транспортной системы IREG1, ионы железа окисляются до трехвалентного железа, связываются с трансферрином и покидают энтероцит, выходя в ток крови (Linder et al., 2006). В плазме крови железо перемещается в соединении с этим же белком, который выполняет как функцию депо, так и функцию переносчика. Наличие свободных ионов железа в крови не характерно и является патологией. Всасывание гемового железа происходит в пределах 15–50% (в среднем 20–30%).
В литературе описывается несколько механизмов транспортировки железа внутри энтероцита, основанные главным образом на экспериментах, проведенных на культуре ткани Caco2 (M. Linder et al., 2006). Согласно первой теории, двухвалентное железо, поступившее в энтероцит с помощью транспортера DMT1, доставляется посредством везикул с трансферрином (некоторые отводят ему роль внутриклеточного рецептора) или в свободном состоянии к базолатеральной мембране энтероцита, где присутствует другой транспортер — IREGI/ferroportin/MTP1 (Donovan et al., 2000). Этот транспортер окисляет двухвалентное железо до трехвалентного и транспортирует в кровь, где он соединяется с плазменным трансферрином. Согласно второй теории, внутри энтероцита железо транспортируется, по-видимому, в везикулах вместе с апотрансферрином, который путем эндоцитоза попадает из тока крови в энтероцит (эндо-/экзоцитоз) (Ma et al., 2002). Во время этой транспортировки двухвалентное железо окисляется до трехвалентного и путем экзоцитоза поступает через базилярную мембрану энтероцита в кровь. В этом процессе возможно участие уже упоминавшейся системы IREG. Согласно литературным данным, именно механизм транспорта железа через базолатеральную мембрану энтероцита в кровь является лимитирующим в процессе адсорбции железа (Roy and Enns, 2000). Усвоение неорганического двухвалентного железа обычно происходит в пределах 6–15%.
Негемовое трехвалентное железо может быть восстановлено с помощью ферриредуктазы до двухвалентного железа и усвоено с помощью DMT1. Восстановление трехвалентного железа сильно зависит от кислотности желудочного сока. Невосстановленное железо может всасываться с помощью специфической интегрин-мобифериновой системы IMP. Усвоение трехвалентного железа происходит наименее полно и редко превосходит 4%.
Количество железа, поступающего в эффекторную клетку, куда оно транспортируется с кровью, прямо пропорционально числу мембранных рецепторов. В клетке происходит высвобождение железа из трансферрина. Затем плазменный апотрансферрин возвращается в циркуляцию. Повышение потребности клеток в железе при их быстром росте или синтезе гемоглобина ведет к индукции биосинтеза рецепторов трансферрина и, напротив, при повышении запасов железа в клетке число рецепторов на ее поверхности снижается. Железо, высвободившееся из трансферрина внутри клетки, связывается с ферритином, который доставляет микроэлемент в митохондрии, где он включается в состав гема. Помимо синтеза гема, двухвалентное железо используется в митохондриях для синтеза железосерных центров. В организме человека происходит постоянное перераспределение железа. В количественном отношении наибольшее значение имеет метаболический цикл: плазма — красный костный мозг — эритроциты — плазма. Обычно 70% плазменного железа поступает в костный мозг. За счет распада гемоглобина в сутки высвобождается около 21–24 мг железа, что во много раз превышает поступление железа из пищеварительного тракта (1–2 мг/сут).
Существует выраженная обратная зависимость между обеспеченностью организма железом и его всасыванием в пищеварительном тракте. В основном всасывание железа происходит в двенадцатиперстной кишке и проксимальных отделах тощей кишки и отсутствует в подвздошной кишке.
Всасывание железа зависит от следующих причин: возраста, обеспеченности организма железом, состояния желудочно-кишечного тракта, количества и химических форм поступающего железа и прочих компонентов пищи. Для оптимального всасывания железа необходима нормальная секреция желудочного сока. Прием соляной кислоты способствует усвоению железа при ахлоргидрии. В таблице приведены основные вещества, содержащиеся в продуктах питания человека, которые могут активизировать или уменьшать всасывание железа, содержащегося в этих продуктах или мультивитаминной таблетке. Аскорбиновая кислота, восстанавливающая железо и образующая с ним хелатные комплексы, повышает доступность этого элемента так же, как и другие органические кислоты. Она является одним из наиболее сильных стимуляторов всасывания железа. Другим компонентом пищи, повышающим всасывание железа, является «фактор животного белка», в котором содержится миоглобин и гемоглобин. Улучшают всасывание железа простые углеводы: лактоза, фруктоза, сорбит, а также такие аминокислоты, как гистидин, лизин, цистеин, образующие с железом легковсасываемые хелаты.
Самыми сильными ингибиторами, блокирующими всасывание железа, являются фитаты и полифенолы. Фитаты представляют собой форму хранения фосфатов и минералов, присутствующих в зернах злаковых растений, овощах, семенах и орехах. Они активно тормозят всасывание железа, действуя при этом в прямой зависимости от дозы. Всасывание железа снижают такие напитки, как чай, содержащий таннин, а также другие полифенольные соединения, которые прочно связывают этот элемент. Феноловые соединения существуют почти во всех растениях и являются частью системы защиты против насекомых и животных. Поэтому чай применяют для профилактики повышенного усвоения железа у больных талассемией. Большое влияние на усвоение железа оказывают различные заболевания. Оно усиливается при недостаточности железа, при анемиях (гемолитической, апластической, пернициозной), гиповитаминозе В6 и гемохроматозе, что объясняется повышением эритропоэза, истощением запасов железа и гипоксией.
Из перечисленных веществ, которые могут уменьшать всасывание железа, особое внимание обращает на себя ион кальция. Кальций обладает высокой биологической активностью, в значительном количестве содержится в основных продуктах питания и, как правило, присутствует в одной мультивитаминной таблетке с железом.
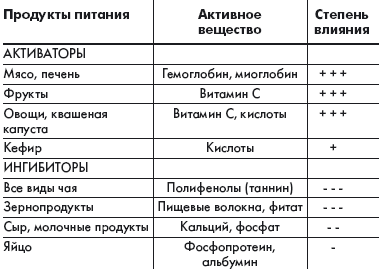 |
| Таблица. Активаторы и ингибиторы всасывания железа, содержащиеся в пищевом рационе человека |
В связи с этим вопрос о возможном влиянии кальция на биодоступность железа изучается длительное время как в экспериментах на животных, так и в исследованиях на людях.
Необходимо отметить, что клеточные механизмы всасывания, т. е. поступления ионов железа и кальция из просвета кишечника в ток крови через энтероциты кишечника, различны. Многочисленными работами было показано, что в этом процессе участвуют различные клеточные транспортеры (J. Hoenderop et al., 2005). Кроме того, имеются данные о том, что кальций уменьшает поступление в организм как гемового (L. Hallberg, 1991), так и негемового железа. Все вместе указывает на то, что кальций может влиять на биодоступность железа, оказывая ингибирующее влияние либо на транспорт его в желудочно-кишечном тракте, либо на связывание с рецепторами, расположенными на апикальной мембране энтероцитов.
В экспериментах на изолированный кишечной петле в условиях in vivo на крысах было показано уменьшение всасывания железа из раствора FeCl2, вводимого непосредственно в петлю при добавлении кальция. Причем эффект зависел от абсолютной концентрации кальция в двенадцатиперстной кишке, а не от молярного соотношения Ca/Fe (Barton et al., 1983). Изучение влияния на клеточный транспорт железа различных солей, содержащих кальций, показало, что наибольший ингибирующий эффект вызывает СаСО3, в то время как эффекты СаSO4 и Na2CO3 присутствуют, но в меньшей степени (Prather, 1992). Эта кальциевая соль, добавленная в количестве 500 мг, способна уменьшить всасывание негемового железа, содержащегося в пищевых продуктах на 32% в случае потребления пищи, не содержащей дополнительные ингибирующие вещества, и на 42% при потреблении продуктов в сочетании с яйцами, кофе и др. (Сook et al., 1991). СaCO3 уменьшает также всасывание железа при совместном использовании их в одной таблетке. В этом случае 300 мг кальциевой соли при совместном употреблении с 37 мг железа, присутствующего в виде FeSO4, уменьшает всасывание железа на 15% (Seligman et al., 1983; Cook et al., 1991).
930 мг кальция в день). Это привело к снижению абсорбции железа на 30–50% (Hallberg, 1995). На основании полученных данных авторы предполагают, что ингибирование всасывания железа происходит на этапе «просвет кишечника — энтероцит».
В исследованиях на людях также изучалось влияние искусственных минеральных добавок: сульфата железа, цитрата и фосфата кальция и др. Работа была проведена на 61 здоровом испытуемом. Для оценки всасывания использовался также двойной радиоизотопный метод. При употреблении цитрата кальция (600 мг) абсорбция железа снижалась на 49%, фосфата — на 62% (Cook et al., 1991). Интересно, что в этом исследовании эффект от применения кальциевых добавок отмечался только на фоне употребления пищи. Вероятно, конкуренция между катионами возникала при заполненном кишечнике. Теоретически возможно, что высокие концентрации кальция могут изменять реологические свойства пищевого комка в просвете верхней части тонкого кишечника (Conrad et al., 1993). На людях также изучалось различие во влиянии кальция на потребление гемового и негемового железа. Так, в исследованиях на 27 добровольцах с применением полного промывания кишечника для измерения степени усвоения железа при использовании кальциевых добавок (450 мг) было показано снижение абсорбции только гемового железа на 20%. В этой работе добавление кальция не влияло на абсорбцию негемового железа (Z. K. Roughead, 2005). В другом исследовании, проведенном на 44 мужчинах и 81 женщине, наблюдали снижение всасывания гемового железа из рациона при добавлении кальция в дозах от 40 до 300 мг. Максимальное снижение наблюдалось при дозе 300 мг и составило 74%. Дальнейшее увеличение содержания кальция до 600 мг не приводило к возрастанию ингибирования иона железа (L. Hallberg et al., 1991). Противоречивые результаты, получаемые в разных работах, связаны, по-видимому, со сложностью воспроизведения точности методических подходов, проводимых на людях.
Во всех приведенных выше исследованиях было показано в той или иной мере уменьшение абсорбции железа в желудочно-кишечном тракте на 20–60% при совместном употреблении с кальцийсодержащими продуктами в ходе однократного приема пищи или таблетированных препаратов. Характерно, что использованные дозы кальция не превышали дневную норму взрослого человека (во всех описанных случаях суммарное поступление кальция за сутки было меньше 1000 мг). Однако непосредственный механизм антагонистического влияния кальция на всасывание железа остается неясным.
Серия исследований, проведенных на добровольцах при длительном совместном приеме пищи, содержащей определенное количество железа и кальция, не позволила получить однозначного ответа о влиянии иона кальция на биодоступность железа, а главное — на уровень гемоглобина у этих испытуемых. Часто эффект выявлялся (ингибирование составляет 19%), но был статистически недостоверен (Reddy et al., 1997). По-видимому, длительные исследования на людях осложняются контролем над соблюдением диеты и составлением диеты для контрольной группы (S. R. Lynch, 2000).
Анализ литературы позволяет заключить, что экспериментальные исследования на животных и работы, проведенные на испытуемых, подтвердили, что ионы кальция способны уменьшать уровень всасывания железа. Степень выявления эффекта зависела от используемых методических подходов, которые в разных работах отличались друг от друга, и это затрудняет интерпретацию результатов. Однако возможность таких взаимодействий может быть наиболее актуальна и должна безусловно учитываться для людей, страдающих железодефицитными состояниями (анемии) или входящих в группу риска по этому состоянию (дети, беременные и т. д.). Для лечения и профилактики таких состояний необходимо увеличить потребление железа, как за счет соблюдения соответствующей диеты, так и с помощью минеральных добавок. Но следует помнить, что эффективность этих мер может значительно снижаться на фоне потребления диетического кальция или кальцийсодержащих витаминных комплексов. Ограничивать потребление кальция не желательно, поскольку во многих случаях (беременность, возраст 12–18 лет) существует повышенная потребность в обоих элементах. Выходом из ситуации может служить раздельное применение кальция и железа. Экспериментальные данные показали, что интервал между приемом кальция и железа даже в 4 ч исключает эффект ингибирования (A. Gleeprup et al., 1993). Помимо этого, во время приема препарата железа стоит воздержаться от употребления любых продуктов, содержащих кальций, т. е. требуется исключить весь спектр молочной продукции, а также зеленые части растений.
В данном случае удобно применять витаминно-минеральные комплексы, которые заранее предусматривают раздельное употребление железа и кальция. И это не единственное сочетание жизненно важных микронутриентов, проявляющих антагонистические свойства. Таким образом, грамотное разделение компонентов витаминно-минеральных комплексов по времени приема является необходимым условием эффективности их применения.
Литература
Н. А. Медведева, доктор биологических наук, профессор
МГУ, Москва
Фармакокинетика ингаляционных глюкокортикостероидов
Ингаляционные глюкокортикостероиды (ИГКС) являются средствами первой линии, которые применяются для длительного лечения больных бронхиальной астмой (БА) [2, 10]. Они эффективно блокируют воспалительный процесс в дыхательных путях, а клиническим проявлени
К препаратам для местного ингаляционного применения относятся флунизолид (ингакорт), триамцинолона ацетонид (ТАА) (азмакорт), беклометазон дипропионат (БДП) (бекотид, бекломет) и препараты современной генерации: будесонид (пульмикорт, бенакорт), флютиказона пропионат (ФП) (фликсотид), мометазона фуроат (МФ) и циклезонид. Для ингаляционного применения выпускаются препараты в виде аэрозолей, сухой пудры с соответствующими устройствами для их применения, а также растворы или суспензии для использования с помощью небулайзеров
В связи с тем что существует множество устройств для ингаляций ИГКС, а также из-за недостаточного умения больных пользоваться ингаляторами необходимо учесть, что количество ИГКС, доставляемого в дыхательные пути в виде аэрозолей или сухой пудры, определяется не только номинальной дозой ГКС, но и характеристикой устройства для доставки препарата — типом ингалятора, а также техникой ингаляции больного [20].
Несмотря на то что ИГКС оказывает местное воздействие на дыхательные пути, существуют разноречивые сведения о проявлении нежелательных системных эффектов (НЭ) ИГКС, от их отсутствия и до выраженных проявлений, представляющих риск для больных, особенно для детей [23]. К таким НЭ необходимо отнести подавление функции коры надпочечников, воздействие на метаболизм костной ткани, кровоподтеки и утончение кожи, образование катаракты [3].
Проявления же системных эффектов преимущественно определяются фармакокинетикой препарата и зависят от общего количества ГКС, поступающего в системный кровоток (системная биодоступность, F) и величины клиренса ГКС. Исходя из этого можно предположить, что выраженность проявлений тех или иных НЭ зависит не только от дозировки, но и, в большей степени, от фармакокинетических свойств препаратов.
Поэтому основным фактором, определяющим эффективность и безопасность ИГКС, является селективность препарата по отношению к дыхательным путям — наличие высокой местной противовоспалительной активности и низкой системной активности (табл. 1).
 |
| Таблица 1. Селективность ИГКС |
В клинической практике ИГКС отличаются между собой по величине терапевтического индекса, представляющего собой отношение между выраженностью клинических (желательных) эффектов и системных (нежелательных) эффектов [3], поэтому при высоком терапевтическом индексе имеет место лучшее соотношение эффект/риск.
Биодоступность
ИГКС быстро всасываются в желудочно-кишечном тракте и дыхательных путях. На абсорбцию ГКС из легких могут оказывать влияние размеры ингалируемых частиц, так как частицы размером менее 0,3 ммк откладываются в альвеолах и всасываются в легочный кровоток [14].
При вдыхании аэрозолей из дозированных ингаляторов через спейсер с большим объемом (0,75 л — 0,8 л) увеличивается процент доставки препарата в периферические дыхательные пути (5,2%). При использовании дозированных ингаляторов с аэрозолями или сухой пудры ГКС через дискахалер, турбухалер и другие устройства только 10—20% ингалированной дозы откладывается в дыхательных путях, при этом до 90% дозы откладывается в ротоглоточной области и проглатывается [8]. Далее эта часть ИГКС, абсорбируясь из желудочно-кишечного тракта, попадает в печеночный кровоток, где большая часть препарата (до 80% и более) инактивируется [19]. В системный кровоток ИГС поступают преимущественно в виде неактивных метаболитов, за исключением активного метаболита БДП — беклометазона 17-монопропионата (17-БМП) (приблизительно 26%), и только незначительная часть (от 23% ТАА до менее 1% ФП) — в виде неизмененного препарата. Поэтому системная оральная биодоступность (Forа1) у ИГКС очень низка, она практически равна нулю.
Однако следует учесть, что часть дозы ИГКС [примерно 20% номинально принятой, а в случае БДП (17-БМП) — до 36%], поступая в дыхательные пути и быстро абсорбируясь, попадает в системный кровоток. Более того, эта часть дозы может вызывать внелегочные системные НЭ, особенно при назначении высоких доз ИГКС, причем здесь немаловажное значение отводится типу используемого ингалятора с ИГКС, так как при вдыхании сухой пудры будесонида через турбухалер легочное отложение препарата увеличивается в 2 раза и более по сравнению с ингаляцией из дозированных аэрозолей [21].
Таким образом, высокий процент отложения препарата во внутрилегочных дыхательных путях в норме дает лучший терапевтический индекс для тех ИГКС, которые имеют низкую системную биодоступность при оральном пути введения. Это относится, например, к БДП, имеющему системную биодоступность за счет кишечной абсорбции, в отличие от будесонида, обладающего системной биодоступностью преимущественно за счет легочной абсорбции [24].
Для ИГКС с нулевой биодоступностью после пероральной дозы (флютиказон), характер устройства и техника проведения ингаляции определяют только эффективность лечения, но не влияют на терапевтический индекс [5].
Поэтому при оценке системной биодоступности необходимо учитывать общую биодоступность, то есть не только низкую оральную (почти нулевую у флютиказона и 6—13% у будесонида), но и ингаляционную биодоступность, средние величины которых колеблются в пределах от 20 (ФП) до 39% (флунизолид) (табл. 2) [8].
Для ИГКС с высокой фракцией ингаляционной биодоступности (будесонид, ФП, БДП) системная биодоступность может возрастать при наличии воспалительных процессов в слизистой бронхиального дерева. Это было установлено при сравнительном исследовании системных эффектов по уровню снижения кортизола в плазме крови после однократного назначения будесонида и БДП в дозе 2 мг в 22 ч здоровым курящим и некурящим лицам [24]. Следует отметить, что после ингаляции будесонида уровень кортизола у курящих был на 28% ниже, чем у некурящих.
Это позволило сделать вывод о том, что при наличии воспалительных процессов в слизистой дыхательных путей при астме и хроническом обструктивном бронхите может измениться системная биодоступность тех ИГКС, которые имеют легочную абсорбцию (в данном исследовании это будесонид, но не БДП, имеющий кишечную абсорбцию).
Большой интерес вызывает мометазона фуроат (МФ), новый ИГКС с очень высокой противовоспалительной активностью, у которого отсутствует биодоступность. Существует несколько версий, объясняющих этот феномен. Согласно первой из них, 1 МФ из легких не сразу попадает в системный кровоток, подобно будесониду, длительно задерживающемуся в дыхательных путях из-за образования липофильных конъюгатов с жирными кислотами. Это объясняется тем, что МФ имеет высоколипофильную группу фуроат в позиции С17 молекулы препарата, в связи с чем он поступает в системный кровоток медленно и в количествах, недостаточных для определения. Согласно второй версии, МФ быстро метаболизируется в печени. Третья версия гласит: агломераты лактоза-МФ обусловливают низкую биодоступность из-за снижения степени растворимости. Согласно четвертой версии, МФ быстро метаболизируется в легких и потому при ингаляции не достигает системной циркуляции. И наконец, предположение, что МФ не поступает в легкие, не находит подтверждения, так как имеются данные о высокой эффективности МФ в дозе 400 мкг у больных с астмой. Поэтому первые три версии могут в какой-то степени объяснять факт отсутствия биоступности у МФ, однако этот вопрос требует дальнейшего изучения [1].
Таким образом, системная биодоступность ИГКС представляет собой сумму ингаляционной и оральной биодоступности. У флунизолида и беклометазона дипропионата системная биодоступность составляет примерно 60 и 62% соответственно, что несколько превышает сумму оральной и ингаляционной биодоступности других ИГКС.
В последнее время был предложен новый препарат ИГКС — циклезонид, оральная биодоступность которого практически равна нулю [23]. Это объясняется тем, что циклезонид является пролекарством, его афинность по отношению к ГКС-рецепторам почти в 8,5 раза ниже, чем у дексаметазона. Однако, попадая в легкие, молекула препарата подвергается действию ферментов (эстераз) и переходит в свою активную форму (афинность активной формы препарата в 12 раз выше, чем у дексаметазона). В связи с этим циклезонид лишен целого ряда нежелательных побочных реакций, связанных с попаданием ИГКС в системный кровоток.
Связь с белками плазмы крови
ИГКС имеют довольно высокую связь с белками плазмы крови (табл. 2); у будесонида и флютиказона эта связь несколько выше (88 и 90%) по сравнению с флунизолидом и триамцинолоном — 80 и 71% соответственно. Обычно для проявления фармакологической активности лекарственных средств большое значение имеет уровень свободной фракции препарата в плазме крови. У современных более активных ИГКС — будесонида и ФП она составляет 12 и 10% соответственно, что несколько ниже, чем у флунизолида и ТАА — 20 и 29%. Эти данные могут свидетельствовать о том, что в проявлении активности будесонида и ФП, кроме уровня свободной фракции препаратов, большую роль играют и другие фармакокинетические свойства препаратов [13].
Объем распределения
Объем распределения (Vd) ИГКС указывает на степень внелегочного тканевого распределения препарата. Большой Vd свидетельствует о том, что более значительная часть препарата распределяется в периферических тканях. Однако большой Vd не может служить показателем высокой системной фармакологической активности ИГКС, так как последняя зависит от количества свободной фракции препарата, способной вступать в связь с ГКР. На уровне равновесной концентрации наибольший Vd, во много раз превышающий этот показатель у других ИГКС, выявлен у ФП (12,1 л/кг) (табл. 2); в данном случае это может указывать на высокую липофильность ФП.
Липофильность
Фармакокинетические свойства ИГКС на уровне тканей преимущественно определяются их липофильностью, являющейся ключевым компонентом для проявления селективности и времени задержки препарата в тканях. Липофильность увеличивает концентрацию ИГКС в дыхательных путях, замедляет их высвобождение из тканей, увеличивает сродство и удлиняет связь с ГКР, хотя до сих пор не определена грань оптимальной липофильности ИГКС [6].
В наибольшей степени липофильность проявляется у ФП, далее у БДП, будесонида, а ТАА и флунизолид являются водорастворимыми препаратами [11]. Высоколипофильные препараты — ФП, будесонид и БДП — быстрее абсорбируются из респираторного тракта и дольше задерживаются в тканях дыхательных путей по сравнению с неингаляционными ГКС — гидрокортизоном и дексаметазоном, назначаемыми ингаляционно. Этим фактом, возможно, и объясняется относительно неудовлетворительная антиастматическая активность и селективность последних [7, 18]. О высокой селективности будесонида свидетельствует тот факт, что его концентрация в дыхательных путях через 1,5 ч после ингаляции 1,6 мг препарата оказывается в 8 раз выше, чем в плазме крови, и это соотношение сохраняется на протяжении 1,5—4 ч после ингаляции [26]. Другое исследование [13] выявило большое распределение ФП в легких, так как через 6,5 ч после приема 1 мг препарата обнаруживалась высокая концентрация ФП в ткани легких и низкая в плазме, в отношении от 70:1 до 165:1.
Поэтому логично предположить, что более липофильные ИГКС могут откладываться на слизистой дыхательных путей в виде «микродепо» препаратов, что позволяет продлить их местный противовоспалительный эффект, так как для растворения кристаллов БДП и ФП в бронхиальной слизи требуется более 5—8 ч, тогда как для будесонида и флунизолида, имеющих быструю растворимость, этот показатель составляет 6 мин и менее 2 мин соответственно [11]. Было показано, что водорастворимость кристаллов, обеспечивающая растворимость ГКС в бронхиальной слизи, является важным свойством в проявлении местной активности ИГКС [11].
Другим ключевым компонентом для проявления противовоспалительной активности ИГКС является способность препаратов задерживаться в тканях дыхательных путей. В исследованиях in vitro, проведенных на препаратах легочной ткани, показано, что способность ИГКС задерживаться в тканях довольно тесно коррелирует с липофильностью. У ФП и беклометазона она выше, чем у будесонида, флунизолида и гидрокортизона [11]. В то же время в исследованиях in vivo показано, что на слизистой трахеи крыс будесонид и ФП задерживались дольше по сравнению с БДП [9, 17], причем будесонид задерживался дольше, чем ФП [17]. В первые 2 ч после интубации будесонидом, ФП, БДП и гидрокортизоном высвобождение радиоактивной метки (Ra-метки) из трахеи у будесонида было замедленным и составляло 40% против 80% у ФП и БДП и 100% у гидрокортизона. В последующие 6 ч наблюдалось дальнейшее увеличение высвобождения будесонида на 25% и БДП на 15%, в то время как у ФП дальнейшего увеличения высвобождения Ra-метки не отмечалось [18]
Эти данные противоречат общепринятому мнению о наличии корреляции между липофильностью ИГКС и их способностью к тканевой связи, так как менее липофильный будесонид задерживается дольше, чем ФП и БДП. Данный факт следует объяснить тем, что под действием ацетил-коэнзима А и аденозина трифосфата гидроксильная группа будесонида у атома углерода в положении 21 (С-21) замещается сложным эфиром жирных кислот, то есть происходит эстерификация будесонида с образованием конъюгатов будесонида с жирными кислотами. Этот процесс протекает внутриклеточно в тканях легких и дыхательных путей и в печеночных микросомах, где идентифицированы эфиры жирных кислот (олеаты, пальмитаты и др.) [25]. Конъюгация будесонида в дыхательных путях и легких происходит быстро, так как уже через 20 мин после применения препарата 70—80% Ra-метки определялось в виде конъюгатов и 20—30% — в виде интактного будесонида, тогда как через 24 ч определялось только 3,2% конъюгатов первоначального уровня конъюгации, причем в одинаковой пропорции они были выявлены в трахее и в легких, что свидетельствует об отсутствии неопределенных метаболитов [18]. Конъюгаты будесонида имеют очень низкое сродство к ГКР и потому не обладают фармакологической активностью [28].
Внутриклеточная конъюгация будесонида с жирными кислотами может происходить во многих типах клеток, будесонид может накапливаться в неактивной, но обратимой форме. Липофильные конъюгаты будесонида образуются в легких в тех же пропорциях, что и в трахее, что указывает на отсутствие неидентифицированных метаболитов [27]. Конъюгаты будесонида не определяются в плазме и в периферических тканях.
Конъюгированный будесонид гидролизируется внутриклеточными липазами, постепенно высвобождая фармакологически активный будесонид, что может удлинить сатурацию рецептора и пролонгировать глюкокортикоидную активность препарата.
 |
| Таблица 3. Липофильность ИГКС и конъюгатов будесонида |
Если будесонид приблизительно в 6—8 раз менее липофилен, чем ФП, и, соответственно, в 40 раз менее липофилен по сравнению с БДП, то липофильность конъюгатов будесонида с жирными кислотами в десятки раз превышает липофильность интактного будесонида (табл. 3), чем и объясняется длительность его пребывания в тканях дыхательных путей [18].
Исследования показали, что эстерификация жирной кислотой будесонида приводит к пролонгированию его противовоспалительной активности. При пульсирующем назначении будесонида было отмечено удлинение ГКС-эффекта, в отличие от ФП. В то же время в исследовании in vitro при постоянном присутствии ФП оказался в 6 раз эффективнее будесонида [27]. Возможно, это объясняется тем, что ФП легче и быстрее извлекается из клеток, чем более конъюгированный будесонид, в результате чего примерно в 50 раз снижается концентрация ФП и, соответственно, его активность [27]).
 |
| Таблица 4. Корреляция между сродством ГКС и их метаболитов к ГКР и степенью подавления отека (параметры дексаметазона приняты за 1,0) |
Таким образом, после ингаляции будесонида в дыхательных путях и легких образуется «депо» неактивного препарата в виде обратимых конъюгатов с жирными кислотами, что может удлинить его противовоспалительную активность. Это, несомненно, имеет огромное значение для лечения больных БА. Что касается БДП, более липофильного, чем ФП (табл. 4), то время его задержки в тканях дыхательных путей короче, чем у ФП, и совпадает с этим показателем у дексаметазона, что является, по-видимому, результатом гидролиза БДП до 17-БМП и беклометазона, липофильность последнего и дексаметазона одинаковы [18]. Более того, в исследовании in vitro [18] длительность пребывания Ra-метки в трахее после ингаляции БДП была больше, чем после его перфузии, что связано с очень медленным растворением кристаллов БДП, откладываемых в респираторных просветах во время ингаляции [11].
Продолжительное фармакологическое и терапевтическое действие ИГКС объясняется связью ГКС с рецептором и образованием комплекса ГКС+ГКР. Вначале будесонид связывается с ГКР медленнее, чем ФП, но быстрее, чем дексаметазон, однако через 4 ч разница в общем количестве связи с ГКР между будесонидом и ФП не обнаруживалась, в то время как у дексаметазона она составляла только 1/3 от связанной фракции ФП и будесонида.
Диссоциация рецептора из комплекса ГКС+ГКР отличалась у будесонида и ФП, будесонид по сравнению ФП диссоцируется быстрее из комплекса. Длительность комплекса будесонид+рецептор in vitro составляет 5—6 ч, этот показатель ниже по сравнению с ФП (10 ч) и 17-БМП (8 ч) [12], но более высок по сравнению с дексаметазоном [18]. Из этого следует, что различия в местной тканевой связи будесонида, ФП, БДП не определяются на уровне рецепторов, а преимущественное влияние на разницу показателей оказывают различия в степени неспецифической связи ГКС с клеточными и субклеточными мембранами.
Как было показано выше (табл. 2), наибольшее сродство к ГКР имеет ФП (приблизительно в 20 раз выше, чем у дексаметазона, в 1,5 раза выше, чем у 17-БМП, и в 2 раза выше, чем у будесонида) [8]. На сродство ИГКС к ГКС-рецептору может оказать влияние и конфигурация молекулы ГКС. Например, у будесонида его право- и левовращающие изомеры (22R и 22S) имеют не только различное сродство к ГКР, но и разную противовоспалительную активность [8] (табл. 4).
Сродство 22R к ГКР более чем в 2 раза превосходит сродство 22S, а будесонид (22R22S) занимает в этой градации промежуточное положение, его сродство к рецептору равно 7,8, а сила подавления отека — 9,3 (параметры дексаметазона приняты за 1,0) (табл. 4).
Метаболизм
БДП быстро, в течение 10 мин, метаболизируется в печени с образованием одного активного метаболита — 17-БМП и двух неактивных — беклометазона 21-монопропионата (21-БМН) и беклометазона [7].
В легких из-за низкой растворимости БДП, являющейся определяющим фактором в степени образования 17-БМП из БДП, может быть замедлено образование активного метаболита. Метаболизм 17-БМП в печени происходит в 2—3 раза медленнее, чем, например, метаболизм будесонида, что может быть лимитирующим фактором перехода БДП в 17-БМП.
ТАА метаболизируется с образованием 3 неактивных метаболитов: 6β-триокситриамцинолона ацетонида, 21-карбокситриамцинолона ацетонида и 21-карбокси-6β-гидрокситриамцинолона ацетонида.
Флунизолид образует главный метаболит — 6β-гидроксифлунизолид, фармакологическая активность которого в 3 раза превосходит активность гидрокортизона и имеет Т1/2 равную 4 ч.
ФП быстро и полностью инактивируется в печени с образованием одного частично активного (1% активности ФП) метаболита — 17β-карбоксильной кислоты.
Будесонид быстро и полностью метаболизируется в печени при участии цитохрома р450 3А (CYP3A) с образованием 2 главных метаболитов: 6β-гидроксибудесонид (образует оба изомера) и 16β-гидроксипреднизолон (образует только 22R). Оба метаболита обладают слабой фармакологической активностью.
Мометазона фуроат (фармакокинетические параметры препарата изучались у 6 добровольцев после ингаляции 1000 мкг — 5 ингаляций сухой пудры с радиометкой): 11% радиометки в плазме определялось через 2,5 ч, этот показатель увеличивался до 29% через 48 ч. Экскреция радиометки с желчью составила 74% и с мочой 8%, общее количество достигало 88% через 168 ч [1].
Кетоконазол и циметидин могут увеличить уровень будесонида в плазме после перорально принятой дозы в результате блокады CYP3A.
Клиренс и период полувыведения
ИГКС имеют быстрый клиренс (CL), его величина примерно совпадает с величиной печеночного кровотока, и это является одной из причин минимальных проявлений системных НЭ. С другой стороны, быстрый клиренс обеспечивает ИГКС высокий терапевтический индекс. Клиренс ИГКС колеблется в пределах от 0,7 л/мин (ТАА) до 0,9—1,4 л/мин (ФП и будесонид, в последнем случае имеет место зависимость от принятой дозы). Системный клиренс для 22R составляет 1,4 л/мин и для 22S — 1,0 л/мин. Наиболее быстрый клиренс, превышающий скорость печеночного кровотока, обнаружен у БДП (150 л/ч, а по другим данным — 3,8 л/мин, или 230 л/ч) (табл. 2), что дает основание предполагать наличие внепеченочного метаболизма БДП, в данном случае в легких, приводящего к образованию активного метаболита 17-БМП [15]. Клиренс 17-БМП равняется 120 л/ч.
Период полувыведения (Т1/2) из плазмы крови зависит от объема распределения и величины системного клиренса и указывает на изменение концентрации препарата с течением времени. У ИГКС Т1/2 из плазмы крови колеблется в широких пределах — от 10 мин (БДП) до 8—14 ч (ФП) (табл. 2). Т1/2 других ИГКС довольно короткий — от 1,5 до 2,8 ч (ТАА, флунизолид и будесонид) и 2,7 ч у 17-БМП [8]. У флютиказона Т1/2 после внутривенного введения составляет 7—8 ч, в то время как после ингаляции из периферической камеры этот показатель равен 10 ч [8]. Имеются и другие данные, например, если Т1/2 из плазмы крови после внутривенного введения был равен 2,7 (1,4—5,4) ч, то Т1/2 из периферической камеры, рассчитанный по трехфазовой модели, составлял в среднем 14,4 ч (12,5—16,7 ч), что связано с относительно быстрой абсорбцией препарата из легких — Т1/2 2 (1,6-2,5) ч по сравнению с его медленной системной элиминацией [15]. Последняя может привести к аккумуляции препарата при длительном его применении, что было показано после семидневного назначения ФП через дискахалер в дозе 1000 мкг 2 раза в день 12 здоровым добровольцам, у которых концентрация ФП в плазме крови увеличивалась в 1,7 раза по сравнению с концентрацией после однократной дозы 1000 мкг. Аккумуляция сопровождалась увеличением подавления уровня кортизола в плазме крови (95% против 47%) [22].
Заключение
Биодоступность ингаляционных ГКС зависит от молекулы препарата, от системы доставки препарата в дыхательные пути, от техники ингаляции и др. При местном назначении ИГКС происходит значительно лучший захват препаратов из дыхательных путей, они дольше удерживаются в тканях дыхательных путей, обеспечивается высокая селективность препаратов, особенно флютиказона пропионата и будесонида, лучшее соотношение эффект/риск и высокий терапевтический индекс препаратов. Внутриклеточная эстерификация будесонида жирными кислотами в тканях дыхательных путей приводит к местной задержке и формированию «депо» неактивного, но медленно регенерирующего свободного будесонида. Более того, большой внутриклеточный запас конъюгированного будесонида и постепенное выделение свободного будесонида из конъюгированной формы может удлинить сатурацию рецептора и противовоспалительную активность будесонида, несмотря на его меньшее, по сравнению с флютиказоном пропионатом и беклометазоном монопропионатом, сродство к ГКС-рецептору [22]. На сегодняшний день существуют единичные сведения о фармакокинетических исследованиях весьма перспективного и высокоэффективного препарата мометазона фуроата, у которого при отсутствии биодоступности при ингаляционном введении обнаруживаются высокая противовоспалительная активность у больных астмой.
Длительная экспозиция и замедленная сатурация рецептора обеспечивают удлинение противовоспалительной активности будесонида и флютиказона в дыхательных путях, что может служить основанием для однократного назначения препаратов.
По вопросам литературы обращайтесь в редакцию