выпил новокаин что делать
Выпил новокаин что делать
Несмотря на все эти мероприятия, токсическое влияние новокаина при крупных торакальных операциях возможно, о чем свидетельствуют наблюдения нашей клиники, а также других хирургов (А. А. Полянцев). Объясняется это не только резорбцией больших количеств новокаина, которая имеет место и при абдоминальных вмешательствах.
При операциях на средостении и органах грудной полости, помимо фактора введения необычно больших количеств раствора новокаина (около 1500 мл), имеет значение гипоксемия, наблюдающаяся при пневмотораксе, а также блокирование симпатических и парасимпатических нервов грудной полости. Все эти факторы у легко возбудимых больных могут вызывать своеобразную реакцию, симптомы которой заставляют хирурга прерывать операцию на длительное время или быстро закончить ее, отказавшись от радикального удаления опухоли.
У таких больных прежде всего появляется двигательное возбуждение, которое быстро усиливается, превращается в судороги и сопровождается потерей сознания. В дальнейшем тонические и клонические судороги мышц шеи, конечностей, туловища и лица нарастают. Появляется цианоз, дыхание становится учащенным и неравномерным (судорожный тип дыхания), зрачки расширяются и плохо реагируют на свет.
Корнеальные рефлексы постепенно снижаются и исчезают. Со стороны сердечно-сосудистой системы наблюдается снижение артериального давления до 80/50—90/50 мм ртутного столба, учащение пульса до 120—140 ударов в минуту, иногда аритмия. Обычно через 5—15 минут, после усиленной дачи кислорода, введения эфедрина и кофеина эти явления постепенно проходят. В конце приступа у некоторых больных отмечается выделение пены изо рта, как при эпилепсии.
Все больные после операции не помнят об этом осложнении, а некоторые считают, что операция у них была произведена под наркозом.
Всего нами зарегистрировано 11 подобных осложнений. В 8 случаях они наблюдались при операциях на пищеводе, в 2 — на легких и в одном — во время операции по поводу кисты средостения. У всех больных (за исключением одного) после 10—15-минутного перерыва и проведения указанных мероприятий операция продолжалась и была закончена по обычному плану. В послеоперационном периоде каких-либо изменений со стороны центральной нервной системы у этих больных не отмечалось.
Только у одного больного, который был оперирован по поводу рака пищевода, в связи с резко выраженными признаками интоксикации пришлось прервать операцию и ограничиться пробной торакотомией. У этого больного после операции также не наблюдалось каких-либо нарушений функции центральной нервной системы.
Описанные выше осложнения, наступающие при операциях на средостении и его органах в связи с местной анестезией, а также ряд недостатков этого вида обезболивания (отсутствие выключения сознания, трудности, возникающие после вскрытия противоположной плевры и двустороннего пневмоторакса, недостаточное выключение болевых рефлексов, отсутствие релаксации мышц и др.) должны заставить хирургов серьезно отнестись к установлению показаний и противопоказаний к местной анестезии при операциях на средостении.
Почечная колика
Почечная колика — это приступ резких болей, возникающий при острой непроходимости лоханки или мочеточника. При почечной колике нарушается пассаж мочи по верхним мочевым путям (чашечно-лоханочная система и мочеточник), возникает внутренняя окклюзия
Почечная колика — это приступ резких болей, возникающий при острой непроходимости лоханки или мочеточника.
При почечной колике нарушается пассаж мочи по верхним мочевым путям (чашечно-лоханочная система и мочеточник), возникает внутренняя окклюзия или внешнее сдавление верхних мочевых путей, что приводит к резкому повышению давления в чашечно-лоханочной системе, отеку паренхимы и растяжению фиброзной капсулы почки (рис.).
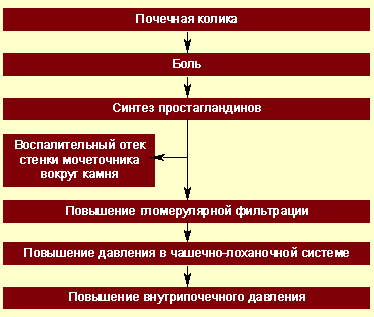 |
| Рисунок. Патогенез почечной колики |
Самой частой причиной почечной колики является мочекаменная болезнь, болевой синдром возникает при движении почечного камня по мочевым путям и обтурации просвета мочеточника конкрементом.
Другие причины почечной колики:
Факторы риска мочекаменной болезни:
Боль внезапная, постоянная и схваткообразная, длительная (до 10–12 ч), локализуется в поясничной области или подреберье и иррадиирует по ходу мочеточника в подвздошную, паховую области, мошонку и ее органы, половой член, влагалище и половые губы.
Иррадиация боли снижается с перемещением камня, который останавливается чаще в местах физиологических сужений мочеточника:
Редко при аномалиях развития почек почечная колика возникает с противоположной по отношению к окклюзированному мочеточнику стороны («зеркальная боль»).
Характерна дизурия (учащенное болезненное мочеиспускание).
Колика может сопровождаться:
Боль, особенно в первые 1,5–2,0 ч, заставляет пациента менять положение тела, что, как правило, не приносит облегчения. Больной мечется, иногда наклоняет туловище, удерживая ладонь на пояснице со стороны боли.
У детей младшего возраста боль при почечной колике обычно локализуется в области пупка, чаще сопровождается рвотой. Ребенок плачет, испуган. Острый приступ боли длится 15–20 мин, возможно повышение температуры тела до 37,2–37,3°С.
Почечная колика с острой болью в пояснице может развиться у беременных в III триместре. Клиническая картина чаще соответствует обструкции в верхних двух третях мочеточника.
Камни размером менее 5 мм в 98% случаев отходят самостоятельно. После прекращения приступа почечной колики сохраняются тупые боли в поясничной области, но самочувствие пациента улучшается.
Почечную колику дифференцируют со следующими состояниями:
При диагностике задаются следующие обязательные вопросы.
К диагностическим мероприятиям относятся:
– поколачивание по пояснице — симптом Пастернацкого (считается положительным при выявлении болезненности на стороне поражения); постукивание следует проводить крайне осторожно — во избежание разрыва почки;
— пальпация поясничной области — отмечается болезненность на стороне поражения;
Лечение на догоспитальном этапе
Когда диагноз почечной колики не вызывает сомнения, проводят сначала экстренные лечебные мероприятия, а затем срочно госпитализируют больного.
– препарат выбора — ревалгин (метамизол натрия + питофенон + фенпивериния бромид). Взрослым и подросткам старше 15 лет вводят внутривенно медленно 2 мл со скоростью 1 мл в течение 1 мин (при внутримышечном введении анальгетический эффект развивается через 16 мин). Расчет дозы для детей:
3–11 мес (5–8 кг) — только внутримышечно 0,1-0,2 мл;
1–2 года (9–15 кг) — внутривенно 0,1–0,2 мл или внутримышечно 0,2–0,3 мл;
3–4 года (16–23 кг) — внутривенно 0,2–0,3 или внутримышечно 0,3–0,4 мл;
5–7 лет (24–30 кг) — внутривенно 0,3–0,4 мл;
8–12 лет (31–45 кг) — внутривенно 0,5–0,6 мл;
12–15 лет — внутривенно 0,8–1 мл.
Перед введением инъекционного раствора его следует согреть в руке. В период лечения препаратом не рекомендуется принимать этанол.
– кеторолак (кеторол) внутривенно 30 мг (1 мл), дозу необходимо вводить не менее чем за 15 с (при внутримышечном введении анальгетический эффект развивается через 30 мин); или
– спазмолитик дротаверин — вводится внутривенно медленно, 40–80 мг (раствор 2% — 2–4 мл). Допустимо в качестве спазмолитика использовать нитроглицерин под язык в таблетках (0,25 мг или 1/2 таблетки; 400 мкг или 1 доза спрея).
Экстренной госпитализации в урологическое отделение подлежат больные в случае:
Транспортировка осуществляется на носилках в положении лежа.
Если диагноз почечной колики вызывает сомнение, больных следует госпитализировать в приемное отделение многопрофильного стационара.
Допустимо проводить амбулаторное лечение больных молодого и среднего возраста при их отказе от госпитализации в случае:
Рекомендации пациентам, оставленным дома
Больным следует соблюдать следующие рекомендации:
Всем больным, которым разрешено амбулаторное лечение, рекомендуется обратиться к урологу поликлиники для дообследования с целью установления причины развития почечной колики. Нередко подобные пациенты нуждаются в дальнейшем стационарном лечении.
Следует избегать следующих часто встречающихся ошибок:
А. Л. Верткин, доктор медицинских наук, профессор
Е. Б. Мазо, доктор медицинских наук, профессор, член-корреспондент РАМН
А. В. Дадыкина, кандидат медицинских наук
М. И. Лукашов, кандидат медицинских наук
ННПОСМП, МГМСУ, РГМУ, ЦПК и ППС НижГМА, Москва, Нижний Новгород
Новокаин : инструкция по применению
Способ применения и дозы
Состав
Действующее вещество: новокаин (procaine)
100 мл раствора содержит новокаина (прокаина гидрохлорида) 0,25 г или 0,5 г
Вспомогательные вещества: раствор соляная кислота разведенная, вода для инъекций.
Раствор для инъекций.
Препараты для местной анестезии. Код АТХ N01В А02.
Местная и инфильтрационная анестезия. Лечебные блокады.
Повышенная чувствительность к препарату. Миастения, артериальная гипотензия, гнойный процесс в месте введения, срочные хирургические вмешательства, сопровождающиеся острой кровопотерей, выраженные фиброзные изменения в тканях (для анестезии методом ползучего инфильтрата).
Способ применения и дозы
Как правило, новокаин хорошо переносится, однако у некоторых больных наблюдается повышенная чувствительность к препарату (головокружение, общая слабость, снижение артериального давления, коллапс, шок).
Со стороны центральной и периферической нервных систем : головная боль, сонливость, двигательное беспокойство, потеря сознания, судороги, тризм, тремор, зрительные и слуховые нарушения, нистагм, синдром конского хвоста (паралич ног, парестезии), паралич дыхательных мышц, блок моторный и чувственный, возвращение боли, стойкая анестезия.
Со стороны сердечно-сосудистой системы : повышение артериального давления, периферическая вазодилатация, брадикардия, аритмия, боль в грудной клетке.
Со стороны мочевыделительной системы : непроизвольное мочеиспускание.
Со стороны пищеварительного тракта : тошнота, рвота, непроизвольная дефекация.
Со стороны крови : метгемоглобинемия.
Аллергические реакции : кожный зуд, шелушение, сыпь, дерматит, другие анафилактические реакции (в т. Ч. Ангионевротический отек, анафилактический шок), крапивница (на коже и слизистых оболочках).
В случаях передозировки введение препарата следует немедленно прекратить. При проведении местной анестезии место введения можно обколоть адреналином. При внутривенном введении проводить мероприятия по налаживанию форсированного диуреза. ОСОБЫЕ.
Симптомы : бледность кожных покровов и слизистых оболочек, головокружение, тошнота, рвота, повышенная нервная возбудимость, «холодный» пот, тахикардия, снижение артериального давления почти до коллапса, тремор, судороги, апноэ, метгемоглобинемия, угнетение дыхания, внезапный сердечно-сосудистый коллапс. Действие на центральную нервную систему проявляется чувством страха, галлюцинациями, судорогами, двигательным возбуждением. В случаях передозировки введение препарата следует немедленно прекратить.
Применение в период беременности или кормления грудью.
Применение в период беременности возможно при условии хорошей переносимости. В период кормления грудью применение препарата возможно после предварительной тщательной оценки ожидаемой пользы терапии для матери и потенциального риска для младенца. При применении во время родов возможно развитие брадикардии, апноэ, судом у новорожденного.
Детям препарат нельзя применять.
С осторожностью вводить больным с сердечными блокадами, нарушениями ритма сердца (особенно брадикардия), больным с отягощенным аллергологического анамнеза, а также в период кормления грудью. Для выявления побочных реакций сначала назначать новокаин в малых дозах или проводить тест на чувствительность. Для уменьшения и ликвидации побочных реакций применять антигистаминные средства и кортикостероиды. Для поверхностной анестезии мало пригоден из-за слабой способностью проникать через неповрежденные слизистые оболочки. Для снижения системного действия, токсичности и пролонгации эффекта при местной анестезии прокаин применять в комбинации с вазоконстрикторами (0,1% раствор эпинефрина гидрохлорида из расчета 1 капля на 2-5 мл раствора).
Для предупреждения побочных реакций сначала следует провести пробу на переносимость. О непереносимости свидетельствуют отек и покраснение места инъекций. При положительной реакции прокаин не применять. При применении препарата требуется контроль фунции сердечно-сосудистой, дыхательной и центральной нервной систем. С осторожностью назначать при тяжелых заболеваниях сердца, печени и почек. При проведении местной анестезии при применении одной и той же общей дозы токсичность прокаина тем выше, чем больше концентрированным является применяемый раствор. В связи с этим с увеличением концентрации раствора общую дозу рекомендуется уменьшить или разбавить раствор препарата в меньшей концентрации (стерильным физиологическим раствором натрия хлорида). Препарат применять с осторожностью при состояниях, сопровождающихся снижением печеночного кровотока, прогрессировании сердечно-сосудистой недостаточности (обычно вследствие развития блокад сердца и шока), воспалительных заболеваниях, дефиците псевдохолинэстеразы, почечной недостаточности, у пациентов пожилого возраста (от 65 лет), тяжелобольных, ослабленных больных, в период беременности и кормления грудью, родов.
Способность влиять на скорость реакции при управлении автотранспортом или работе с другими механизмами.
В период лечения необходимо соблюдать осторожность при управлении транспортными средствами и занятиях другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
Препарат уменьшает влияние антихолинэстеразных средств на нервно-мышечную передачу. Введение новокаина потенцирует действие средств, применяемых для наркоза. Для уменьшения всасывания и удлинения действия новокаина при местном обезболивании введение новокаина сочетать с введением 0,1% адреналина гидрохлорида из расчета 1 капля на 2-5-10 мл новокаина. Новокаин уменьшает эффективность сульфаниламидных препаратов. Применение одновременно с ингибиторами МАО повышает риск развития артериальной гипотензии. Токсичность прокаина повышают антихолинэстеразные препараты (угнетают его гидролиз). Возможна перекрестная сенсибилизация. При обработке места инъекции местного анестетика дезинфицирующими растворами, содержащими тяжелые металлы, повышается риск развития местной реакции в виде болезненности и отека. Потенцирует действие прямых антикоагулянтов.
Механизм анестезирующего действия связан с блокадой натриевых каналов, торможением калиевого тока, конкуренцию с кальцием, снижением поверхностного натяжения фосфолипидного слоя мембран, угнетением окислительно-восстановительных процессов, генерации импульсов. При поступлении в кровь препарат уменьшает образование ацетилхолина, снижает возбудимость периферических холинореактивных систем, проявляет блокирующее действие на вегетативные ганглии, уменьшает спазм гладкой мускулатуры, снижает возбудимость сердечной мышцы и моторных зон коры головного мозга.
Основные физико-химические свойства: прозрачная, бесцветная или слегка желтоватого цвета жидкость.
Алкоголь и анестезия при лечении зубов
Автор данной статьи:
Ведущий специалист, стоматолог-хирург, стоматолог-терапевт
Не секрет, что при лечении зубов требуется использование анестезии для снижения болевых ощущений. К данной процедуре необходимо подойти ответственно как врачу-стоматологу, так и пациенту. Рекомендуется воздержаться от употребления спиртных напитков, чтобы избежать неприятного исхода и минимизировать риски. Почему специалисты просят отказаться от спиртосодержащих напитков в процессе стоматологического вмешательства? Следует более детально разобраться в данном вопросе.
Почему нельзя пить алкоголь перед посещением стоматолога
Можно ли принимать крепкие напитки перед лечением зубов? Крайне нежелательно пить алкоголь перед визитом к врачу, так как от общего состояния организма зависит эффективность стоматологической анестезии и окончательный результат.
Отрицательное влияние спиртных напитков
Многие ошибочно полагают, что употребление алкоголя после лечения зубов обеззараживает ротовую полость. Но это является большим заблуждением. Совместимы ли крепкие напитки и стоматологическая анестезия? Если не хотите навредить своему здоровью, стоит задуматься о пагубном воздействии спиртного на организм. Почему опасно употреблять алкоголь при лечении зубов? Он приводит к следующим негативным последствиям:
Более того, алкоголь в сочетании с обезболивающим препаратом оказывает отрицательное влияние на центральную нервную систему. Зачастую возникают непредсказуемые побочные эффекты: головная боль, слабость, судороги, учащенное сердцебиение.
Через сколько можно употреблять алкоголь после анестезии
Через какое время можно пить спиртные напитки после анестезии? Срок определяется врачом-стоматологом и зависит от характера вмешательства и типа лечения. Наркоз не сразу перерабатывается, поэтому следует отложить застолье. После стоматологических манипуляций необходимо подождать хотя бы сутки. Употреблять алкоголь допустимо через 48 часов после полного выведения медицинского препарата из организма. Стоит отметить, что после удаления зубов отказ от крепких напитков рекомендуется продлить на 6-7 дней. Если у вас наблюдается низкая свертываемость крови, лучше воздержаться на более долгий срок. Это снизит риск появления осложнений: воспаления, нагноения, развития инфекции.
Алкогольные напитки могут сильно повлиять на результат лечения. В итоге стоматологическое вмешательство будет малоэффективным и безуспешным. Как бы ни хотелось победить волнение и стресс, лучше забыть о спиртосодержащих напитках на время проведения процедуры.
БОЛИ В СПИНЕ: болезненный мышечный спазм и его лечение миорелаксантами
Боли в спине — одна из наиболее распространенных жалоб, которые пациенты предъявляют в общемедицинской практике. Часто они вызываются остеохондрозом позвоночника — дегенеративным поражением хряща межпозвонкового диска и реактивными изменениями со стороны
Боли в спине — одна из наиболее распространенных жалоб, которые пациенты предъявляют в общемедицинской практике. Часто они вызываются остеохондрозом позвоночника — дегенеративным поражением хряща межпозвонкового диска и реактивными изменениями со стороны тел смежных позвонков. Поражение межпозвонкового диска развивается вследствие его повторных травм (подъем тяжести, избыточная статическая и динамическая нагрузка, падения и др.) и возрастных дегенеративных изменений. Студенистое ядро, центральная часть диска, высыхает и частично утрачивает амортизирующую функцию. Фиброзное кольцо, расположенное по периферии диска, истончается, в нем образуются трещины, к которым смещается студенистое ядро, образуя выпячивание (пролапс), а при разрыве фиброзного кольца — грыжу. В настоящее время созданы препараты, оказывающие структурно-модифицирующее действие на хрящевую ткань (старое название — хондропротекторы). Типичным представителем группы является препарат хондро, назначаемый курсом по 4 месяца (эффект сохраняется 2 месяца после отмены). В пораженном позвоночном сегменте возникает относительная нестабильность позвоночника, развиваются остеофиты тел позвонков (спондилез), повреждаются связки и межпозвонковые суставы (спондилоартроз). Грыжи межпозвонковых дисков наиболее часто наблюдаются в нижних поясничных дисках, реже — в нижних шейных и верхних поясничных, крайне редко — в грудных. Грыжи диска в тело позвонка (грыжи Шморля) клинически не значимы, грыжи диска в заднем и заднебоковом направлении могут вызвать сдавление спинно-мозгового корешка (радикулопатию), спинного мозга (миелопатию на шейном уровне) или их сосудов.
Кроме компрессионных синдромов возможны рефлекторные (мышечно-тонические), которые обусловлены импульсацией из рецепторов в ответ на изменения в дисках, связках и суставах позвоночника — болезненный мышечный спазм. Рефлекторное напряжение мышц вначале имеет защитный характер, поскольку приводит к иммобилизации пораженного сегмента, однако в дальнейшем этот фактор становиться причиной возникновения боли. В отличие от компрессионных синдромов остеохондроза позвоночника, которые встречаются относительно редко, болевые мышечные спазмы возникают в течение жизни практически у каждого второго человека.
Классический пример болезненного мышечного спазма представляет люмбаго (поясничный прострел), который характеризуется резкой, простреливающей болью в пояснице, развивающейся, как правило, при физической нагрузке (подъем тяжести и др.) или неловком движении. Больной нередко застывает в неудобном положении, попытка движения приводит к усилению боли. При обследовании выявляют напряжение мышц спины, обычно сколиоз, уплощение поясничного лордоза или кифоз.
Люмбалгия — боль в спине — и люмбоишиалгия — боль в спине и по задней поверхности ноги — развиваются чаще после физической нагрузки, неловкого движения или переохлаждения, реже — без каких-либо причин. Боли носят ноющий характер, усиливаются при движениях в позвоночнике, определенных позах, ходьбе. Для люмбоишиалгии характерна боль в ягодице, в задненаружных отделах ноги, не достигающая пальцев. При обследовании выявляют болезненность, напряжение мышц спины и задней группы мышц ноги, ограничение подвижности позвоночника, часто сколиоз, симптомы натяжения (Ласега, Вассермана и др.).
На шейном уровне могут возникать рефлекторные мышечно-тонические синдромы: цервикалгия и цервикобрахиалгия, которые чаще развиваются после физической нагрузки или неловкого движения шеи. Цервикалгия — боль в шейной области, которая нередко распространяется на затылок (цервикокраниалгия). Цервикобрахиалгия — боль в шейной области, распространяющаяся на руку. Характерно усиление болей при движениях в шее или, наоборот, при длительном статическом положении (в кино, после сна на плотной высокой подушке и др.). При обследовании выявляют напряжение шейных мышц, часто наблюдается ограничение движений в шейном отделе, болезненность при пальпации остистых отростков и межпозвонковых суставов на стороне боли.
При компрессии нервного корешка (радикулопатии) кроме болезненного мышечного спазма и ограничений подвижности в позвоночнике и конечностях выявляются чувствительные, рефлекторные и (или) двигательные нарушения в зоне пораженного корешка. На поясничном уровне чаще поражаются пятый поясничный (L5) и первый крестцовый (S1) корешки, реже — четвертый поясничный корешок и очень редко — верхние поясничные корешки. Радикулопатии нижних шейных корешков встречаются значительно реже.
Важно помнить, что боли в спине могут быть единственным симптомом при опухоли спинного мозга, сирингомиелии и других заболеваниях спинного мозга. Боли возникают при деструкции позвонков и поражении нервных корешков вследствие инфекционных процессов (туберкулезный спондилит, спинальный эпидуральный абсцесс), новообразованиях (первичные и метастатические опухоли позвоночника, миеломная болезнь), дисметаболических нарушениях (остеопороз, гиперпаратиреоз, болезнь Педжета). Боль в спине может быть следствием перелома позвоночника, его врожденных или приобретенных деформаций (сколиоза и др.), стеноза позвоночного канала, спондилолистеза, анкилозирующего спондилоартрита.
Она возможна при различных соматических заболеваниях (сердца, желудка, поджелудочной железы, почек, органов малого таза и др.) по механизму отраженных болей.
Обследование пациента с болью в спине требует тщательности. Нельзя любые боли в спине списывать на «остеохондроз» — состояние, которое при рентгенологическом исследовании выявляется у большинства людей среднего и пожилого возраста. Для неврологических проявлений остеохондроза позвоночника и миофасциальных болей характерны болезненный мышечный спазм и ограничение подвижности позвоночника.
Диагноз рефлекторных и компрессионных осложнений остеохондроза основывается на клинических данных и требует исключения других возможных причин болей в спине. Рентгенографию позвоночника используют, в основном, для исключения врожденных аномалий и деформаций, воспалительных заболеваний (спондилитов), первичных и метастатических опухолей. Рентгеновская КТ или МРТ позволяет выявить грыжу диска, определить ее размеры и локализацию, а также обнаружить стеноз позвоночного канала, опухоль спинного мозга.
Диагноз миофасциальных болей основывается на клинических данных (выявление болезненного мышечного напряжения одной или нескольких мышц) и требует исключения других возможных причин боли; дифференциальный диагноз с рефлекторными синдромами (мышечно-тоническими синдромами) вследствие остеохондроза позвоночника часто вызывает сложности; возможно сочетание этих заболеваний.
Лечение рефлекторных синдромов и радикулопатий вследствие остеохондроза основывается в остром периоде на обеспечении покоя — больному рекомендуется избегать резких наклонов и болезненных поз. Предписаны постельный режим в течение нескольких дней до стихания резких болей, жесткая постель (щит под матрац), прием миорелаксантов центрального действия, при необходимости — также дополнительно анальгетиков, нестероидных противовоспалительных средств. Для облегчения передвижения в этот период следует надеть шейный или поясничный корсет (фиксирующий пояс). Можно использовать физиотерапевтические анальгезирующие процедуры, втирание обезболивающих мазей, компрессы с 30–50-процентным раствором димексида и новокаином, новокаиновые и гидрокортизоновые блокады. При ослаблении болей рекомендуют постепенное увеличение двигательной активности и упражнения на укрепление мышц.
При хроническом течении рефлекторных синдромов и радикулопатий могут быть эффективны мануальная терапия, рефлексотерапия, физиотерапевтическое лечение, санаторно-курортное лечение. Хирургическое лечение (удаление грыжи диска) необходимо в тех редких случаях, когда возникает сдавление спинного мозга или корешков конского хвоста. Хирургическое лечение также показано при дискогенной радикулопатии, сопровождающейся выраженным парезом, и при длительном (более трех-четырех месяцев) отсутствии эффекта от консервативного лечения и наличии большой грыжи диска. Для профилактики обострений остеохондроза рекомендуют избегать провоцирующих факторов (подъем больших грузов, ношение тяжелой сумки в одной руке, переохлаждение и др.), регулярно заниматься лечебной гимнастикой.
При миофасциальных болях необходимо, чтобы мышца находилась в покое в течение нескольких дней. В качестве лечения можно назначать упражнения на растяжение мышц (постизометрическая релаксация), физиотерапию, рефлексотерапию или местное введение анестетиков в триггерные зоны, компрессы с димексидом и анестетиками.
Как уже было отмечено, и при острых болях, и при хронических болевых синдромах большое значение имеет лечение болезненного мышечного спазма. Тоническое напряжение мышц может не только само по себе быть причиной боли, но и способно вызвать деформацию и ограничивать подвижность позвоночника, а также обуславливать компрессию проходящих вблизи нервных стволов и сосудов. Для его лечения помимо нестероидных противовоспалительных средств, анальгетиков, (например, нимулид в форме трансдермального геля для местной терапии или в форме лингвальных таблеток при остром болевом синдроме), физиотерапии и лечебной гимнастики в качестве препаратов первого ряда применяют миорелаксанты — препараты, способные разорвать «порочный круг» болевого синдрома [2].
Для лечения болезненного мышечного спазма миорелаксанты используются внутрь или парентерально. Снижая рефлекторное мышечное напряжение, миорелаксанты уменьшают боль, улучшают двигательные функции и облегчают проведение лечебной физкультуры. Лечение миорелаксантами начинают с обычной терапевтической дозы и продолжают до тех пор, пока сохраняется болевой синдром; как правило, курс лечения составляет несколько недель. В ходе целого ряда исследований удалось доказать, что при болезненном мышечном спазме добавление к стандартной терапии (нестероидные противовоспалительные средства, анальгетики, физиотерапия, лечебная гимнастика) миорелаксантов приводит к более быстрому регрессу боли, мышечного напряжения и улучшению подвижности позвоночника.
В качестве миорелаксантов применяются мидокалм, баклофен и сирдалуд. Миорелаксанты обычно не комбинируют друг с другом. Для снятия болезненных мышечных спазмов можно также использовать диазепам (седуксен, реланиум) в индивидульно подобранной дозе.
Сирдалуд (тизанидин) — агонист α-2 адренергических рецепторов. Препарат снижает мышечный тонус вследствие подавления полисинаптических рефлексов на уровне спинного мозга, что может быть вызвано угнетением высвобождения возбуждающих аминокислот и активацией глицина, снижающего возбудимость интернейронов спинного мозга; сирдалуд обладает также умеренным центральным анальгезирующим действием. При приеме внутрь максимальная концентрация сирдалуда в крови достигается через час, прием пищи не влияет на его фармакокинетику. Начальная доза препарата составляет 6 мг в сутки в три приема, средняя терапевтическая доза — 12—24 мг в сутки, максимальная доза — 36 мг в сутки. В качестве побочных эффектов отмечаются сонливость, головокружение, незначительное снижение артериального давления; требуется осторожность при приеме препарата больными пожилого возраста.
Мидокалм (толперизон) в течение длительного времени широко используется при лечении рефлекторных и компрессионных осложнений дегенеративно-дистрофических изменений позвоночника (остеохондроз, спондилез, спондилоартроз) и миофасциальных болей [3]. Мидокалм оказывает преимущественно центральное миорелаксирующее действие. Снижение мышечного тонуса при приеме препарата связывается с угнетающим влиянием на каудальную часть ретикулярной фармации и подавлением спинно-мозговой рефлекторной активности. Препарат обладает умеренным центральным анальгезирующим действием и легким сосудорасширяющим влиянием. Прием мидокалма начинают с 150 мг в сутки три раза в день, постепенно увеличивая дозу до получения эффекта, у взрослых обычно до 300—450 мг в сутки. Для быстрого эффекта препарат вводится внутримышечно по 1 мл (100 мг) два раза в сутки или внутривенно по 1 мл один раз в сутки.
Эффективность и безопасность применения мидокалма при болезненном мышечном спазме доказана в ходе двойного слепого плацебо-контролируемого исследования [4]. В восьми исследовательских центрах 110 больных в возрасте от 20 до 75 лет методом рандомизации получали мидокалм в дозе 300 мг в сутки или плацебо в сочетании с физиотерапией и реабилитацией в течение 21 дня. В качестве объективного критерия эффективности лечения рассматривают болевой порог давления, измеряемый с помощью специального прибора (Pressure Tolerance Meter) в 16 симметричных точек туловища и конечностей. Кроме того, пациенты субъективно оценивали свое состояние по интенсивности боли, ощущению напряжения мышц и подвижности позвоночника; врач также оценивал напряжение мышц и подвижность позвоночника. Перед началом лечения и после его окончания проводилось развернутое клиническое и лабораторное обследование, включая ЭКГ, измерение артериального давления, биохимический анализ крови по 16 показателям.
Согласно результатам исследований, применение мидокалма достоверно снижает болезненный мышечный спазм, измеряемый объективно инструментальным методом. Различие между группами лечения и плацебо, которое отмечалось уже на четвертый день, постепенно увеличивалось и становилось статистически достоверным на 10-й и 21-й дни лечения, которые были выбраны в качестве конечных точек для доказательного сравнения. Анализ субъективной оценке результатов лечения, данной врачами и пациентами после его окончания (через 21 день), показал, что в группе больных, получавших мидокалм, достоверно чаще результаты лечения оценивались как очень хорошие, тогда как в группе плацебо эффект существенно чаще отсутствовал. Согласно субъективной оценке результатов лечения, данной больными после его окончания (через 21 день), каких-либо значимых различий, касающихся переносимости мидокалма и плацебо, выявлено не было. У подавляющего большинства больных отмечалась хорошая переносимость мидокалма. Результаты ЭКГ, биохимические и гематологические показатели в группе пациентов, принимавших как мидокалм, так и плацебо, также не различались.
Важно отметить, что более половины (62%) пациентов, включенных в исследование, получали другие виды терапии до начала исследования, и у большинства из них (68%) при этом не отмечалось улучшения. Это свидетельствует об эффективности мидокалма в лечении болезненного мышечного спазма, резистентного к другим видам терапии.
Введение мидокалма парентерально позволяет быстро снять боль и уменьшить мышечное напряжение. При вертеброгенном мышечно-тоническом синдроме внутримышечное введение 100 мг мидокалма ослабляет боль уже через 1,5 ч, а лечение мидокалмом в течение недели по 200 мг/сут в/м, а затем на протяжении двух недель по 450 мг/сут перорально имеет достоверное преимущество над стандартной терапией; при этом терапия мидокалмом не только позволяет уменьшить боль, но и снимает тревожность, повышает умственную работоспособность [1].
При болезненном мышечном спазме достоинствами мидокалма помимо эффективного миорелаксирующего и обезболивающиего эффекта являются отсутствие побочных эффектов и хорошее взаимодействие с нестероидными противовоспалительными средствами, что во многих случаях позволяет уменьшить дозу последних и вследствие этого ослабить или даже полностью устранить их побочные эффекты, не снижая эффективности лечения.
Важным преимуществом мидокалма перед другими миорелаксантами является отсутствие седативного эффекта и мышечной слабости при его приеме. Это преимущество доказано в ходе двойного слепого плацебо-контролируемого исследования [5]. В исследовании вошли 72 здоровых добровольца в возрасте от 19 до 27 лет (средний возраст — 21,7 лет). Исследование проводилось в течение восьми дней, все это время добровольцы методом рандомизации получали 150 или 450 мг мидокалма в сутки в три приема либо плацебо — также в три приема. Нейропсихологические исследования осуществляются утром в первый и последний (восьмой) дни исследования до и после приема мидокалма через 1,5, 4 и 6 ч либо плацебо. Результаты исследования не показали каких-либо существенных различий в скорости сенсомоторных реакций и быстроте выполнения различных психологических тестов через 1,5, 4 и 6 ч после приема мидокалма в дозе 50 или 150 мг либо плацебо. Аналогичные исследования, проведенные на восьмой день с начала приема мидокалма, также не показали существенных различий в сравнении с группой плацебо. Это свидетельствует о хорошей переносимости мидокалма и возможности назначения его в тех случаях, когда по роду деятельности пациенту требуется сохранить быстроту реакций и способность концентрировать внимание, в том числе при вождении автомобиля.
Таким образом, болезненный мышечный спазм представляет собой одну из наиболее распространенных причин болей в спине (вследствие рефлекторных синдромов остеохондроза или миофасциальных болей). В таких случаях рекомендуется применение миорелаксантов в комбинации с различными лекарственными средствами, физиотерапией и лечебной гимнастикой. В последние годы доказана эффективность и безопасность миорелаксанта мидокалма, который не вызывает седативного эффекта и выпускается в форме для парентерального введения с целью быстрого купирования болевого синдрома.
Литература.
В. А. Парфенов, доктор медицинских наук, профессор ММА им. И. М. Сеченова
Т. Т. Батышева, кандидат медицинских наук Поликлиника восстановительного лечения №7 Москвы