вязкость мембраны что это
Биологических мембран



Физические вопросы строения и функционирования
Введение
Явления переноса в биологических системах
Структурной и функциональной единицей живого организма является клетка. Клетка обменивается с окружающей средой и веществом, и энергией, и информацией. Энергия питательных веществ, поступающих в клетку, расходуется на выполнение ею разнообразных функций.
Все функции клетки тесно связаны с ее структурой
Известно, что любая клетка состоит из окруженной плазматической (клеточной) мембраной цитоплазмы, в которой находятся ядро клетки, органеллы и различные включения. К органеллам клетки относятся митохондрии, лизосомы, рибосомы, аппарат Гольджи, эндоплазматический ретикулум. Все они, в том числе и ядро клетки, тоже имеют мембраны, и основная цель данного параграфа состоит в ознакомлении с современными представлениями о структуре и функциях биологических мембран.
Роль мембран в строении и функционировании клетки чрезвычайно велика. Как заметил Бернал Д. “только после образования мембраны вокруг клетки мы действительно имеем то, что с полным правом может быть названо организмом”. Именно через мембраны происходит обмен веществ в организме. Нарушение структуры мембран ведет к нарушению их функции и, следовательно, к нарушению функциональных состояний организма в целом. Нарушение функций биологических мембран является причиной многих заболеваний.
Несмотря на большое разнообразие клеток и организмов в природе, строение и многие функции биологических мембран во многом одинаковы, что и позволяет нам рассматривать их основные свойства безотносительно к виду клеток.
Строение биологических мембран изучается уже более 80 лет. Еще в 1902 году Овертоном была выдвинута первая модель мембраны в виде тонкого слоя липидов. С тех пор представления о строении мембран постоянно усложнялись, совершенствовались, дополнялись и к настоящему времени они существенно отличаются от той первой простейшей модели Овертона. Однако и по современным представлениям основу, матрицу любой биологической мембраны составляет липидный бислой. Каковы же физические свойства липидов и липидного слоя?
Так как вода является основным, универсальным растворителем в биологических системах (цитоплазма, например, на 95% состоит из воды), то нас интересует, как будут вести себя липиды, помещенные “внутрь” воды.
Толщина такого липидного бислоя не превышает 6¸7 нм. Липидные бислои достаточной протяженности стремятся замкнуться сами на себя, чтобы лучше спрятать гидрофобные участки от воды. Так происходит самопроизвольный процесс сборки мембраны, то есть их “самосборка”.
В липидном бислое мембран может быть много белков, встроенных в сам липидный бислой, которые пронизывают липидный бислой насквозь.
По словам одного из авторов этой модели, названной жидкостно-мозаичной, мембрана представляется ему в виде липидного моря, в котором плавают белковые айсберги.
Соотношение между количеством белков и количеством липидов в мембране неодинаково и зависит от функционального назначения клетки.
В настоящее время большой интерес представляет изучение информации белков (то есть изменение их пространственной формы, структуры), поскольку предполагается, что такие жизненно важные процессы, как окислительное фосфорилирование, активный транспорт веществ, химические реакции при фотосинтезе, проведение нервного импульса и др. тесно связаны с изменением пространственной укладки атомов, то есть с конформацией полипептидной цепи белковых молекул.
Роль липидов в мембранах тоже не сводится лишь к приданию мембранам определенной физической структуры и низкой проницаемости для полярных веществ. Сейчас установлено, что физическое состояние, главным образом вязкость липидного бислоя самым непосредственным образом влияет на каталитическую активность мембранных ферментов, на проницаемость мембран, а значит, на процессы обмена веществ в клетках.
При многих видах патологий, а также при воздействии биологически активных соединений вязкость мембран изменяется.
Чем выше подвижность хвостов фосфолипидов, тем меньше вязкость мембран, и тем лучше их проницаемость для диффундирующих веществ. Поэтому вязкость бислоя очень важна для всей функциональной деятельности ферментов, находящихся в липидном слое и других.
Вязкость мембраны сильно зависит от агрегатного состояния бислоя (жидкое и твердое), то есть от температуры.
Ассиметрия мембран проявляется в том, что внутренние и наружные по отношению к клетке стороны любой биологической мембраны всегда имеют разный липидный и белковый состав. Молекулы углеводов располагаются только на внешней стороне мембраны. Ассиметричная ориентация ферментативных и транспортных белков в мембране приводит к наличию преимущественно направления активного транспорта веществ через мембрану, что играет исключительно важную роль для функционирования клетки в целом.
Текучесть мембраны
На текучесть мембран влияют жирные кислоты. Более конкретно, то, являются ли жирные кислоты насыщенными или ненасыщенными, влияет на текучесть мембран. Насыщенные жирные кислоты не имеют двойных связей в углеводородной цепи и имеют максимальное количество водорода. Отсутствие двойных связей снижает текучесть, делая мембрану очень прочной и плотно уложенной. Ненасыщенные жирные кислоты имеют по крайней мере одну двойную связь, создавая «петлю» в цепи. Двойная связь увеличивает текучесть. На текучесть мембран также влияет холестерин. Холестерин может сделать клеточную мембрану жидкой, а также жесткой.
На текучесть мембран может влиять ряд факторов. [1] Одним из способов увеличения текучести мембраны является нагревание мембраны. Липиды приобретают тепловую энергию при нагревании; энергичные липиды больше перемещаются, располагаясь и перестраиваясь случайным образом, делая мембрану более жидкой. При низких температурах липиды упорядочены по бокам и организованы в мембране, а липидные цепи в основном находятся в полностью транс-конфигурации и хорошо упаковываются вместе.
Температура плавления Т м <\ displaystyle T_ 
Текучесть мембраны можно описать двумя разными типами движения: вращательным и боковым. В электронном спиновом резонансе время корреляции вращения спиновых зондов используется для характеристики того, насколько ограничения налагаются на зонд мембраной. При флуоресценции можно использовать стационарную анизотропию зонда в дополнение ко времени корреляции вращения флуоресцентного зонда. [1] Флуоресцентные датчики демонстрируют разную степень предпочтения в условиях ограниченного движения. В гетерогенных мембранах некоторые зонды можно найти только в областях с более высокой текучестью мембран, в то время как другие можно найти только в областях с более низкой текучестью мембран. [6] Предпочтение разделения зондов также может быть показателем текучести мембраны. В спектроскопии ядерного магнитного резонанса дейтерия средняя ориентация связи углерод-дейтерий дейтерированного липида приводит к определенным спектроскопическим особенностям. Все три метода могут дать некоторую меру усредненной по времени ориентации соответствующей молекулы (зонда), что указывает на динамику вращения молекулы. [1]
Боковое движение молекул внутри мембраны можно измерить с помощью ряда флуоресцентных методов: восстановление флуоресценции после фотообесцвечивания включает фотообесцвечивание равномерно маркированной мембраны интенсивным лазерным лучом и измерение времени, необходимого флуоресцентным зондам, чтобы диффундировать обратно в фотообесцвеченное пятно. [1] Флуоресцентная корреляционная спектроскопия отслеживает колебания интенсивности флуоресценции, измеренные с помощью небольшого количества зондов в небольшом пространстве. На эти колебания влияет режим боковой диффузии зонда. Отслеживание отдельных частиц включает отслеживание траектории флуоресцентных молекул или частиц золота, прикрепленных к биомолекуле, и применение статистического анализа для извлечения информации о боковой диффузии отслеживаемой частицы. [7]
Коэффициенты диффузии
Плавление заряженных липидных мембран, таких как 1,2-димиристоил-sn-глицеро-3-фосфоглицерин, может происходить в широком диапазоне температур. В этом диапазоне температур эти мембраны становятся очень вязкими. [2]
В биологии текучесть мембраны относится к вязкость из липидный бислой из клеточная мембрана или синтетическая липидная мембрана. Упаковка липидов может влиять на текучесть мембраны. Вязкость мембраны может повлиять на вращение и распространение белков и других биомолекул внутри мембраны, тем самым влияя на функции этих вещей. [1]
На текучесть мембран влияют жирные кислоты. Более конкретно, то, являются ли жирные кислоты насыщенными или ненасыщенными, влияет на текучесть мембран. Насыщенные жирные кислоты не имеют двойных связей в углеводородной цепи и имеют максимальное количество водорода. Отсутствие двойных связей снижает текучесть, делая мембрану очень прочной и плотно уложенной. Ненасыщенные жирные кислоты имеют по крайней мере одну двойную связь, создавая «петлю» в цепи. Двойная связь увеличивает текучесть. На текучесть мембран также влияет холестерин. Холестерин может сделать клеточную мембрану жидкой, а также жесткой.
Содержание
Факторы, определяющие текучесть мембран
Состав мембраны также может влиять на ее текучесть. Мембрана фосфолипиды включать жирные кислоты разной длины и насыщенность. Липиды с более короткими цепями менее жесткие и менее вязкие, потому что они более восприимчивы к изменениям кинетической энергии из-за меньшего размера молекул и имеют меньшую площадь поверхности для стабилизации. Лондонские силы с соседними гидрофобными цепями. Липидные цепи с двойными углерод-углеродными связями (ненасыщенный) более жесткие, чем липиды, насыщенный с атомами водорода, поскольку двойные связи не могут свободно вращаться. Из-за этой жесткости ненасыщенные двойные связи затрудняют упаковку липидов вместе, создавая перегибы в выпрямленной углеводородной цепи. В то время как отдельные липиды могут быть более жесткими, мембраны, изготовленные из таких липидов, более текучие и имеют меньшую точки плавления: требуется меньше тепловой энергии для достижения такого же уровня текучести, как у мембран из липидов с насыщенными углеводородными цепями. [1] Включение определенных липидов, таких как сфингомиелин, в синтетические липидные мембраны, как известно, укрепляет мембрану. Такие мембраны можно охарактеризовать как «стеклянное состояние, то есть жесткое, но без кристаллического порядка». [2]
Неоднородность физических свойств мембраны
Дискретный липидные домены с различным составом и, следовательно, текучестью мембран, могут сосуществовать в модельных липидных мембранах; это можно наблюдать с помощью флуоресцентная микроскопия. [2] Биологический аналог, ‘липидный плот’, предположительно существует в клеточных мембранах и выполняет биологические функции. [3] Также узкий кольцевая липидная оболочка из мембранные липиды в контакте с интегральные мембранные белки имеют низкую текучесть по сравнению с объемными липидами в биологические мембраны, поскольку эти молекулы липидов остаются на поверхности белка макромолекулы.
Методы измерения
Текучесть мембраны можно описать двумя разными типами движения: вращательным и боковым. В электронном спиновом резонансе время корреляции вращения Количество спиновых зондов используется для определения степени ограничения, накладываемого мембраной на зонд. Во флуоресценции, стационарный анизотропия зонда, помимо времени корреляции вращения флуоресцентного зонда. [1] Флуоресцентные датчики демонстрируют разную степень предпочтения в условиях ограниченного движения. В гетерогенных мембранах некоторые зонды можно найти только в областях с более высокой текучестью мембран, в то время как другие можно найти только в областях с более низкой текучестью мембран. [6] Предпочтение разделения зондов также может быть показателем текучести мембраны. В спектроскопии ядерного магнитного резонанса дейтерия средняя ориентация связи углерод-дейтерий дейтерированного липида приводит к определенным спектроскопическим особенностям. Все три метода могут дать некоторую меру усредненной по времени ориентации соответствующей молекулы (зонда), что указывает на динамику вращения молекулы. [1]
Боковое движение молекул внутри мембраны можно измерить с помощью ряда флуоресцентных методов: восстановление флуоресценции после фотообесцвечивания включает фотообесцвечивание однородно маркированной мембраны интенсивным лазерным лучом и измерение времени, необходимого флуоресцентным зондам, чтобы диффундировать обратно в фотообесцвеченное пятно. [1] Флуоресцентная корреляционная спектроскопия отслеживает колебания интенсивности флуоресценции, измеренные с помощью небольшого количества датчиков в небольшом пространстве. На эти колебания влияет режим боковой диффузии зонда. Отслеживание отдельных частиц включает отслеживание траектории флуоресцентных молекул или частиц золота, прикрепленных к биомолекуле, и применение статистического анализа для извлечения информации о боковой диффузии отслеживаемой частицы. [7]
Биомембраны с дефицитом фосфолипидов
Исследование ширины центральной линии электронный спиновой резонанс спектры тилакоид мембраны и водные дисперсии их всего экстрагируют липиды, меченный стеариновой кислотой метка вращения (имеющий спиновый или доксильный фрагмент при 5,7,9,12,13,14 и 16-м атомах углерода по отношению к карбонильной группе), обнаруживает градиент текучести. Уменьшение ширины линии с 5-го до 16-го атомов углерода представляет возрастающую степень свободы движения (градиент текучести) от стороны головной группы до метильного конца как в нативных мембранах, так и в их водном липидном экстракте (многослойная липосомная структура, типичная для липидный бислой организация). Этот образец указывает на сходство организации липидного бислоя как в нативных мембранах, так и в липосомы. Это наблюдение имеет решающее значение, поскольку тилакоидные мембраны содержат в основном галактолипиды, содержат только 10% фосфолипид, в отличие от других биологических мембран, состоящих в основном из фосфолипидов. Белки в хлоропласт мембраны тилакоидов, по-видимому, ограничивают сегментарную подвижность жирных ацильных цепей липидов от 9 до 16 атомов углерода Vis a vis их липосомальные аналоги. Неожиданно, липосомные жирные ацильные цепи более ограничены в 5-м и 7-м положениях углерода по сравнению с этими положениями в тилакоидных мембранах. Это объяснимо тем, что из-за эффекта ограничения движения в этих положениях, из-за стерический помеха в целом хлорофилл головные группы, особенно в липосомах. Однако в мембранах нативных тилакоидов хлорофиллы в основном образуют комплексы с белками в виде светоуборочные комплексы и может не в значительной степени ограничивать текучесть липидов как таковую. [8]
Коэффициенты диффузии
Коэффициенты диффузии флуоресцентных аналогов липидов составляют около 10 −8 см 2 / с в жидких липидных мембранах. В гелевых липидных мембранах и природных биомембранах коэффициенты диффузии составляют около 10 −11 см 2 / с до 10 −9 см 2 / с. [1]
Заряженные липидные мембраны
Плавление заряженных липидных мембран, таких как 1,2-димиристоил-sn-глицеро-3-фосфоглицерин, может происходить в широком диапазоне температур. В этом диапазоне температур эти мембраны становятся очень вязкими. [2]
Биологическая значимость
Известно, что микроорганизмы, подвергающиеся термическому стрессу, изменяют липидный состав своей клеточной мембраны (см. гомеовязкая адаптация). Это один из способов регулирования текучести мембраны в зависимости от окружающей среды. [1] Известно, что текучесть мембраны влияет на функцию биомолекул, находящихся внутри мембранной структуры или связанных с ней. Например, связывание некоторых периферических белков зависит от текучести мембран. [9] Боковая диффузия (внутри мембранного матрикса) мембранных ферментов может влиять на скорость реакции. [1] Следовательно, мембранозависимые функции, такие как фагоцитоз и клеточная сигнализация, может регулироваться текучестью клеточной мембраны. [10]
Методы изучения динамического поведения мембранных систем
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
МЕТОДЫ ИЗУЧЕНИЯ ДИНАМИЧЕСКОГО ПОВЕДЕНИЯ МЕМБРАННЫХ СИСТЕМ И ЛИПИД-БЕЛКОВЫХ ВЗАИМОДЕЙСТВИЙ
Все биологические структуры по своей природе динамичны, и при рассмотрении их функций необходимо учитывать подвижность компонентов, из которых эти структуры состоят. Это относится к ферментам, полинуклеотидам и конечно, к мембранам. В жидкостно-мозаичной модели, в центре которой находится представление о подвижности мембранных компонентов, мембрана рассматривается как некое липидное море, в котором свободно плавают глобулярные белки, окруженные аннулярными липидами.
Динамическая подвижность мембранных компонентов связана с их биологическим функциями и является залогом их нормального функционирования. Необходимым условием протекания ферментативных процессов является свободная диффузия мембраносвязанных компонентов. Между шероховатым и гладким ЭР, аппаратом Гольджи и плазматической мембраной происходит быстрый обмен различными веществами, тем не менее, их состав и функции различаются. Чтобы понять суть этих и многих других биологических феноменов, необходимо прежде всего выяснить механизмы, управляющие динамической подвижностью мембран.
Что кроется за понятием «динамические свойства мембран»? Поперечная асимметрия в распределении липидов, а, возможно, и пассивная диффузия через бислой очевидным образом связаны со скоростью трансмембранного флип-флоп перехода липидов. Биогенез мембран зависит от скорости обмена липидов между различными мембранами. Скорость ферментативных реакций, протекающих с участием мембраносвязанных компонентов, зависит от скорости латеральной диффузии компонентов мембран. И, наконец, липидно-белковые взаимодействия зависят от скорости, с которой происходит обмен липидами между ближайшим окружением белков и остальным объемом мембраны.
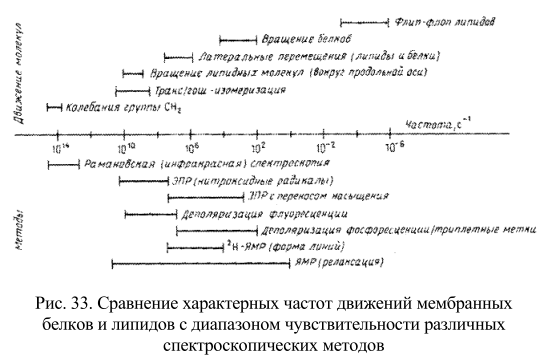
Изучая процессы, протекающие в мембранных структурах, необходимо представлять их временные характеристики и одновременно временное разрешение методов, используемых для анализа. Для примера на рис. 33 приведено сопоставление некоторых химических и физических реакций в биологических мембранах с диапазоном скоростей, доступных для измерения с помощью распространенных методов.
Первые основаны на использовании внутримембранных зондов для изучения микровязкости мембраны. Индикаторами физического состояния мембраны, а также характера липидно-белковых взаимодействий могут служить низкомолекулярные ЭПР-метки и флуоресцентные зонды. Второй тип экспериментов направлен на прямое измерение латеральной диффузии мембранных белков или липидов и вращательной подвижности белков внутри бислоя. Исследовались также молекулярные взаимодействия в бислое, поскольку они влияют на динамику изучаемых молекул.
МИКРОВЯЗКОСТЬ МЕМБРАН И ПРИМЕНИМОСТЬ МЕМБРАННЫХ ЗОНДОВ
Для обычной жидкости, какой является, например, вода, текучесть определяется как величина, обратная вязкости – понятному и легко измеряемому физическому параметру. Вязкость характеризует трение, возникающее между соседними слоями жидкости, которые движутся с разными скоростями. Вязкость жидкости можно оценить, измерив скорость, с которой падает мраморный шарик в жидкой среде. В случае мембран термин «текучесть» обычно носит качественный характер: имеется в виду сопротивление, которое оказывает мембрана различным типам перемещений в ней.
Почему так важно определить микровязкость мембран? Как уже отмечалось, она играет важную физиологическую роль при адаптации различных организмов к внешним воздействиям. Подобные явления наблюдаются чаще всего при изучении термического стресса, когда микроорганизмы, растения, пойкилотермные или зимующие животные подвергаются воздействию низких температур. Адаптация заключается в изменении липидного состава мембран, а именно в увеличении содержания ненасыщенных липидов или уменьшении средней длины ацильной цепи. Подобные изменения ведут к уменьшению плотности упаковки липидов в мембране и таким образом поддерживают микровязкость мембран на необходимом уровне. Так почему же все-таки так важна микровязкость мембран?
Обычно мембраны находятся в жидкокристаллическом состоянии, и, по-видимому, его поддержание очень важно для их функционирования. При переходе мембраны из жидкокристаллической фазы в фазу геля (более твердое состояние) микровязкость увеличивается. Структурные и функциональные свойства бислоя, находящегося в фазе геля, не совместимы с организацией и успешным функционированием белковых компонентов в мембране. При переходе мембраны из жидкокристаллической фазы в фазу геля микровязкость увеличивается примерно на два порядка. Как правило, для измерения текучести измеряют молекулярную подвижность спиновых или флуоресцентных зондов, включенных в мембрану. Зондами обычно являются небольшие молекулы, сравнимые по размерам с мембранными фосфолипидами. Некоторые из них представлены в таблице 8. Следует указать моменты, существенные для интерпретации данных по движению зондов внутри мембраны.
Липидный бислой не является просто вязкой трехмерной жидкокристаллической структурой, а представляет собой жидкую среду с низкой вязкостью, у которой состав и динамические свойства в центральной области сильно отличаются от состава и свойств периферических полярных участков. Вращательная подвижность молекулы зонда в мембране не изотропна, как это имеет место в случае сферических частиц, не обладающих выделенной осью вращения, а до определенной степени ограничено. Часто зонды внутри мембраны имеют предпочтительную ориентацию и их движения ограничены определенными рамками. Локализация разных зондов в мембране зависит от их природы, так что подбирая зонды различной структуры, можно получать информацию от различных участков мембран. Например, зонд может быть связан с белковой молекулой или белковыми агрегатами, или располагаться внутри липидных кластеров, которые могут находиться в различных физических состояниях.
Таблица 8. Некоторые метки, используемые для изучения динамики мембран
В таблице 8 приведены структурные формулы некоторых зондов, используемых при измерении динамических свойств мембран. Для оценки микровязкости мембран определяют специфические параметры ЭПР спектров.
К таким параметрам относятся:
Ясно, что микровязкость мембраны, оцененная только по одному параметру, не может служить достаточно полной характеристикой физического состояния мембраны. И все же измерение отдельных параметров весьма полезно, особенно для характеристик изменений физического состояния мембраны, обусловленных, например, изменениями температуры, давления, внедрением в бислой холестерола, изменения фосфолипидного состава бислоя или ионного состава среды. Воздействия, приводящие к уменьшению площади, приходящейся на одну липидную молекулу (увеличение гидростатического давления, понижение температуры или добавление холестерола к фосфолипидам в жидкокристаллическом состоянии), вызывают увеличение микровязкости. Это согласуется с теорией свободного объема, согласно которой микровязкость и плотность связаны между собой. Действительно, чем более плотная упаковка характерна для мембраны, тем в большей степени ограничивается подвижность зонда.
Рассмотрим 3 метода: электронный парамагнитный резонанс (ЭПР), метод деполяризации флуоресценции, которые позволяют измерять как скорость движения зонда, так и сопротивление этому движению, и метод ядерного магнитного резонанса (ЯМР).
Необходимо иметь представление о том, что именно измеряется с помощью мембранных зондов. Рассмотрим общий случай, который применим к ЭПР, измерению флуоресценции или 2 Н-ЯМР. Все три спектроскопических метода чувствительны к ориентации молекул зондов. Спектр 2 Н-ЯМР чувствителен к ориентации связи С-D (углерод – дейтерий) относительно приложенного поля. Градиент локального поля, векторно суммируясь с внешним полем, дает результирующую, которая и улавливается дейтерием. Аналогичная ситуация характерна и для ЭПР. Спектр ЭПР зависит от ориентации нитроксильной связи N-О, которую содержат большинство обычно используемых зондов (табл. 8), относительно приложенного магнитного поля. В случае флуоресцентной спектроскопии измеряемая поляризация испускаемого света зависит от ориентации дипольного момента перехода относительно направления, определяемого используемым поляризатором.
ЭЛЕКТРОННЫЙ ПАРАМАГНИТНЫЙ РЕЗОНАНС (ЭПР)
Принцип парамагнитного резонанса был открыт в 1944 г. профессором Е.К. Завойским. Как метод исследования подвижности (упорядоченности) макроструктур он стал применяться лишь 88 после разработки способа создания стабильных парамагнитных соединений, содержащих нитроксидный радикал, впервые синтезированных Э.Г. Розанцевым.
В спектре нитроксильного радикала имеются три пика, отвечающие спин-спиновым взаимодействиям неспаренного электрона и ядра атома азота. Как уже было отмечено, спектр ЭПР зависит от ориентации молекулы – спиновой метки или спинового зонда, содержащих нитроксильный радикал, относительно приложенного магнитного поля. Введение такого радикала позволяет использовать ЭПР-спектроскопию для характеристики упорядоченности вращательной или поступательной подвижности спиновой метки или спин-меченых молекул в разных условиях.
ЭПР-спектроскопия позволяет измерять плотность упаковки бислоя. Спин-меченые жирные кислоты, содержащие нитроксильную группировку на разном расстоянии от полярной СООН-группы, встраиваясь в бислой, ориентируются в поперечном направлении. Вид ЭПР спектра этих меток зависит от глубины погружения спиновой метки внутрь бислоя. С помощью спиновых меток можно оценить скорость вращательной корреляции и, соответственно, подвижность жирнокислотных цепей на разной глубине бислоя. Результаты измерения степени упорядоченности спиновых меток, фиксированных в мембране на разной глубине, свидетельствуют о росте неупорядоченности в направлении от поверхности мембраны к ее центральной части.
Рис. 34. Зависимость ЭПР-спектров нитроксидной спиновой метки от скорости молекулярного вращения. Спектры, представляющие собой первую производную сигнала, получены при разных температурах и, следовательно, при разной вязкости среды.
Во многих исследованиях проводилось сравнение микровязкости мембран, которую определяли по данным о величинах τ и S при различных возмущающих воздействиях. Метод ЭПР-спектроскопии требует специального оборудования, хотя сами измерения высоко автоматизированы. Использование этого подхода широко и разнообразно. В то же время, этот метод имеет определенные ограничения. Высокие концентрации спиновых зондов модифицируют бислой, а ковалентные метки, связываясь с белками, могут инактивировать их. В результате исследователь изучает мембрану не в нативном состоянии, а в том виде, который она принимает после модификации, хотя надо сказать, что это артефакт не только данного метода. Кроме того, надо иметь в виду, что скорости процессов, описываемых с помощью метода ЭПР, много больше тех, которые лежат в основе функционирования мембранных ферментов.
ДЕПОЛЯРИЗАЦИЯ ФЛУОРЕСЦЕНЦИИ
1) К исследуемому белку присоединяют зонд, время жизни которого в возбужденном триплетном состоянии достаточно велико. Если метка жестко связана с белком, то для регистрации вращения белка можно использовать измерение анизотропии фосфоресценции. Для таких измерений оказались пригодными производные эозина, поскольку время жизни эозина в триплетном состоянии составляет примерно 2 мсек. Эксперимент состоит в определении характерного времени затухания анизотропии фосфоресценции.
Недавно предложен модифицированный метод деполяризации флуоресценции. В его основе лежат те же принципы, что и в основе метода деполяризации флуоресценции, но используется другая молекулярная модель движения, вызывающего деполяризацию. К исследуемому белку присоединяют зонд с достаточно большим временем жизни в возбужденном состоянии. Если система гетерогенна, могут возникнуть определенные трудности с количественным расчетом. Аналогичные ограничения возникают и в тех случаях, если метка может свободно вращаться на поверхности белка или если у белковой молекулы имеются гибкие сегменты.
Интегральные мембранные белки характеризуются широким спектром времен вращательной релаксации. На одном конце временной шкалы находится родопсин, который, по-видимому, свободно вращается в мембране наружного сегмента палочки сетчатки, а на другом – бактериородопсин, который образует в пурпурной мембране упорядоченную кристаллическую решетку и неподвижен. Мембранные белки способны к заметному вращению в плоскости мембраны, и скорость этого вращения согласуется с величиной, ожидаемой исходя из простой гидродинамической модели.
ЯДЕРНО-МАГНИТНЫЙ РЕЗОНАНС (ЯМР)
В основе ЯМР-спектроскопии лежит поглощение электромагнитных волн в радиочастотном диапазоне ядрами, обладающими магнитным моментом. Наиболее часто в исследованиях используются ядра 13 С, 2 Н, 31 Р. Детальную картину строения гидрофобной области липидного бислоя удалось получить с помощью метода 2 Н-ЯМР. Атомы водорода в определенных местах липидной молекулы можно избирательно заменить дейтерием. Это мягкий способ зондирования мембран. Считается, что он, как правило, не вносит возмущений в их структуру. Спектры некоторых дейтерированных димиристоилфосфатидилхолинов представлены на рис. 36.
Рис. 35. Спектры 2 Н-ЯМР димиристоилфофатидилхолина, дейтерированного по разным положениям ацильной цепи. Числа слева обозначают положение двух (или трех) атомов дейтерия в каждой цепи. Спектр образца с дейтерированной концевой метильной группой гораздо уже всех остальных приведенных спектров, что указывает на значительную неупорядоченность центральной области бислоя.
Метод ЯМР позволяет с высокой избирательностью получить сведения о поведении разных частей молекулы. Например, на рис. 36 указаны значения Т 1 для отдельных атомов углерода в молекуле фосфатидилхолина. Увеличение Т 1 соответствует возрастанию подвижности С-С-связей от поверхности мембраны к атомам, приближенным к середине бислоя.
Рис. 36. Величины подвижности Т 1 для различных атомов углерода в молекуле фосфатидилхолина в составе мембраны при температуре выше критической (рассчитаны по данным ЯМР-спектроскопии)
Исследовались как липидные бислои, так и природные мембраны, находящиеся в жидкокристаллическом состоянии, поскольку в случае фазы геля спектры сильно уширяются из-за плотной упаковки липидов и поэтому с трудом поддаются анализу.
Несмотря на то, что для изучения мембранных белков ЯМР-спектроскопия оказалась не столь эффективна, этот подход часто используют как немодифицирующий метод изучения мембранных структур. Столь же перспективны и другие немодифицирующие методы: кругового дихроизма и сканирующей калориметрии.
МЕТОД КРУГОВОГО ДИХРОИЗМА
Метод кругового дихроизма позволяет выяснить, какой тип вторичной структуры преобладает в мембранных белках. Величина кругового дихроизма, характеризуемая обычно эллиптичностью, представляет собой разницу в поглощении образцом право- и лево-поляризованного света. Она объясняется различиями в коэффициентах молярной экстинкции право- и лево-поляризованного по кругу света. При интерпретации спектров кругового дихроизма возникают некоторые трудности, которые связаны, в основном, с негомогенностью мембранных суспензий, обуславливающей сглаживание спектральных кривых.
Рис. 37. Зависимость параметра упорядоченности S от положения метки в ацильном хвосте спинмеченой декановой кислоты 1 – по результатам ЭПР, 2 – по данным ЯМР-спектроскопии (n – положение метки у атома углерода, начиная от карбоксильной группы).
На первый взгляд представляется, что доля спиральных участков в молекуле белка – не самый информативный параметр. Но с помощью этого метода можно выяснить, осуществляется ли прямое влияние на мембранные структуры внешних факторов, если это влияние изменяет спирализацию белковых молекул. Это изменение часто имеет место в тех случаях, когда наблюдается собственный конформационный сдвиг в молекуле белка или есть взаимодействие молекул белка друг с другом, которое изменяет их конформацию.
МЕТОД СКАНИРУЮЩЕЙ КАЛОРИМЕТРИИ
Принцип метода дифференциальной сканирующей калориметрии состоит в измерении тепла, необходимого для увеличения температуры объекта на очень малую величину при непрерывном повышении температуры объекта. При работе с липидами мембран изменение их фазового состояния также может сопровождаться поглощением или выделением тепла. Чем выше значение поглощенного тепла, тем более значительная молекулярная реорганизация происходит в образце при этих условиях. Таким образом, изменения конформации макромолекул можно измерять, регистрируя тепло, выделяемое или поглощаемое при конформационных переходах.
Почему метод называется дифференциальным? Потому что для нахождения теплоты фазового состояния вещества необходимо из регистрируемого поглощения (или выделения) системой тепла вычесть тепло, поглощаемое (или выделяемое) ею в отсутствии фазовых переходов, – собственную теплоемкость. Современные чувствительные калориметры позволяют измерять фазовые переходы в водно-липидных дисперсиях. Применение этого метода для исследования простых искусственных систем (мицеллы, везикулы, бислои которых организованы из фосфолипидов заданного вида) дало ценную информацию о принципах организации бислоя. Было обнаружено, что в бислоях индивидуальных фосфолипидов критическая температура (Т кр ) для фазового перехода занимает доли градуса.
В смеси различных фосфолипидов область фазового перехода занимает 1–2 градуса. Некоторые фосфолипиды плохо смешиваются друг с другом, например, если их жирнокислотные цепи отличаются по длине более, чем на 4 атома углерода. Не смешиваются также глицерофосфолипиды и сфингофосфолипиды: пики, характеризующие их фазовые переходы, регистрируются на термограммах отдельно. Добавление к таким образцам холестерола способствует образованию фазы со смешанными свойствами, при этом фазовый переход уже не выявляется. В фосфолипидах смешанного состава, образующих одну фазу, величина Т кр представляет собой характеристику этой смеси. На величину Т кр влияют длина жирнокислотных цепей в молекуле (чем больше атомов углерода в жирнокислотном радикале, тем выше температура перехода) и степень ее гидратации. Обводнение бислоя снижает температуру фазового перехода. Анализ термограмм некоторых фосфолипидов выявляет перед наступлением области фазового перехода так называемый предпереход (рис. 38). В настоящее время считают, что предпереход вызван образованием складок бислоя, выявляющихся при изменении объема, занимаемого каждой молекулой, толщины бислоя и связывания молекул воды с его компонентами. При охлаждении образца состояния, соответствующие предпереходу, не обнаруживаются (рис. 38).
Рис. 38. Схематическое изображение гелеобразного (I), переходного (II) и жидкокристаллического (III) состояния бислоя в ходе изменения температуры Термограммы характеризуют переход между этими состояниями при увеличении (1) и уменьшении (2) температуры.
Термограмма нагревания мембранных образцов отличается от термограммы их охлаждения. Это явление носит название гистерезиса липидных систем и объясняется «памятью» липидов. Одна из причин такой памяти заключается в неодинаковой энергии гидратации и дегидратации липидного бислоя. Для нативных мембран ценность метода дифференциальной сканирующей калориметрии ниже, чем для искусственных систем. Высокое содержание холестерола в плазматических мембранах не позволяет выявить отчетливых изменений теплопродукции в области фазовых переходов. В случае внутриклеточных мембран фазовые переходы не обнаруживаются по другой причине – эти мембраны оказываются достаточно «жидкими» в приемлемом интервале температур (5–60ºС).
ФЛУОРЕСЦЕНТНАЯ СПЕКТРОСКОПИЯ
Световая волна, сталкиваясь с молекулой какого-либо вещества, либо рассеивается (изменяет направление движения), либо поглощается (передает свою энергию молекуле). При этом молекула переходит в возбужденное состояние. Энергия, поглощенная молекулой, может рассеяться в виде тепла (в результате столкновения с другими молекулами) или излучиться в виде света. Какое именно событие из указанных здесь будет иметь место, – определяется состоянием молекулы в момент столкновения. Возбужденные электроны возвращаются на основной уровень двумя путями: либо испуская свет, либо с помощью безизлучательного перехода. В первом случае испускаемый свет обладает меньшей энергией и большей длиной волны (так называемый Стоксов сдвиг), так как часть энергии теряется.
Стоксов сдвиг будет тем больше, чем больше:
В некоторых случаях возбужденная молекула, сталкиваясь с идентичной невозбужденной молекулой, образует комплекс – эксимер. При этом из плоских молекул возникают структуры типа сэндвича, которые стабилизированы переносом заряда от одной молекулы к другой. На перенос заряда тратится часть энергии поглощенного кванта, поэтому эксимер флуоресцирует в более длинноволновой области. Степень эксимеризации зависит от концентрации хромофора, температуры и вязкости окружающей среды. Распространенным флуоресцентным зондом, используемым для измерения микровязкости мембран по легкости его эксимеризации, является пирен (рис. 39). Пирен концентрируется в гидрофобных компартментах мембраны, располагаясь между жирнокислотными цепями липидов. Его эксимеризация пропорциональна подвижности молекул в бислое, поэтому при прочих равных условиях и неизменной концентрации пирена величина эксимеризации может служить характеристикой микровязкости мембраны. Понижение температуры увеличивает микровязкость бислоя, ограничивает подвижность молекул пирена и снижает уровень его эксимеризации. При возрастании температуры подвижность жирнокислотных цепей в сердцевине бислоя возрастает, увеличивается и вероятность встречи молекул пирена. Изучение зависимости эксимеризации пирена в мембранах от температуры (или других факторов) позволяет выяснить относительную микровязкость мембранных структур и выявить область критических температур, при которых наблюдается фазовый переход в мембранах.
Рис. 39. Спектры флуоресценции пирена в мембранах микросом почек при разных температурах с указанием максимума флуоресценции мономерной (I 392) и эксимерной (I 465) форм (А) и график Аррениуса для эксимеризации пирена в исследуемом образце (Б) Область перегиба на графике соответствует температуре фазового перехода.
Тушение флуоресценции иногда представляет собой результат дальней безызлучательной передачи (так называемого резонансного переноса) энергии. В этом случае система содержит два флуоресцирующих хромофора, причем спектр испускания одного из них (донора) должен перекрываться со спектром поглощения другого (акцептора). При наличии переноса энергии интенсивность флуоресценции донора снижается, а акцептора – увеличивается. Эффективность переноса зависит от дистанции между донором и акцептором, и это явление может быть использовано для определения расстояния между определенными группами в мембране с помощью своеобразной «спектроскопической линейки». Такой «линейкой» может являться пирен. С его помощью можно измерить упорядоченность анулярного слоя липидов и оценить характер межбелковых взаимодействий в мембране.
Область возбуждения пирена перекрывается с областью испускания триптофанильных радикалов белка (330–335 нм). Если мембранные белки содержат триптофанильные радикалы и обладают собственной флуоресценцией, частично она будет тушиться теми молекулами пирена, которые могут подойти к белковым хромофорам на расстояние радиуса Ферстера (15–20 Å). Следовательно, освещая пробу в области возбуждения триптофанильных остатков (280 нм) и исследуя тушение белковой флуоресценции и возгорание флуоресценции пирена, можно оценить доступность белку той порции пирена, которая локализуется в аннулярном слое. Образование белковых ассоциатов, сопровождающееся снижением доли аннулярных липидов вследствие их вытеснения из области межбелковых контактов, будет защищать собственную флуоресценцию триптофанильных радикалов белка от тушения пиреном и также может быть выявлено и количественно выражено с помощью этого метода.