вторичная коагулопатия что это такое
Коагулопатия
Коагулопатии – это гематологические синдромы, характеризующиеся нарушением гемостаза по типу гипо- или гиперкоагуляции. Расстройства гемокоагуляции проявляются геморрагическим синдромом (кровотечениями из носа, десен, ран, подкожными геморрагиями), тромбозами различной локализации. Коагулопатии диагностируются по данным гематологических исследований: ОАК, коагулограммы, факторов свертывания, тромбоцитов, аутоантител и др. Терапия зависит от нарушенного звена гемостаза, может включать гемотрансфузии, назначение глюкокортикоидов, витаминов, антикоагулянтов, проведение хирургического вмешательства.
МКБ-10
Общие сведения
Коагулопатии объединяют различные состояния, сопровождающиеся как снижением, так и повышением свертываемости крови. По статистике ВОЗ, около 5 млн. человек в мире страдает геморрагическим синдромом. Нарушения гемостаза лабораторно определяются у 66%, а клинически ‒ у 16% пациентов ОРИТ. С расстройствами гемокоагуляции в повседневной практике могут столкнуться не только специалисты в области гематологии, но и акушеры-гинекологи, педиатры, хирурги, травматологи, кардиологи. Коагулопатии значительно утяжеляют прогноз основных заболеваний, требуют оказания ургентной медицинской помощи.
Причины коагулопатии
Основным механизмом нарушений гемостаза выступает дисбаланс в свертывающей и противосвертывающей системах крови. Коагулопатии развиваются под влиянием наследственных, эндогенных и экзогенных факторов. Основные группы причин:
Патогенез
Основными структурно-функциональными компонентами гемостаза являются сосудистая стенка, форменные элементы крови и факторы свертывания плазмы. Первичный (сосудисто-тромбоцитарный) гемостаз осуществляется эндотелием и субэндотелием сосудов совместно с тромбоцитами. Вторичный (коагуляционный) гемостаз реализуется плазменными свертывающими и противосвертывающими факторами. Коагулопатии могут развиваться при патологии любого из этих звеньев.
Нормальная неповрежденная сосудистая стенка обладает антитромботическими свойствами, что обеспечивает беспрепятственную циркуляцию крови по сосудам. Различные патогенные факторы (бактериальные токсины, ЦИК, провоспалительные цитокины) вызывают повреждение эндотелия, в результате чего усиливаются его прокоагулянтные свойства.
Происходит усиленная адгезия и агрегация тромбоцитов, активация плазменных факторов при одновременном угнетении антикоагулянтных факторов и фибринолиза. Гиперкоагуляция ведет к формированию внутрисосудистых тромбов, ишемии тканей и инфарктам органов. При ДВС-синдроме развивается генерализованный тромбоз и полиорганная недостаточность.
Коагулопатии, протекающие по типу гипокоагуляции, могут быть вызваны заболеваниями сосудов (вазопатиями), снижением количества тромбоцитов (тромбоцитопенией) или их дефектами (тромбоцитопатией), дефицитом факторов свертывания, повышением антикоагулянтной или фибринолитической активности (гемостазиопатии). При этом развивается повышенная кровоточивость ‒ геморрагический синдром.
Классификация
По времени и причинам возникновения коагулопатические синдромы подразделяют на наследственные и приобретенные. По характеру изменений гемостаза дифференцируют гипокоагуляцию и гиперкоагуляцию. С учетом клинических проявлений различают следующие виды коагулопатий:
В зависимости от нарушенного звена свертывающей системы выделяют три класса приобретенных коагулопатий:
Также существует деление коагулопатий на следующие группы:
Симптомы коагулопатий
Синдром гиперкоагуляции
Гиперкоагуляционные синдромы характеризуются высоким риском тромбообразования. Клинические проявления могут полностью отсутствовать, тогда коагулопатия диагностируется только лабораторным путем. В других случаях отмечается быстрое свертывание крови при небольших ранениях, тромбирование венозных катетеров и игл при заборе крови.
Клиника симптоматических тромбозов зависит от вида и калибра закупоренного сосуда, локализации кровяного сгустка. Серьезную опасность представляют инфаркты органов: сердца, мозга, почек, кишечника, легких. Артериальные тромбозы приводят к инфаркту миокарда, ишемическому инсульту, окклюзии мезентериальных сосудов, гангрене конечностей, потере плода у беременных. Тромбозы глубоких вен являются источником тромбоэмболии легочной артерии.
Наиболее типичным клиническим признаком тромбоза является боль, зависящая от локализации тромба: головная боль в груди, животе, пояснице и т.д. Возможны слабость, одышка, онемение конечностей, судороги. Без своевременной медицинской помощи наступает необратимый некроз органа, нередко ‒ летальный исход.
Синдром гипокоагуляции
Геморрагические синдромы сопровождаются повышенной кровоточивостью. Кровотечения капиллярного типа проявляются образованием петехий и экхимозов на кожных покровах, носовыми кровотечениями, меноррагиями, иногда – внутримозговыми кровоизлияниями.
Гематомная кровоточивость приводит к кровоизлияниям в полости тела и мышцы. При коагулопатиях такого рода формируются болезненные подкожные гематомы, гемартрозы, гематомы забрюшинной области. Могут возникать желудочно-кишечные кровотечения, гематурия, длительное кровоистечение после ранений, экстракции зубов, хирургических операций.
Ангиоматозные кровотечения развиваются из аномальных сосудов: ангиом, телеангиэктазий, артериовенозных мальформаций. Васкулитно-пурпурной кровоточивости свойственно наличие геморрагической сыпи, воспалительной эритемы, нефрита на фоне системных васкулитов.
Следствием геморрагических коагулопатий является железодефицитная анемия. Одномоментная массивная кровопотеря может привести к геморрагическому шоку и смерти.
Диагностика
В диагностике коагулопатий принимают участие гематологи-гемостазиологи, кардиологи, иммунологи, флебологи и др. Основными диагностическими критериями являются лабораторные показатели различных звеньев гемостаза:
Лечение коагулопатии
Терапия гиперкоагуляции
В лечении тромбозов находят применение антиагреганты, антикоагулянты непрямого и прямого действия, фибринолитические препараты, ангиопротекторы. При венозных тромбозах, ишемическом инсульте прибегают к регионарному катетерному тромболизису. С целью удаление из кровеносного русла ЦИК, токсинов, продуктов фибринолиза проводится плазмаферез, цитаферез. При коагулопатиях аутоиммунного генеза назначаются глюкокортикостероиды, цитостатики, иммуноглобулины.
Терапия гипокоагуляции
Для купирования коагулопатий, сопровождающихся кровотечениями, осуществляется местный и общий гемостаз. Во всех случаях, кроме симптоматического лечения, необходимо проведение этиопатогенетической терапии.
Прогноз и профилактика
Любые нарушения гемостаза являются потенциально опасными для жизни. Однако при соблюдении всех мер предосторожности и следовании врачебным рекомендациям риск фатальных кровотечений и тромбозов минимален. Для предупреждения приобретенных коагулопатий не следует запускать хронические заболевания, бесконтрольно принимать лекарственные препараты, подвергаться избыточной инсоляции и другим неблагоприятным экзогенным воздействиям. Профилактика наследственных коагулопатий возможна только путем проведения генетического скрининга.
Вторичная коагулопатия что это такое
Причин развития коагулопатии потребления множество, принципиальным же примером является синдром диссеми-нированного внутрисосудистого свертывания крови (ДВС). Четкого разделения между ДВС и другими описываемыми состояниями не существует, одновременно может прокетать несколько процессов, вызывающих коагулопатию.
В микрососудистом русле происходит накопление фибрина, приводящее к снижению уровня фибриногена, здесь же задерживаются и тромбоциты, в результате развивается тромбоцитопения. Гипофибриногенемия вкупе с тромбоцитопенией у пациента с кровоточивостью являются надежными показателями коагулопатии потребления. Запускается процесс фибринолиза, приводя к повышению в крови содержания продуктов деградации фибрина.
Сепсис или инфекция при коагулопатии потребления. Эти состояния нередко являются причиной тромбоцитопении в послеоперационном периоде. Механизм ее развития неясен, однако определенная роль в этом может принадлежать индуцированной эндотоксинами агрегации и разрушению тромбоцитов в микроциркуляторном русле либо непосредственной активации коагуляционного каскада. Также при этих состояниях развивается недостаток активированного протеина С, вследствие чего процесс образования микротромбов ничем не сдерживается.
Шок, травмы, ожоги, панкреатит при коагулопатии потребления. Данные состояния являются причиной высвобождения веществ, обладающих тромбопластическими свойствами, которые способствуют образованию тромбина и потреблению факторов свертывания крови. Они также могут приводить к развитию тромбоцитопении. Кроме того, неадекватная перфузия тканей запускает развитие воспалительного ответа, также приводящего к коагулопатии.
Травмы головного мозга при коагулопатии потребления. При травматических повреждениях головного мозга высвобождается большое количество тромбопластина, что приводит к повышению свертываемости крови за счет ускорения образования фибрина с формированием тромбов в микроциркуляторном русле. В результате происходит потребление участвующих в процессе свертывания субстратов с последующим снижением свертывающей способности крови.
Неотложные акушерские состояния при коагулопатии потребления. К активному высвобождению веществ, обладающих тромбопластическими свойствами и приводящих к усилению образования тромбина и потреблению факторов свертывания крови, могут приводить такие состояния, как отслойка плаценты, эмболия околоплодными водами, внутриутробная гибель плода, эклампсия, септические аборты, а также пузырный занос.
Диссеминированное внутрисосудистое свертывание (ДВС) при коагулопатии потребления. ДВС является приобретенным нарушением гемостаза, характеризующимся диффузной активацией свертывающей системы крови, приводящей к накоплению фибрина в микроциркуляторном русле, агрегации тромбоцитов и тромбозам. Степень тяжести ДВС может варьировать в широких пределах: от легкой или субклинической до тяжелой и жизнеугрожающей.
Клинически ДВС проявляется генерализованной кровоточивостью и нарушениями функций отдельных органов, обусловленными диффузными тромбозами микроциркуляторного русла. В тяжелых случаях может развиваться полиорганная недостаточность, приводящая к летальному исходу. Летальность от ДВС выше в группе септических пациентов и пациентов с тяжелыми травмами.
ДВС может осложнять течение многих заболеваний. Кроме уже описанных состояний ДВС может развиваться при массивных трансфузиях, гемолизе, заболеваниях печени и онкологических заболеваниях (в т. ч. при лейкозах). Патофизиологический процесс ДВС запускается посредством механизмов воспалительного и цитокинового ответа, особая роль в этом принадлежит интерлейкину-6. Системная активация образования фибрина реализуется тремя механизмами.
Первый из них включает активацию тканевым фактором (TF) VII фактора свертывания, опосредованное комплексом ТF-ф.VII образование фибрина с последующим превращением фибриногена в фибрин и активацией тромбоцитов. Вторым механизмом является нарушение при ДВС функции естественных противосвертывающих механизмов — АТШ, протеина С и ингибитора ТЕ Все это приводит к смещению равновесия в свертывающей системе в сторону образования тромбов.
Наконец, третий механизм заключается в угнетении деградации фибрина ввиду относительного избытка PAI-1, ингибитора образования тромбина и фибринолиза.
Диагноз ДВС основывается на сочетании клинических признаков с определенными лабораторными изменениями. Каких-либо специфических тестов, позволяющих подтвердить или исключить ДВС, не существует. Клинически наличие ДВС следует подозревать у пациентов с генерализованной коагулопатией, кровоточивостью при наличии у них провоцирующего фактора или заболевания, которое может привести к развитию ДВС. Обычно у пациентов отмечается снижение уровня тромбоцитов и удлинение ПВ/АЧТВ.
В плазме крови могут обнаруживаться продукты деградации фибрина, может выявляться недостаточность ингибиторов свертывания, например, АТШ. При тяжелом ДВС может наблюдаться снижение уровня фибриногена, однако поскольку фибриноген является белком острой фазы, в ответ на стрессовые воздействия его продукция увеличивается, поэтому уровень фибриногена может оставаться нормальным. Наиболее чувствительным тестом при ДВС является оценка содержания D-димера, уровень которого изменяется у 94% пациентов с ДВС. При наличии у пациента коагулопатии и подозрении на ДВС никогда не следует забывать о гипотермии как возможной первопричине патологических изменений гемостаза, особенно при отсутствии у пациента сепсиса.
Лечение ДВС основывается на лечении первичного патологического процесса, который привел к развитию ДВС. Симптоматическое лечение обычно неэффективно до тех пор, пока одновременно не будет проводиться лечение основного заболевания. Разработано несколько стратегий специфического лечения ДВС.
Ранее с целью купирования избыточной свертывающей активности крови при ДВС использовались антикоагулянты. В настоящее время, однако, нет ни одного контролируемого исследования, которое бы подтвердило эффективность применения нефракционированных или низкомолекулярных гепаринов (НМГ) при ДВС. В одном рандомизированном двойном слепом плацебо-контролируемом исследовании на здоровых людях показано, что нефракцио-нированный гепарин и НМГ могут улучшать лабораторные показатели свертывания крови у людей, активация свертывающей системы у которых вызвана влиянием эндотоксинов.
Однако у пациентов с ДВС эти данные подтверждены не были. В настоящее время изучается применение АТШ-независимых ингибиторов тромбина, таких как дезирудин. Профилактическое применение СЗП и тромбоконцентрата у пациентов с ДВС неэффективно. Однако они эффективны при наличии у пациента активного кровотечения или если планируется проведение инвазивного вмешательства.
В последнем случае трансфузии необходимо выполнять непосредственно перед или во время вмешательства, что увеличивает вероятность обеспечения гемостаза до того момента, как переливаемые тромбоциты и факторы свертывания будут израсходованы.
Как уже отмечалось, уровень АТШ у пациентов с ДВС снижен. Показана некоторая эффективность применения высоких доз АТШ в подгруппе пациентов с септическим шоком, у которых отмечена положительная динамика в отношении симптомов ДВС, функции органов и уровня летальности. Данная терапия выглядит многообещающе. Применение антифибринолитических препаратов, таких как е-аминокапроновая кислота, способствовало снижению кровоточивости у отдельных онкологических пациентов и при фибринолитических синдромах, однако не у пациентов с ДВС. Использование этих препаратов при ДВС не рекомендуется.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Редкие нарушения свертывания крови: наследственный дефицит факторов свертывания крови II, VII, X
Общая информация
Краткое описание
НАЦИОНАЛЬНОЕ ГЕМАТОЛОГИЧЕСКОЕ ОБЩЕСТВО
Рекомендации утверждены на IV Конгрессе гематологов России (апрель 2018)
по ДИАГНОСТИКЕ И ЛЕЧЕНИЮ РЕДКИХ НАРУШЕНИЙ СВЕРТЫВАНИЯ КРОВИ: НАСЛЕДСТВЕННОГО ДЕФИЦИТА ФАКТОРОВ СВЕРТЫВАНИЯ КРОВИ II, VII, X
Опубликованные описания РНСК до недавнего времени исторически состояли из исследований случай-контроль или малочисленных когортных исследований. Однако, в течение последних 10 лет появилось несколько специфических регистров (European Network of Rare Bleeding Disorders, Peyvandi et al, 2012; the North American Rare Bleeding Registry, Acharya et al, 2004; RCD-Registries: Herrmann et al, 2006, 2009; Ivaskevicius et al, 2007; Bernardi et al, 2009), позволивших улучшить понимание РНСК. Создание международной базы РНСК способствовало определению четких лабораторных критериев тяжести большинства РНСК, которые были разработаны под эгидой Международного Общества по Тромбозу и Гемостазу (ISTH) в 2012 году.
Дефицит FII обусловлен мутациями гена F2, кодирующего протромбин. Не существует прямой корреляции между генотипом F2 и фенотипом заболевания. Гемостатически достаточный уровень FII составляет около 40%. Период полувыведения FII — около 60 часов.
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Таблица 1. Формы РНСК по степени тяжести
Тяжелый дефицит факторов, как правило, связан с развитием тяжелых спонтанных кровотечений/кровоизлияний.Умеренный дефицит факторов проявляется в виде легких/умеренных спонтанных и посттравматических эпизодов кровотечений. Легкие формы дефицита факторов в большинстве случаев протекают бессимптомно [2].
Клиническая картина
Cимптомы, течение
Диагностика
Примерно у 2/3 больных нет указаний на геморрагические проявления у близких родственников. Необходимо обращать внимание на наличие геморрагических проявлений в неонатальном периоде в виде кефалогематом, внутричерепных кровоизлияний, кровоточивости и длительном заживлении пупочной ранки; у грудных детей – экхимозов, не связанных со значимой травмой, гематом мягких тканей после незначительных ушибов или спонтанных [9]. Важно обращать внимание на несоответствие выраженности геморрагических проявлений тяжести предшествовавшей травмы, на рецидивы кровотечений после первичной остановки, не связанные с повторной травмой, массивные и/или множественные гематомы, системность геморрагических проявлений (проявления различной локализации). У лиц, с незначительными дефицитами факторов свертывания крови кровотечения могут отсутствовать до первой травмы или хирургического вмешательства. Сбор жалоб и анамнеза позволит определить объем обследования пациента.
При подозрении на геморрагические состояния первым этапом лабораторной диагностики является коагулологический скрининг, при котором определяется активированное частичноео тромбопластиновое временя (АЧТВ), протромбиновое временя (ПВ), тромбиновое временя (ТВ), концентрация фибриногена (по Клауссу), временя кровотечения (ВК) стандартизованным методом (например, по Айви или с применением анализаторов PFA-100, PFA-200) и количество тромбоцитов по Фонио [10]. Показатели скрининговых тестов для дефицита FII, FVII, FX представлены в таблице 2.
Таблица 2. Скрининговые коагулологические тесты для диагностики РНСК
При любом удлинении ПВ необходимо исключить все виды приобретенного дефицита факторов протромбинового комплекса, в первую очередь обусловленные тяжелой патологией печени, механической желтухой, токсическим действием антикоагулянтов непрямого действия, циркулирующими антифосфолипидными антителами, эндогенным дефицитом витамина К, тяжелыми инфекциями, онкологического заболеваниями, системным амилоидозом и нефротическим синдромом [11].
Лечение
Активность FVII в течение нормально протекающей беременности повышается. Женщины с легким дефицитом FVII могут достигнуть к моменту родов необходимого гемостатического уровня активности FVII без проведения специфической заместительной терапии. У беременных с тяжелым дефицитом FVII есть риск геморрагических осложнений в родах. Женщинам с активностью FVII 20% перед кесаревым сечением или с началом родовой деятельности необходимо проведение заместительной терапии препаратом Эптаког альфа (активированным) в дозе 15—30 мкг/кг каждые 4—6 часов в течение не менее 3-х дней. Остальным женщинам с дефицитом FVII Эптаког альфа назначается только при развитии кровотечения согласно общим принципам терапии [23, 24].
У женщин с активностью FX менее 30% возможны проблемы с зачатием. Беременность осложняется ранними выкидышами в первом триместре, геморрагическими проявлениями (чаще геморрагическим циститом) во втором и третьем триместрах. Необходимый уровень FX до и во время беременности должен быть не менее 30%.Несмотря на физиологическое повышение активности FX в течение нормально протекающей беременности, у женщин с тяжелым дефицитом FX его уровень к родам обычно остается недостаточным для обеспечения нормального гемостаза. Женщинам с активностью FX 30% в третьем триместре беременности с наличием в анамнезе кровотечений до беременности, а также перед кесаревым сечением или с началом родовой деятельности необходима заместительная терапия КПК в дозе 20—40 МЕ/кг для достижения активности FX > 40%. Дальнейшие инфузии КПК проводятся с интервалом в 24 часа в дозе 10—20 МЕ/кг в течение как минимум трех дней для поддержания активности FX не менее 30% [25].
Пациенты с РНСК могут быть вакцинированы. Особенно важно проведение вакцинации от гепатита В. При вакцинации предпочтение отдается оральному или подкожному введению препарата, по сравнению с внутримышечным или внутрикожным. Если для данной вакцины доступен только внутримышечный путь введения, необходима заместительная терапия для предотвращения развития гематомы. В этом случае заместительную терапию проводят накануне вакцинации. В день вакцинации введение препарата не рекомендуется. Нельзя проводить вакцинацию во время кровотечения [20].
Проведение лабораторных исследований.
Лабораторные анализы лежат в основе диагностики и контроля у пациентов с РНСК. Требования к условиям и технике отбора образцов и выполнения исследований не отличаются от стандартных. Важным аспектом лабораторных исследований является участие в системе контроля качества. При диагностике РНСК оптимально участвовать не только в государственной, но и в международной системе контроля качества лабораторных исследований, охватывающей основные коагулологические параметры [3, 8, 12].
Алгоритм ведения пациентов с РНСК
Коагулопатия (плохая свертываемость крови)
Общие сведения
Система свертывания крови — это сложный последовательный каскад реакций, происходящих в организме, который направлен на остановку кровотечения. Процесс свёртывания — важная защитная реакция организма, благодаря которой поддерживается постоянный объём циркулирующей крови. В системе гомеостаза участвуют множество компонентов, основные из которых указаны на рисунке ниже.
Факторы свертывания находятся в крови в неактивном состоянии. Если кровеносный сосуд травмируется, запускается процесс свертывания, и все факторы последовательно активируются и обеспечивают формирование сгустка. Сам непосредственный процесс свертывания связан с превращением белка фибриногена (фактор I) в нерастворимый фибрин.
Коагулопатией называется болезнь, вернее группа заболеваний или состояний, в основе которых лежит нарушение свертываемости крови. Клиническим признаком коагулопатии является кровотечение. Приобретенные коагулопатии — самые часто встречаемые синдромы. При этом плохая свертываемость крови может быть обусловлена патологией разных звеньев системы свертывания: фибрин, тромбоциты или факторы свертывания крови. Если какое-либо звено этой системы не функционирует или отсутствует, то у человека будет продолжительное кровотечение и разовьется критическое состояния. Среди коагулопатий есть врожденные состояния и заболевания (гипофибриногенемия (дефицит I фактора), афибриногенемия, гемофилия А, болезнь Виллебранда, гемофилия В) так и приобретенные синдромы, возникающие при различных септических состояниях и заболеваниях почек и печени.
Патогенез
В патогенезе геморрагического синдрома присутствует:
В патогенезе уремической тромбоцитопатии имеет значение недостаточность тромбоцитов, которая связана с действием токсических метаболитов плазмы. Кроме того, больным с уремией выполняют процедуру экстракорпорального кровообращения, при которой возникает дисфункция тромбоцитов из-за взаимодействия их с трубками и мембранами аппарата. При этом тромбоциты активируются и освобождают гранулы (дегрануляция тромбоцитов). Тромбоцитарная дисфункция вызывает настолько выраженное кровотечение, что требуется переливание тромбоцитарной массы.
Лекарственная тромбоцитопения связана с взаимодействием препарата (или его метаболита) и гликопротеина мембраны тромбоцита. В результате такого взаимодействия образуется иммуногенный комплекс — гликопротеин-препарат. Измененные тромбоциты удаляются из кровотока клетками РЭС. При лекарственной тромбоцитопении повышается уровень IgG и связанные тромбоцитами антитела к препарату. В основе идиопатической пурпуры — выработка антител против антигенов вируса. Тромбоциты повреждаются, адсорбируя на своей мембране вирусный антиген или же иммунный комплекс вирус-антитело.
Классификация
Коагулопатии делятся на наследственные и приобретенные.
Различают следующие виды приобретенной коагулопатии:
В системе свертывания крови важную роль играет фибриноген (фактор I). В норме его содержание 2-4 г/л. Часто у больных определяется гипофибриногенемия — снижение уровня фибриногена. Это состояние может быть наследственным, но чаще приобретенным, по причине недостаточного образования этого белка печени при ее поражении или повышенного растворения его (фибринолиз). При этом состоянии свертывание крови замедляется и в результате образуется рыхлый распадающийся сгусток. Проявляется гипофибриногенемия образованием синяков при незначительной травме, различными кровотечениями.
Однако у большинства пациентов сниженный уровень фибриногена никак не проявляется. Снижение уровня этого белка отмечается при циррозе, некрозе печени, метастазах в костный мозг, лейкозах, шоке, анемии, эклампсии, преждевременной отслойке плаценты, осложненных родах, сепсисе. Причиной острой гипофибриногенемии является внутрисосудистое свертывание крови, когда фибриноген усиленно потребляется. Многим пациентам со сниженным уровнем фибриногена лечение не требуется. Обильные менструации у женщин предотвращаются гормональными средствами и антифибринолитическими препаратами.
Афибриногенемия — полное отсутствие фибриногена в крови при нормальном уровне тромбоцитов. Это генетически обусловленное заболевание, но встречается очень редко. При этом состоянии любая травма приводит к кровотечению, гематомам, кровоизлияниям в суставы. Стоматологические манипуляции и операции сопровождаются значительной кровопотерей. Дети редко доживают до взрослого возраста. В лечении этой патологии применяется заместительная терапия: введение концентрата фибриногена, криопреципитата и свежезамороженной плазмы.
Причины плохой свертываемости крови
Исходя из вышеизложенного, можно назвать основные причины нарушений свертываемости:
Симптомы
Какой бы ни была причина коагулопатии основным симптомом является кровотечение разной степени выраженности — от небольших синяков до сильных кровотечений во время травм (в том числе и незначительных). Со стороны кожи у больных появляются мелкие петехии, гематомы, синяки в местах инъекций, носовые и десневые, обильные маточные кровотечения у женщин, а также часто желудочно-кишечные кровотечения.
Тромбоцитопатии как врожденные, так и или приобретенные не сопровождаются выраженными геморрагиями. Кровотечение у таких пациентов может развиваться только при операциях, травмах и удалении зубов. Наиболее частые проявления — синяки и периодические носовые и десневые кровотечения.
Тромбоцитопеническая пурпура очень распространённое заболевание, особенно среди женщин 20-30 лет. У больных появляются петехии, кровянистые пузырьки, которые возвышаются над кожей, кровоточивость десен и обильные маточные кровотечения. Заболевание начинается или постепенно или остро с геморрагическим синдромом. По проявлениям бывает два варианта пурпуры: «влажный», когда кровоизлияния сочетаются с кровотечениями и «сухой», если у больного есть только кожные кровоизлияния. Геморрагический синдром на коже отмечается у 100% пациентов.
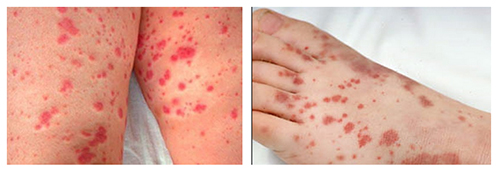
При болезни Виллебранда отмечается склонность к внутрикожным кровоизлияниям, излияниям крови в слизистые и сильные кровотечения после травмы.
Анализы и диагностика
Коагулологический скрининг включает:
При изолированном удлинении активированного частичного тромбопластинового времени переходят на второй этап обследований:
При снижении активности фактора VIII переходят к третьему этапу обследований:
Лечение плохой свертываемости крови
Что делать при плохой свертываемости крови? Прежде всего нужно тщательно обследоваться и выявить в каких звеньях свертывающей системы есть нарушения. После установления диагноза проводится лечение основного заболевания, которое сопровождается нарушениями свертываемости. При некоторых заболеваниях это достаточно серьезное лечение.
Лечение тромбоцитопенической пурпуры
При тромбоцитопенической пурпуре на время геморрагического криза больному показан постельный режим, который можно расширить при угасании геморрагических высыпаний. Специальной диеты нет, но, если слизистая полости рта кровоточит, больные должны употреблять холодную и протертую пищу.
Основные виды лечения тромбоцитопенической пурпуры — глюкокортикоиды, иммунодепрессанты и удаление селезенки. Преднизолон назначают на 2-3 недели, а потом постепенно снижают дозу. Если преднизолон назначают в высоких дозах, то короткими недельными с перерывом пять дней. При угрозе кровоизлияния в мозг применяется «пульс-терапия» Метипредом внутривенно. При назначении глюкокортикоидов быстро исчезает геморрагический синдром, а потом увеличивается количество тромбоцитов. В лечении тромбоцитопенической пурпуры используют человеческий иммуноглобулин внутривенно в течение 5 дней. Его применяют в виде монотерапии или сочетают с глюкокортикоидами, а также интерфероны (Реаферон, Интрон-А, Роферон-А).
Препаратами второй линии лечения являются агонисты рецепторов тромбопоэтина (препараты Энплейт, Револейд), к которым переходят при неэффективности глюкокортикоидов и иммуноглобулинов и противопоказаниях к удалению селезенке или отказе от операции.
Удаление селезенки или эмболизацию ее сосудов делают в том случае, если отсутствует эффект от консервативного лечения, а также при длительных и тяжёлых кровотечениях, которые угрожают жизни. У 70% больных удаление селезенки приводит к выздоровлению. Эффективность цитостатиков (Винкристин, Циклофосфан, Азатиоприн) меньше, чем удаления селезенки, поэтому их редко используют.
Для уменьшения геморрагического синдрома в острый период заболевания назначают внутрь или внутривенно аминокапроновую кислоту, но ее нельзя назначать при появлении крови в моче. Аминокапроновая кислота подавляет фибринолиз (растворение сгустка фибрина), а также усиливает агрегацию (слипание) тромбоцитов для остановки кровотечения. Также применяют внутрь или внутривенно Этамзилат (стабилизирует стенки сосудов, повышает слипчивость тромбоцитов). Для остановки кровотечений из носа применяют гемостатическую губку тампоны с аминокапроновой кислотой и перекисью, а также фибринные и желатиновые плёнки.
Лечение тромбоцитопенической пурпуры у беременных
Если при беременности выявляется тромбоцитопеническая пурпура, то тактика ведения зависит от уровня тромбоцитов:
Обычно при тромбоцитопенической пурпуре, гемолитико-уремическим и HELLP синдромах трансфузию тромбоцитарного концентрата не делают либо только по жизненным показаниям. Переливание тромбоцитарного концентрата показано при апластической и гемодилюционной тромбоцитопении.
Лечение врожденных коагулопатий
При гемофилии в случае предстоящей операции в течение нескольких дней вводят рекомбинантный фактор VIII или IX, если их уровень меньше 50 ЕД. При болезни Виллебранта перед операцией тоже вводят концентрат фактора (препарат Вилфактин) или Десмопрессин, который увеличивает уровень фактора Виллебранда в крови за счет стимуляции его выхода из эндотелия (выстилка кровеносных сосудов). Для профилактики кровотечения при хирургических вмешательствах назначается аминокапроновая или транексамовая кислота (препарат Транексам).