вторичная допаминергическая активация что это
Вторичная допаминергическая активация что это
Как биогенный амин дофамин принадлежит к группе веществ, образующихся в организме путем декарбоксилирования аминокислот. Кроме дофамина и образующегося из него норадреналина эта группа включает много других молекул-посредников, таких как гистамин, серотонин и ГАМК.
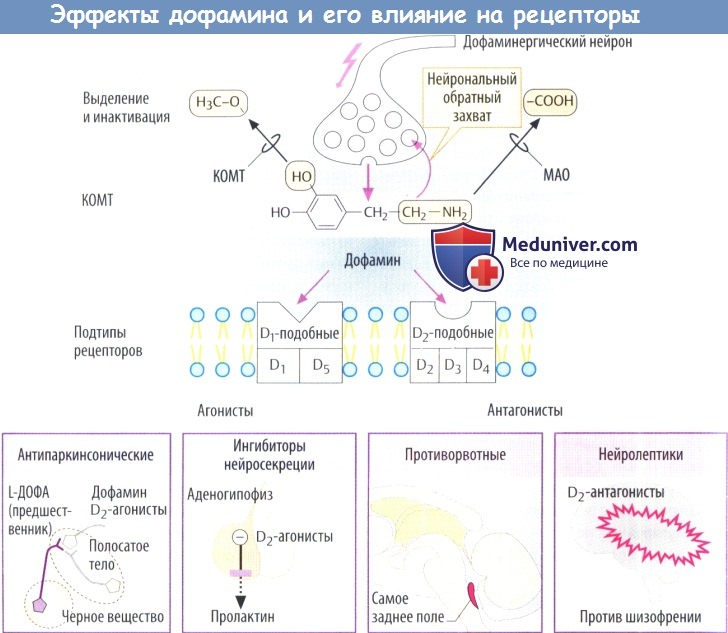
а) Действие дофамина и фармакологическое значение. Дофамин служит в качестве нейромедиатора в ЦНС. Дофаминовые рецепторы присутствуют и на периферии. Выделенный нейронами дофамин может взаимодействовать с различными подтипами рецепторов, каждый из которых связан с G-белками: семейство D1-подобных рецепторов (включает подтипы D1 и D5) и семейство D2-подобных рецепторов (включает подтипы D2, D3 и D4). Эти подтипы отличаются своими сигнальными путями.
Так, синтез цАМФ стимулируется D1-подобными рецепторами и ингибируется D2-подобными.
Высвобожденный дофамин используется повторно благодаря нейрональному обратному захвату (специфическим дофаминовым переносчиком, DAT) и повторному накоплению в везикулах (неспецифическим везикулярным переносчиком моноаминов, VMAT) либо катаболизируется ферментами МАО и КОМТ, как и другие эндогенные катехоламины.
Для влияния на дофаминергическую передачу сигналов в терапевтических целях используют различные препараты.
Антипаркинсоническив средства. При болезни Паркинсона происходит дегенерация дофаминовых нейронов черного вещества и полосатого тела. Для того чтобы компенсировать недостаток дофамина, используют препарат L-ДОФА как предшественник дофамина, а также агонисты D2-рецепторов.
Ингибиторы пролактина. Выход дофамина из нейросекреторных клеток гипоталамуса угнетает секрецию пролактина аденогипофизом. Пролактин вызывает образование грудного молока на протяжении лактационного периода; более того, он ингибирует секрецию гонадорелина.
Агонисты D2-рецепторов препятствуют секреции пролактина и могут использоваться для отнятия ребенка от груди и для лечения женского бесплодия, обусловленного гиперпролактинемией.
Агонисты D2—рецепторов отличаются по продолжительности действия и, следовательно, интервалам между приемами; например, бромокриптин применяют З раза в сутки, хинаголид — 1 раз в сутки, каберголин —1-2 раза в неделю.
Противорвотные. Стимуляция дофаминовых рецепторов в самом заднем поле может вызывать рвоту. Самое заднее поле находится на дне IV желудочка; здесь отсутствует ГЭБ. Антагонисты D2—рецепторов, такие как метоклопрамид и домперидон, используются в качестве противорвотных средств. К тому же они стимулируют опорожнение желудка.
Нейролептики. Различные препараты, проникающие в ЦНС, оказывающие терапевтическое действие при шизофрении, проявляющие антагонистические свойства по отношению к D2—рецепторам; например, нейролептики фенотиазины и бутирофенон.
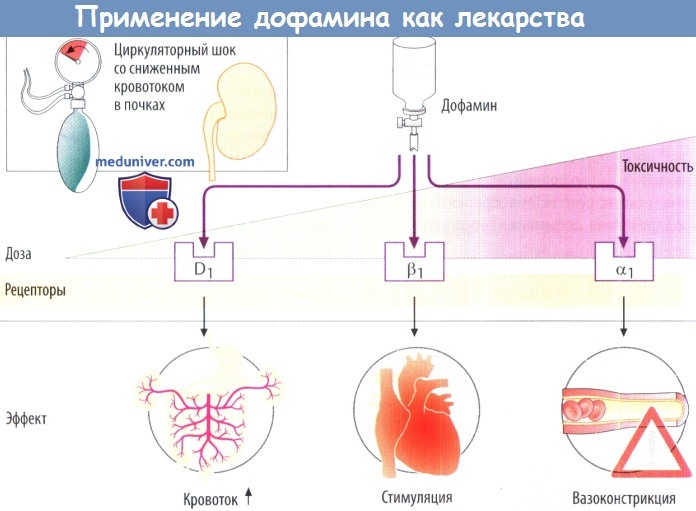
б) Дофамин как терапевтическое средство. При инфузионном введении дофамин вызывает расширение почечных и висцеральных артерий вследствие стимуляции D1-рецепторов. В результате уменьшается сердечная постнагрузка и увеличивается почечный кровоток. Эти эффекты используют при лечении кардиогенного шока.
При постепенном увеличении дозы дофамин способен активировать β1-, а затем и α1-рецепторы. Опосредованная α-рецепторами вазоконстрикция с терапевтической точки зрения нежелательна (обозначается красным предупреждающим знаком).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Дофаминергическая терапия когнитивных нарушений
Опубликовано в журнале:
«ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ» 2007, № 11, с. 45-48
В.В. Захаров
Кафедра нервных болезней Московской медицинской академии им. И.М. Сеченова
Dophaminergic therapy of cognitive disturbances
Одной из наиболее хорошо зарекомендовавших себя стратегий терапии когнитивных нарушений является воздействие на церебральные нейротрасмиттерные системы. Применение ацетилхолинергических и глютаматергических препаратов является в настоящее время «золотым стандартом» лечения наиболее распространенных форм деменции [1—4, 8, 20, 22], хотя применение первых на стадии умеренных когнитивных нарушений пока дало противоречивые результаты [19—21]. Предполагают, что развитие ацетилхолинергической недостаточности является относительно поздним событием в патогенезе когнитивных расстройств и менее тяжелые нарушения в большей степени обусловлены дисфункцией со стороны других нейротрансмиттерных систем — дофаминергической, норадренергической, серотонинергической и др.
В связи с этим весьма интересны результаты исследований L. Backman и соавт., N. Volkow и соавт. [15, 30]. В цитируемых работах было показано, что в пожилом возрасте закономерно развивается легкая дофаминергическая недостаточность, о чем свидетельствует уменьшение биодоступности D2-рецепторов полосатых тел (по данным позитронно-эмиссионной томографии головного мозга). При этом прослеживается корреляция между указанными нейрохимическими изменениями и выраженностью когнитивных нарушений лобного типа, которые являются одним из основных и наиболее ранних признаков хронической сосудистой мозговой недостаточности [2, 4, 7, 12].
В основе данной корреляции вероятно лежит недостаточность дофаминергической активации лобных долей со стороны вентральной зоны покрышки среднего мозга (так называемый мезокортикальный дофаминергический путь).
К настоящему времени накоплен значительный клинический опыт применения дофаминергических препаратов при возрастной когнитивной дисфункции. Наиболее изученным препаратом является пирибедил, или проноран (фирма «Сервье»). Он совмещает свойства агониста дофаминовых D2/DЗ-рецепторов и блокатора пресинаптических а2-адренорецепторов. Применение пронорана способствует усилению не только дофаминергической, но и норадренергической медиации, что весьма выгодно с клинической точки зрения, так как активация норадренергической системы играет одну из ключевых ролей в процессе запоминания новой информации. Кроме того, по экспериментальным данным проноран обладает также положительным вазоактивным эффектом в отношении церебрального и периферического кровообращения, что также является преимуществом при использовании данного препарата у пациентов с хронической сосудистой мозговой недостаточностью [5, 6, 14, 15, 24, 27, 28].
В 70—80-х годах XX века в европейских странах проводилась серия плацебо-контролируемых клинических испытаний, в которых был показан положительный ноотропный эффект пронорана у пациентов с возрастной когнитивной дисфункцией, не достигающей выраженности деменции [14, 15, 27, 28]. При этом, по некоторым данным, эффективность пронорана превосходила эффективность монотерапии сосудистыми препаратами [28]. В 2001 г. эти результаты были воспроизведены в работе D. Nagaraia и соавт. [25], которые применяли проноран у пациентов с синдромом умеренных когнитивных нарушений. Было показано, что применение пронорана сопровождалось достоверно большим процентом улучшений когнитивных функций по Краткой шкале оценки психического статуса по сравнению с плацебо. Известно также, что на ранних стадиях болезни Паркинсона использование пронорана сопровождается не только улучшением двигательных, но и когнитивных функций [10].
Согласно требованиям доказательной медицины, проведение двойных слепых плацебо-контролируемых рандомизированных исследований является основным и абсолютно необходимым методом оценки эффективности ноотропных препаратов. Однако этот метод также имеет определенные ограничения, которые препятствуют «механическому» перенесению полученных результатов на повседневную клиническую практику. Как известно, отбор пациентов при проведении клинических исследований проводится по определенным критериям, которые, как правило, значительно ограничивают число сопутствующих заболеваний и применение прочих препаратов. Также не всегда просто интерпретировать практическое значение полученных в ходе рандомизированных исследований изменений психометрических шкал. В связи с этим целесообразен дополнительный анализ результатов применения того или иного препарата в условиях обычной клинической практики. При этом наряду с психометрическими [например «Краткой шкалой оценки психического состояния» (Mini-mental scale examination — MMSE)] используются шкалы типа шкалы «Общего клинического впечатления» (Clinical Global Impression — CGI). Последние предоставляют лечащему врачу значительную свободу в оценке практического значения проводимой терапии на основании всей совокупности изменений клинического статуса пациента. Применение таких шкал является общепринятым в мировой практике и настоятельно рекомендуется [23, 26] для применения в области когнитивной неврологии.
В 2005—2007 г. в России в рамках программы «Прометей» (координатор проекта — акад. РАМН Н.Н. Яхно) был проанализирован опыт применения пронорана в терапии возрастной когнитивной дисфункции в повседневной клинической практике. Результаты выполнения этой программы были опубликованы в целом ряде статей [6, 9, 14].
Данная публикация отражает раздел указанной программы, целью которого была оценка влияния препарата проноран на возрастные когнитивные нарушения при определении их выраженности разными методами. В этом случае сопоставляли данные психометрических шкал (MMSE) [18] и нейропсихологических тестов (тест рисования часов) [23], с одной стороны, и клинической шкалы (CGI) [27], с другой.
Материал и методы
В соответствии с указанной целью исследование было разделено на 2 части. В 1-й части для оценки эффективности терапии использовались психометрические (MMSE) и нейропсихологические тесты, а во 2-й части — шкала CGI.
В 1-й части был проведен анализ лечения 574 пациентов в возрасте от 60 до 89 лет (в среднем 69,5±5,5 года) с легкими или умеренными когнитивными нарушениями возрастного и/или сосудистого характера. Эти пациенты наблюдались в поликлиниках 33 городов из 30 регионов России. Наиболее частым клиническим диагнозом была дисциркуляторная энцефалопатия I или II стадии. В лечении и наблюдении за пациентами приняли участие 132 врача-невролога амбулаторного звена.
Проноран назначали в дозе 50 мг в сутки в 1 прием в течение 3 мес. Монотерапия данным препаратом проводилась 385 пациентам, а 189 пациентов получали проноран в сочетании с другими сосудистыми и метаболическими средствами. Оценка эффективности терапии проводилась на 6-й и на 12-й неделе лечения.
Во 2-й части был проведен анализ лечения 2058 пациентов (1447 женщин и 611 мужчин в возрасте от 50 до 94 лет, в среднем 64,9+8,3 года) с диагнозом дисциркуляторная энцефалопатия I или II стадии и легкими или умеренными когнитивными нарушениями. Данные пациенты наблюдались в поликлиниках 54 городов из 37 регионов России. В лечении и наблюдении за пациентами приняли участие 212 врачей-неврологов амбулаторного звена.
В этой группе проноран пациентам назначали в дозе 50 мг в сутки в 1 прием в течение 3 мес. Монотерапия этим препаратом проводилась 1181 пациенту, а 875 получали проноран в сочетании с другими сосудистыми и метаболическими средствами.
Оценка эффективности терапии в этих случаях также проводилась на 6-й и на 12-й неделе лечения. Различий по возрасту, полу и выраженности когнитивных расстройств между пациентами, получавшими мототерапию пронораном и политерапию в обеих группах не было.
По CGI лечащий врач до начала терапии, и далее на 6-й и 12-й дни оценивал общее состояние пациента на основании всей совокупности имеющейся симптоматики по 7-балльной шкале оценке «нет нарушений» соответствовал 1 балл, «незначительные» — 2, «легкие» — 3, «умеренные» — 4, «умеренно тяжелые» — 5, «тяжелые» — 6, «крайне тяжелые нарушения» — 7 (эти баллы далее см. на рисунке).
Кроме того, отмечалась степень влияния соответствующих нарушений на повседневную жизнь больных.
Как в 1-й, так и во 2-й частях исследования в анализ не включались пациенты в остром периоде инсульта, черепно-мозговой травмы, после оперативного вмешательства, с болезнью Паркинсона и синдромом паркинсонизма, с шизофренией, а также пациенты с тяжелыми речевыми, двигательными и чувствительными расстройствами.
Результаты и обсуждение
На фоне терапии пронораном было отмечено достоверное улучшение когнитивных функций. Так, средний результат по MMSE повысился с 26,0±1,0 до лечения до 27,9±3,5 балла на 12-й неделе лечения (pРаспределение больных (в %) по показателям шкалы CGI до лечения, на 6-й и 12-й неделе терапии.
По оси ординат — процент больных, по оси абсцисс — баллы (1—7); (8) — нет данных.
На фоне проводимой терапии достоверно уменьшилась также доля пациентов, допустивших существенные ошибки в тесте рисования часов. До лечения такие ошибки выявлялись у 48,6% пациентов, после лечения (на 12-й неделе) — лишь у 14,3% (p Улучшение когнитивного функционирования больных было отмечено и по шкале CGI. Если до лечения выраженность нарушений по данной шкале у большинства пациентов варьировала от легкой до умеренно тяжелой (3—5 баллов), то после лечения это были или умеренные либо незначительные (2—4 балла) расстройства. Отсутствие динамики зафиксировано у 170 пациентов, а отрицательная — только у 6. Распределение больных в соответствии с показателями шкалы CGI до лечения, на 6-й и 12-й неделе терапии приведено на рисунке.
Терапия пронораном характеризовалась удовлетворительным профилем безопасности и переносимости. Нежелательные явления отмечались у 15,4% пациентов. Наиболее распространенными из них были тошнота, головокружение, рвота, головная боль, повышенная сонливость, боли или дискомфорт в эпигастрии, диспепсия, общая слабость. Данные явления не угрожали жизни пациентов, не наносили непоправимого вреда здоровью и крайне редко (менее 1% случаев) вынуждали прекратить проводимую терапию. Несколько чаще нежелательные явления отмечались у пациентов, получавших комбинированную терапию, по сравнению с получавшими монотерапию пронораном (15 и 22% соответственно).
Таким образом, опыт практического применения пронорана в условиях повседневной амбулаторной неврологической практики согласуется с результатами опубликованных ранее плацебо-контролируемых рандомизированных клинических исследований.
Применение пронорана у пациентов с хронической сосудистой мозговой недостаточностью способствует регрессу выраженности когнитивных нарушений. При этом улучшение когнитивных функций фиксируется не только с помощью психометрических, но общих клинических шкал. Данный факт свидетельствует о практической значимости выявленного когнитивного улучшения, которое, по нашим наблюдениям, оказывает ощутимое положительное влияние на повседневную жизнь пациента, его поведение и самочувствие.
Сказанное дает основание утверждать, что терапия пронораном показана для лечения пациентов с недементными (легкими или умеренными) когнитивными нарушениями. Это имеет практическое значение, ибо на сегодняшний день отсутствует единый протокол ведения пациентов с когнитивными расстройствами, не достигающими стадии деменции [7, 9, 11, 12, 20], хотя распространенность недементных нарушений в пожилом возрасте значительно превышает частоту деменции [6, 16, 18]. При этом они, снижая качество жизни не только пациентов и их ближайших родственников, приносят социально-экономический ущерб обществу в целом. Поэтому раннее начало лечения когнитивных нарушений имеет большое значение и для профилактики деменции, так как пациенты с умеренными когнитивными нарушениями, представляют собой группу высокого риска ее развития в будущем (так, заболеваемость болезнью Альцгеймера в данной категории пациентов составляет 10-15% в год [25]).
Из изложенного видно, что дофаминергическая терапия может проводиться как самостоятельный вид лечения недементных когнитивных нарушений, так и в комплексе с традиционными сосудистыми и ноотропными препаратами. Важно, что проноран может сочетаться с другими ноотропными и сосудистыми препаратами, поскольку такое сочетание не приводит к увеличению частоты побочных эффектов. Вместе с тем следует обратить внимание на то, что в нашей работе не было получено различий по величине ноотропного эффекта между монотерапией пронораном и комбинацией данного препарата с другими сосудистыми и ноотропными лекарственными средствами. Это дает нам основание сделать вывод, что указанная комбинированная терапия не имеет в данном случае особых преимуществ в отношении коррекции когнитивных расстройств по сравнению с монотерапией пронораном.
Таким образом, проноран оказывает положительный ноотропный эффект при недементных (легких и умеренных) когнитивных нарушениях сосудистой этиологии. Данный эффект не фиксируется с помощью различных методов оценки нейропсихологических тестов и клинически ориентированных шкал, позволяющих оценить состояние больных в целом.
Эффективность в отношении когнитивных расстройств и удовлетворительный профиль переносимости и безопасности у пациентов пожилого возраста позволяет рекомендовать проноран для широкого клинического применения при дисциркуляторной энцефалопатии I и II стадии.
Что такое допамин и какова его роль в нашей жизни?
Статья обновлена: 2021-01-26
Допамин (дофамин, dopamine) представляет собой органическое химическое вещество, которое передает нервные импульсы между нейронами.
Производство допамина
Допамин вырабатывается в нескольких областях мозга, включая черную субстанцию и вентральную область. Это нейрогормон, который выделяется гипоталамусом. Он действует как гормон, который является ингибитором или высвобождает пролактин из передней доли гипофиза. Когда нерв высвобождает допамин, он пересекает очень маленький промежуток, называемый синапсом, а затем присоединяется к рецептору допамина в следующем нерве. Когда уровень допамина в мозге уменьшается, нервные импульсы не могут передаваться должным образом и это может нарушить функции мозга: поведение, настроение, внимание, познание, обучение, движение и сон.
История
Допамин встречается как у людей, так и у животных, включая позвоночных и беспозвоночных. Впервые допамин был синтезирован в 1910 году Джорджем Баргером и Джеймсом Юенсом в лаборатории Wellcome в Лондоне, Англия. В 1958 году Арвид Карлссон и Нильс-Оке Хилларп из лаборатории химической фармакологии Национального института сердца Швеции открыли функцию допамина как нейротрансмиттера. Арвид Карлссон был удостоен Нобелевской премии 2000 года по физиологии и медицине за то, что показал, что допамин является не только предшественником норэпинефрина и адреналина, но и нейротрансмиттером.
Допамин и движение
Дофамин является основным передатчиком в экстрапирамидной системе мозга и играет важную роль в регуляции движений. Часть мозга, называемая базальными ганглиями, регулирует движение. Базальные ганглии, в свою очередь, зависят от определенного количества допамина. Когда в мозге наблюдается дефицит допамина, движения могут стать отсроченными и не скоординированными. С другой стороны, если есть избыток допамина, мозг заставляет организм делать ненужные движения, такие как повторяющиеся тики, которые о можно увидеть при синдроме Жиля де ла Туретта. Когда мозг не вырабатывает достаточное количество допамина, может развиться болезнь Паркинсона. Поэтому основным средством лечения болезни Паркинсона является препарат под названием L-допа, который стимулирует выработку допамина.
Допамин и психические болезни
Считается, что некоторые признаки шизофрении (социальная абстиненция, апатия, ангедония) связаны с низким уровнем допаминергического состояния в определенных областях мозга. И наоборот, люди, страдающие от болезней, таких как психоз, имеют в мозге чрезвычайно высокое количество допамина, что приводит к тому, что они очень чувствительны. Таким пациентам необходимо принимать антипсихотические препараты, которые помогают снизить уровень допамина и сделать их более спокойными.
Низкий уровень допамина может привести к синдрому дефицита внимания.
Возрастные когнитивные нарушения связаны с изменениями допамина в головном мозге.
Согласно недавним исследованиям, допамин, как полагают, играет роль в депрессии, наряду с серотонином и норэпинефрином, которые также являются нейротрансмиттерами.
Допамин и зависимости
Допамин в познании
Допамин в лобных долях головного мозга контролирует поток информации из других областей головного мозга. Нарушения допамина в этой области приводят к снижению нейрокогнитивных функций, таких как память, внимание и решение проблем.
Влияние допамина на настроение
Допамин и сон
Допамин и работа внутренних органов
Симптомы допаминового дефицита
Симптомы повышенного уровня дефицита
Повышенный уровень допамина связан с психическими расстройствами, такими как шизофрения или биполярное расстройство. Лекарства, которые назначают для этих состояний, часто являются ингибиторами допамина, которые задерживают передачу допамина от одного нейрона к другому.
Cпособы лечения дефицита допамина
Рассмотрите следующую тактику повышения уровня допамина.
1. Уменьшите потребление сахара. Сахар меняет химию мозга, нарушая уровень допамина. Система допамина активируется в ожидании ощущения удовольствия. Повторная активация системы поощрения дофамина, например, при употреблении большого количества сладких продуктов, заставляет мозг адаптироваться к частой стимуляции системы вознаграждения. Когда мы регулярно наслаждаемся большим количеством этих продуктов, система начинает меняться, чтобы предотвратить ее чрезмерную стимуляцию. В частности, дофаминовые рецепторы начинают подавляться. Теперь рецепторов дофамина становится меньше, поэтому в следующий раз, когда мы едим эти продукты, их эффект притупляется. В следующий раз, когда мы будем есть, нужно больше сахара, чтобы получить такое же чувство вознаграждения. Ограничение потребления сахара поможет бороться с этим круговоротом истощения допамина и сахара. Негативные последствия неограниченного потребления сладких продуктов включают увеличение веса, разрушение зубов и развитие метаболических нарушений, включая диабет 2 типа.
2. Принимайте тирозин. Когда клетки вашего мозга нуждаются в производстве нейротрансмиттеров для правильной регуляции настроения, они используют аминокислоты в качестве основного сырья. Аминокислоты являются строительными блоками белка, в котором нуждается наш организм. Мозг использует аминокислоту l-фенилаланин в качестве сырья (предшественника) для производства допамина. Фенилаланин является одной из незаменимых аминокислот. «Незаменимая» означает, что организм не может синтезировать ее сам, поэтому мы должны «добывать» ее из пищи. Как только организм получает фенилаланин, он преобразовывает его в тирозин, который, в свою очередь, используется для синтеза допамина. Таким образом, способ повысить уровни нейротрансмиттеров центральной нервной системы состоит в том, чтобы обеспечить надлежащее количество «сырья» для образования аминокислоты.
Другие продукты, которые увеличивают допамин за счет превращения фенилаланина в тирозин, включают миндаль, яблоки, арбузы, вишню, йогурт, бобы, яйца и мясо. Важно отметить, что одни только допаминсодержащие продукты обычно не содержат терапевтических уровней аминокислот, необходимых для повышения уровня допамина для тех, кто испытывает серьезные депрессивные расстройства.
Ешьте бананы. Они содержит дофамин в высоких уровнях как в кожуре, так и в мякоти. Уровни допамина колеблются от 80-560 мг на 100 г в кожуре и 2,5-10 мг в мякоти (3). Для повышения уровня допамина одной только пищи может быть недостаточно. Могут помочь добавки тирозина.
Тирозин содержится в продуктах, богатых белками, таких как индейка, говядина, яйца, молочные продукты, соя и бобовые.
3. Уменьшите потребление кофеина.
4. Придерживайтесь здорового распорядка бодрствования и сна. Вы должны распределить время для работы и для полноценного отдыха. В идеале, ваш день должен включать 7-8 часов сна в сутки в сочетании с периодами физической активности. Недосыпание, как и чрезмерный сон в сочетании с отсутствием регулярных физических упражнений могут истощить допаминовый запс. Полноценныйы сон дает мозгу время для восстановления сил после дня и пополнения запасов нейротрансмиттеров.
5. Не забывайте про физические упражнения. Они усиливают кровообращение, что повышает присутствие в мозгу гормонов, влияющих на уровень допамина.
6. Уменьшите уровень стресса. Высокий уровень стресса также тесно связан с дефицитом допамина. Стресс может быть вызван двумя причинами: плохой функцией надпочечников и хроническими стрессами в повседневной жизни. Хотя мы не всегда можем контролировать обстоятельства, существуют меры защиты от стресса, которые вы можете использовать, чтобы помочь вам справиться с повседневными проблемами.
7. Обратите внимание на магний. Дефицит магния может вызвать снижение уровня допамина, и, по оценкам экспертов, многие люди испытывает дефицит этого расслабляющего минерала.
8. Принимайте витамины. Допамин легко окисляется. Антиоксиданты, содержащиеся в витаминах (таких как витамины С и Е), защищают здоровье нейронов мозга, которые используют допамин. По этой причине многие врачи рекомендуют пациентам принимать поливитамины, чтобы помочь защитить нейроны от повреждения свободными радикалами. Общие симптомы дефицита магния включают в себя: тягу к еде (соль или углеводы), запоры, учащенное сердцебиение, аритмия, высокое кровяное давление, мышечные боли и спазмы, усталость, головные боли, депрессия, перепады настроения, беспокойство и раздражительность.
По материалам сайтов
1. University Health News (https://universityhealthnews.com)
2. https://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.1001347
3. ACS Publication (https://pubs.acs.org/doi/abs/10.1021/jf9909860)
Полезная информация, организации инвалидов, знакомства