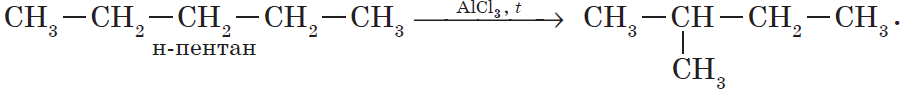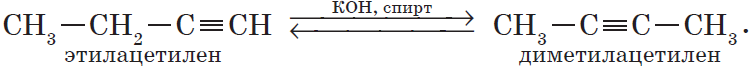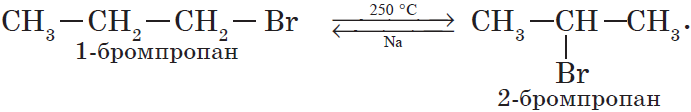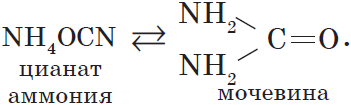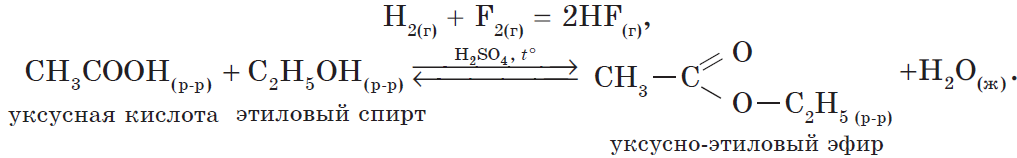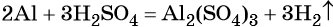все реакции в химии что с чем реагирует
Классификация химических реакций в неорганической и органической химии
Теория к заданию 19 из ЕГЭ по химии
Классификация химических реакций в неорганической и органической химии
Химические реакции, или химические явления, — это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и (или) строению.
При химических реакциях обязательно происходит изменение веществ, при котором рвутся старые и образуются новые связи между атомами.
Химические реакции следует отличать от ядерных реакций. В результате химической реакции общее число атомов каждого химического элемента и его изотопный состав не меняются. Иное дело ядерные реакции — процессы превращения атомных ядер в результате их взаимодействия с другими ядрами или элементарными частицами, например, превращение алюминия в магний:
Классификация химических реакций многопланова, т.е. в ее основу могут быть положены различные признаки. Но под любой из таких признаков могут быть отнесены реакции как между неорганическими, так и между органическими веществами.
Рассмотрим классификацию химических реакций по различным признакам.
Классификация химических реакций по числу и составу реагирующих веществ. Реакции, идущие без изменения состава вещества
В неорганической химии к таким реакциям можно отнести процессы получения аллотропных модификаций одного химического элемента, например:
В органической химии к этому типу реакций могут быть отнесены реакции изомеризации, которые идут без изменения не только качественного, но и количественного состава молекул веществ, например:
1. Изомеризация алканов.
Реакция изомеризации алканов имеет большое практическое значение, т.к. углеводороды изостроения обладают меньшей способностью к детонации.
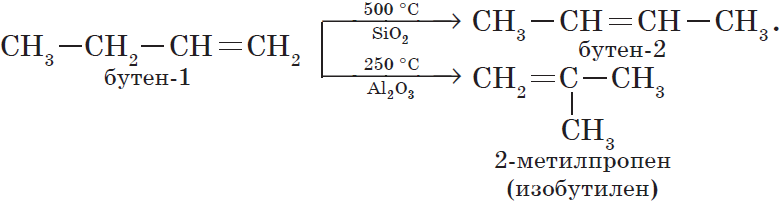
2. Изомеризация алкенов.
3. Изомеризация алкинов (реакция А. Е. Фаворского).
4. Изомеризация галогеналканов (А. Е. Фаворский).
5. Изомеризация цианата аммония при нагревании.
Впервые мочевина была синтезирована Ф. Велером в 1882 г. изомеризацией цианата аммония при нагревании.
Реакции, идущие с изменением состава вещества
Можно выделить четыре типа таких реакций: соединения, разложения, замещения и обмена.
1. Реакции соединения — это такие реакции, при которых из двух и более веществ образуется одно сложное вещество.
В неорганической химии все многообразие реакций соединения можно рассмотреть на примере реакций получения серной кислоты из серы:
1) получение оксида серы (IV):
$S+O_2=SO_2$ — из двух простых веществ образуется одно сложное;
2) получение оксида серы (VI):
3) получение серной кислоты:
$SO_3+H_2O=H_2SO_4$ — из двух сложных веществ образуется одно сложное.
Примером реакции соединения, при которой одно сложное вещество образуется из более чем двух исходных, может служить заключительная стадия получения азотной кислоты:
В органической химии реакции соединения принято называть реакциями присоединения. Все многообразие таких реакций можно рассмотреть на примере блока реакций, характеризующих свойства непредельных веществ, например этилена:
1) реакция гидрирования — присоединение водорода:
2) реакция гидратации — присоединение воды:
3) реакция полимеризации:
2. Реакции разложения — это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ.
В неорганической химии все многообразие таких реакций можно рассмотреть на примере блока реакций получения кислорода лабораторными способами:
1) разложение оксида ртути (II):
$2HgO<→>↖
2) разложение нитрата калия:
$2KNO_3<→>↖
3) разложение перманганата калия:
$2KMnO_4<→>↖
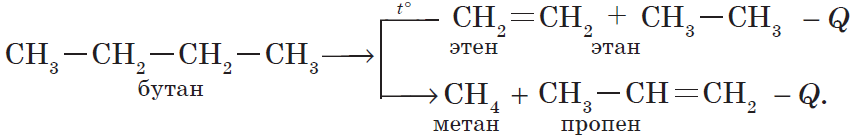
В органической химии реакции разложения можно рассмотреть на примере блока реакций получения этилена в лаборатории и промышленности:
1) реакция дегидратации (отщепления воды) этанола:
2) реакция дегидрирования (отщепления водорода) этана:
3) реакция крекинга (расщепления) пропана:
3. Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы какого-либо элемента в сложном веществе.
В неорганической химии примером таких процессов может служить блок реакций, характеризующих свойства, например, металлов:
1) взаимодействие щелочных и щелочноземельных металлов с водой:
2) взаимодействие металлов с кислотами в растворе:
3) взаимодействие металлов с солями в растворе:
Предметом изучения органической химии являются не простые вещества, а только соединения. Поэтому как пример реакции замещения приведем наиболее характерное свойство предельных соединений, в частности метана, — способность его атомов водорода замещаться на атомы галогена:
Другой пример — бромирование ароматического соединения (бензола, толуола, анилина):
Обратим внимание на особенность реакций замещения у органических веществ: в результате таких реакций образуются не простое и сложное вещества, как в неорганической химии, а два сложных вещества.
В органической химии к реакциям замещения относят и некоторые реакции между двумя сложными веществами, например, нитрование бензола:
Она формально является реакцией обмена. То, что это реакция замещения, становится понятным только при рассмотрении ее механизма.
4. Реакции обмена — это такие реакции, при которых два сложных вещества обмениваются своими составными частями.
В неорганической химии это может быть блок реакций, характеризующих, например, свойства щелочей:
1) реакция нейтрализации, идущая с образованием соли и воды:
2) реакция между щелочью и солью, идущая с образованием газа:
3) реакция между щелочью и солью, идущая с образованием осадка:
В органической химии можно рассмотреть блок реакций, характеризующих, например, свойства уксусной кислоты:
2) реакция, идущая с образованием газа:
3) реакция, идущая с образованием осадка:
Классификация химических реакций по изменению степеней окисления химических элементов, образующих вещества
Реакции, идущие с изменением степеней окисления элементов, или окислительно-восстановительные реакции.
К ним относится множество реакций, в том числе все реакции замещения, а также те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество, например:
Как вы помните, сложные окислительно-восстановительные реакции составляются с помощью метода электронного баланса:
В органической химии ярким примером окислительно-восстановительных реакций могут служить свойства альдегидов:
1. Альдегиды восстанавливаются в соответствующие спирты:
2. Альдегиды окисляются в соответствующие кислоты:
Реакции, идущие без изменения степеней окисления химических элементов.
К ним, например, относятся все реакции ионного обмена, а также:
Классификация химических реакций по тепловому эффекту
По тепловому эффекту реакции делят на экзотермические и эндотермические.
Эти реакции протекают с выделением энергии.
К ним относятся почти все реакции соединения. Редкое исключение составляют эндотермические реакции синтеза оксида азота (II) из азота и кислорода и реакция газообразного водорода с твердым иодом:
Экзотермические реакции, которые протекают с выделением света, относят к реакциям горения, например:
Гидрирование этилена — пример экзотермической реакции:
Она идет при комнатной температуре.
Эндотермические реакции
Эти реакции протекают с поглощением энергии.
Очевидно, что к ним относятся почти все реакции разложения, например:
а) обжиг известняка:
Количество выделенной или поглощенной в результате реакции энергии называют тепловым эффектом реакции, а уравнение химической реакции с указанием этого эффекта называют термохимическим уравнением, например:
Классификация химических реакций по агрегатному состоянию реагирующих веществ (фазовому составу)
Это реакции, в которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях (в разных фазах):
Это реакции, в которых реагирующие вещества и продукты реакции находятся в одном агрегатном состоянии (в одной фазе):
Классификация химических реакций по участию катализатора
Некаталитические реакции идут без участия катализатора:
Каталитические реакции идут с участием катализатора:
Так как все биологические реакции, протекающие в клетках живых организмов, идут с участием особых биологических катализаторов белковой природы — ферментов, все они относятся к каталитическим или, точнее, ферментативным.
Классификация химических реакций по направлению
Необратимые реакции протекают в данных условиях только в од ном направлении.
К ним можно отнести все реакции обмена, сопровождающиеся образованием осадка, газа или малодиссоциирующего вещества (воды), и все реакции горения.
Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях.
Таких реакций подавляющее большинство.
В органической химии признак обратимости отражают названия-антонимы процессов:
Обратимы все реакции этерификации (противоположный процесс, как вы знаете, носит название гидролиза) и гидролиза белков, сложных эфиров, углеводов, полинуклеотидов. Обратимость лежит в основе важнейшего процесса в живом организме — обмена веществ.
Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях
Химической реакцией называют взаимодействия, приводящие к изменению химической природы участвующих в них частиц. При этом происходит изменение их состава и (или) строения. В химических реакциях могут участвовать атомы, молекулы, ионы и радикалы.
В ходе химических реакций атомные ядра не затрагиваются и число атомов каждого химического элемента сохраняется.
Химические реакции протекают при определённых условиях (температура, давление, наличие или отсутствие растворителя, катализа, ультрафиолетовое излучение).
Признаками протекания химических реакций являются выделение или поглощение газа, образование или растворение осадка, изменение цвета, выделение или поглощение теплоты.
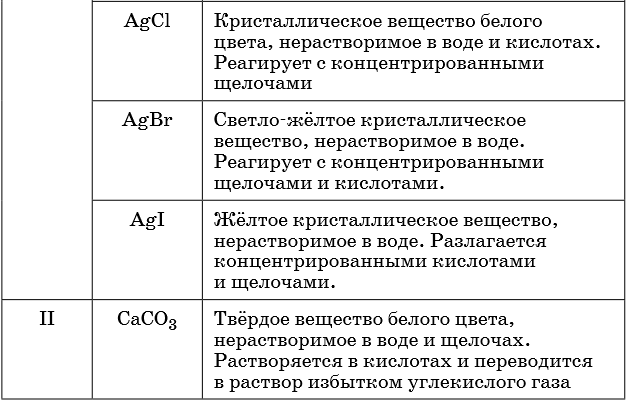
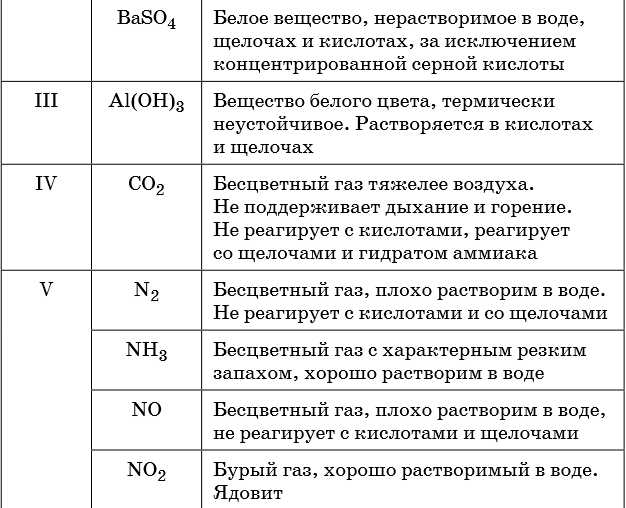
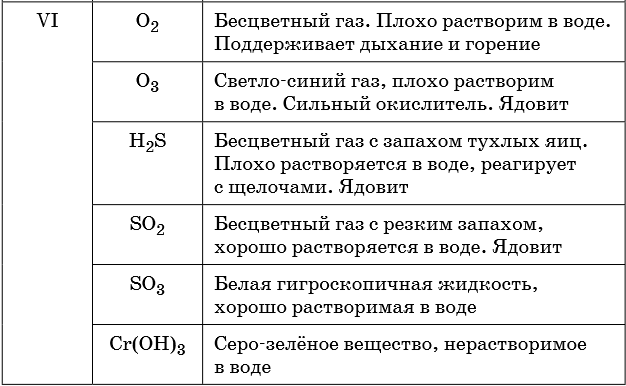
Описание качественных реакций, используемых для определения некоторых катионов и анионов, приводится в приложении в конце урока.
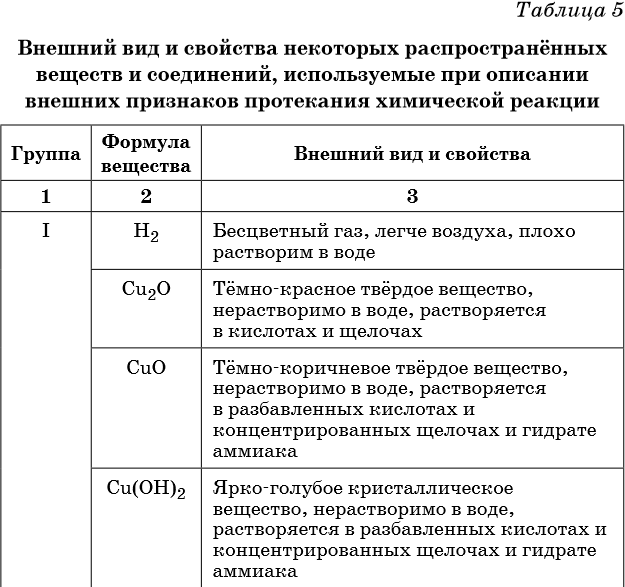
В таблице 5 представлены сведения о внешнем виде и свойствах некоторых распространённых веществ и соединений, используемых при описании внешних признаков протекания химической реакции.
Для описания химических реакций используют химические уравнения, в левой части которых указывают исходные вещества, а в правой — продукты реакции. Обе части химического уравнения соединяют стрелкой (в случае необратимых химических превращений), а если химическая реакция является обратимой, то это показывают с помощью прямой и обратной стрелок.
В неорганической химии, если количество атомов химических элементов в левой и правой частях уравнено с помощью стехиометрических коэффициентов, части уравнения часто соединяют знаком равенства.
Стехиометрией называют учение о количественных соотношениях между реагентами и продуктами реакции.
Коэффициенты стехиометрические — действительные натуральные (то есть положительные, как правило, целые) числа, стоящие перед формулой химического вещества в уравнении реакции. Коэффициенты показывают минимальное количество структурных единиц вещества (атомов, молекул, ионов, радикалов), участвующих в данной реакции.
В вышеприведённой реакции два атома алюминия реагируют с тремя молекулами серной кислоты, в результате чего образуется одна молекула сульфата алюминия (коэффициент, равный одному, перед формулой не ставят) и три молекулы водорода.
В соответствии с законом сохранения массы (закон Ломоносова — Лавуазье) масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Этот закон подтверждает, что атомы являются неделимыми и в ходе химических реакций не изменяются. Молекулы при реакциях претерпевают изменения, но общее число атомов каждого вида не изменяется, и поэтому общая масса веществ в процессе реакции сохраняется.
Тренировочные задания
1. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) растворение осадка
2) выделение чёрного осадка
3) отсутствие внешних признаков
4) выделение синего осадка
2. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) растворение осадка
3) выделение белого осадка
4) выделение синего осадка
3. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение жёлто-зелёного газа
3) выделение жёлтого осадка
4) растворение осадка
4. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) появление оранжевой окраски
2) выделение газа с характерным запахом
3) растворение осадка
4) отсутствие внешних признаков
5. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) отсутствие внешних признаков
3) выделение белого осадка
4) выделение чёрного осадка
6. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Zn и KOH
В) HCl и FeS
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) выделение газа с характерным запахом
3) выделение бесцветного газа
4) выделение чёрного осадка
7. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
8. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
9. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение синего осадка
2) растворение осадка
3) выделение белого осадка
4) выделение бурого осадка
10. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Al и NaOH
В) HCl и K2SO3
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка
11. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) отсутствие внешних признаков
12. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Cu и HNO3 (конц.)
Б) Cu и H2SO4 (конц.)
В) BaCO3 и HCl
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение бесцветного газа
13. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
14. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого осадка
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
15. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа
3) выделение белого осадка
4) выделение чёрного осадка
16. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
17. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение чёрного осадка
18. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
19. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) выделение студенистого бесцветного осадка
20. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка
Химическая реакция
Хими́ческая реа́кция — превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не меняются, в частности не изменяется их общее число, изотопный состав химических элементов, при этом происходит перераспределение электронов и ядер и образуются новые химические вещества.
Химические реакции происходят при смешении или физическом контакте реагентов самопроизвольно, при нагревании, участии катализаторов (катализ), действии света (фотохимические реакции), электрического тока (электродные процессы), ионизирующих излучений (радиационно-химические реакции), механического воздействия (механохимические реакции), в низкотемпературной плазме (плазмохимические реакции) и т. п. Взаимодействие молекул между собой происходит по цепному маршруту: ассоциация — электронная изомеризация — диссоциация, в котором активными частицами являются радикалы, ионы, координационно-ненасыщенные соединения. Скорость химической реакции определяется концентрацией активных частиц и разницей между энергиями связи разрываемой и образуемой.
Содержание
Классификация
Существует большое количество признаков, по которым можно классифицировать химические реакции.
По фазовому составу реагирующей системы
По изменению степеней окисления реагентов
В данном случае различают
Пример окислительно-восстановительной реакции — горение водорода (восстановитель) в кислороде (окислитель) с образованием воды:
Пример реакции диспропорционирования — реакция разложения нитрата аммония при нагревании. Окислителем в данном случае выступает азот (+5) нитрогруппы, а восстановителем — азот (-3) катиона аммония:
По тепловому эффекту реакции
Все реакции сопровождаются тепловыми эффектами. При разрыве химических связей в реагентах выделяется энергия, которая, в основном, идет на образование новых химических связей. В некоторых реакциях энергии этих процессов близки, и в таком случае общий тепловой эффект реакции приближается к нулю. В остальных случаях можно выделить:
Тепловой эффект реакции (энтальпию реакции, ΔrH), часто имеющий очень важное значение, можно вычислить по закону Гесса, если известны энтальпии образования реагентов и продуктов. Когда сумма энтальпий продуктов меньше суммы энтальпий реагентов (ΔrH 0) — поглощение.
По типу превращений реагирующих частиц
Химические реакции всегда сопровождаются физическими эффектами: поглощением и выделением энергии, например в виде теплопередачи, изменением агрегатного состояния реагентов, изменением окраски реакционной смеси и др. Именно по этим физическим эффектам часто судят о протекании химических реакций.
Химические процессы, протекающие в веществе, отличаются и от физических процессов, и от ядерных превращений. В физических процессах каждое из участвующих веществ сохраняет неизменным свой состав (хотя вещества могут образовывать смеси), но могут изменять внешнюю форму или агрегатное состояние.
В химических процессах (химических реакциях) получаются новые вещества с отличными от реагентов свойствами, но никогда не образуются атомы новых элементов. В атомах же участвующих в реакции элементов обязательно происходят видоизменения электронной оболочки.
В ядерных реакциях происходят изменения в атомных ядрах всех участвующих элементов, что приводит к образованию атомов новых элементов.
С помощью химических реакций можно получать практически важные вещества, которые в природе находятся в ограниченных количествах, например азотные удобрения, либо вообще не встречаются по каким-либо причинам, например сульфаниламиды и другие синтетические лекарственные препараты, полиэтилен и другие пластмассы. Химия позволяет синтезировать новые, неизвестные природе вещества, необходимые для жизнедеятельности человека. Вместе с тем, неумелое или безответственное химическое воздействие на окружающую среду и на протекающие природные процессы может привести к нарушению установившихся естественных химических циклов, что делает актуальной экологическую проблему (загрязнение окружающей среды) и усложняет задачу рационального использования природных ресурсов и сохранения естественной среды обитания на Земле.
Химические реакции их классификация (Схема, Таблица)
Химическая реакция — это превращение одного или нескольких исходных веществ (реагентов) в другие вещества, при этом ядра атомов не меняются, происходит только перераспределение электронов и ядер, и образуются новые химические вещества. При химических реакциях не изменяется общее число ядер атомов и изотопный состав химических элементов (в отличие от ядерных реакций).
Классификация химических реакций схема
Химические реакции классифицируются по тепловому эффекту, по изменению степени окисления атомов в реагирующих веществах, по числу и составу исходных и образующихся веществ, и по признаку обратимости.
Классификация химических реакций по числу и составу исходных и образующихся веществ
Реакция, в которой из одного исходного вещества образуется несколько новых веществ
Реакция между простым и сложным веществами, в результате которой атомы простого вещества замещают атомы одного из элементов сложного вещества
Реакция, в результате которой два вещества обмениваются своими составными частями, образуя два новых вещества
NaOH + HCl → NaCl + H2O
Реакция, в результате которой из двух или нескольких веществ образуется одно новое
Классификация химических реакций по тепловому эффекту
Тепловой эффект химической реакции — это количество теплоты (Q), которое выделяется или поглощается в химической реакции.
Реакция, проходящая с поглощением теплоты
Реакция, проходящая с выделением теплоты
Термохимическое уравнение — уравнение химической реакции, в котором указан тепловой эффект реакции:
Термохимические расчеты основаны на законе Гесса:
— тепловой эффект химической реакции зависит от состояний исходных веществ и продуктов реакций, но не зависит от промежуточных стадий процесса
— тепловой эффект химической реакции равен сумме теплот образования продуктов реакции эа вычетом суммы теплот образования исходных веществ
Классификация химических реакций по признаку обратимости
Такая реакция, которая в данных условиях протекает одновременно в двух взаимно противоположных направлениях
Такая реакция, которая в данных условиях протекает до конца, т. е. до полного превращения исходных реагирующих веществ в конечные продукты реакции
Таблица признаки необратимости реакций
Реакция идет с выделением большого количества теплоты
Хотя бы один продукт реакции покидает сферу реакции (выпадает в осадок или выделяется в виде газа)
В результате реакции образуются малодиссоциируе-мые вещества
HCl + NaOH → NaCl + H2O
Классификация химических реакций по изменению степени окисления
Проходящая с изменением степени окисления атомов (окислительно-восстановительная)
реакция, при которой происходит переход электронов от одних атомов, молекул или ионов к другим
Проходящая без изменения степени окисления
Реакция, в которой степень окисления каждого атома после реакции остается неизменной
Влияние изменения условий на положение химического равновесия
Изменение условий, при которых система находится в состоянии химического равновесия
Изменение скоростей прямой и обратной реакции в начальный момент
Направление смешения положения равновесия
В большей степени возрастает скорость эндотермической реакции
В сторону эндотермической реакции
В большей степени понижается скорость эндотермической реакции
В сторону экзотермической реакции
В большей степени возрастает скорость реакции, протекающей с уменьшением числа молей газообразных веществ
В сторону уменьшения числа молей газообразных веществ в системе
В большей степени понижается скорость реакции протекающей с уменьшением числа молей газообразных веществ
В сторону увеличения числа молей газообразных веществ в системе
Возрастает скорость реакции, по которой вводимое вещество расходуется
В сторону реакции, по которой вводимое вещество расходуется
Уменьшается скорость реакции, где реагентом является вещество, концентрация которого уменьшается
В сторону реакции, по которой образуется вещество, концентрация которого уменьшается
Скорости прямой и обратной реакции изменяются одинаково