временная дисплазия это что
Это страшное слово дисплазия
Дисплазия соединительной ткани – это состояние, при котором имеет место врожденное нарушение строения и функции соединительной ткани
Признаки дисплазии соединительной ткани столь многолики, что пациенты с данной патологией могут наблюдаться одновременно несколькими специалистами поликлиники – кардиологом, неврологом, окулистом, отоларингологом и др. Степень распространенности дисплазии соединительной ткани (ДСТ) в общей популяции людей на сегодняшний день не известна, поскольку данные, приводимые в научной литературе, варьируют в широком диапазоне (от 14 до 85 %). Но специалисты считают, что эта патология имеет преимущественно женское лицо и передается по наследству.
Что же такое дисплазия соединительной ткани?
Дисплазия соединительной ткани – это состояние, при котором имеет место врожденное нарушение строения и функции соединительной ткани.
Степень распространенности дисплазии соединительной ткани (ДСТ) в общей популяции людей на сегодняшний день не известна, поскольку данные, приводимые в научной литературе, варьируют в широком диапазоне (от 14 до 85 %). Но специалисты считают, что эта патология имеет преимущественно женское лицо и передается по наследству.
Все дело в коллагене.
По своей значимости соединительная ткань занимает в организме особое место, составляя около 50% всей массы тела. Распространенная по всему организму соединительная ткань представлена в дерме кожи, подкожной клетчатке, сухожилиях, связках, суставных хрящах, межпозвонковых дисках, костях, клапанах сердца, кровеносных сосудах, дентине и эмали зубов, в структурах глаза и т.д. Нет ни одного органа и системы, которые не содержали бы основные структурные элементы соединительной ткани. А болезнь возникает из-за молекулярных изменений структурных элементов соединительной ткани, преимущественно коллагена.
Каковы же симптомы дисплазии соединительной ткани?
Уважаемому читателю, вероятно, хорошо эти признаки знакомы. Это
И задача врача общей практики за частной симптоматикой увидеть системную патологию.
Пролапс митрального клапана
В настоящее время наиболее изученным проявлением синдрома дисплазии соединительной ткани сердца является пролапс митрального клапана (ПМК). Проблема ПМК привлекает к себе пристальное внимание врачей из-за большой частоты в популяции и повышенного риска развития серьезных осложнений. Большинство исследователей предполагают, что в развитии ПМК наряду со «слабостью» соединительной ткани немаловажную роль играет дефицит магния. С дефицитом магния связывают полиморфизм и выраженность клинической симптоматики у этих пациентов. Поэтому лечение магнием рассматривается как специфическая, учитывающая генез заболевания, терапия ПМК.
Таким образом, дисплазия соединительной ткани, сопровождающаяся выраженными клиническими и структурными нарушениями, изменениями функционального состояния сердечно-сосудистой системы, уменьшением содержания магния в волосах, снижает качество жизни и трудоспособность пациентов. Обладает прогредиентным течением и утяжеляет течение сопутствующей патологии (легочной, сердечно-сосудистой, почечной и т.д.).
Поэтому раннее выявление отклонений от нормы и профилактические мероприятия, направленные на коррекцию нарушений, способствуют благоприятному прогнозу.
Запись на прием к врачу терапевту
Обязательно пройдите консультацию квалифицированного специалиста в клинике «Семейная».
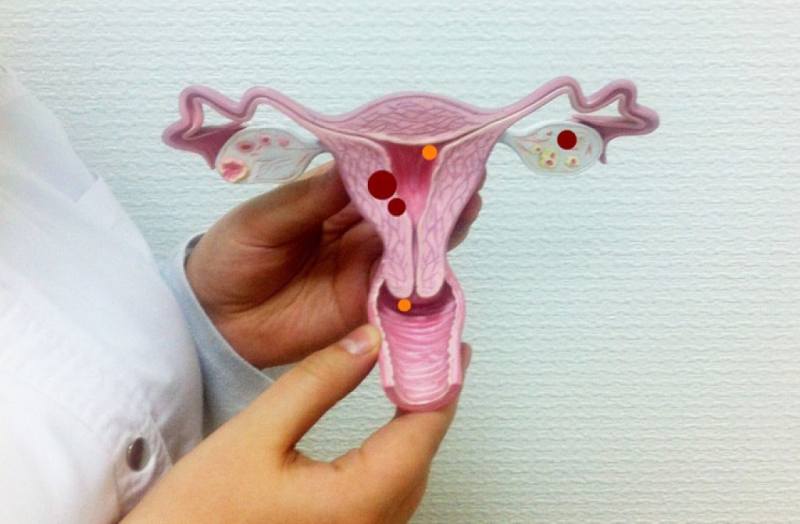
Дисплазия шейки матки
Дисплазия шейки матки — это патологические изменения в эпителиальном слое шейки матки, которые могут привести к образованию злокачественной опухоли. Аналоговые названия: шеечное внтуриэпитальное новообразование, цервикальная интраэпителиальная неоплазия — сокращенно ЦИН или CIN.
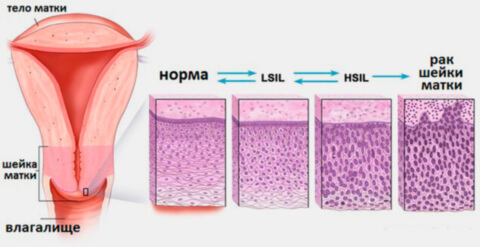
Дисплазия — это обратимая трансформация тканей шейки матки в аномальное состояние. Переход происходит постепенно и незаметно для женщины — в этом заключается главная опасность патологии.
Эпителиальный слой слизистой шейки матки представляет собой последовательность из базального, промежуточного и поверхностного слоев. В базальном происходит деление клеток, в промежуточном они дозревают, а поверхностный выполняет барьерную функцию. При дисплазии, среди нормальных клеток появляются атипичные: многоядерные, неправильной формы, размеров и аномально расположенных по отношению к базальной мембране. В результате развивается утолщение (гиперплазия) и разрастание клеток (пролиферация) в слоях эпителия. Из-за этого невозможно нормальное обновление, созревание, старение и отторжение клеток. До определенного момента дисплазия не опасна. Однако в запущенном состоянии она может привести к серьезным проблемам — развитию раковой опухоли. Поэтому своевременная диагностика и лечение дисплазии предотвращает развитие рака в шейке матки.
Виды дисплазии шейки матки
После проведения биопсии шейки матки специалист под микроскопом изучит гистологическое строение взятого материала. При наличии патологии будут обнаружены аномальные эпителиальные клетки со множеством мелких ядрышек или чрезмерно крупным бесформенным ядром с нечеткими границами. Далее необходимо определить степень глубины поражения и состояния клеток на соответствующих слоях.
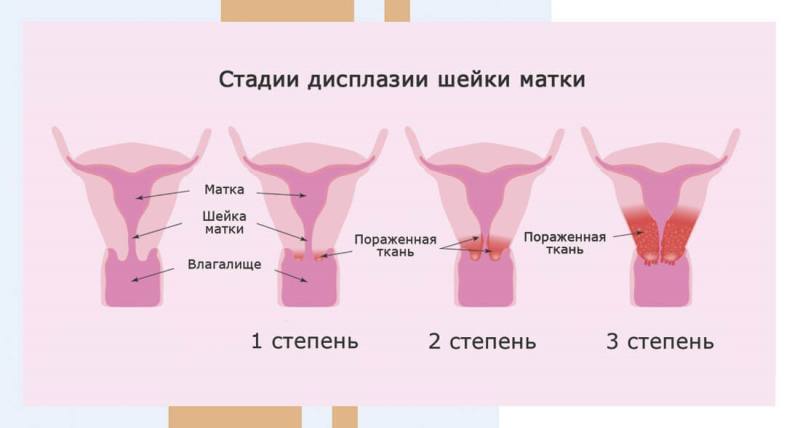
Стадии (степени тяжести) дисплазии шейки матки означают глубину распространения измененных клеток в шейке матки. Счет для определения толщины поражения эпителиального слоя органа ведется от базальной мембраны:
Легкая стадия довольно редко переходит в умеренную или тяжелую стадию: этому способствуют неправильный образ жизни, слабый иммунитет и отсутствие периодических осмотров у гинеколога. Время перехода в рак в глубокие ткани шейки матки:
Причины дисплазии шейки матки
Основная причина образования атипичных клеток в шейке матки — онкогенные штаммы вируса папилломы человека (ВПЧ16 и ВПЧ18). Анализ на обнаружение этого вируса является положительным в 95-98% случаях дисплазии шейки матки. Поэтому ВПЧ принято считать пусковым механизмом в образовании и развитии заболевания.
Папилломавирус — это инфекционное заболевание, передающееся половым путем, поражающее кожные покровы. Наиболее частое его проявление: папилломы и бородавки.
При диагностике даже легкой формы неоплазии врач обращает внимание на следующие факторы:
Причины возникновения дисплазии:
Состояние иммунодефицита может привести к развитию дисплазии шейки матки и ее трансформации в раковую опухоль. Поэтому врачу нужно знать о частоте воспалительных процессов в организме человека, наличии хронических заболеваний. Также нужно рассказать лечащему доктору о характере питания, стрессах, лечении препаратами, которые снижают иммунитет.
Долгое время считалось, что дисплазия — «болезнь молодых», что ей подвержены девушки в возрасте 20-30 лет. Однако современные данные показывают, что трансформация клеток в эпителии шейки матки может начаться в любом возрасте, включая период после 70 лет.
Симптомы
Дисплазию невозможно диагностировать по конкретным симптомам или признакам за исключением редких случаев (см. ниже). Выявить патологию возможно только по результатам обследования врачом и сдачи анализов.
Но стоит обратиться за дополнительным обследованием к специалисту если имеют место быть:
Выраженной, но не очевидной симптоматикой обладает только третья степень неоплазии:
Признаки дисплазии шейки матки
При легкой форме ЦИН эпителий выглядит гладким, однородным по цвету;
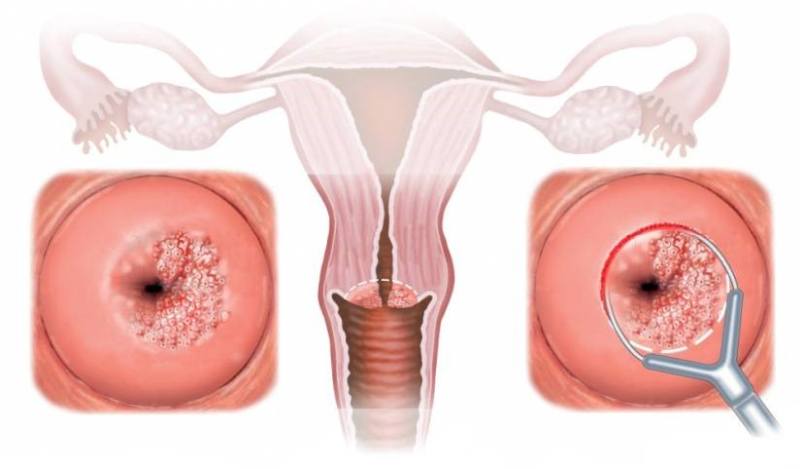
При умеренной дисплазии ткани отличаются явными изменениями в структуре клеток, которые определяются визуально и пальпированием. Именно поэтому врачи часто называют дисплазию эрозией, чтобы пациентке было понятно, что с ее органом происходит и как он выглядит на данный момент. Но все-таки данные патологии имеют существенное отличие: эрозия — разъедание тканей, дисплазия — патологическая трансформация ткани.
Тяжелая ЦИН характеризуется поражением слизистой оболочки влагалищного отдела шейки матки. Кроме того, у женщин старше 40 лет, патологические процессы могут проходить и в канале шейки матки.
Диагностика
В целях профилактики дисплазии шейки матки необходимо периодически бывать на приеме гинеколога, проходить скрининговый осмотр и сдавать анализы на ВПЧ. Раз в три года рекомендуется проходить цитологический анализ, особенно если женщина находится в группе риска. Также превентивной мерой для девушек является вакцинация от вируса ВПЧ: ее можно проводить в возрасте от 11 до 26 лет (но не младше 9 лет и старше 26).
Методы диагностики дисплазии шейки матки
Инструментальные и клинические:
К каким специалистам нужно обратиться
Естественно, первым специалистом в данной области выступает гинеколог — только он может диагностировать дисплазию, провести необходимые анализы и осмотр. Однако ЦИН редко вызывается одним лишь вирусом папилломы. Поэтому необходимо пройти обследование и в случае необходимости — лечение у следующих врачей:
Лечение
Степень и глубина поражения, а также длительность течения заболевания определяют тактику лечения дисплазии шейки матки.
Можно выделить общие особенности для всех стадий ЦИН:
Способ лечения выбирается врачом на основании:
Методы лечения в зависимости от степени заражения
Легкая степень — используется выжидательная тактика и применяются общеукрепляющие препараты. На данном этапе требуется не допустить инфекционно-воспалительных заболеваний, а также регулярно появляться на осмотре у гинеколога.
Средняя степень — зависит от глубины поражения и скорости распространения: в 70% неглубокое проникновение излечивается самостоятельно, однако при выявлении ВПЧ лечение начинается незамедлительно.
Обычно на данном этапе требуется медикаментозное лечение:
При неэффективности консервативного лечения, а также при упорном течении заболевания проводится хирургическое вмешательство:
Тяжелая степень — лечение проходит теми же методами, что и при диагностировании умеренной дисплазии. При этой степени заболевания лечение необходимо осуществить в срочном порядке. Из хирургических методов, как правило, применяется конизация шейки матки.
Методы хирургического лечения
Ножевая конизация
Это старый и уже почти ушедший в прошлое метод удаления пораженных дисплазией тканей с помощью скальпеля. Фактически не используется из-за высокой эффективности и безопасности других методов.
Прижигание электротоком
Этот метод также известен как петлевая электроэксцизия, диатермокоагуляция. Механизм заключается в удалении трансформированных тканей посредством электротока. Способ эффективный, но не рекомендуется молодым и нерожавшим женщинам: после процедуры на шейке матки остаются рубцы, что может привести к бесплодию или преждевременным родам.
Прижигание проводится амбулаторно — не требуется ложиться в больницу. Процедура безболезненная, поскольку перед началом операции врач введет обезболивающий укол.
Лазерное удаление
Лазерное излучение безопаснее использования электротока, поскольку не оставляет на шейке матки рубцовых деформаций. Различают лазерную вапоризацию и лазерную конизацию шейки матки.
Лазерная вапоризация означает выпаривание зараженных участков без удаления здоровых тканей. Процедура безболезненна и безопасна для молодых нерожавших женщин, планирующих иметь детей. Операция занимает около получаса и проводится в амбулаторных условиях.
Лазерная конизация — способ отсечения пораженных тканей лазерным лучом. Этот метод используется в том числе для того, чтобы провести гистологическое исследование клеток, пораженных дисплазией. Процедура проводится под общей анестезией, поскольку требует точности в наведении луча, иначе могут пострадать здоровые участки шейки матки.
Радиоволновой метод
Один из самых популярных и доступных способ избавления от дисплазии, рекомендован молодым и нерожавшим пациенткам, считается безопасным и эффективным методом. В данном случае используется аппарат «Сургитрон».
Криодеструкция
Разрушение очагов дисплазии путем их замораживания жидким азотом. Метод безопасный, поскольку не затрагивает здоровые участки органа. Процедура проводится в амбулаторных условиях и не требует введения обезболивающих. После криодеструкции у пациентки могут начаться водянистые прозрачные выделения желтоватого оттенка.
Для исключения рецидива после лечения пациенткам необходим регулярный осмотр у гинеколога и пройти профилактическое обследование (мазок на цитологию, анализы на ВПЧ, кольпоскопия).
Лечение дисплазии при беременности
Дисплазия шейки матки не сказывается отрицательно на зачатии, вынашивании или развитии плода. Поэтому хирургическое вмешательство рекомендовано отложить на послеродовой период.
Также нужно помнить о риске преждевременных родов у женщин, которые прошли лечение дисплазии посредством конизации шейки матки.
Профилактика заболевания
Чтобы снизить риск развития патологии, а также исключить рецидивы дисплазии, необходимо соблюдать простые правила:
Андрей Леонидович
Провизор
Дисплазия шейки матки – предраковое состояние, характеризующееся структурными и функциональными изменениями клеток слизистого эпителия ШМ. В отличие от эрозии, развивающейся в результате механического повреждения тканей, при дисплазии происходят клеточные атипические изменения, поэтому природа этих заболеваний совершенно разная. На начальных стадиях дисплазия шейки матки может никак себя не проявлять, поэтому важно хотя бы раз в год проходить профилактические осмотры для своевременной диагностики и эффективного консервативного лечения. На III степени прогрессирования дисплазия шейки матки может перерасти в рак. Диагностированием и лечением патологии занимается врач-гинеколог. Лечение дисплазии III стадии проводит онкогинеколог.
Степени дисплазии шейки матки
Причины дисплазии шейки матки
В большинстве случае предраковое заболевание развивается на фоне инфицирования ВПЧ, который, как правило, передается половым путем при незащищенном половом акте. Длительное нахождение вируса в организме и клетках плоского эпителия способствует атипичному клеточному перерождению и развитию дисплазии. В большинстве случаев иммунитет женщины обезвреживает инфекцию. Однако если иммунная защита нарушена, вирус неконтролируемо размножается, что приводит к патологическим изменениям в клетках.
Факторы риска развития дисплазии ШМ:
Симптомы
На ранних этапах дисплазия ШМ никак себя не проявляет. Отсутствует специфическая клиническая картина. Часто на фоне дисплазии присоединяется микробная инфекция, которая становится причиной развития цервицита, кольпита. Симптомы воспалительного процесса во влагалище:
В шейке матки отсутствуют нервные окончания, поэтому боль при дисплазии практически никогда не беспокоит. Однако женщину должны насторожить такие симптомы:
Дисплазия: симптомы и характерные признаки
Чем опасна дисплазия шейки матки?
Диагностика дисплазии ШМ на начальных стадиях и адекватная терапия под наблюдением опытного гинеколога позволяет полностью излечить заболевание и предотвратить малигнизацию измененных тканей. Отсутствие лечения на третьей стадии приводит к развитию грозного, смертельно опасного заболевания – рака шейки матки.
Цервикальный рак занимает третье место после рака молочной железы и рака эндометрия. Бессимптомное течение злокачественного процесса приводит к тому, что у более 40% пациенток онкологическое заболевание диагностируется на поздних (II-IV) стадиях. Это существенно влияет на благоприятность прогноза и эффективность лечения.
Диагностика
Установить точный диагноз и определиться с планом терапии помогут такие методы диагностики:
Лечение дисплазии шейки матки
Если результаты комплексной диагностики подтверждают наличие диспластических изменений в эпителии влагалищной части шейки матки, необходимо немедленно приступать к лечению. Отсутствие своевременной терапии способствует прогрессированию патологии и перерождению атипичных клеток в раковые.
Как лечить дисплазию шейки матки?
Дисплазию I стадии можно вылечить консервативным путем. Какие группы препаратов назначаются:
Дисплазия II-III стадии лечится хирургическим путем. Методы хирургического вмешательства:
Все лекарства, доступные к продаже в аптеках Вашего города, а также цены на них, Вы можете увидеть на нашем сайте, введя в поисковой строке название лекарства и запустив поиск.
Дисплазия соединительной ткани: основные клинические синдромы, формулировка диагноза, лечение
Дисплазия соединительной ткани (ДСТ) (dis — нарушения, рlasia — развитие, образование) — нарушение развития соединительной ткани в эмбриональном и постнатальном периодах, генетически детерминированное состояние, характеризующееся дефектами волокнистых стр
Дисплазия соединительной ткани (ДСТ) (dis — нарушения, рlasia — развитие, образование) — нарушение развития соединительной ткани в эмбриональном и постнатальном периодах, генетически детерминированное состояние, характеризующееся дефектами волокнистых структур и основного вещества соединительной ткани, приводящее к расстройству гомеостаза на тканевом, органном и организменном уровнях в виде различных морфофункциональных нарушений висцеральных и локомоторных органов с прогредиентным течением, определяющее особенности ассоциированной патологии, а также фармакокинетики и фармакодинамики лекарств [15, 24].
Данные о распространенности собственно ДСТ разноречивы [5, 14, 17], что обусловлено различными классификационными и диагностическими подходами. Распространенность отдельных признаков ДСТ имеет половозрастные различия [3]. По самым скромным данным показатели распространенности ДСТ, по меньшей мере, соотносятся с распространенностью основных социально значимых неинфекционных заболеваний.
ДСТ морфологически характеризуется изменениями коллагеновых, эластических фибрилл, гликопротеидов, протеогликанов и фибробластов, в основе которых лежат наследуемые мутации генов, кодирующих синтез и пространственную организацию коллагена, структурных белков и белково-углеводных комплексов, а также мутации генов ферментов и кофакторов к ним [1, 12, 23]. Некоторые исследователи, основываясь на выявляемом в 46,6–72,0% наблюдений при ДСТ дефиците магния в различных субстратах (волосы, эритроциты, ротовая жидкость), допускают патогенетическое значение гипомагниемии.
Одна из основополагающих характеристик дисплазии соединительной ткани как дисморфогенетического феномена — фенотипические признаки ДСТ могут отсутствовать при рождении или иметь очень незначительную выраженность (даже в случаях дифференцированных форм ДСТ) и, подобно изображению на фотобумаге, проявляться в течение жизни. С годами количество признаков ДСТ и их выраженность нарастает прогредиентно.
Классификация ДСТ — один из самых дискутабельных научных вопросов. Отсутствие единой, общепринятой классификации ДСТ отражает разногласие мнений исследователей по данной проблеме в целом. ДСТ может классифицироваться с учетом генетического дефекта в периоде синтеза, созревания или распада коллагена [1, 12]. Это перспективный классификационный подход, который дает возможность обосновать генетически дифференцированную диагностику ДСТ [23], однако на сегодняшний день данный подход ограничен наследственными синдромами ДСТ.
Т. И.Кадурина (2000 г.) выделяет MASS-фенотип, марфаноидный и элерсоподобный фенотипы, отмечая, что именно эти три фенотипа являются наиболее частыми формами несиндромной ДСТ. Это предложение является очень заманчивым, благодаря своей простоте и исходной идее, что несиндромные формы ДСТ являются «фенотипическими» копиями известных синдромов. Так, «марфаноидный фенотип» характеризуется сочетанием «признаков генерализованной дисплазии соединительной ткани с астеническим телосложением, долихостеномелией, арахнодактилией, поражением клапанного аппарата сердца (а порой и аорты), нарушением зрения». При «элерсоподобном фенотипе» отмечается «сочетание признаков генерализованной дисплазии соединительной ткани с тенденцией к гиперрастяжимости кожи и разной степенью выраженности гипермобильности суставов». «MASS-подобному фенотипу» присущи «признаки генерализованной дисплазии соединительной ткани, ряд нарушений со стороны сердца, скелетные аномалии, а также кожные изменения в виде истончения или наличия участков субатрофии». На основе этой классификации предлагается формулировать диагноз ДСТ [12].
Учитывая, что классификация любой патологии несет важный «прикладной» смысл — используется как основа для формулировки диагноза, решение классификационных вопросов являются очень важным с точки зрения клинической практики.
Универсальных патологических повреждений соединительной ткани, которые бы формировали конкретный фенотип, не существует. Каждый дефект у каждого больного в своем роде уникален. При этом всеобъемлющее распространение в организме соединительной ткани определяет полиорганность поражений при ДСТ. В связи с этим предлагается классификационный подход с обособлением синдромов, связанных с диспластикозависимыми изменениями и патологическими состояниями [15, 24].
Синдром неврологических нарушений: синдром вегетативной дисфункции (вегетососудистая дистония, панические атаки и др.), гемикрания.
Синдром вегетативной дисфункции формируется у значительного числа пациентов с ДСТ одним из самых первых — уже в раннем детском возрасте и рассматривается как обязательный компонент диспластического фенотипа [11, 12, 14, 15, 17]. У большинства пациентов выявляется симпатикотония, реже встречается смешанная форма, в малом проценте случаев — ваготония [9, 23]. Выраженность клинических проявлений синдрома нарастает параллельно тяжести ДСТ [11, 23]. Вегетативная дисфункция отмечается в 97% случаев наследственных синдромов, при недифференцированной форме ДСТ — у 78% пациентов. В формировании вегетативных нарушений у пациентов с ДСТ, несомненно, имеют значение генетические факторы, лежащие в основе нарушения биохимизма обменных процессов в соединительной ткани и формировании морфологических субстратов, приводящих к изменению функции гипоталамуса, гипофиза, половых желез, симпатико-адреналовой системы.
Астенический синдром: снижение работоспособности, ухудшение переносимости физических и психоэмоциональных нагрузок, повышенная утомляемость.
Астенический синдром выявляется в дошкольном и особенно ярко — в школьном, подростковом и молодом возрасте, сопровождая пациентов с ДСТ на протяжении всей жизни. Отмечается зависимость выраженности клинических проявлений астении от возраста больных: чем старше пациенты, тем больше субъективных жалоб.
Клапанный синдром: изолированные и комбинированные пролапсы клапанов сердца, миксоматозная дегенерация клапанов.
Чаще он представлен пролапсом митрального клапана (ПМК) (до 70%), реже — пролапсами трикуспидального или аортального клапанов, расширением корня аорты и легочного ствола; аневризмами синусов Вальсальвы. В части случаев выявленные изменения сопровождаются явлениями регургитации, что отражается на показателях контрактильности миокарда и объемных параметрах сердца. Durlach J. (1994) предположил, что причиной ПМК при ДСТ может быть дефицит магния.
Клапанный синдром начинает формироваться также в детском возрасте (4–5 лет). Аускультативные признаки ПМК выявляются в различном возрасте: от 4 до 34 лет, однако наиболее часто — в возрасте 12–14 лет. Следует отметить, что эхокардиографические данные находятся в динамическом состоянии: более выраженные изменения отмечаются при последующих осмотрах, что отражает влияние возраста на состояние клапанного аппарата. Кроме того, на выраженность клапанных изменений влияет степень тяжести ДСТ и объем желудочков.
Торакодиафрагмальный синдром: астеническая форма грудной клетки, деформации грудной клетки (воронкообразная, килевидная), деформации позвоночника (сколиозы, кифосколиозы, гиперкифозы, гиперлордозы и др.), изменения стояния и экскурсии диафрагмы.
Среди пациентов с ДСТ наиболее часто встречается воронкообразная деформация грудной клетки, на втором месте по частоте — килевидная деформация и наиболее редко выявляется астеническая форма грудной клетки.
Начало формирование торакодиафрагмального синдрома приходится на ранний школьный возраст, отчетливость проявлений — на возраст 10–12 лет, максимальная выраженность — на период 14–15 лет. Во всех случаях воронкообразная деформация отмечается врачами и родителями на 2–3 года раньше, чем килевидная.
Наличие торакодиафрагмального синдрома определяет уменьшение дыхательной поверхности легких, деформацию просвета трахеи и бронхов; смещение и ротацию сердца, «перекрут» основных сосудистых стволов. Качественные (вариант деформации) и количественные (степень деформации) характеристики торакодиафрагмального синдрома определяют характер и выраженность изменений морфофункциональных параметров сердца и легких. Деформации грудины, ребер, позвоночника и связанное с ними высокое стояние диафрагмы приводят к уменьшению грудной полости, повышению внутригрудного давления, нарушают приток и отток крови, способствуют возникновению аритмий сердца [13, 15]. Наличие торакодиафрагмального синдрома может повлечь за собой повышение давления в системе малого круга кровообращения [23, 27].
Сосудистый синдром: поражение артерий эластического типа: идиопатическое расширение стенки с формированием мешотчатой аневризмы; поражение артерий мышечного и смешанного типов: бифуркационно-гемодинамические аневризмы, долихоэктазии удлиненных и локальных расширений артерий, патологическая извитость вплоть до петлеобразования; поражение вен (патологическая извитость, варикозное расширение вен верхних и нижних конечностей, геморроидальных и др. вен); телеангиоэктазии; эндотелиальная дисфункция.
Изменения сосудов сопровождаются повышением тонуса в системе крупных, мелких артерий и артериол, уменьшением объема и скорости наполнения артериального русла, снижением венозного тонуса и избыточным депонированием крови в периферических венах.
Сосудистый синдром, как правило, манифестирует в подростковом и молодом возрасте, прогрессируя с увеличением возраста пациентов.
Изменения артериального давления: идиопатическая артериальная гипотензия.
Торакодиафрагмальное сердце: астенический, констриктивный, ложностенотический, псевдодилатационный варианты, торакодиафрагмальное легочное сердце.
Формирование торакодиафрагмального сердца происходит параллельно манифестации и прогрессированию деформации грудной клетки и позвоночника, на фоне клапанного и сосудистого синдромов. Варианты торакодиафрагмального сердца служат отражением нарушения гармоничности взаимоотношений веса и объема сердца, веса и объема всего тела, объема сердца и объема больших артериальных стволов на фоне диспластикозависимой дезорганизации роста тканевых структур самого миокарда, в частности, его мышечных и нервных элементов.
У пациентов с типичной астенической конституцией формируется астенический вариант торакодиафрагмального сердца, характеризующийся уменьшением размеров камер сердца при «нормальной» систолической и диастолической толщине стенок и межжелудочковой перегородки, «нормальных» показателях миокардиальной массы, — формирование истинного малого сердца. Сократительный процесс в данной ситуации сопровождается увеличением циркулярного стресса и внутримиокардиального напряжения в циркулярном направлении в систолу, что свидетельствовало о гиперреактивности компенсаторных механизмов на фоне преобладавших симпатических влияний. Установлено, что определяющими факторами в изменении морфометрических, объемных, контрактильных и фазовых параметров сердца являются форма грудной клетки и уровень физического развития костно-мышечного аппарата [15].
У части больных с выраженной формой ДСТ и различными вариантами деформации грудной клетки (воронкообразная деформация I, II степени) в условиях уменьшения объема грудной полости наблюдается «перикардитоподобная» ситуация с развитием диспластикозависимого констриктивного сердца. Уменьшение максимальных размеров сердца с изменением геометрии полостей при этом носит гемодинамически неблагоприятный характер, сопровождаясь уменьшением толщины стенок миокарда в систолу. При уменьшении ударного объема сердца происходит компенсаторное повышение общего периферического сопротивления.
У ряда пациентов с деформацией грудной клетки (воронкообразная деформация III степени, килевидная деформация) при смещении сердца, когда оно «уходит» от механических воздействий костяка грудной клетки, ротируя и сопровождаясь «перекрутом» основных сосудистых стволов, формируется ложностенотический вариант торакодиафрагмального сердца. «Синдром стеноза» выхода из желудочков сопровождается увеличением напряжения миокардиальных структур в меридиональном и циркулярном направлениях, ростом систолического напряжения миокардиальной стенки с увеличением длительности подготовительного периода к изгнанию, увеличением давления в легочной артерии.
У пациентов с килевидной деформацией грудной клетки II и III степени выявляется увеличение устьев аорты и легочной артерии, связанное со снижением упругости сосудов и зависящее от степени тяжести деформации. Изменения геометрии сердца характеризуются компенсаторным увеличением размеров левого желудочка в диастолу либо в систолу, в результате чего полость приобретает шаровидную форму. Сходные процессы наблюдаются со стороны правых отделов сердца и устья легочной артерии. Формируется псевдодилятационный вариант торакодиафрагмального сердца.
В группе пациентов с дифференцированной ДСТ (синдромами Марфана, Элерса–Данлоса, Стиклера, несовершенного остеогенеза), а также у пациентов с недифференцированной ДСТ, имеющих сочетание выраженных деформаций грудной клетки и позвоночника, морфометрические изменения правого и левого желудочков сердца совпадают: уменьшается длинная ось и площади полостей желудочков, особенно в конце диастолы, отражая снижение сократительной способности миокарда; снижаются конечно- и среднедиастолические объемы. Наблюдается компенсаторное снижение общего периферического сосудистого сопротивления, зависящее от степени снижения сократимости миокарда, выраженности деформаций грудной клетки и позвоночника. Неуклонный рост легочного сосудистого сопротивления приводит в данном случае к формированию торакодиафрагмального легочного сердца.
Метаболическая кардиомиопатия: кардиалгии, аритмии сердца, нарушения процессов реполяризации (I степень: увеличение амплитуды Т V2-V3, синдром Т V2 > Т V3; II степень: инверсия Т, смещение ST V2-V3 вниз на 0,5–1,0 мм; III степень: инверсия Т, косовосходящее смещение ST до 2,0 мм).
Развитие метаболической кардиомиопатии определяется влиянием кардиальных факторов (клапанный синдром, варианты торакодиафрагмального сердца) и экстракардиальных условий (торакодиафрагмальный синдром, синдром вегетативной дисфункции, сосудистый синдром, дефицит микро- и макроэлементов). Кардиомиопатия при ДСТ не имеет специфических субъективных симптомов и клинических проявлений, вместе с тем потенциально определяет повышенный риск внезапной смерти в молодом возрасте с преобладающей ролью в танатогенезе аритмического синдрома.
Аритмический синдром: желудочковая экстрасистолия различных градаций; многофокусная, мономорфная, реже полиморфная, монофокусная предсердная экстрасистолия; пароксизмальные тахиаритмии; миграция водителя ритма; атриовентрикулярные и внутрижелудочковые блокады; аномалии проведения импульса по дополнительным путям; синдром предвозбуждения желудочков; синдром удлинения интервала Q-T.
Частота выявления аритмического синдрома — около 64%. Источником нарушения ритма сердца может быть очаг нарушенного метаболизма в миокарде. При нарушении структуры и функции соединительной ткани всегда присутствует подобный субстрат биохимического генеза. Причиной нарушений сердечного ритма при ДСТ может служить клапанный синдром. Возникновение аритмий при этом может быть обусловлено сильным натяжением митральных створок, содержащих мышечные волокна, способные к диастолической деполяризации с формированием биоэлектрической нестабильности миокарда [29]. Кроме того, появлению аритмий может способствовать резкий сброс крови в левый желудочек с пролонгированной диастолической деполяризацией. Изменения геометрии камер сердца также могут иметь значение в возникновении аритмий при формировании диспластического сердца, особенно торакодиафрагмального варианта легочного сердца. Кроме кардиальных причин происхождения аритмий при ДСТ существуют и экстракардиальные, обусловленные нарушением функционального состояния симпатического и блуждающего нервов, механического раздражения сердечной сорочки деформированным костяком грудной клетки. Одним из аритмогенных факторов может быть дефицит магния, выявляемый у пациентов с ДСТ. В предшествующих исследованиях российских и зарубежных авторов получены убедительные данные о причинной взаимосвязи между желудочковыми и предсердными аритмиями и внутриклеточным содержанием магния [19, 22, 25, 26]. Предполагают, что гипомагниемия может способствовать развитию гипокалиемии. При этом увеличивается мембранный потенциал покоя, нарушаются процессы деполяризации и реполяризации, снижается возбудимость клетки. Замедляется проводимость электрического импульса, что способствует развитию аритмий. С другой стороны, внутриклеточный дефицит магния повышает активность синусового узла, снижает абсолютную и удлиняет относительную рефрактерность [19, 22, 26].
Бронхолегочный синдром: трахеобронхиальная дискинезия, трахеобронхомаляция, трахеобронхомегалия, вентиляционные нарушения (обструктивные, рестриктивные, смешанные нарушения), спонтанный пневмоторакс.
Бронхолегочные нарушения при ДСТ современные авторы описывают как генетически обусловленные нарушения архитектоники легочной ткани в виде деструкции межальвеолярных перегородок и недоразвития эластических и мышечных волокон в мелких бронхах и бронхиолах, ведущие к повышенной растяжимости и сниженной эластичности легочной ткани [12, 15, 23]. Следует отметить, что согласно классификации болезней органов дыхания у детей, принятой на Совещании педиатров-пульмонологов РФ (Москва, 1995), такие «частные» случаи ДСТ органов дыхания, как трахеобронхомегалия, трахеобронхомаляция, бронхоэктатическая эмфизема, а также синдром Вильямса–Кемпбелла, на сегодняшний день трактуются как пороки развития трахеи, бронхов, легких [18].
Изменение функциональных параметров дыхательной системы при ДСТ зависит от наличия и степени деформации грудной клетки, позвоночника и чаще характеризуется рестриктивным типом вентиляционных нарушений со снижением общей емкости легких (ОЕЛ) [18, 23]. Остаточный объем легких (ООЛ) у многих пациентов с ДСТ не меняется или слегка повышается без изменения соотношения объема форсированного выдоха в первую секунду (ОФВ1) и форсированной жизненной емкости легких (ФЖЕЛ) [23]. У некоторых пациентов выявляются обструктивные нарушения, феномен гиперреактивности бронхов, что пока не нашло однозначного объяснения [2, 10, 23]. Пациенты с ДСТ представляют собой группу с высоким риском возникновения ассоциированной патологии, в частности, туберкулеза легких [32].
Синдром иммунологических нарушений: синдром иммунодефицита, аутоиммунный синдром, аллергический синдром.
Функциональное состояние иммунной системы при ДСТ характеризуется как активацией иммунных механизмов, обеспечивающих поддержание гомеостаза, так и их недостаточностью, ведущей к нарушению способности адекватно освобождать организм от чужеродных частиц и, следовательно, к развитию рецидивирующих инфекционно-воспалительных заболеваний бронхолегочной системы. Иммунологические нарушения у части пациентов с ДСТ включают повышение в крови уровня иммуноглобулина Е [4]. В целом, литературные данные о нарушениях в иммунной системе при различных клинических вариантах ДСТ носят неоднозначный, нередко противоречивый характер, что требует дальнейшего их изучения. До сих пор остаются практически неизученными механизмы формирования иммунных нарушений при ДСТ. Наличие иммунных нарушений, сопутствующее бронхолегочному и висцеральному синдромам ДСТ, повышает риск возникновения ассоциированной патологии соответствующих органов и систем.
Висцеральный синдром: нефроптоз и дистопии почек, птозы органов желудочно-кишечного тракта, органов малого таза, дискинезии органов желудочно-кишечного тракта, дуоденогастральные и гастроэзофагеальные рефлюксы, несостоятельность сфинктеров, дивертикулы пищевода, грыжи пищеводного отверстия диафрагмы; птозы половых органов у женщин.
Синдром патологии органа зрения: миопия, астигматизм, гиперметропия, косоглазие, нистагм, отслойка сетчатки, вывих и подвывих хрусталика.
Нарушения аккомодации проявляется в различные периоды жизни, у большинства обследованных — в школьные годы (8–15 лет) и прогрессирует до 20–25 лет.
Геморрагические гематомезенхимальные дисплазии: гемоглобинопатии, синдром Рандю–Ослера–Вебера, рецидивирующие геморрагические (наследственная дисфункция тромбоцитов, синдром Виллебранда, комбинированные варианты) и тромботические (гиперагрегация тромбоцитов, первичный антифосфолипидный синдром, гипергомоцистеинемия, резистентность фактора Vа к активированному протеину С) синдромы [20].
Синдром патологии стопы: косолапость, плоскостопие (продольное, поперечное), полая стопа.
Синдром патологии стопы является одним из самым ранних проявлений несостоятельности соединительнотканных структур. Наиболее часто встречается поперечно-распластанная стопа (поперечное плоскостопие), в части случаев сочетающаяся с отклонением 1 пальца наружу (hallus valgus) и продольное плоскостопие с пронацией стопы (плосковальгусная стопа). Наличие синдрома патологии стопы еще больше уменьшает возможность физического развития пациентов с ДСТ, формирует определенный стереотип жизни, усугубляет психосоциальные проблемы.
Синдром гипермобильности суставов: нестабильность суставов, вывихи и подвывихи суставов.
Синдром гипермобильности суставов в большинстве случаев определяется уже в раннем детском возрасте. Максимальная гипермобильность суставов наблюдается в возрасте 13–14 лет, к 25–30 годам распространенность снижается в 3–5 раз. Частота встречаемости гипермобильности суставов достоверно выше среди пациентов с выраженной ДСТ.
Вертеброгенный синдром: ювенильный остеохондроз позвоночника, нестабильность, межпозвонковые грыжи, вертебробазиллярная недостаточность; спондилолистез.
Развиваясь параллельно развитию торакодиафрагмального синдрома и синдрома гипермобильности, вертеброгенный синдром существенно усугубляет их последствия.
Косметический синдром: диспластикозависимые дисморфии челюстно-лицевой области (аномалии прикуса, готическое небо, выраженные асимметрии лица); О- и Х-образные деформации конечностей; изменения кожных покровов (тонкая просвечивающаяся и легко ранимая кожа, повышенная растяжимость кожи, шов в виде «папиросной бумаги»).
Косметический синдром ДСТ значительно усугубляется наличием малых аномалий развития, выявляемых у абсолютного большинства пациентов с ДСТ. При этом подавляющее большинство пациентов имеет 1–5 микроаномалий (гипертелоризм, гипотелоризм, «мятые» ушные раковины, большие торчащие уши, низкий рост волос на лбу и шее, кривошея, диастема, неправильный рост зубов и др.).
Нарушения психической сферы: невротические расстройства, депрессии, тревожность, ипохондрия, обсессивно-фобические расстройства, нервная анорексия.
Известно, что пациенты с ДСТ формируют группу повышенного психологического риска, характеризующуюся сниженной субъективной оценкой собственных возможностей, уровнем претензий, эмоциональной устойчивости и работоспособности, повышенным уровнем тревожности, ранимостью, депрессивностью, конформизмом [3, 9]. Наличие диспластикозависимых косметических изменений в сочетании с астенией формируют психологические особенности этих больных: сниженное настроение, потеря ощущения удовольствия и интереса к деятельности, эмоциональная лабильность, пессимистическая оценка будущего, нередко с идеями самобичевания и суицидальными мыслями [23]. Закономерным следствием психологического дистресса является ограничение социальной активности, ухудшение качества жизни и значительное снижение социальной адаптации [12, 3, 23], наиболее актуальные в подростковом и молодом возрасте.
Поскольку фенотипические проявления ДСТ чрезвычайно многообразны и практически не поддаются какой-либо унификации, а их клиническое и прогностическое значение определяется не только степенью выраженности того или иного клинического признака, но и характером «комбинаций» диспластикозависимых изменений, с нашей точки зрения, наиболее оптимально использовать термины «недифференцированная дисплазия соединительной ткани», определяющий вариант ДСТ с клиническими проявлениями, не укладывающимися в структуру наследственных синдромов, и «дифференцированная дисплазия соединительной ткани, или синдромная форма ДСТ». Практически все клинические проявления ДСТ имеют свое место в Международном классификаторе болезней (МКБ 10). Таким образом, у практического врача есть возможность определить шифр ведущего на момент обращения проявления (синдрома) ДСТ.При этом в случае недифференцированной формы ДСТ при формулировке диагноза следует указывать все имеющиеся у пациента синдромы ДСТ, формируя таким образом «портрет» пациента, понятный любому врачу последующего контакта.
Варианты формулировки диагноза.
1. Основное заболевание. Синдром Вольфа–Паркинсона–Вайта (синдром WPW) (I 45.6), ассоциированный с ДСТ. Пароксизмальная мерцательная аритмия.
Фоновое заболевание. ДСТ:
Осложнения: хроническая сердечная недостаточность (ХСН) IIА, ФК II.
2. Основное заболевание. Пролапс митрального клапана II степени с регургитацией (I 34.1), ассоциированный с малой аномалией развития сердца — аномально расположенной хордой левого желудочка.
Фоновое заболевание. ДСТ:
Осложнения основного: ХСН, ФК II, дыхательная недостаточность (ДН 0).
3. Основное заболевание. Хронический гнойно-обструктивный бронхит (J 44.0), ассоциированный с диспластикозависимой трахеобронхомаляцией, обострение.
Фоновое заболевание. ДСТ:
Осложнения: эмфизема легких, пневмосклероз, адгезивный двухсторонний плеврит, ДН II ст., ХСН IIА, ФК IV.
Вопросы тактики ведения пациентов с ДСТ также являются открытыми. Единых общепризнанных подходов к лечению пациентов с ДСТ на сегодняшний день не существует. Учитывая, что в настоящее время медицине недоступна генная терапия, врачу необходимо использовать любые способы, которые помогут остановить прогредиентность течения заболевания. Наиболее приемлем синдромальный подход к выбору терапевтических вмешательств: коррекция синдрома вегетативных нарушений, аритмического, сосудистого, астенического и др. синдромов.
Ведущим компонентом терапии должны быть немедикаментозные воздействия, направленные на улучшения гемодинамики (лечебная физкультура, дозированные нагрузки, аэробный режим). Однако нередко существенным фактором, ограничивающим достижения целевого уровня физических нагрузок у пациентов с ДСТ, оказывается плохая субъективная переносимость тренировок (обилие астенических, вегетативных жалоб, эпизоды гипотонии), что снижает приверженность пациентов к этому виду реабилитационных мероприятий. Так, по нашим наблюдениям до 63% пациентов имеют низкую толерантность к физической нагрузке по данным велоэргометрии, большинство из этих пациентов отказываются от продолжения курса лечебной физкультуры (ЛФК). В связи с этим представляется перспективным применение в комплексе с ЛФК вегетотропных средств, препаратов метаболического действия. Целесообразным является назначение препаратов магния. Многогранность метаболических эффектов магния, его способность повышать энергетический потенциал миокардиоцитов, участие магния в регуляции гликолиза, синтезе белков, жирных кислот и липидов, вазодилятационные свойства магния широко отражены в многочисленных экспериментальных и клинических исследованиях [6, 7, 22, 26, 30, 31]. В ряде работ, проведенных к настоящему времени, показана принципиальная возможность устранения характерной кардиальной симптоматики и ультразвуковых изменений у больных с ДСТ в результате лечения препаратами магния [7, 22, 25, 26].
Нами проводилось изучение эффективности поэтапного лечения пациентов, имеющих признаки ДСТ: на первом этапе больным проводилась терапия препаратом «Магнерот», на втором к медикаментозному лечению добавляли комплекс лечебной физкультуры. В исследование были включены 120 пациентов с недифференцированной формой ДСТ, имеющих низкую толерантность к физической нагрузке (по данным велоэргометрии) в возрасте от 18 до 42 лет (средний возраст 30,30 ± 2,12 года), мужчин — 66, женщин — 54. Торакодиафрагмальный синдром проявлялся воронкообразной деформацией грудной клетки различной степени (46 человек), килевидной деформацией грудной клетки (49 пациентов), астенической формой грудной клетки (7 пациентов), комбинированными изменениями позвоночного столба (85,8%). Клапанный синдром был представлен: пролапсом митрального клапана (I степени — 80,0%; II степени — 20,0%) с регургитацией (91,7%) или без таковой. У 8 человек было выявлено расширение корня аорты. В качестве группы контроля были обследованы 30 практически здоровых добровольцев, соответствующих по полу и возрасту.
По данным ЭКГ у всех пациентов с ДСТ выявлялись изменения конечной части желудочкового комплекса: I степень нарушения процессов реполяризации выявлялась у 59 пациентов; II степень — у 48 пациентов, III степень определялась реже — в 10,8 % случаев (13 человек). Анализ вариабельности сердечного ритма пациентов с ДСТ по сравнению с группой контроля продемонстрировал статистически значимо более высокие значения среднесуточных показателей — SDNN, SDNNi, RMSSD. При сопоставлении показателей вариабельности сердечного ритма с тяжестью вегетативной дисфункции у пациентов с ДСТ была выявлена обратная зависимость — чем выраженнее вегетативная дисфункция, тем ниже показатели вариабельности сердечного ритма.
На первом этапе комплексной терапии назначался Магнерот по следующей схеме: 2 таблетки 3 раза в день первые 7 дней, затем по 1 таблетке 3 раза в день в течение 4 недель.
В результате проведенного лечения была отмечена отчетливая положительная динамика частоты кардиальных, астенических и разнообразных вегетативных жалоб, предъявляемых пациентами. Позитивная динамика ЭКГ-изменений проявилась в снижении частоты встречаемости нарушений процессов реполяризации I степени (р
Г. И. Нечаева, доктор медицинских наук, профессор
В. М. Яковлев, доктор медицинских наук, профессор
В. П. Конев, доктор медицинских наук, профессор
И. В. Друк, кандидат медицинских наук
С. Л. Морозов
ОмГМА Росздрава, Омск
СГМА Росздрава, Ставрополь