впч онкогенного типа у женщин что это такое
Что такое папилломавирусная инфекция (ВПЧ)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Борисова Э. В., гинеколога со стажем в 34 года.
Определение болезни. Причины заболевания
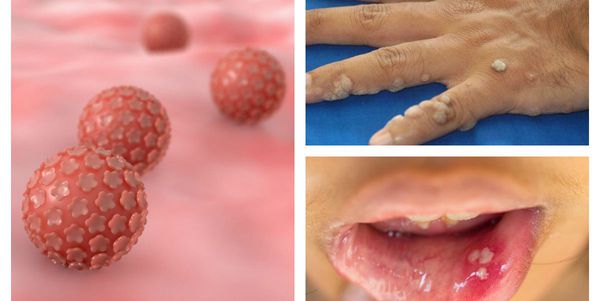
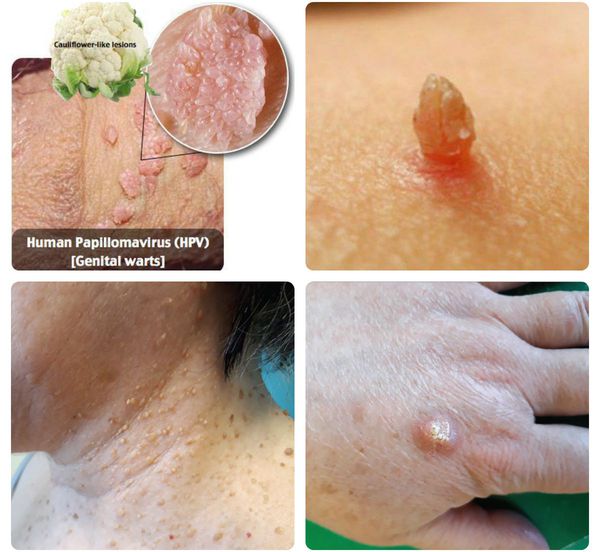
Папилломавирусная инфекция — это состояние, развивающееся при заражении какой-либо разновидностью вируса папилломы человека (ВПЧ). Возбудители данной группы могут существовать только в человеческом организме, поражая кожу и слизистые оболочки, приводя к появлению папиллом, бородавок, плоских и остроконечных кондилом. [1] [2] [4]
ВПЧ довольно широко распространён в человеческой популяции, особенно среди сексуально активных людей, а это свыше 80% всего населения. До недавнего времени вирусы этой группы считались относительно безобидными, вызывающими лишь косметические дефекты, но последние научные исследования показывают, что проблема гораздо серьёзнее. [9]
Чаще всего заражение происходит в молодом возрасте, как правило, с началом половой жизни, при этом возможно неоднократное инфицирование. Наиболее уязвимой группой в плане вероятности заражения ВПЧ и развития неблагоприятных последствий являются молодые женщины в возрасте 15-30 лет.
Помимо этого ВПЧ может перейти от инфицированной матери к ребёнку, например, при родах. Не исключается и контактно-бытовой способ передачи возбудителя, например, при соприкосновениях и даже при совместном использовании предметов личной гигиены.
К факторам риска, способствующим заражению ВПЧ, развитию хронической папилломавирусной инфекции и её переходу в предраковые состояния с потенциальным перерождением в злокачественную опухоль, относятся:
Симптомы папилломавирусной инфекции
Далеко не всегда человек догадывается о наличии в своём организме папилломавирусной инфекции, оставаясь при этом источником заражения для потенциальных партнёров. [1] [2] Дело в том, что заболевание может долгое время протекать бессимптомно: вирус скрыто существует в организме от нескольких месяцев до нескольких лет, никак себя не проявляя. Кроме того, уже имеющиеся проявления инфекции не всегда доступны для наружного обзора. Например, если папилломы, бородавки и кондиломы на открытых участках тела и поверхности гениталий ещё можно заметить самостоятельно, то патологические изменения, локализующиеся на шейке матки, сможет обнаружить только специалист в ходе осмотра с применением соответствующих инструментов.
И всё же существует несколько симптомов, которые прямо или косвенно могут указывать на наличие папилломавирусной инфекции и её неблагоприятных последствий. [3] К ним относятся:
Наиболее тревожными признаками заболевания являются:
Патогенез папилломавирусной инфекции
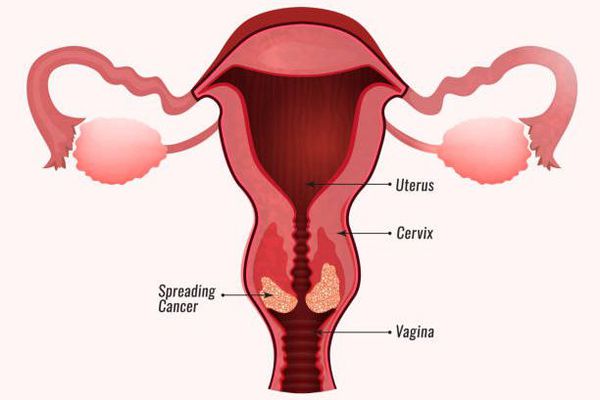
Заражение папилломавирусной инфекцией происходит при попадании вирусных частиц на кожу или слизистую оболочку. [1] [2] Излюбленная локализация инфекции на теле женщины — промежность, большие и малые половые губы, вульва, влагалище и шейка матки, у мужчин — половой член. Может также произойти поражение слизистой полости рта, пищевода, мочевого пузыря, трахеи, конъюнктивы и других органов и тканей.
Заражению способствуют микротравмы и потёртости. Особенно благоприятные для инфицирования условия создаются при половом акте. В 60–80% случаев достаточно однократного сексуального контакта с больным папилломавирусной инфекцией или бессимптомным носителем ВПЧ. К развитию заболевания может привести попадание в организм буквально единичных вирусных частиц.
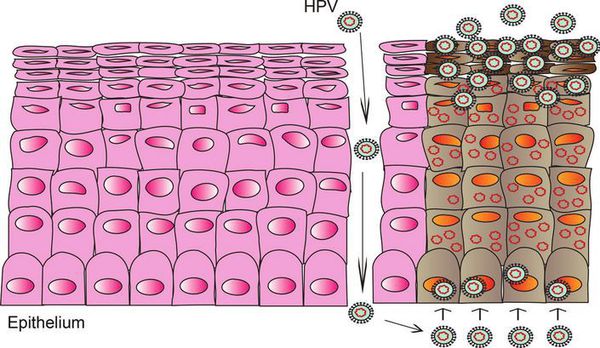
При наличии предрасполагающих факторов (микроповреждения, слабого иммунитета и других) возбудитель проникает в эпителиальную ткань до её базального слоя. Там он прикрепляется к оболочке незрелой клетки и внедряется сначала в её цитоплазму, а затем и в ядро, где повреждает генетический аппарат. После этого начинается деление клеток с изменённым геномом, что приводит к появлению в месте внедрения вируса генитальных кондилом (образований, которые постепенно разрастаются), а, например, на шейке матки — к развитию диспластических процессов различной степени тяжести (дисплазия шейки матки).
В случае ВПЧ высокого онкогенного риска определённые гены в вирусной ДНК кодируют синтез специфических белков-онкопротеинов (Е6 и Е7), которые подавляют противораковую защиту клеток. Под действием онкопротеинов нарушается стабильность генома клеток, стимулируется их размножение и снижается способность к дифференцировке — всё это со временем может привести к онкопатологии. [12]
Формирование новых полноценных вирусных частиц, способных инфицировать другого человека, происходит уже не в базальном, а в самых поверхностных слоях поражённого эпителия. Возбудитель может содержаться в слущивающихся отмирающих клетках, которые отделаются слизистой оболочкой. Таким образом они переходят к новому хозяину при тесном (сексуальном или бытовом) контакте.
Классификация и стадии развития папилломавирусной инфекции
По способности индуцировать развитие злокачественных новообразований ВПЧ подразделяют на четыре группы: [8]
Максимально опасными считаются 16-й и 18-й типы: на их долю приходится до 70% случаев рака шейки матки. [7] [8]
Клинические формы папилломавирусной инфекции: [5]
Латентная инфекция может переходить в субклиническую и манифестную форму в случае возникновения предрасполагающих условий (факторов риска), но чаще всего она протекает бессимптомно, не манифестируя.
Клинические проявления папилломавирусной инфекции:
Разновидности поражений:
Осложнения папилломавирусной инфекции
Основными наиболее опасными осложнениями папилломавирусной инфекции являются злокачественные новообразования. Но возможны и другие серьёзные последствия:
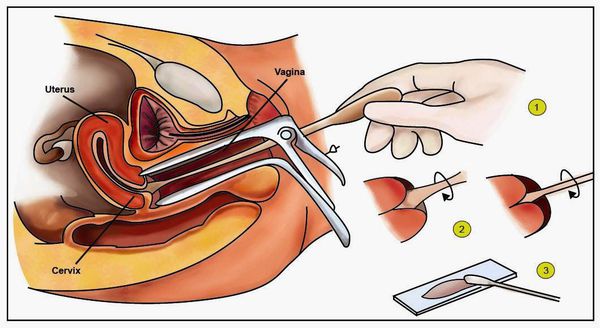
Диагностика папилломавирусной инфекции
Основные цели диагностических мероприятий: [3]
Для выявления папилломавирусной инфекции на сегодняшний день существует целый комплекс диагностических процедур:
Целесообразно дополнительное обследование пациента на наличие других инфекций, передающихся половым путём, так как папилломавирус в 90% случаев с ними сочетается, и это может осложнять течение заболевания.
Лечение папилломавирусной инфекции
Лечение папилломавирусной инфекции должно быть комплексным и включать следующие составляющие: [3] [5]
Деструктивные методы делятся на две основные группы:
Лечение сопутствующих половых инфекций проводят до начала деструктивной терапии на фоне адекватной иммунокоррекции.
Удаление видимых проявлений папилломавирусной инфекции должно сочетаться с противовирусной терапией — как с общей, так и с применением препаратов местного действия после удаления кондилом.
Следует помнить, что успешно проведённое лечение не исключает развитие рецидивов в дальнейшем, особенно у пациентов с нарушениями иммунитета. Поэтому за ними устанавливается динамическое наблюдение в течение как минимум 1-2 лет.
Прогноз. Профилактика
В 90% случаев здоровая иммунная система человека справляется с папилломавирусной инфекцией самостоятельно за период от полугода до двух лет с момента инфицирования, после чего происходит полное выздоровление с исчезновением вируса из организма. При этом не формируется напряжённого пожизненного иммунитета, то есть человек может заразиться повторно.
В других случаях, при наличии предрасполагающих факторов, заболевание приобретает хроническую форму, склонную к длительному скрытому течению с периодическими рецидивами и возможным развитием тяжёлых осложнений.
От момента попадания вируса в организм до развития предраковых состояний и тем более возникновения рака может пройти достаточно много времени, иногда десятки лет. Поэтому регулярные профилактические обследования, своевременное выявление и лечение предраковых состояний — вполне реальный и эффективный способ избежать самого неблагоприятного варианта развития событий. [13] С этой целью Всемирная организация здравоохранения рекомендует всем женщинам старше 30 лет при первичном скрининге проходить не только “рутинное” цитологическое исследование, но и делать тест на наличие ВПЧ. [10]
Регулярное посещение гинеколога (при отсутствии каких-либо жалоб — раз в год) с проведением теста Папаниколау позволяет своевременно обнаружить начальные признаки дисплазии и предпринять все необходимые меры для предотвращения прогрессирования процесса и его перехода в онкологическое заболевание.
Использование методов барьерной контрацепции хоть и не полностью защищает от инфицирования, но несколько снижает его вероятность.
Главным методом первичной профилактики папилломавирусной инфекции считается вакцинация. [11] Современные вакцины разработаны с целью защиты от наиболее опасных, высокоонкогенных штаммов ВПЧ, ответственных за 70-80% случаев развития рака шейки матки. Стандартный курс, состоящий из трёх прививок, даёт вполне надёжную защиту.
Целесообразно вакцинировать детей (девочек, а для сдерживания распространения инфекции и мальчиков) с 9-10 до 17 лет, а также молодых женщин (18-25 лет) до вступления в половую жизнь, так как вакцина предотвращает заражение, но не является средством лечения уже развившейся инфекции. Если пациентка уже живёт половой жизнью, то перед вакцинацией ей необходимо пройти исследование на наличие папилломавирусной инфекции. Однако даже при выявлении одного из штаммов, входящих в состав вакцины, проводить вакцинирование всё равно можно, так как это не является противопоказанием.
«Вирус папилломы человека — это не всегда рак в будущем». Гинеколог о тонкостях заболевания
Есть несколько типов вируса папилломы человека, и многие из них даже лечить не нужно. О том, почему не стоит бояться, если недуг обнаружен, и как связан ВПЧ с беременностью и родами, рассказывает врач акушер-гинеколог Татьяна Чайкина.
Вирус папилломы человека может передаваться половым и контактным путем
— Вирус папилломы человека сегодня распространен во всем мире, не только в Беларуси. При этом при нормальной работе иммунитета он как попадает в организм, так из него и исчезает.
Вирус больше распространен среди молодежи, потому как парни и девушки сегодня легче вступают в сексуальные контакты, имеют большее количество половых партнеров.
Если же речь идет о вирусе папилломы человека невысокого онкогенного риска, то здесь все немного по-другому. Он может вызывать образование наружных кондилом и папиллом на половых органах и часто передается даже контактным путем.
В работе с вирусом папилломы человека имеет значение его тип
— Причем во втором случае не требуется сдавать никаких дополнительных анализов. Для лечения не имеет значения, какой тип папиллома-вируса вызвал появление кондилом или папиллом. Врач просто-напросто решает (в зависимости от состояния пациентки), нужна деструкция образований или их можно просто понаблюдать какое-то время.
Если же говорить о вирусах высокого онкогенного риска (которые встречаются на шейке матки), то имеет значение, какой тип вируса привел к патологическому состоянию. Сегодня в нашей стране распространены 4 типа вируса — 16, 18, 31 и 33. Для их определения врач назначает проведение анализов.
— Их большое количество. Они помогают определить, каким типом вируса вызвана проблема. И врачу становится проще контролировать ситуацию. В основном, все анализы — это различные мазки, которые берет доктор.
ВПЧ не лечится, иногда за ним достаточно просто наблюдать
Врач уверена: однократное обнаружение папиллома-вируса ни о чем не говорит. Тем более, если проблем в ходе осмотра не выявлено (или выявлены, но незначительные), а отклонения есть именно по результатам анализа. Главное — не паниковать.
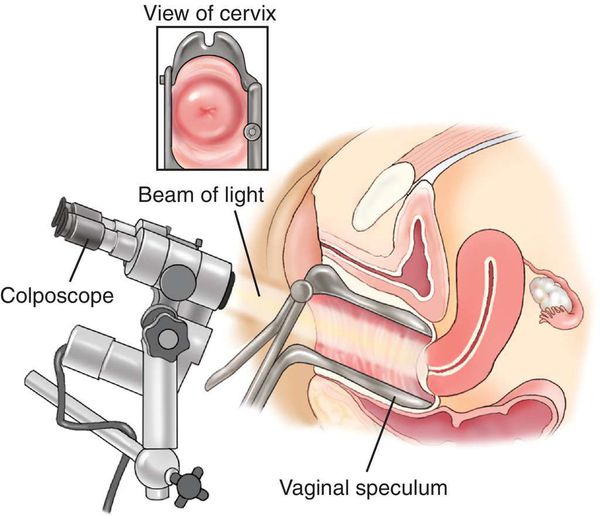
— Доктор обязательно возьмет мазок на онкоцитологию. Затем проведет кольпоскопию (осмотр шейки матки при помощи специального прибора — прим. И.Р). В ходе комплексного обследования будет решено, необходимо лечиться или достаточно регулярного наблюдения у врача.
Для еще более понятной картины в некоторых случаях врач делает биопсию. Это метод исследования, при котором проводится забор клеток/тканей из органа с диагностической целью.
— Иногда бывает сложно объяснить пациенткам, что ВПЧ не лечится и в определенных случаях за поведением вируса достаточно просто наблюдать.
— При этом все иммунные методы лечения не дают 100% гарантии. На Западе в принципе просто наблюдают. В нашем же менталитете принято, что нужно лечить любое заболевание.
Профилактика заражения вирусом папилломы человека — это вакцинация
Сегодня есть возможность предупредить недуг. Для этого необходимо сделать вакцинацию. Способ предпочтителен для юных девушек.
— Если вводить вакцину в организм до того момента, как он впервые встретится с ВПЧ, считается, что женщина будет защищена.
Прививка рекомендуется юным девушкам, которые еще не начинали половую жизнь. Возраст может быть разным, но обычно с 9 лет. К началу взрослости иммунитет будет готов к «сюрпризам».
Врач объясняет: в нашей стране нет ограничений по возрасту для того, чтобы сделать прививку. Никто не мешает женщине сделать вакцинацию и в 50 лет. Все зависит от жизненной ситуации и того, как развиваются события.
— Иногда при тяжелых формах дисплазии шейки матки проводится оперативное лечение и рекомендуется вакцина от ВПЧ.
Вирус папилломы человека может вызывать проблемы не только у женщин, но и у мужчин
Врач объясняет, что у сильной половины человечества при заражении ВПЧ также бывают кондиломы и папилломы. Иногда, как и у женщин, могут встречаться злокачественные перерождения.
— А как связаны между собой вирус папилломы человека и беременность?
— Опасности с точки зрения плода нет, есть немного другая. Беременность сама по себе — это физиологическое снижение иммунитета. Если будущая мать инфицирована папиллома-вирусом, то развитие событий в сторону дисплазии может ускориться. При этом медики не могут воздействовать на организм беременной. Вот почему вначале рекомендуется проверяться и только потом планировать детей.
Процессы проходят индивидуально. Вовсе не обязательно, что у беременной с наличием ВПЧ будут проблемы с шейкой матки.
— К сожалению, кондиломы при беременности встречаются часто. Работать с ними нельзя. Получается, что могут появиться проблемы у ребенка. Ведь при рождении он проходит через родовые пути и может наглотаться частиц кондилом. Вот почему нередко в таких ситуациях врачи рекомендуют кесарево сечение.
— ВПЧ становится предвестником рака шейки матки. Это правда?
Гинеколог объясняет, что онкология возникает у женщины не потому, что она не лечит папиллома-вирус. При его обнаружении не нужно бояться. Ведь для развития рака в организме должна сложиться очень неблагополучная ситуация. Только в таком случае вирус встроится в клетки и начнет изменять их структуру, что в итоге приведет к злокачественному образованию. Так бывает редко.
— К тому же следует учитывать, что процесс этого преобразования небыстрый, как и перерождение в онкологию. Вот почему главное — вовремя «ухватить» проблему. При регулярных обследованиях чаще всего можно избавить женщину от появившейся проблемы.
Вирус папилломы человека и рак шейки матки
ВПЧ, или вирусы папилломы человека, широко распространены по всему миру. Известно более 100 различных типов ВПЧ. Большинство населения являются носителями по меньшей мере одного из типов вируса, а чаще всего нескольких типов одновременно. Большинство ВПЧ никак себя не проявляют, и человек является лишь носителем. Некоторые типы вызывают образование папиллом и других изменений на коже и слизистых оболочках. С наличие ВПЧ связывают образование бородавок, папиллом гортани, но в основном эти вирусы не опасны.
Наибольшую опасность представляют типы ВПЧ, способные вызвать изменения, ведущие к развитию опухолей. Такие ВПЧ называют высокоонкогенными. Рак шейки матки – серьёзное онкологическое заболевание, ассоциированное с ВПЧ. Отличается долгим периодом предраковых изменений, в течение которого можно выявить изменения клеток и своевременно провести лечение.
Для того, чтобы не допустить развитие рака шейки матки, очень важно:
От дисплазии начальной стадии до развития рака обычно проходит несколько лет. Своевременное выявление ВПЧ и дисплазии позволяет предотвратить рак
Скрининг рака шейки матки – идеальный тест для регулярного обследования.
В основе одновременное проведение жидкостной цитологии и ВПЧ- теста, что важно для полноценной оценки изменений.
Жидкостная цитология – автоматизированная стандартизованная методика выполнения тонкослойных мазков, позволяющая под микроскопом разглядеть каждую клетку с целью выявления ее изменений, в том числе онкологической трансформации. Исследуется смешанный соскоб из цервикального канала и шейки матки, взятый специальной щёточкой, которая позволяет достичь зоны перехода плоского эпителия шейки матки в эпителий цервикального канала (железистые клетки). В этой зоне чаще всего развиваются опухолевые клетки. Помещение полученного материала в специальную виалу и окраска по Папаниколау увеличивает качество и точность исследования.
ВПЧ тест включает определение:
Ответ выдается в формате «обнаружено/не обнаружено». Результат «обнаружено» означает, что вирус выявлен в том количестве, которое требует наблюдения и/или лечения.
Дело в том, что ВПЧ –достаточно капризные вирусы. Они могут попадать в организме и спонтанно исчезать при хорошем иммунитете у пациента. Основные пути передачи – контактный и половой, поэтому возможно повторное заражение или проявление вируса при ослаблении иммунитета. Известны случаи, когда ВПЧ то обнаруживается, то не обнаруживается. Обычно эта ситуация бывает при небольшом количестве вируса и зависит ни от пациента, ни от врача. Всё дело в особенностях жизнедеятельности вируса и процессе его противостояния с иммунитетом.
В чём преимущества Скрининга рака шейки матки по сравнению с другими тестами, выявляющими ВПЧ?
Одновременное проведение цитологического исследования и ВПЧ теста – стратегия максимально выявить риски.
Во-первых, выявление ВПЧ в том количестве, которое является значимым, позволяет спланировать визит к врачу, наблюдаться и провести необходимое лечение, если надо.
Для того, чтобы исследование было максимально достоверным, важно правильно подготовиться:
Регулярное обследование – способ сохранить здоровье на долгие годы.
Папилломавирусная инфекция и ВПЧ-ассоциированные заболевания
Рассмотрены пути распространения папилломавирусной инфекции (ПВИ) человека, этиология и эпидемиология заболеваний, ассоциированных с вирусом папилломы человека, факторы риска и подходы к терапии ПВИ у женщин.
The ways of human papiloma viral infection (ПВИ) distribution were considered, as well as etiology and epidemiology of the diseases associated with human papilloma virus, risk factors and approaches to ПВИ therapy in women.
Папилломавирусная инфекция человека (ПВИ) — это болезнь, которая относится к группе инфекционных заболеваний, передается половым путем и является одной из наиболее распространенных инфекций в мире. В большинстве случаев ПВИ проявляется возникновением у больного остроконечных кондилом, плоских и инвертированных кондилом с внутренним ростом, папиллярных разновидностей кондилом. Болезнь вызывается вирусами из семейства папилломавирусов, включающих 27 видов из 5 родов (Alphapapillomavirus, Betapapillomavirus, Gammapapillomavirus, Mupapillomavirus и Nupapillomavirus) [1] и более 600 типов (штаммов) [2].
ПВИ известна давно, со средних веков, но только в последние десятилетия были накоплены научные данные о строении и свойствах папилломавирусов (ПВ). Это мелкие безоболочечные 20-гранные ДНК-содержащие вирусы, характерная особенность которых заключается в способности вызывать пролиферацию эпителия кожи и/или слизистых оболочек. Вирусы папилломы человека (ВПЧ) не размножаются в культуре клеток, поэтому сведения о биологии вирусов получены с помощью молекулярно-генетических технологий и эпидемиологических исследований. Диаметр вируса 55 нм, геном ВПЧ представлен длинной двуспиральной циркулярной ДНК с размером 8 тысяч пар основ. В зависимости от времени экспрессии гены ВПЧ делятся на ранние и поздние, соответственно они кодируют ранние Е1-Е7 и поздние L1- и L2-протеины [3, 4].
В настоящее время известно уже более 200 типов (штаммов) ПВЧ [2]. Из них более 40 вызывают поражение половых органов и перианальной области мужчин и женщин и появление остроконечных кондилом. Одни из них безвредны, другие вызывают бородавки, некоторые вызывают рак.
Внедрение вируса в организм человека происходит при микроповреждении тканей. ВПЧ инфицирует стволовые клетки базального слоя эпителия. Вирус заражает самый нижний, глубокий, слой кожи или слизистой оболочки. Под его влиянием происходит усиленное размножение клеток этого слоя, что и приводит к образованию опухолевидных разрастаний кожи и слизистых. Сам вирус размножается в поверхностных слоях кожи и слизистых — в чешуйчатых клетках [5].
В зараженной клетке вирус существует в двух формах: эписомальной (вне хромосом клетки), которая считается доброкачественной формой, и интросомальной форме, при которой вирус встраивается в геном клетки и которую определяют как злокачественную форму паразитирования вируса [1, 2], так как наряду с доброкачественными опухолевидными разрастаниями ПВ признан причиной некоторых форм рака половых органов, наиболее часто рака шейки матки (РШМ). Так, в образцах тканей РШМ, полученных из 22 стран мира, ВПЧ обнаруживался в 99,7% случаев [5].
По данным ВОЗ ежегодно в мире выявляется более 530 тыс. больных РШМ, что составляет 5% среди всех локализаций [7]. В РФ, по сравнению с другими развитыми странами, заболеваемость РШМ остается довольно высокой — 16,7 на 100 тыс. женского населения. В частности, распространенность РШМ в России увеличилась со 110,3 в 2004 г. до 119,7 в 2015 г. на 100 тыс. населения. В 2015 г. было выявлено 16 439 новых случаев РШМ, из которых при профилактическом осмотре — всего у 32,7% больных. У 62,3% женщин установлена I–II стадия заболевания, у 26,2% — III, у 9,2% — IV стадия РШМ, что привело к высокому уровню летальности на первом году с момента выявления — 16,3%. Абсолютное число больных РШМ в стадии in situ в России увеличилось с 1951 в 2005 г. до 4418 в 2014 г. Ежегодно более 6000 женщин в России умирают от РШМ. В 2014 г. РШМ стал причиной смертности у 119 девушек в возрасте до 24 лет [6].
При этом ВПЧ 16-го и 18-го типов ассоциируются с 70% сквамозно-клеточной карциномы и 80% случаев с аденокарциномой шейки матки. В 20% случаев РШМ определяется ВПЧ 31-го, 33-го, 35-го, 45-го, 52-го, 58-го типов [8–10].
По мере изучения ВПЧ гибридизационными методами выяснилось, что риск злокачественного перерождения связан с несколькими типами ВПЧ. Они были обозначены как вирусы высокого риска онкогенного заболевания. Дело в том, что при инфицировании клеток эпителия ВПЧ развиваются неоплазии (для них характерно изменение нормальной структуры клеток), имеющие как доброкачественный, так и злокачественный характер. По мнению В. А. Молочкова и соавт. [11], инфицирование эпителиальных клеток ВПЧ является не достаточным для развития рака. Для формирования неоплазии, по их мнению, необходимы следующие факторы: во-первых, активная экспрессия генов Е6 и Е7, причем высокоонкогенных 16-го и 18-го типов ВПЧ; во-вторых, индукция метаболических механизмов конверсии эстрадиола в 16-ОН; в-третьих, индукция множественных повреждений хромосомной ДНК в инфицированной клетке, которая завершает процесс перерождения.
Некоторые из ВПЧ не только напрямую воздействуют на клеточный цикл, но и притормаживают воздействие блокирующих белков, и, как следствие, может происходить процесс озлокачествления. Это типы ВПЧ 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 и 68. Перечень типов ВПЧ высокого онкогенного риска в настоящее время расширяется за счет уточнения строения ДНК и появления новых типов промежуточного риска [4, 12]. Типы 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58 и 59 могут быть причиной развития цервикальных интраэпителиальных неоплазий, вульварных интраэпителиальных неоплазий, рака гортани. Рак шейки матки — один из немногих видов злокачественных новообразований с установленной этиологией заболевания. За открытие роли ВПЧ в развитии рака шейки матки немецкий ученый Harald zur Hausen был удостоен в 2008 г. Нобелевской премии в области медицины и физиологии [3].
Отмечено, что 16-й тип наиболее часто встречается в ткани плоскоклеточного рака шейки матки, а 18-й тип — в ткани железистого рака — аденокарциномы.
Вирусами низкого онкогенного риска являются 5 типов ВПЧ — 6-й, 11-й, 42-й, 43-й, 44-й [4].
Основным путем заражения аногенитальными бородавками (остроконечными кондиломами) является половой. Возможно заражение ВПЧ новорожденных при родах, что является причиной возникновения ларингеального папилломатоза у детей и аногенитальных бородавок у новорожденных. Возможно заражение бытовым путем, так как ВПЧ способен существовать некоторое время в общественных местах (туалеты, бани, бассейны, спортзалы) и проникать в организм человека через ссадины и царапины на коже; редко, но возможно самозаражение (аутоинокуляция) при бритье, эпиляции.
Самый распространенный путь передачи инфекции — это прямой контакт с кожным покровом или слизистыми оболочками больного человека или вирусоносителя при наличии микротравм у реципиента [3]. Не менее 50% взрослого населения, живущего активной половой жизнью, заражено одним или более типами ВПЧ, причем преобладает в большинстве случаев генитальная форма. Генитальная ПВИ имеет высокую контагиозность: заражение при однократном половом контакте происходит примерно в 60% случаев [13].
Ряд авторов доказали возможность инфицирования плода и новорожденного во время беременности. При этом существует два пути инфицирования: перинатальная передача ВПЧ на ротоглоточную и генитальную области у новорожденных детей, родившихся через естественные половые пути, и возможность восходящего инфицирования, что доказывают сообщения о врожденных кондиломах у новорожденных, рожденных кесаревым сечением [11, 14]. Необходимо отметить, что у новорожденных, рожденных от ВПЧ-позитивных матерей, в 10% случаев отмечается серопозитивность к какому-либо типу ВПЧ, при полимеразной цепной реакции (ПЦР) отрицательных результатах соскобов эпителия со слизистых полости рта или гениталий [15], что подтверждает вертикальный путь передачи инфицирования плода. Таким образом, ПВИ может передаваться трансплацентарно и интранатально (в частности, ВПЧ 6-го и 11-го типов). Риск инфицирования прямо пропорционален тяжести инфекции у матери и времени безводного промежутка в родах. Наряду с этим проведенные исследования также свидетельствуют о том, что родоразрешение путем кесарева сечения не снижает риска инфицирования плода, что свидетельствует о внутриутробном его заражении. Интранатальное инфицирование может приводить к ювенильному рецидивирующему респираторному папилломатозу, частота которого составляет 1,7–2,6 на 100 000 детей и 1 на 1500 родов среди женщин с генитальной ПВИ [16].
Ряд авторов пишут о внутрисемейном пути передачи инфекции. Например, в Испании было проведено ретроспективное исследование, включавшее наблюдение за ВПЧ-позитивными и ВПЧ-отрицательными беременными женщинами и их детьми, которые наблюдались на протяжении 14 месяцев. ПВИ диагностировалась у 19,7% новорожденных детей, рожденных от ВПЧ-позитивных матерей. Однако среди детей, рожденных от ВПЧ-отрицательных женщин, положительные результаты ПЦР-диагностики ВПЧ были зарегистрированы в 16,9% случаев. Авторы сделали вывод, что в данном случае наиболее вероятен горизонтальный путь передачи инфекции внутри семьи [17]. Таким образом, помимо полового пути передачи, возможен горизонтальный и вертикальный пути передачи ВПЧ от инфицированных родителей детям.
Максимальная заболеваемость, обусловленная ВПЧ, наблюдается в возрасте от 18 до 28 лет. Однако и в старших группах населения эта проблема актуальна в силу возрастных изменений иммунитета и гормональной функции, которые благоприятствуют многим факторам канцерогенеза, возможны проявления ВПЧ и клеточная трансформация ракового характера [11].
Как российские, так и зарубежные исследователи отмечают неуклонный рост заболеваемости ПВИ детей препубертатного возраста и подростков как инфекцией, передающейся половым путем. Выявление ВПЧ 2-го, 6-го, 11-го типов может быть следствием заражения от матери, имеющей вульгарные бородавки, причем чаще всего у таких детей имеются вульгарные бородавки на пальцах рук [11].
В 2005–2006 гг. в Москве было проведено обследование 854 девочек от периода новорожденности до 15 лет. В 7,1% случаев была выявлена ПВИ аногенитальной области. При этом была показана высокая ассоциация ПВЧ с другими инфекциями, передающимися половым путем. Таким образом, проведенное исследование свидетельствует о крайне неблагоприятных тенденциях распространения ПВЧ среди детского населения, об ухудшении репродуктивного здоровья молодежи, что диктует необходимость разработки эффективной системы профилактики данной патологии у несовершеннолетних [12, 18].
ПВЧ вызывают выраженную клеточную пролиферацию эпителия слизистых оболочек и кожи. На месте внедрения вируса образуется разрастание клеток эпителия в виде разнообразных по форме и величине бородавок, папиллом, кондилом. Но нередко присутствие в коже и на слизистых оболочках ПВЧ не дает никаких заметных изменений, хотя вирус присутствует и легко передается половому партнеру и бытовым путем. Часто имеющиеся разрастания самопроизвольно исчезают, как это наблюдается при кожных юношеских бородавках.
Важную роль в активации ПВЧ играют половые гормоны. Беременность активизирует не только генитальный папилломатоз, но также и латентный папилломатоз гортани. Кстати, вирус, вызывающий папилломатоз гортани, обычно приобретается еще новорожденным ребенком либо в родах, либо вследствие инфекции in utero, поскольку обнаружен и у детей, рожденных с помощью операции кесарева сечения [3]. При исследовании околоплодных вод у женщин, которые страдают генитальными бородавками, и назофарингеальных аспиратов у рожденных ими детей, определяются конкордатные типы вирусов папилломы. А кесарево сечение у беременных женщин с ПВИ в 5 раз снижает инфицированность ВПЧ детей и возникновение респираторного папилломатоза у них [3].
Молекулярно-гибридизационный метод, вошедший в медицинскую практику, сделал известным, что существует много типов ПВ, 40 из которых инфицируют половые органы и область заднего прохода. При этом у женщин инфицируется и покрывается генитальными бородавками область преддверия влагалища, стенки влагалища, шейка матки, наружное отверстие уретры. У мужчин поражаются головка полового члена, крайняя плоть, мошонка, анальная область. В табл. приведены типы ВПЧ, встречающиеся при различных заболеваниях ПВИ.
Фактором риска ПВИ является тот факт, что женщина имеет большое количество сексуальных партнеров и не ведет упорядоченную половую жизнь, а также то, что девушка-подросток начала половую жизнь очень рано. К факторам риска относятся также использование женщиной тех сексуальных партнеров, кто игнорирует барьерную контрацепцию, в частности презервативы. Также факторами риска являются другие инфекции, передающиеся половым путем (ИППП), применение оральных контрацептивов, курение и недостаточность гормонального баланса, некоторые медицинские вмешательства (аборт, введение внутриматочных контрацептивов). Также повышается риск заражения у беременных женщин.
Более восприимчивы к поражению вирусом люди, в организме которых имеется недостаточность клеточного иммунитета, недостаточное содержание ряда витаминов, в частности фолиевой кислоты.
Длительность инкубационного периода болезни может продолжаться разный период времени — от одного месяца до одного года. Но в среднем он длится от трех до шести месяцев. В большинстве случаев (до 90%) в течение 6–12 месяцев происходит самоизлечение, в других случаях отмечается длительное хроническое рецидивирующее течение с возможной малигнизацией процесса (в зависимости от типа вируса) [19, 20].
Все клинические проявления объединены в три группы:
В зависимости от проявлений и характера течения различают три формы ПВИ [19, 20]:
ПВИ в большинстве случаев существует в виде латентной и субклинической форм. Манифестация заболевания возникает под влиянием провоцирующих факторов или факторов риска.
Субклиническая форма проявляется плоскими элементами небольших размеров, часто визуально незаметными. Симптоматически она обычно ничем себя не проявляет, но иногда может сопровождаться зудом, а при локализации во влагалище и в цервикальной зоне — провоцирует кровоточивость во время и после полового акта, выделения из влагалища.
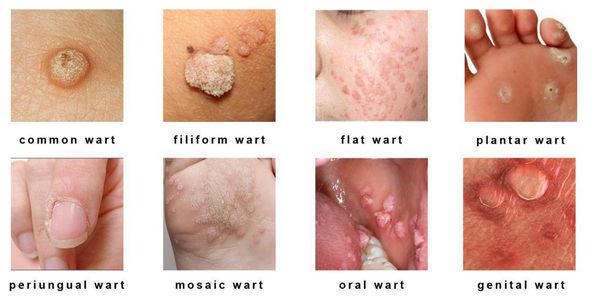
Клиническая манифестная форма представлена преимущественно высыпаниями различных видов в области гениталий, симптомы которых зависят от участка расположения, типа и размера элементов. Условно различают следующие типы бородавок [19, 20]:
При беременности очень часто у инфицированной женщины отмечается рецидив болезни. После родов болезнь, как правило, регрессирует. Особенно интенсивный рост кондилом отмечается: у беременных женщин и подростков в период полового созревания [24], у ВИЧ-инфицированных людей. Как правило, ВПЧ с образованием кондилом протекает на фоне других заболеваний, передающихся половым путем.
Кожные папилломы в виде тонких нитей с широким или тонким основанием локализуются на веках, шее, руках, под молочными железами. ВПЧ в виде кожных бородавок локализуются на ступнях, ладонях. Как правило, данный тип ПВ наблюдается у детей и подростков, так называемые юношеские бородавки.
Патологический процесс в детском возрасте носит активный характер, для него характерны распространенность и частое рецидивирование, в связи с чем дети подвергаются многократным хирургическим вмешательствам с целью удаления папиллом. Многократная повторная эксцизия ларингеальных опухолей приводит к развитию рубцовых осложнений, необходимости трахеостомии, к потере способности говорить, усугублению хронической респираторной гипоксемии. При прогрессировании и распространении опухоли в дистальные дыхательные пути заболевание часто заканчивается фатальным исходом.
Установлено, что регрессия ВПЧ-обусловленных заболеваний напрямую зависит от состояния Т-клеточного иммунитета и нейтрализующих антител, которые блокируют распространение вирусной инфекции. Дефицит Т-клеточного звена иммунитета, например, при ВИЧ-инфекции, ассоциируется с увеличением риска развития аногенитальной неоплазии в 5,4 раза [22, 23, 25].
Методы диагностики ПВИ:
Лечение ПВИ предполагает следующие мероприятия: деструкция, предупреждение развития осложнений, уменьшение числа рецидивов, улучшение качества жизни пациентов. Лечение направлено на устранение клинических признаков ВПЧ: любых разновидностей бородавок или патологии шейки матки при наличии атипичных клеток в мазках и биоптатах.
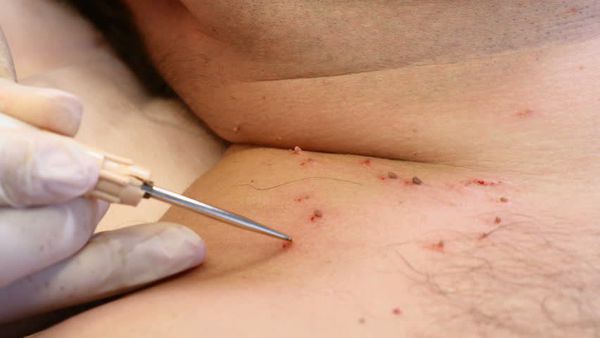
Традиционные методы лечения бородавок общеизвестны и включают крио-, электро-, радиоволновую и лазерную хирургию, а также обработку цитотоксическими веществами (подофиллин, подофиллотоксин, 5-фторурацил) и химическими веществами (Солкодерм, Веррукацид, Дуофил и др.), вызывающими цитолиз и некроз ткани [3, 28].
Перспективным методом в лечении клинических манифестаций ВПЧ могло бы быть применение лечебных вакцин. Недостатком вакцинотерапии является ее узкое терапевтическое воздействие, тогда как около 40 штаммов ВПЧ паразитируют на гениталиях. В 2006 г. Управление по контролю за продуктами питания и лекарственными средствами США (Food and Drug Administration, FDA) зарегистрировало первую в мире квадривалентную вакцину Гардасил, продемонстрировавшую эффективность в предупреждении инфекции ведущими типами ВПЧ (6-й/11-й/16-й/18-й). Кроме того, вакцина Гардасил обеспечивает частичную перекрестную защиту против персистирующей инфекции и цервикальных поражений, вызванных десятью невакцинными типами ВПЧ высокого риска, включая ВПЧ 31-го, 33-го, 35-го, 45-го, 52-го и 58-го типа, которые филогенетически родственны ВПЧ 16-го и 18-го типа [3].
В 2008 г. зарегистрирована также двухвалентная вакцина Церварикс, содержащая два типа капсидных белков L1 ВПЧ — 16-й и 18-й.
В плане профилактики наилучших результатов можно достичь сочетанием скрининговых программ обследования с повсеместной организацией плановой вакцинации населения, особенно определенных медико-социальных контингентов (подростки из группы рискового поведения, сексуально-активные женщины, принимающие комбинированные оральные контрацептивы, лица с иммунодефицитом различного генеза и т. д.).
Среди препаратов, зарегистрированных для применения при лечении папилломавирусной инфекции, активно используется Виферон® — рекомбинантный интерферон альфа-2b в сочетании с антиоксидантами — витаминами Е и С, который выпускается в виде мази, геля и суппозиториев.
Хороший терапевтический эффект в виде повышения частоты элиминации вируса, регрессии плоскоклеточных интраэпителиальных поражений шейки матки низкой степени и снижения частоты инфицирования новорожденных в 3 раза достигают при использовании комбинированной схемы иммунокорригирующей терапии: локальное применение человеческого рекомбинантного интерферона ИФН-альфа-2b гель Виферон® для наружного и местного применения, 36 000 МЕ/г) в сочетании с системным применением препарата в виде ректальных суппозиториев (500 000 МЕ).
Высокоактивные антиоксиданты — витамин Е и аскорбиновая кислота, входящие в состав препарата Виферон®, — обладают мембраностабилизирующим эффектом, а также оказывают потенцирующее действие на выработку собственного интерферона, что не только приводит к предсказуемым клиническим результатам, но и обеспечивает увеличение межрецидивных промежутков. Одна из важных особенностей препарата — основа в виде масла какао — дает ряд следующих преимуществ:
Препарат Виферон® ректальные суппозитории назначают по следующей схеме: взрослым — по 500 000 МЕ 2 раза в сутки в течение 5–10 дней, детям — по 150 000 МЕ 2 раза в сутки в течение 5 дней. При необходимости терапия может быть продолжена [26–28].
Для лечения эндоуретральных кондилом наиболее оправдано использование геля Виферон®. Основной компонент препарата — человеческий рекомбинантный интерферон альфа-2b обладает выраженным противовирусным действием. Природный антиоксидант — витамин Е и его синергисты — бензойная и лимонная кислоты, метионин — способствуют стабилизации клеточных мембран, обладают ранозаживляющим действием. Гелевая основа обеспечивает пролонгацию воздействия препарата, а вспомогательные вещества — стабильность специфической активности и надлежащую микробиологическую чистоту препарата.
В настоящее время наиболее эффективными методами, особенно при обширных высыпаниях и рецидивирующем течении заболевания, в том числе и в детской практике при аногенитальном поражении и респираторном папилломатозе, являются использование комбинированных методов терапии, которые включают применение физических, химических или медикаментозных методов удаления бородавок и применение различных системных и местных противовирусных и иммуномодулирующих препаратов [29].
Оригинальная схема комплексного использования препаратов Виферон® при папилломавирусной инфекции, предложенная А. В. Молочковым, — 14-дневный курс терапии Виферон® ректальными суппозиториями по 3 000 000 МЕ в сутки в комплексе с местным использованием гель Виферон® предшествовал деструкции новообразований методом электрокоагуляции (на 15-й день), после чего продолжалось применение Виферон® ректальных суппозиториев по 1 000 000 МЕ в сутки в течение 15 дней — позволяет добиться хороших результатов: отсутствие рецидивов в течение не менее 8 месяцев наблюдения, хорошую переносимость применявшихся препаратов, поскольку побочных эффектов или осложнений также не наблюдалось [30].
Хорошие результаты были получены при использовании повторных курсов Виферон® ректальных суппозиториев по 1 000 000 МЕ в сутки в течение 10 суток с проведением между курсами радиохирургического лечения с применением скальпельных и шариковых электродов. После первого десятидневного курса Виферон® ректальных суппозиториев по 1 000 000 МЕ в сутки у всех больных удалось добиться стабилизации патологического процесса: отмечалось прекращение появления свежих кондилом, периферического и экзофитного роста имеющихся кондиломатозных образований, снижение остроты воспалительной реакции. Стойкое клиническое выздоровление было достигнуто в 82,8% случаях, элиминация вируса папилломы человека наблюдалась в 73,5% случаях [31].
Положительный результат был достигнут при лечении девочек-подростков в возрасте от 14 до 17 лет с аногенитальными кондиломами комбинацией препаратов Виферон® суппозитории ректальные 500 000 МЕ 2 раза в день в течение 10 дней с местным использованием геля 3 раза в день в течение 30 дней в сочетании с антибактериальной терапией и хирургической/или химической деструкцией кондилом (у 40%). Авторами убедительно доказано, что комбинированная терапия с использованием препаратов Виферон® является эффективным и безопасным методом лечения девочек-подростков и приводит к исчезновению образований у 40% пациенток, а в сочетании с деструктивными методами — у 93,3% [32].
После получения в 1989 г. доказательств возможности вертикальной передачи вируса папилломы человека [33] особую актуальность приобретают методы лечения, позволяющие предотвратить инфицирование новорожденных детей. В частности, для беременных разработана специальная поэтапная схема терапии препаратом Виферон® папилломавирусной инфекции.
Первый этап: применение препарата 500 000 МЕ по 1 суппозиторию 2 раза в сутки через 12 часов ежедневно в течение 10 суток, затем в течение 9 дней 3 раза с интервалом в 3 дня (на четвертый день) по 1 суппозиторию 2 раза в сутки через 12 ч. Курс позволяет снизить интенсивность симптоматики и улучшить состояние беременной. Старт терапии с 14 нед беременности или позднее (при запоздалой диагностике заболевания).
Второй этап: применение препарата 150 000 МЕ каждые 4 нед до родоразрешения по 1 суппозиторию 2 раза в сутки через 12 ч ежедневно в течение 5 суток. Профилактические курсы позволяют уменьшить вероятность внутриутробного вирусного инфицирования плода.
Третий этап: применение препарата 500 000 МЕ по 1 суппозиторию 2 раза в сутки через 12 ч ежедневно в течение 10 суток. Курс проводят при необходимости непосредственно перед родоразрешением (с 38 нед гестации) с целью снижения вероятности передачи инфекции во время родов.
Применение препаратов Виферон® у женщин с ПВИ на любом сроке беременности (начиная с 14-й недели) способствует рождению детей, не инфицированных вирусом [34–36]. Кроме того, профилактическое лечение беременных женщин даже в III триместре беременности не только восстанавливает функциональную активность NK клеток у беременных с клиническими формами проявления ПВИ, но и способствует рождению здоровых детей [36].
Полученные результаты позволяют рассматривать Виферон® как эффективный препарат для иммунотерапии ВПЧ-ассоциированных генитальных неоплазий и рекомендовать его широкое внедрение в практику специалистов.
Приводим наше собственное наблюдение — ведение пациентки с рецидивирующими аногенитальными кондиломами (рис.).
Пациентка Т., 25 лет, обратилась с жалобами на рост множественных кондилом в области малых и больших половых губ, выделения из половых путей с резким запахом.
Anamnesis vitae. Перенесенные заболевания: ОРВИ, ветряная оспа, краснуха.
Tуберкулез, гепатиты, венерические заболевания отрицает.
Аллергические реакции отрицает.
Операции: аппендэктомия в детстве, без осложнений.
Mensis с 12 лет, по 5 дней через 30 дней, регулярно, обильно, болезненно. Половая жизнь с 17 лет.
Контрацепция: interruptus, condoms.
Беременность — 2 — самопроизвольный выкидыш в сроке 7–8 недель.
Anamnesis morbi. В течение последнего года отмечает рост аногенитальных кондилом. Проводилось лечение: суппозитории Галавит по схеме ректально на ночь в течение 20 дней без видимого эффекта. За последние 2–3 месяца отмечает выраженный рост кондилом.
Объективно: рост — 159 см, вес 61 кг.
Общее состояние удовлетворительное. Кожа и видимые слизистые розовые. Нормального телосложения. Умеренного питания. Молочные железы мягкие безболезненные во всех отделах. Физиологические отправления не нарушены.
Status genitalis. Наружные половые органы развиты по женскому типу. Обращает на себя внимание наличие разрастаний на коже больших половых губ, лобковой области гроздьевидно.
В зеркалах: шейка матки цилиндрической формы, без видимых дефектов слизистой оболочки.
Per vaginum. Матка отклонена кпереди, не увеличена, подвижна, безболезненна. Придатки — без особенностей. Своды, параметрии свободны.
Проведена кольпоскопия: неудовлетворительная кольпоскопическая картина. Признаки цервицита.
Предварительный диагноз. Кондиломатоз вульвы. Цервицит. Рекомендовано дообследование: цитологическое исследование по Папаниколау, посев из цервикального канала на флору, ВПЧ-типирование, обследование на ИППП, бактериоскопическое исследование мазка из влагалища и цервикального канала.
Повторный визит: жалобы прежние.
Результаты проведенного обследования.
Цитологическое исследование материала из шейки матки — NILM (клетки не изменены, онкологической настороженности нет).
Бактериологическое исследование мазка из цервикального канала — роста флоры нет.
ПЦР на ИППП — отрицательная. ВПЧ — 11-й тип — положительно.
Бактериоскопическое исследование мазка из влагалища и цервикального канала: цервикальный канал — лейкоцитов 25–30 в поле зрения, микрофлора представлена в основном мелкими палочками, скудно — кокками; влагалище — лейкоциты до 10–15 в поле зрения, микрофлора — мелкие палочки, кокки — обильно; споры гриба — не обнаружены, гонококки, трихомонады — abs.
Диагноз: ВПЧ-инфекция (11-й тип). Кондиломатоз вульвы. Цервицит.
Обоснование назначения терапии. Принимая во внимание наличие ВПЧ 11-го типа, выраженного кондиломатоза вульвы, длительный период заболевания (около 1 года), отсутствие эффекта от проводимой ранее терапии, а также отмеченный пациенткой рост образований, рекомендовано провести терапию человеческим рекомбинантным интерфероном альфа-2b.
Препарат обладает выраженными противовирусными, антипролиферативными и иммуномодулирующими свойствами.
Иммуномодулирующие свойства интерферона, такие как усиление фагоцитарной активности макрофагов, увеличение специфической цитотоксичности лимфоцитов к клеткам-мишеням, обусловливают его опосредованную антибактериальную активность.
В присутствии аскорбиновой кислоты и альфа-токоферола ацетата возрастает специфическая противовирусная активность интерферона, усиливается его иммуномодулирующее действие, что позволяет повысить эффективность собственного иммунного ответа организма на патогенные микроорганизмы. При применении препарата повышается уровень секреторных иммуноглобулинов класса А, нормализуется уровень иммуноглобулина Е, происходит восстановление функционирования эндогенной системы интерферона. Аскорбиновая кислота и альфа-токоферола ацетат, являясь высокоактивными антиоксидантами, обладают противовоспалительным, мембраностабилизирующим, а также регенерирующим свойствами.
Повторный визит через 1 месяц от начала терапии: отмечает уменьшение размеров кондилом, уменьшение обильности выделений, исчезновение резкого запаха выделений.
При осмотре обращает на себя внимание уменьшение размеров образований.
Диагноз: ВПЧ-инфекция (11-й тип). Кондиломатоз вульвы. Цервицит.
Рекомендовано. В качестве поддерживающей терапии продолжить в течение 1 месяца комбинированное лечение препаратами Виферон® суппозитории 1 млн МЕ на ночь ректально и гель Виферон® местно на область кондилом 2 раза в день.
Повторный визит через 2 месяца от начала терапии: отмечает исчезновение кондилом. При осмотре обращает на себя внимание отсутствие образований.
Диагноз: ВПЧ-инфекция (11-й тип). Кондиломатоз вульвы в стадии регресса. Цервицит.
Рекомендовано: контроль мазка на флору, онкоцитологию, кольпоскопия через 4 мес.
Через 6 месяцев пациентка была осмотрена, патологии не выявлено, ПЦР на ВПЧ 11-го типа — отрицательно, результат мазка на онкоцитологию — NILM. В связи с ремиссией ПВИ с целью профилактики возможного повторного инфицирования вирусом проведена вакцинация квадривалентной вакциной по схеме 0–2–6 месяцев.
Диагноз: ПВИ (11-й тип), ремиссия. Кондиломатоз вульвы, регресс.
Рекомендовано наблюдение 1 раз в год.
Таким образом, проводимое комбинированное лечение с применением препаратов Виферон® суппозитории ректальные и гель Виферон® позволило добиться клинического выздоровления — полного исчезновения кондилом, даже без применения деструктивных методов лечения.
Многочисленные исследования доказывают высокую клиническую эффективность и уникальную безопасность отечественного препарата Виферон®, что находит применение в самых различных областях медицины, в том числе в акушерстве и гинекологии.
Литература
* ГБУЗ МО МОНИИАГ, Москва
** ООО «Педиатрия», Москва
*** ФГАОУ ВО РУДН, Москва
**** ФГБУ ФНИЦЭМ им. Н. Ф. Гамалеи МЗ, Москва




.gif)
.jpg)