вода хороший растворитель благодаря тому что ее молекулы
почему вода хороший растворитель?
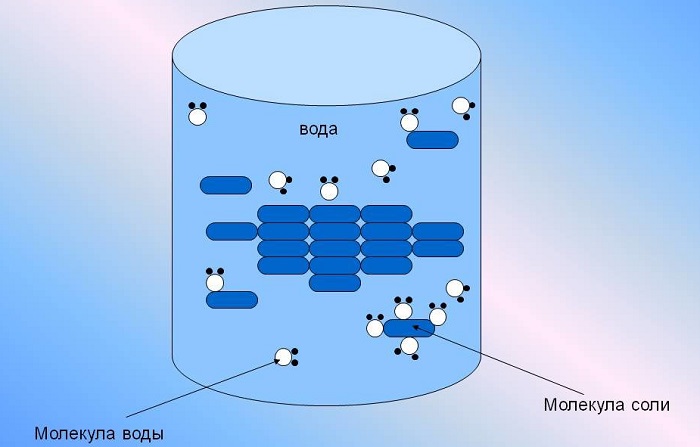
вода является хорошим растворителем для полярных веществ, т. к. молекулы воды по-лярны и представляют собой диполь.
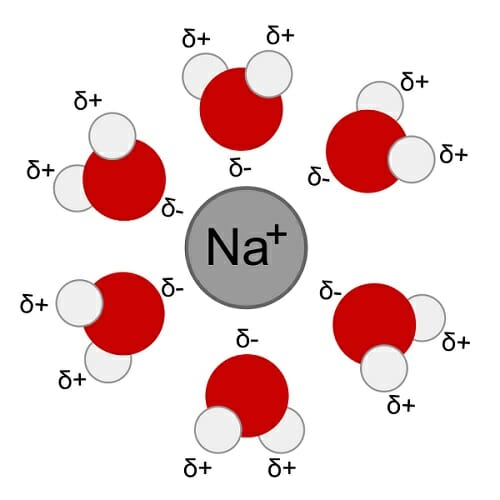
Поскольку кислород притягивает электроны сильнее, чем водород, молекула воды при-обретает полярный характер. Таким образом, молекула воды полярна, она представляет со-бой диполь : ее кислородный атом несет частичный отрицательный заряд ( δ-), а каждый из двух атомов водорода – частичный положительный ( δ+) заряд. Молекула воды асимметрич-на, ковалентные связи О-Н в ней расположены под углом, близким к прямому, вследствие чего создается форма треугольника с атомом кислорода – у вершины и атомами водорода – в углах основания. Таким образом, молекула воды имеет угловое строение с атомом кислорода у вершины и атомами водорода в углах основания. Угол связи близок к тетраэдрическому и составляет 104,5○. Дипольный характер строения молекул воды объясняет ее способность активно вступать во взаимодействие с различными веществами.
Одно из наиболее удивительных свойств воды — ее способность растворять многие вещества с образованием водных растворов. Раство ры — очень важное состояние вещества; они имеют весьма большое значение для промышленности и для жизненных процессов. Вода океа нов представляет собой водный раствор, содержащий тысячи компонентов: ионы металлов и неметаллов, комплексные неорганические ионы, множество различных органических веществ. Именно в этом растворе впервые возникли и развились живые организмы, и из него они получали ионы и молекулы, необходимые для их роста и жизни
Вода в отличие от органических растворителей хорошо растворяет соли, так как она обладает очень высокой диэлектрической проницаемостью (примерно 81 при комнатной температуре) и ее молекулы имеют тенденцию соединяться с ионами с обра зованием гидратированных ионов. Оба эти свойства обусловлены боль шим электрическим дипольным моментом 1 молекулы воды. И это свойство воды играет большую роль в развитии жизни и обмене веществ.
Вода как растворитель играет предельно важную роль далеко не только в плане нашего быта. Исследователи давно говорят, что данное волшебное соединение является основой для образования жизни вообще. И именно поэтому его наличие выступает обязательным условием для существования чего-то более сложного, нежели неживая природа.
Растворимость тех или иных химических элементов напрямую связана с существованием воды, так как она чаще всего выступает той средой, которая преобразует все вокруг себя и создает новые формы органической и неорганической материи.
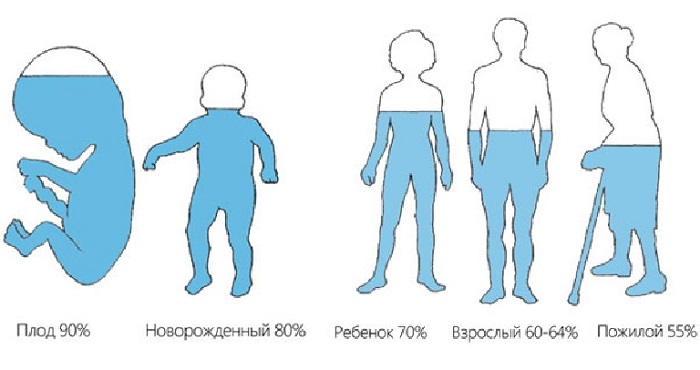
Человек примерно на 70% состоит из воды (имеется ввиду кровь, межклеточная жидкость, плазма крови и прочие вещества), у большинства других существ этот показатель колеблется от 50 до 95%. Очевидно, что свойства данного соединения оказывают решающую роль на происходящие вокруг нас и внутри нас процессы синтеза, регенерации и многие другие.
Это универсальный растворитель, который буквально формирует окружающий мир, постоянно преображает и обновляет его!
Свойства воды как растворителя
Вода – сложное вещество, отличающееся многими уникальными характеристиками, которые нельзя встретить больше нигде.
Она способна растворить большую часть существующих в природе комплексных соединений, содержащих в своей структуре молекулы как с положительными, так и отрицательными ионами одновременно.
При проведении так называемых кинетических исследований все растворы также изготавливаются на основе H2O.
Яркий пример особенности воды – при схожести по своей структуре с метаном CH4, она имеет температуру кипения выше на целых 250 0 С!
Важную роль играет также ее способность выступать одновременно либо донором, либо акцептором частиц водорода, благодаря чему проходят многие химические процессы. Химия говорит нам еще и о том, что вода выступает идеальным растворителем для диссоциирующих соединений.
Интересно отметить, что по причине высокого уровня диэлектрической проницаемости, вода отлично экранирует электрические поля ионов друг от друга. Благодаря этому притяжение противоположно заряженных частиц в воде снижается примерно в 80 раз.
Какие вещества растворяются в воде
Даже если школьник ходит только в 3 класс, он наверняка может привести примеры материалов, которые боятся контакта с водой, или, другими словами, растворяются в ней и теряют свои свойства.
Вот перечень только некоторых веществ такого типа:
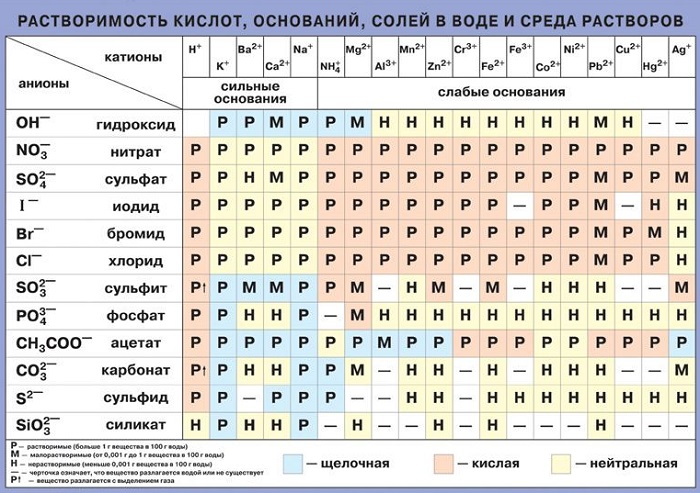
К хорошо растворимым относятся: соль, сахар, сода, хлориды, щелочные металлы и нитраты, а также бромиды. Воздух также претерпевает изменения при контакте с жидкой средой. Крахмал полностью растворим, спирт тоже.
Есть и такие материалы, которые являются нерастворимыми: сульфид меди, стекло, золото, керосин, серебро, растительный жир и многие другие. Правда, при некоторых условиях даже они не способны устоять от такого мощного воздействия.
В организме человека есть целая группа витаминов (С, В1, 2, 3(РР), В12 и другие), которые способны оказывать свое положительное воздействие на здоровье только в контакте с H2O. Это касается также и фолиевой кислоты, биотина и т. д.
Что не растворяется в воде
Существуют такие химические образования, которые не воспринимают воздействия воды в качестве растворителя совсем.
Хороший пример: углерод С, который находится в простом карандаше, многие металлы и сплавы, типа алюминия, а также золото, серебро, медь.
Такая ситуация складывается благодаря тому, что между молекулами и атомами нерастворимых веществ действуют сильные связи, которые водород разрушить не в состоянии. Полярное состояние молекулы также способствует большей прочности материала, который состоит из таких частиц.
Многие вещи, которые мы видим вокруг себя в быту, также являются нерастворимыми. Очень популярный пример – пластик.
В мировом океане плавает огромное пятно из пластикового мусора, которое ежегодно растет, и количество пластмассы там совершенно не желает уменьшаться естественным путем. Его не могут никак переработать, что очень плохо для всей экосистемы.
Именно поэтому экологи бьют тревогу и в ЕС уже сейчас планируется отказ от целлофановых пакетов, пластиковых стаканчиков и трубочек и тому подобные меры.
Значение воды как растворителя
Как уже упоминалось в начале статьи, рассматриваемые свойства воды являются ключевыми для всей живой и неживой природы нашей планеты.
Если бы она не обладала этими характеристиками, то большинство химических процессов на Земле, в живых организмах, в органической природе бы просто остановилось. Картинка такого мира была бы очень неутешительна – темная пустыня без признаков жизни.
Роль воды настолько огромна, что именно ее определение в далеких планетах и галактиках является для астрономов основным занятием в надежде когда-то отыскать там если не разумное существование, то хотя бы зачатки жизни.
Вода как растворитель

Вследствие своих аномальных свойств вода уникальный растворитель, прекрасно приспособленный для жизнедеятельности.

Другой многочисленный класс веществ, хорошо растворимых в воде, включает такие полярные органические соединения, как сахара, альдегиды, кетоны, спирты. Их растворимость в воде объясняется склонностью молекул воды к образованию полярных связей с полярными функциональными группами этих веществ, например с гидроксильными группами спиртов и сахаров или с атомом кислорода карбонильной группы альдегидов и кетонов. Ниже приведены примеры водородных связей, важных для растворимости веществ в биологических системах. Вследствие высокой полярности вода вызывает гидролиз веществ.
Так как вода составляет основную часть внутренней среды организма, то она обеспечивает процессы всасывания, передвижения питательных веществ и продуктов обмена в организме.
Необходимо отметить, что вода является конечным продуктом биологического окисления веществ, в частности глюкозы. Образование воды в результате этих процессов сопровождается выделением большого количества энергии приблизительно 29 кДж/моль.
Важны и другие аномальные свойства воды: высокое поверхностное натяжение, низкая вязкость, высокие температуры плавления и кипения и более высокая плотность в жидком состоянии, чем в твердом.
Для воды характерно наличие ассоциатов групп молекул, соединенных водородными связями.
В зависимости от сродства к воде функциональные группы растворяемых частиц подразделяются на гидрофильные (притягивающие воду), легко сольватируемые водой, гидрофобные (отталкивающие воду) и дифильные.
К гидрофобным — неполярные группы, например углеводородные радикалы: СНз—(СН2)п —, С6Н5 —.
При растворении дифильных веществ происходит изменение структуры воды как результат взаимодействия с гидрофобными группами. Степень упорядочения молекул воды, близко расположенных к гидрофобным группам, увеличивается, и контакт молекул воды с гидрофобными группами сводится к минимуму. Гидрофобные группы, ассоциируясь, выталкивают молекулы воды из области своего расположения.
Процесс растворения
Природа процесса растворения сложна. Естественно, возникает вопрос, почему некоторые вещества легко растворяются в одних растворителях и плохо растворимы или практически нерастворимы в других.

Великий русский химик Д. И. Менделеев (1834—1907) считал, что важную роль при растворении играют химические процессы. Он доказал существование гидратов серной кислоты H2SО4*H2O, H2SО4*2H2O, H2SО4*4H2О и некоторых других веществ, например, С2Н5ОН*3Н2О. В этих случаях растворение сопровождается образованием химических связей частиц растворяемого вещества и растворителя. Этот процесс называется сольватацией, в частном случае, когда растворителем является вода, гидратацией.
Как установлено, в зависимости от природы растворенного вещества сольваты (гидраты) могут образовываться в результате физических взаимодействий: иондипольного взаимодействия (например, при растворении веществ с ионной структурой (NaCI и др.); дипольдипольного взаимодействия при растворении веществ с молекулярной структурой (органические вещества)).
Химические взаимодействия осуществляются за счет донорноакцепторных связей. Здесь ионы растворенного вещества являются акцепторами электронов, а растворители (Н2О, NН3) донорами электронов (например, образование аквакомплексов), а также в результате образования водородных связей (например, растворение спирта в воде).

Например, при растворении гидроксида калия в воде выделяется теплота:
А при растворении хлорида натрия теплота поглощается:
Теплота, выделяемая или поглощаемая при растворении 1 моля вещества, называется теплотой растворения Qраств
В соответствии с первым началом термодинамики
где ΔНраств изменение энтальпии при растворении данного количества вещества.
Растворение в воде безводного сульфата меди белого цвета приводит к появлению интенсивной голубой окраски. Образование сольватов, изменение окраски, тепловые эффекты, как и ряд других факторов, свидетельствуют об изменении химической природы компонентов раствора при его образовании.
Таким образом, в соответствии с современными представлениями, растворение физико-химический процесс, в котором играют роль как физические, так и химические виды взаимодействия.
Занятие по химии «Вода-самый хороший растворитель»
Выбранный для просмотра документ Сидорова Л.А._занятие_Вода.doc
Конспект урока по теме «Вода – самый хороший растворитель»
Автор: Сидорова Любовь Анатольевна,
учитель химии МБОУ «Гимназия №11», г.Норильск
Тип урока : изучение нового материала
Цель : формирование эко-валеологической и исследовательской компетенций в ходе изучения растворительной способности воды, классификации и физико-химических свойств растворов.
Форма урока : урок – исследование с использованием интерактивной доски
Метод изучения материала: постановка и решение проблемной ситуации.
Формы работы: фронтальная, индивидуальная и групповая.
Организационный этап с актуализацией изучаемой на уроке темы.
СЛАЙД 1. Видеофрагмент о воде
Проблемные вопросы (обсуждаются с учителем):
Что вы знаете об этом веществе?
Бесцветная, прозрачная жидкость, без запаха, без вкуса, можно вспомнить температуры кипения и плавления ( физические свойства присущи чистой воде).
Какие проблемные вопросы возникают у вас при разговоре о воде?
Вопросов много, но сегодня, мы попробуем ответить на один из них.
СЛАЙД 2. Так почему воду с растворенными в ней веществами мы все равно называем водой?
Этап формирования новых знаний.
1. Сколько воды на Земле?
Много это или мало? Так мы богачи или все-таки бедняки?
Попробуем ответить на этот вопрос.
Вспомните, в каком виде вода существует на Земле?
А в каком природном виде она может существовать?
-В виде родников, озер, океанов, морей, рек, атмосферной влаги, ледников.
Около 70% поверхности Земли покрыто водой. Территория большая, но сколько из нее является доступной нам?
СЛАЙД 4. Попробуем найти соответствие между природными источниками воды и их процентным содержанием (работа с интерактивной доской) .
ПРОЦЕНТНОЕ СОДЕРЖАНИЕ ПРИРОДНЫЕ ИСТОЧНИКИ
СЛАЙД 5. ( Ответ: реки, атмосферная влага, озера, подземная влага, ледники, океаническая вода)
Итак, 97% всех водных ресурсов – это запасы Мирового океана, не пригодные для питья. Получается, что доступной воды совсем мало: 2,9% с ледниками вместе. Только 1% воды на планете пригоден для питья. Поэтому наше ежедневное отношение к воде должно быть более ответственным и бережливым.
ВЫВОД № 1 : Вода – дефицитное вещество, хотя на Земле это самое распространенное вещество.
2. Что из себя по составу представляет природная вода?
Видеофрагмент «Состав природной воды»
Мини-исследование: анализ состава природной питьевой воды «Северное сияние» и др. по этикеткам
Состав природной воды
Почему данная питьевая вода считается «чистой»? Содержание ионов в воде не превышает ПДК, в небольшом количестве они даже полезны (например, ионы свинца и ртути, которые даже в малых дозах способны вызвать тяжелейшие отравления)
Итак, что из себя по составу представляет природная вода?
Это смесь разных веществ, растворенных в воде.
К какому типу смесей она относится?
Как по-другому мы чаще всего ее называем?
Да, мы часто произносим термин «раствор». А что он означает?
Раствор – это однородная смесь веществ, состоящая из нескольких компонентов.
СЛАЙД 6. Рассмотрим классификацию растворов.
По агрегатному состоянию они делятся на твердые, жидкие и газообразные.
Твердые – сплавы металлов.
Жидкие – столовый уксус, минеральная вода, кровь и т.д.
Жидких растворов, пожалуй, больше всего.
Мы остановимся на них.
СЛАЙД 7. Вы сами сказали, что любой раствор, особенно жидкий, как правило, состоит из двух компонентов. Назовите их.
Мы часто говорим о водных растворах. Чем они отличаются от всех остальных растворов?
СЛАЙД 8. В них растворителем является вода.
Вернемся к изначальному вопросу: почему в природе встречается не чистая вода, а смесь веществ?
3. Как вы думаете, что из себя представляет процесс растворения веществ в воде?
Лабораторная работа : «Растворение перманганата калия в воде»
Это химический или физический процесс?
Хотите увидеть его, что называется, изнутри?
СЛАЙД 9. Анимационная модель .
К какому типу, на ваш взгляд, он относится?
Как мы можем определить, к какому типцу относится то или иное явление?
По признакам (выпадение осадка, изменение окраски, выделение газа, изменение температуры).
Лабораторная работа : «Растворение в воде сульфата меди ( II ), нитрата аммония».
4. На все ли вещества вода одинаково хорошо действует в качестве растворителя?
Лабораторная работа : «Растворение поваренной соли, серы, растительного масла в воде»
Вывод: Не все вещества хорошо растворяются в воде, есть нерастворимые и малорастворимые в воде вещества.
Кстати, эта классификация условна, так как совершено нерастворимых веществ не бывает. Например, если опустить в воду серебряную ложку, постепенно частички серебра будут переходить в раствор. Воду, содержащую ионы серебра, называют «святой». Почему?
5. Растворимость – это способность вещества растворяться в воде или другом растворителе.
Как вы думаете, от каких факторов зависит растворимость веществ в воде?
СЛАЙД 11. 1. От природы. Полярные молекулы веществ способны растворяться в полярном растворителе (в воде): « подобное растворяется в подобном» ( анимационная модель )
2. Как влияет температура на изменение растворимости?
СЛАЙД 12. Анализ графиков.
Как этот факт сказывается на жизни биологических (природных) объектов?
3. При увеличении давления, объем уменьшается и молекулы могут чаще сталкиваться друг с другом, поэтому растворение газов увеличивается.
6. Какое значение имеют водные растворы для организма человека?
Вода является участников большинства химических реакций, протекающих в нашем организме.
Рассчитайте массу воды в своем организме.
Сообщение: «Влияние воды на организм человека».
«..Наш организм на 60%-70% состоит из воды. Потеря 10% воды может привести к необратимым изменениям в организме, 15%-20% приводит к смерти, поскольку кровь настолько густеет, что с ее перекачкой не справляется сердце. Таким образом, если без пищи человек может прожить около месяца, то без воды – всего лишь несколько суток …».
Загрязнения воды ( Сообщения учащихся )
СЛАЙД 17.Общий вывод
Вода – ценное вещество, необходимое человеку, животным и растительным организмам для существования.
Доступной воды на Земле мало. Поэтому к ней нужно относиться бережно.
В 21 веке мы начинаем понимать, что самые дорогие сокровища нашей планеты Земля – не золото и бриллианты, а те, что, кажутся нам бесплатными и неисчерпаемыми: вода и воздух!
Универсальный растворитель – определение и характеристики
Универсальное определение растворителя
Вода это вещество, которое мы называем универсальным растворитель, Растворитель – это просто жидкость, в которой могут растворяться другие вещества, и причина, по которой вода получила ярлык универсального растворителя, заключается в том, что никакой другой растворитель не может растворить столько веществ, сколько может. Это в основном то, что делает его таким важным для жизни на земле. Кроме того, удивительно, что каждый водоем, найденный на земле, включая лед, поддерживает ту или иную форму жизни, которая адаптировалась к температуре и давлению, обнаруженному в этой форме воды.
Тот простой факт, что ученым всегда интересно находить воду, связанную с жизнью, на других планетах, многое говорит об этом, казалось бы, простом веществе. Вода является наиболее распространенным веществом в организмах и клетках. Конечно, есть много очевидных применений для воды, таких как питье, мытье и тушение пожаров, и это благодаря характеристикам, которыми он обладает, которые делают его универсальным растворителем. Вода очень важна для жизни, потому что для многих важных реакций в организме организмов необходима водная среда. Например, вода необходима для переваривания белков в аминокислоты, И в фотосинтез и пищеварение.
Характеристики универсального растворителя
полярность
Это большая часть того, почему вода является универсальным растворителем. Полярность – это неравномерность распределения электронов в молекула, что приводит к одной молекуле, имеющей две противоположные стороны; один отрицательный и один положительный. Теперь вода имеет молекулярную формулу H2O, поэтому каждая молекула воды имеет два атома водорода и один атом кислорода, как вы можете видеть на диаграмме ниже. Атомы водорода не находятся на противоположных сторонах друг друга, и они несут частичный положительный заряд. Это означает, что они создают положительно заряженную часть молекулы, в то время как кислородный конец создает отрицательно заряженную часть. Эта полярность означает, что вода может присоединяться и, следовательно, растворять полярные и ионные (заряженные) вещества.
Высокая удельная теплоемкость
Количество энергии, необходимое для повышения температуры одного грамма воды на 1 градус Цельсия, является ее удельной теплотой, и при одной калории на грамм она намного выше, чем удельная теплоемкость большинства жидкостей. Это хорошая новость для нас, так как мы на 60% состоим из воды, и мы не смогли бы выжить, если бы наши тела сильно и быстро остыли и нагрелись. Это также имеет решающее значение для выживания всех других организмов, в том числе водных организмов. Это означает, что океаны и реки не замерзают постоянно или не испаряются при изменении температуры. Если вода не может стабилизировать свою температуру, энергия, которая выделяется во время обмена веществ в живых организмах, может привести к перегреву и смерти.
Уникальные свойства плотности и температуры
Когда мы помещаем кубик льда в воду, он плавает, и, к счастью, то же самое относится и к айсбергу. Если бы лед был более плотным, чем вода, он бы постоянно замерзал наверху, а затем опускался, пока все водоемы не превратятся в лед, уничтожая всю жизнь. Вода также существует в виде газа, жидкости и твердого вещества в очень небольшом диапазоне температур, что означает, что мы можем найти ее во всех трех формах на Земле в зависимости от того, где мы находимся, и часто в одном и том же месте. Это не часто встречающаяся собственность.
викторина
1. Вода считается полярной, потому что:A. У этого есть одна отрицательная сторона и другая, которая является положительной.B. Это универсальный растворитель.C. У него два атома водорода.D. Это самый плотный в твердой форме.
Ответ на вопрос № 1
верно. У воды есть сторона, которая немного положительна, и сторона, которая слегка отрицательна.
2. Что из следующего является силой, которая удерживает молекулы воды вместе?A. Ковалентные связи B. Ионные связиC. Полярные связиD. Водородные связи
Ответ на вопрос № 2
D верно. Водородные связи образуются между атомами кислорода и атомами водорода различных молекул воды.
3. Какое свойство относится к слипшимся молекулам воды?A. прилипание B. полярностьC. когезияD. Быть универсальным растворителем
Ответ на вопрос № 3
С верно. Силы сцепления, вызванные водородными связями, делают воду эластичной.