вобэнзим или флогэнзим что лучше в гинекологии
Вобэнзим: аналоги и побочные эффекты
В составе каждой таблетки содержится ряд действующим компонентов: панкреатин, бромелаин, рутозид, трипсин, химотрипсин, липаза, амилаза и папаин.
В качестве вспомогательных компонентов для изготовления препарата используют кукурузный крахмал, лактозу, магния стеарат, диоксид кремния, тальк, стеариновую кислоту и воду.
Каждая таблетка покрыта оболочкой, состоящей из шеллака, сахарозы, белой глины, красителей и ряда других веществ.
Фармакологическое действие, фармакодинамика и фармакокинетика
Основные эффекты, оказываемые Вобэнзимом:
Активные компоненты препарата снижают количество активных циркулирующих ИК в крови, активизирует иммунитет, направленный против опухолевых клеток, и фагоцитоз, тем самым осуществляя свое иммуномодулирующее действие.
Также ЛС нормализует проницаемость стенок сосудов, снижает инфильтрацию поврежденных тканей, благодаря чему уменьшает отек и ускоряет время рассасывания кровоподтеков и гематом.
Вобэнзим регулирует вязкость крови, нормализует численность форменных элементов, тем самым улучшая реологические показатели и микроциркуляцию в тканях.
Всасывается из тонкого кишечника достаточно быстро, попадает в кровяное русло, где вступает в связь с белками-переносчиками, благодаря которым и поступает в органы, где протекают патологические процессы.
Какие существуют показания и противопоказания к приему Вобэнзима?
В клинике описано множество патологических состояний, когда применение данного лекарственного препарата может быть полезным. Вот их перечень:
В ангиологии: флебиты, тромбофлебиты, атеросклероз сосудов нижних конечностей, посттромбофлебитическая болезнь, эндартерииты.
В кардиологии: ИМ, стабильная стенокардия напряжения.
В гинекологии: воспалительные заболевания женских половой сферы, инфекции (вызванные хламидиями, уреаплазмами, микоплазмами), гестоз, привычное невынашивание беременности.
В дерматовенерологии: акне, различные дерматозы.
В гастроэнтерологии: воспаления ЖКТ, дисбактериоз.
В неврологии: рассеянный склероз.
В офтальмологии: ириты, увеиты, ретинопатия, различные формы глауком.
В ЛОР: синусит, гайморит, отит, ларингит.
В пульмонологии: трахеиты, бронхиты, пневмонии, туберкулез.
В урологии: цистит, простатит.
В онкологии: для облегчения переносимости противоопухолевой терапии.
В ревматологии: артриты, деформирующий остеоартроз.
В хирургии и травматологии: послеоперационные, посттравматические осложнения воспалительного, отечного или тромботического характера.
Также существует ряд противопоказаний к назначению Вобэнзима:
Повышенный риск возникновения кровоизлияний и кровотечений.
Детский возраст до пяти лет.
Индивидуальная непереносимость к компонентам ЛС.
Побочное действие медикамента
Как правило, лечение Вобэнзимом переносится пациентами хорошо и негативных реакций не возникает. Однако в некоторых случаях возможно возникновение аллергии по типу крапивницы. В данной ситуации ЛС необходимо отменить.
Рекомендации по применению препарата
Принимаются таблетки Вобэензима перорально за 25-30 минут до еды, разжевывать их нельзя. Запивать препарат следует стаканом чистой воды.
Дозировка, кратность приема и длительность курса лечения устанавливаются индивидуально для каждого пациента. При этом специалисты учитывает характер заболевания, его тяжесть и наличие сопутствующих патологий.
Взаимодействует ли Вобэнзим с другими лекарствами и совместим ли с приемом алкоголя?
На настоящий момент не обнаружено какого-либо негативного взаимодействия данного препарата с иными ЛС.
Если говорить о возможности приема Вобэнзима совместно с алкогольными напитками, то следует иметь в виду то, что его, как правило, назначают в комплексе с иными медикаментами, применяющимися для лечения инфекционных, воспалительных, онкологических заболеваний, а также для терапии абстинентного синдрома. А вот с ними сочетать алкоголь ни в коем случае нельзя.
Дополнительная информация и особые оказания
Отпускается препарат без рецепта. Хранить его можно в течение 30 месяцев с даты производства при температуре от 15 до 25 градусов.
Важным фактом, о котором следует помнить при лечении Вобэнзимом, является то, что он может усиливать симптомы болезни в самом начале терапии. В этом случае отменять его не нужно, необходимо лишь скорректировать дозу и негативные проявления разрешатся.
Аналоги
Наиболее известные и распространенные заместители Вобэнзима:
Также есть недорогие аналоги российского производства. К ним относятся Лонгидаза, Ронидаз, Эванзим и ряд другим препаратов. К зарубежным дешевым дженерикам можно отнести ЛС Серрата, Флогэнзим.
Возможность назначения препарата в период беременности и ГВ
Данные состояния не являются противопоказаниями к назначению ЛС. Даже наоборот, этот медикамент часто назначают беременным женщинам после 13 недели беременности, чтобы предупредить самопроизвольный аборт. Дозировка препарата подбирается индивидуально, при этом необходимо учитывать показатели развития и здоровья плода, а также самочувствие будущей мамы.
Достоинства и недостатки Вобэнзима
Отзывы о данном лекарственном препарате, как и многих других, весьма противоречивы. Потребители и специалисты спорят о его эффективности, высказывая то положительное, то отрицательное мнение.
Однако все-таки можно выделить ряд существенных преимуществ Вобэнзима:
Высокая эффективность по мнению большинства пациентов и врачей.
Заметное усиление действия других препаратов.
Отсутствия привыкания и синдрома отмены.
Среди недостатков чаще всего отмечают высокую стоимость лекарственного средства.
Что лучше: Флогэнзим или Вобэнзим
Флогэнзим
Вобэнзим
Исходя из данных исследований, Вобэнзим лучше, чем Флогэнзим. Поэтому мы советуем выбрать его.
Но не забывайте, что у данных препаратов в составе разные активные вещества. Поэтому обязательно проконсультируйтесь с врачом. Возможно, какой-то из них может не подойти для вашей терапии.
Сравнение эффективности Флогэнзима и Вобэнзима
Эффективность у Флогэнзима достотаточно схожа с Вобэнзимом – это означает, что способность лекарственного вещества оказывать максимально возможное действие схоже.
Например, если терапевтический эффект у Флогэнзима более выраженный, то при применении Вобэнзима даже в больших дозах не получится добиться данного эффекта.
Также скорость терапии – показатель быстроты терапевтического действия у Флогэнзима и Вобэнзима примерно одинаковы. А биодоступность, то есть количество лекарственного вещества, доходящее до места его действия в организме, схожа. Чем выше биодоступность, тем меньше его потерь будет при усвоении и использовании организмом.
Сравнение безопасности Флогэнзима и Вобэнзима
Безопасность препарата включает множество факторов.
При этом у Флогэнзима она выше, чем у Вобэнзима. Важно, где метаболизируется препарат: лекарственные вещества выделяются из организма либо в неизмененном виде, либо в виде продуктов их биохимических превращений. Метаболизм протекает спонтанно, но чаще всего задействует основные органы, такие как печень, почки, лёгкие, кожу, мозг и другие. При оценивании метаболизма у Флогэнзима, также как и у Вобэнзима мы смотрим, какой орган является метаболизирующим и наколько критично действие на него.
Соотношение риска к пользе – это когда назначение лекарственного препарата нежелательно, но оправдано при определенных условиях и обстоятельствах, с обязательным соблюдением осторожности применения. При этом у Флогэнзима рисков при применении меньше, чем у Вобэнзима.
Также при рассчете безопасности учитывается проявляются ли только аллергические реакции или же возможная дисфункция основных органов. В прочем как и обратимость последствий от использования Флогэнзима и Вобэнзима.
Сравнение противопоказаний Флогэнзима и Вобэнзима
Исходя из инструкции. Количество противопоказаний у Флогэнзима достаточно схоже с Вобэнзимом и составляет малое количество. Это и перечень симптомов с синдромами, и заболевания, различные внешних и внутренние условия, при которых применение Флогэнзима и Вобэнзима может быть нежелательным или недопустимым.
Сравнение привыкания у Флогэнзима и Вобэнзима
Как и безопасность, привыкание тоже включает множество факторов, которые необходимо учитывать при оценивании препарат.
Так совокупность значения таких параметров, как «cиндром отмены» и «развитие резистентности», у Флогэнзима достаточно схоже со аналогичными значения у Вобэнзима. Синдром отмены – это патологическое состояние, возникающее после прекращения поступления в организм веществ, вызывающих привыкание или зависимость. А под резистентностью понимают изначальную невосприимчивость к препарату, этим она отличается от привыкания, когда невосприимчивость к препарату развивается в течение определенного периода времени. Наличие резистентности можно констатировать лишь в том случае, если была сделана попытка увеличить дозу препарата до максимально возможной. При этом у Флогэнзима значения «синдрома отмены» и «резистентности» достотачно малое, впрочем также как и у Вобэнзима.
Сравнение побочек Флогэнзима и Вобэнзима
Побочки или нежелательные явления – это любое неблагоприятное с медицинской точки зрения событие, возникшее у субъекта, после введения препарата.
У Флогэнзима состояния нежелательных явлений почти такое же, как и у Вобэнзима. У них у обоих количество побочных эффектов малое. Это подразумевает, что частота их проявления низкая, то есть показатель сколько случаев проявления нежелательного эффекта от лечения возможно и зарегистрировано – низкий. Нежелательное влияние на организм, сила влияния и токсическое действие у Флогэнзима схоже с Вобэнзимом: как быстро организм восстановиться после приема и восстановиться ли вообще.
Сравнение удобства применения Флогэнзима и Вобэнзима
Это и подбор дозы с учетом различных условий, и кратность приемов. При этом важно не забывать и про форму выпуска препарата, ее тоже важно учитывать при составлении оценки.
Удобство применения у Флогэнзима примерно одинаковое с Вобэнзимом. При этом они не являются достаточно удобными для применения.
Рейтинг препаратов составлен опытными фармацевтами, изучающий международные исследования. Отчет сгенерирован автоматически.
Дата последнего обновления: 2020-12-04 13:44:13
Системная энзимотерапия в комплексной терапии инфекционных болезней
Современная стратегия и тактика терапии инфекционных болезней в большинстве случаев предусматривают комплексное лечение больных с использованием разнообразных этиотропных средств, иммуноориентированной и иных видов патогенетической терапии и симптоматиче
Современная стратегия и тактика терапии инфекционных болезней в большинстве случаев предусматривают комплексное лечение больных с использованием разнообразных этиотропных средств, иммуноориентированной и иных видов патогенетической терапии и симптоматической терапии.
Этими соображениями в свое время была вызвана необходимость поиска, изучения и внедрения в повседневную практику вспомогательных средств обеспечения и усиления основного лечения, так называемой сервис- и бустер-терапии.
В последние годы в этом качестве с большим успехом стала широко использоваться системная энзимотерапия (СЭТ). Разнообразие полезных свойств полиферментных препаратов вобэнзима, флогэнзима и вобэ-мугоса — противовоспалительный, противоотечный, анальгезирующий, фибринолитический, иммуномодулирующий, реологический эффекты — позволяет использовать их в комплексном лечении очень широкого круга заболеваний.
Разработанный М. Вольфом и К. Рансбергером более 40 лет назад первый препарат для системной энзимотерапии — вобэнзим — содержит протеолитические ферменты, которые способны эффективно воздействовать на самые разные физиологические и патофизиологические процессы в организме.
В большинстве случаев при лечении инфекционных больных используется этиотропная терапия антибактериальными, противовирусными, антимикотическими, антипротозойными и прочими средствами. Можно добиться усиления их воздействия на инфекционный агент (бустер-терапия), создания лучших условий для их работы и/или специального обеспечения, в том числе уменьшения выраженности, вплоть до полного устранения побочного действия лекарств (сервис-терапия), путем использования полиферментных препаратов.
Главные механизмы интегрального клинического потенцирования действия этиотропных препаратов (А. П. Ремезов, Г. Ю. Кнорринг) перечислены ниже.
Бустер-эффекты
Сервис-эффекты
В первую очередь, полиферментные средства существенно повышают концентрацию антибактериальных препаратов в крови (см. рисунок 1).
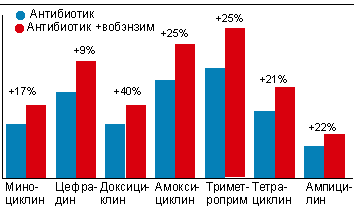 |
| Рисунок 1. повышение концентрации антибиотиков в сыворотке крови через 8 ч после сочетанного приема с вобэнзимом (по S. Barsom et al., 1982, 1983). |
Еще одним важным обоснованием применения СЭТ в терапии инфекционных болезней является прямое участие полиферментных препаратов в разносторонней функции желудочно-кишечного тракта. Во-первых, полиферментные системы как пищеварительный агент (прежде всего — папаин, бромелаин) активны в толстой кишке, где рН среды смещен в кислую сторону. Тем самым обеспечивается глубокий протеолиз белков и гликопротеидов, что, по-видимому, лишает условно-патогенные (и патогенные) микробы условий для роста и пищевых субстратов, в то время как неприхотливые компоненты нормальной, сбалансированной микробиоценотической системы кишечника (например, микробы-сахаролитики) не нуждаются в белках для своей жизнедеятельности. Во-вторых, иммуномодулирующие свойства полиферментного препарата, прежде всего стимуляция макрофагов, позволяют противостоять антигенной гиперстимуляции с последующим истощением иммунитета. В-третьих, в условиях углубляющегося микробиоценотического дисбаланса кишечника нарастающий эндо- и экзотоксикоз приводит к сенсибилизации организма и создает риск возникновения и развития пищевой аллергии.
К настоящему времени накоплено достаточно много сведений, касающихся влияния энзимов на иммунную систему, что позволяет комплементарно использовать их в схемах иммуноориентированной терапии.
Наконец, еще одно из довольно давно описанных свойств системных полиэнзимных препаратов — перекисное окисление липидов и протеинов — лежит в основе многочисленных метаболических эффектов, которые уже начали использовать в лечении вирусных гепатитов, гиперлипидемии, а также при детоксикации.
В конце 70-х — начале 80-х гг. XX века в клинических исследованиях неоднократно использовалась способность энзимов повышать концентрацию антибиотиков в крови, облегчать их проникновение в ткани и тем самым повышать эффективность лечения.
В 80-х и 90-х гг. было проведено большое количество клинических исследований, в которых чаще всего сравнивалась эффективность препаратов вобэ-мугос и ацикловир при опоясывающем герпесе (Scheef, Konig, Ahumada, Kleine, Klaschka, Mendoza, Billingham). Большинство исследований продемонстрировало равную эффективность этих препаратов, однако после применения препарата вобэ-мугос как побочные нежелательные эффекты, так и последующие невралгии появлялись реже, чем в случае с ацикловиром. Успехи энзимотерапии при опоясывающем герпесе (herpes zoster) дали импульс к применению ее в лечении инфекций, вызванных вирусом herpes simplex 1 и 2 типа.
Благоприятные воздействия препаратов СЭТ вместе с их минимальными побочными действиями подвигли Stauder и Kabil (1997) к тому, чтобы использовать флогэнзим в комплексной терапии хронического вирусного гепатита С с высокоактивной вирусной репликацией. Эффективность такого лечения существенно превышала действенность терапии только интерфероном или только рибаверином. При этом элиминация вируса по результатам ПЦР достигла 50%. Hartman и Mikazans (1996) использовали комплексную терапию гонореи антибиотиками с вобэнзимом. Сравнение лабораторных и клинических результатов исследования однозначно говорят в пользу группы, получавшей комплексную терапию антибиотиками и вобэнзимом: произошла существенная нормализация количества Т-лимфоцитов и их подгрупп, пришел к норме индекс CD4+/CD8+, и приблизилась к норме концентрация ИК. Вобэнзим повышает терапевтическую эффективность традиционного лечения тяжелых форм гонореи.
Успех работы проф. Т. Г. Сухих соавтор. (1997), посвященной использованию вобэнзима в терапии некоторых инфекций, передающихся половым путем (ИППП), побудил Mikazans и Hartman (1996) взяться за проверку эффективности препарата в лечении синдрома Рейтера, при этом результаты исследования оказались положительными.
Недавно было предложено использовать вобэнзим для того, чтобы облегчить выявление некоторых ИППП. Его разжижающее действие на секреты дополнительных половых желез улучшает отток секретов и ускоряет появление возбудителей ИППП на слизистых (А. Д. Юцковский, 2002).
В ряде работ последних лет также показана возможность потенцирования вобэнзимом эффективности применения СЭТ в терапии некоторых инфекций: А. А. Хрянин (1999–2001) — урогенитальные инфекции; А. М. Лила соавт. (2000) — реактивные артриты; С. Н. Калинина, О. Л. Тиктинский соавт. (2002) — урогенитальные инфекции; В. Н. Ткачук соавт. (2000) — пиелонефриты; Н. В. Стрижова соавт. (2000-2001) — хронические сальпингоофориты; А. К. Мирзабалаева (2002) — актиномикоз гениталий; Ю. А. Спесивцев соавт. (2001) — гнойно-септические заболевания и многих других авторов.
Нами в цикле работ 1996–2003 гг. также была выявлена высокая эффективность СЭТ в комплексной терапии целого ряда инфекционных заболеваний: хламидийной, герпесвирусной, иерсиниозной инфекций.
Для исследования были выбраны 200 больных с ХИ, 200 больных с ПГГ, а также по 45 пациентов с острым иерсиниозным мезаденитом и острым иерсиниозным артритом в возрасте от 18 до 45 лет. В двух группах в каждую из которых входили по 150 пациентов с ХИ и ПГГ, а также в двух группах, включавших по 30 пациентов с иерсиниозным мезаденитом и артритом, в составе комплексной терапии назначался вобэнзим в дозе 10 таблеток три раза в день за 40 мин до еды с достаточным количеством воды. В двух других группах, включавших по 50 больных с ХИ или ПГГ каждая, а также в группах, в которые входили по 15 пациентов с иерсиниозным мезадентом и артритом, проводилось аналогичное комплексное лечение, но без использования вобэнзима. Эти группы рассматривались как контрольные. В общей сложности у больных определялись 68 специальных показателей иммунитета. Было достоверно установлено, что использование вобэнзима дает выраженный многосторонний эффект: повышение качества жизни, увеличение эрадикации бактериальных возбудителей и сокращение сроков выделения ВПГ, снижение риска развития специфических урогенитальных и экстрагенитальных, а также неспецифических осложнений (простатита, вульвовагинита, хронических артропатий (хронических артритов), дисбактериоза, хронического мезаденита), а в случае их возникновения — существенно ускоряет выздоровление.
Таким образом, назначение СЭТ в комплексном лечении инфекционных больных обосновано следующими свойствами полиэнзимных препаратов:
Приведенные данные позволяют считать обоснованным включение препаратов системной энзимотерапии в комплексы лечения инфекционных больных, при этом для уточнения тонких механизмов потенцирования эффективности основной терапии, безусловно, требуются дальнейшие исследования.
По вопросам литературы обращайтесь в редакцию
А. П. Ремезов, кандидат медицинских наук
Г. Ю. Кнорринг, кандидат медицинских наук
Медицинская академия последипломного образования, Санкт-Петербург
Роль системной энзимотерапии в комплексном лечении больных ревматоидным артритом и системной красной волчанкой
Среди системных аутоиммунных заболеваний особое место занимают ревматоидный артрит (РА) и системная красная волчанка (СКВ). Это связано с высокой распространенностью и социальной значимостью данных заболеваний, их чрезвычайной гетерогенностью, а также о
Среди системных аутоиммунных заболеваний особое место занимают ревматоидный артрит (РА) и системная красная волчанка (СКВ). Это связано с высокой распространенностью и социальной значимостью данных заболеваний, их чрезвычайной гетерогенностью, а также отсутствием единых алгоритмов фармакотерапии. Ежегодная заболеваемость СКВ составляет от 6 до 35 новых случаев на 100 000 населения.
Ревматоидный артрит — наиболее часто встречающееся воспалительное заболевание суставов, распространенность в популяции около 1%, характеризующееся неуклонно прогрессирующим течением с поражением суставов, приводящее к ранней инвалидизации и снижению продолжительности жизни [3, 4].
В основе патогенеза РА лежат иммунные нарушения, характеризующиеся патологией Т-клеточного звена иммунитета, а также гиперпродукцией провоспалительных цитокинов (ИЛ-1β, ФНО-α, ИЛ-6, ИЛ-8 и др.) [3, 5]. В результате развивающихся изменений В-лимфоциты продуцируют агрегированный (измененный) IgG, способный вступать в реакцию по типу антиген-антитело. Воспринимая измененный IgG как чужеродный антиген, плазматические клетки синовиальной оболочки вырабатывают антитела — ревматоидные факторы — классов IgG и IgМ. При взаимодействии ревматоидных факторов и иммуноглобулинов образуются иммунные комплексы, которые индуцируют выработку провоспалительных цитокинов, активируют компоненты комплемента, вызывающие хемотаксис и повреждение клеток, а также активацию системы свертывания крови. Это ведет к развитию и поддержанию иммуновоспалительного процесса в тканях суставов и внутренних органах.
В основе аутоиммунных нарушений при СКВ лежит патология гуморального звена иммунитета, характеризующаяся спонтанной неконтролируемой В-клеточной гиперреактивностью с нарушением продукции ИЛ-2 и образованием антител к компонентам ядер и цитоплазмы собственных клеток — антинуклеарных антител (АНА). Клинические системные проявления СКВ связаны с развитием васкулита, обусловленного образованием иммунных комплексов с последующим осаждением их на эндотелии сосудов, снижением клиренса ЦИК, изменениями в системе комплемента, включая генетически обусловленный дефицит С2— и С4-компонентов комплемента.
Основными средствами «актуальной» терапии РА и СКВ являются нестероидные противовоспалительные препараты (НПВП), которые применяются для купирования лихорадки, уменьшения болевого синдрома и улучшения функции пораженных суставов. Наиболее широко применяются «стандартные» НПВП — диклофенак, кетопрофен, напроксен и др. Однако при их длительном применении часто развиваются НПВП-индуцированные гастропатии, проявляющиеся эрозиями (нередко множественными) или язвами антрального отдела желудка или двенадцатиперстной кишки. Создание нового класса НПВП — селективных ингибиторов ЦОГ-2 — позволяет снизить риск развития НПВП-гастропатий, при этом противовоспалительный и обезболивающий эффекты этих препаратов сопоставимы с таковыми «стандартных» НПВП. Из группы ЦОГ-2 ингибиторов применяются нимесулид (найз, нимесил), мелоксикам (мовалис), целекоксиб (целебрекс), рофекоксиб (виокс) и др.
Глюкокортикоиды по-прежнему занимают важное место в комплексной терапии РА и СКВ. Преднизолон в низких дозах (5–10 мг) назначается больным РА для достижения адекватного контроля за ревматоидным воспалением, в высоких(1000 мг/сут) — для быстрого подавления активности иммуновоспалительного процесса (в варианте пульс-терапии). Сейчас уже ни у кого не вызывает сомнений положение о том, что глюкокортикоиды следует назначать больным СКВ в течение многих лет, чередуя высокие дозы в фазы обострения заболевания с поддерживающими при стихании иммуновоспалительного процесса и даже в период клинической ремиссии.
Основой лечения РА является применение базисных препаратов, способных модифицировать течение заболевания — сульфасалазина, метотрексата, имурана, циклофосфана, циклоспорина А, лефлюномида, антицитокиновых «биологических» агентов. «Золотым стандартом» фармакотерапии РА в настоящее время считается метотрексат, обладающий высоким терапевтическим индексом и низкой токсичностью. В последние годы рекомендуется назначать метотрексат в более высоких дозах — 10–15 мг в нед, иногда до 25 мг в нед. К числу эффективных препаратов для лечения РА относятся также соли золота (тауредон), D-пеницилламин, имуран, циклоспорин А. Одним из новых базисных антиревматических препаратов является лефлюномид (арава), обладающий антипролиферативным и противовоспалительным действием.
В лечении СКВ обнадеживающие результаты получены при использовании иммуносупрессанта селективного действия — мофетила микофенолата (селлсепта). Препарат является пролекарством, оказывает выраженный антипролиферативный эффект в отношении Т- и В-лимфоцитов и проявляет цитостатическую активность.
Установление фундаментальной роли в патогенезе РА интерлейкинов позволило рассматривать их в настоящее время в качестве перспективных «мишеней» антиревматической терапии. В настоящее время используются химерные моноклональные антитела к ФНО-α (инфликсимаб), рекомбинантный растворимый ФНО-α-рецептор, соединенный с Fc фрагментом IgG (Etanercept) и рекомбинантный растворимый антагонист ИЛ-1 (Anakinra) [5]. Однако широкое применение «биологических» агентов в значительной степени становится проблематичным из-за их высокой стоимости и нередко развивающихся побочных эффектов.
Таким образом, на сегодняшний день антиревматические препараты не полностью удовлетворяют предъявляемым требованиям в связи с недостаточной их эффективностью, а также из-за высокого риска побочных эффектов: миелосупрессий, патологических изменений со стороны органов желудочно-кишечного тракта и почек. Следует также упомянуть о недостаточном и поздно проявляющемся противовоспалительном эффекте, риске развития онкогематологических заболеваний и др.
Одним из альтернативных методов лечения является метод системной энзимотерапии (СЭТ), основанный на использовании целенаправленно составленных смесей гидролитических энзимов растительного и животного происхождения [6]. Среди препаратов СЭТ можно упомянуть вобэнзим и флогэнзим (MUCOS Pharma GmbH & Co., Германия).
Системная энзимотерапия за последние 10 лет нашла широкое применение при лечении различных заболеваний внутренних органов, в том числе и аутоиммунных [6, 8]. В частности, показано, что под действием гидролитических энзимов уменьшается инфильтрация плазматическими белками интерстиция и увеличивается элиминация белкового детрита и депозитов фибрина в зоне воспаления [7, 10]. Это, в свою очередь, обеспечивает улучшение микроциркуляции и ускоряет течение восстановительного процесса. Доказано также, что гидролитические энзимы могут модулировать активность ряда провоспалительных цитокинов (ИЛ-β, ФНО-α, ИЛ-6, ИЛ-8 и др.), играющих ключевую роль в патогенезе ревматических заболеваний [2, 9]. Способность энзимов подавлять экспрессию цитокиновых рецепторов на «клетках-мишенях», поддерживая тем самым их оптимальную концентрацию, возможно, и является одним из регуляторных механизмов, противодействующих массовому проявлению провоспалительных эффектов цитокинов на системном уровне.
Нами обследовано 120 пациентов с ревматическими заболеваниями (82 человека с РА и 38 — с СКВ). Возраст больных РА (25 мужчин и 57 женщин) составлял 26–66 лет, давность заболевания колебалась от 3 мес до 19 лет (в среднем 92,4±15,3 мес). У 27 пациентов была диагностирована суставная форма болезни, у 55 — суставно-висцеральная. Наиболее часто из внесуставных проявлений РА диагностировались анемический синдром (61,3%), лихорадка (50,7%), лимфоаденопатия (51,2%), спленомегалия (33,8%) и ревматоидные узелки (23,2%). Диагностические титры ревматоидного фактора обнаружены у 68 больных. 1-я группа больных РА (38 пациентов) получала НПВП и метотрексат в дозе 7,5–12,5 мг/нед, 2-я (44 пациента) — НПВП, метотрексат (7,5–12,5 мг/нед) и вобэнзим в дозе 30 драже/сут в течение первых двух недель, а затем по 21 драже/сут.
Группу СКВ составили 38 больных (9 мужчин и 29 женщин) от 18 до 46 лет, «стаж» заболевания 34,7±11,2 мес. Острое течение СКВ отмечалось у 12, подострое — у 11 и хроническое — у 15 больных. Люпус-нефрит был выявлен у 11 больных, периферическая лимфоаденопатия — у 9, лейкопения, тромбоцитопения отмечены у 17 пациентов. Больные СКВ были также разделены на две группы, 1-я из которых (16 пациентов) получала традиционную терапию (преднизолон в дозе 10-45 мг/сут, НПВП в средних терапевтических дозах, 6 больным был назначен метотрексат по 7,5 мг/нед, 6 — циклофосфан по 200 мг через день внутримышечно, 4 — делагил по 0,25 г/сут), а 2-й группе (22 пациента) наряду с ГКС, НПВП и цитостатиками был назначен вобэнзим в дозе 21-30 драже/сут. Контроль над параметрами заболевания осуществлялся на протяжении 3 мес.
При анализе клинических показателей у больных РА было установлено, что у пациентов 2-й группы наблюдалось более значимое уменьшение длительности утренней скованности, снижение индексов Ritchie и Lee, а также индекса боли, определяемого по 10-сантиметровой визуальной аналоговой шкале (ВАШ) (табл.). Важным является и тот факт, что снижение воспалительной активности заболеваний наблюдалось уже через 5–7 дней после начала приема препарата, что давало возможность уменьшить дозу принимаемых НПВП и тем самым снизить риск возникновения НПВП-гастропатии.
При анализе лабораторных показателей отмечено более значимое снижение уровня СОЭ, концентрации глобулиновых белковых фракций и IgM у пациентов c РА 2-й группы.
У всех обследованных больных РА отмечалось достоверное снижение уровня ЦИК в сыворотке крови уже после 2 мес терапии. Однако если у больных 1-й группы снижение концентрации ЦИК в процессе лечения составило 24,3%, то у пациентов 2-й группы — 40,9% (р
В. И. Мазуров, доктор медицинских наук, профессор, член-корреспондент РАМН
А. М. Лила, доктор медицинских наук, профессор
СПбМАПО, Санкт-Петербург




