во что может перерасти астма
Бронхиальная астма: как распознать и преодолеть?
Андрей Леонидович
Провизор
Астма — хронический недуг, поражающий бронхи, который часто проявляется в виде отека слизистой оболочки дыхательных путей и спазмов, сопровождающихся нехваткой воздуха. С греческого название болезни переводится, как «удушье», «тяжелое дыхание». Разберемся, что представляет собой эта болезнь, как ее распознать и можно ли вылечить.
Особенности бронхиальной астмы
Главная особенность недуга — быстрое прогрессирование, которое беспокоит человека частыми приступами удушья и приводит к серьезному ухудшению качества жизни. В мире более 100 000 000 людей страдает от этой болезни, а это — примерно 5-9% взрослого населения каждого государства. Каждый год недуг забирает жизни порядка 250 000 людей.
Симптомы бронхиальной астмы
Степени и формы заболевания
Медики выделяют 3 основные формы заболевания:
Независимо от формы заболевания оно может протекать в 4-х стадиях (ступенях, этапах):
Степени и формы бронхиальной астмы
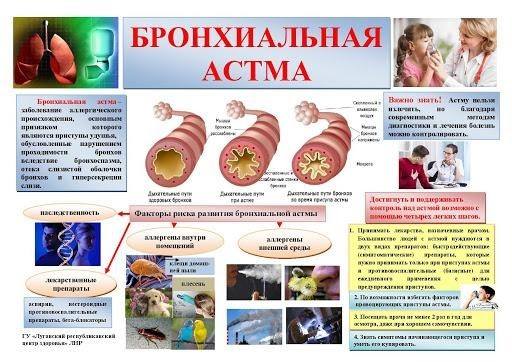
Причины возникновения
Развитию недуга способствуют определенные внешние и внутренние факторы. Внутренними могут быть такие, как:
Внешними причинами могут быть
Аллергия на что-либо и табакокурение — 2 наиболее частых фактора-провокатора бронхиальной астмы.
Симптомы заболевания
Важно понимать, что чем раньше врачи диагностируют заболевание, тем больше шансов на полное выздоровление. Поэтому нужно внимательно следить за своим организмом и при появлении любых признаков, описанных ниже, скорее обращаться к медикам:
На ранних стадиях вышеописанная симптоматика может либо проявляться слабо, либо вообще никак не давать о себе знать. Но постепенно симптомы будут становиться все более выраженными, а также приведут к другим не менее приятным ощущениям:
Лечение и профилактика бронхиальной астмы
Лечение и профилактика заболевания
Увы, современная медицина пока не в силах полностью избавить пациента от астмы. Поэтому всем терапевтические методы направлены на облегчение состояния человека и устранении симптомов заболевания. Лечением недуга занимаются пульмонологи и обычно медикаментозная терапия включает прием препаратов 2-х групп:
В качестве профилактических мер пульмонологи советуют следовать 6-и простым правилам:
Также стоит минимум 2 раза в неделю проводить тщательную влажную уборку в доме, стирать белье в машинке не реже раза в неделю на максимально допустимой температуре и не использовать в интерьере ковры с мягкой мебелью, которые накапливают пыль.
Если рассматривать конкретные препараты от бронхиальной астмы, то чаще всего врачи выписывают:
Все лекарства, доступные к продаже в аптеках Вашего города, а также цены на них, Вы можете увидеть на нашем сайте, введя в поисковой строке название лекарства и запустив поиск.
Бронхиальная астма
Бронхиальная астма (БА) – сложная медицинская, социально-экономическая проблема. До 10% населения планеты страдают различными видами БА. Развивается астма и в детском возрасте (50 %), и у взрослых до 40 лет. На распространенность и тяжесть течения бронхиальной астмы оказывают влияние генетические факторы, климат, экологическая обстановка, питание, эндокринные патологии, иммунодефицитные состояния.
Что такое бронхиальная астма
По определению ВОЗ бронхиальная астма – это полиэтиологическое хроническое воспалительное заболевание, затрагивающее дыхательные пути. Сопровождается периодической одышкой, приступами удушья. Отмечается заложенность в груди, ночной или утренний кашель с свистящими хрипами. Эти проявления связаны с обструкцией (сужением) просвета бронхиального дерева.
Диагностика и обследование при бронхиальной астме
Диагностика и обследование при бронхиальной астме проводится аппаратными методами, лабораторными и инструментальными исследованиями.
Рентгеноскопия и рентгенография на ранних стадиях заболевания неинформативны. При присоединении эмфиземы на рентгенограмме – повышенная воздушность легочной ткани.
Для детального изучения функциональных возможностей лёгких применяются:
Анализы при бронхиальной астме
Анализы при бронхиальной астме проводят как общеклинические, так и специфические для подтверждения диагноза.
Признаки бронхиальной астмы
К ранним факторам относятся:
Приступы бронхиальной астмы
Бронхиальная астма: клинические рекомендации
Бронхиальная астма, код по МКБ-10
Помощь при бронхиальной астме
Вторичная профилактика проводится у больных для предупреждения приступов.
Атопическая бронхиальная астма
Провоцирующими факторами, влияющими на развитие болезни, являются неинфекционные экзоаллергены: пищевые, бытовые, пыльцевые и многие другие.
Полное устранение причинного аллергена переводит болезнь в стойкую длительную ремиссию. Атопическая астма передаётся по наследству, причём чаще проявляется у детей.
Степени бронхиальной астмы
Степени тяжести бронхиальной астмы определяются в зависимости от симптоматики и прогрессирующего нарушения внешнего дыхания.
Бронхиальная астма: классификация
Классификация бронхиальной астмы строится в зависимости от следующих факторов:
Купирование бронхиальной астмы
Осложнения бронхиальной астмы
Осложнения бронхиальной астмы развиваются при длительном течении заболевания, при неадекватной терапии и отражаются на многих системах и органах.
Осложнения на сердечную мышцу
Патогенное влияние на желудок и печень оказывают лекарственные препараты, применяемые в лечении БА. Под их действием развиваются гастриты и язвы желудка. Иногда наблюдаются желудочные кровотечения.
Другие осложнения
Кашель при бронхиальной астме
Инвалидность при бронхиальной астме
Инвалидность при бронхиальной астме назначается пациентам со стойким длительным тяжёлым (среднетяжелым) нарушением дыхательной функции, что ведет к ухудшению качества жизни.
Инвалидность 1 группы назначается пациентам с тяжелой рецидивирующей астмой, не поддающейся амбулаторному лечению. Больной не способен к самообслуживанию, нуждается в постороннем уходе.
Инвалидность 11 группы – астма тяжелая неконтролируемая, с осложнениями: «легочное» сердце, расстройство кровообращения, диабет.
Инвалидность 111 группы – астма средней тяжести, частично контролируемая. Дыхательная недостаточность от 40-60%. Одышка при физических нагрузках.
Лечение бронхиальной астмы
Лечение бронхиальной астмы – сложный и длительный процесс, включающий медикаментозное лечение с базисной (поддерживающей) и симптоматической (купирующей приступы) терапией, исключение причинных аллергенов, гипоаллергенную диету и общеукрепляющие мероприятия.
К дополнительным методам терапии, значительно улучшающим течение болезни, относят санаторно-курортное лечение (море, горы, соляные пещеры), лечебную физкультуру, массаж, закаливание.
Принципы лечения при рецидивах:
Ингаляции при бронхиальной астме
Ингаляции при бронхиальной астме – это быстрый и действенный способ купирования приступов удушья. По сравнению с таблетками и инъекциями – результат мгновенный. Лучшим аппаратом для проведения ингаляций является небулайзер, который превращает лекарственный раствор в аэрозоль. В таком распыленном состоянии лекарство легко попадает в бронхи, снимает спазм гладкой мускулатуры, восстанавливает их проходимость, тем самым снимает симптомы астмы.
Таблетки от бронхиальной астмы
Дыхательная гимнастика
Дыхательная гимнастика при бронхиальной астме дополняет терапию, но не заменяет лечение медикаментами. Упражнения желательно выполнять утром и вечером. В первое время делать по 8 повторений, постепенно доводя до 16.
Противопоказания к занятиям:
Лёжа, после сна
На выдохе, сгибая ноги в коленях, подтягивать их к груди.
Упражнения при бронхиальной астме
Упражнения при бронхиальной астме являются обязательным этапом в комплексном лечении. Они восстанавливают дыхательные функции, облегчают кашель, укрепляют организм, сокращают число приступов.
Занятия проводятся трижды в неделе по полчаса. В подходе 5-6 повторений с доведением до 8. Обязателен доступ свежего воздуха.
На первых трёх занятиях выполняется вводный комплекс:
Из-за чего возникает бронхиальная астма?
Бронхиальная астма – хроническое заболевание дыхательных путей, связанное с воспалением слизистой оболочки, это и приводит к формированию бронхообструкции. В итоге появляются хрипы, нарушения дыхания. Так почему развивается бронхиальная астма и какие триггеры провоцируют приступы?
Бронхиальная астма и ее приступы
В первую очередь, астма – хроническое заболевание, которое приводит к тому, что в легкие не может поступать достаточно воздуха. К числу самых распространенных симптомов астмы относят:
Приступ астмы возникает, когда симптомы становятся серьезными. Они начинаются внезапно, и у некоторых пациентов носят тяжелый характер. Здесь без медицинской помощи не обойтись.
Типы бронхиальной астмы
Несмотря на то, что существует несколько видов астмы, причины и триггеры чаще одинаковые. А вот типы астмы различаются по времени формирования, симптомам и др.
Детская астма
Астма может развиваться в любом возрасте, но чаще формируется у детей. Спровоцировать ее развитие могут следующие факторы:
Если у малыша начинаются приступы астмы, нужно медицинское обследование и лечение. Только после опроса, обследования, врач может назначить соответствующее лечение, которое лучше всего подойдет ребенку. Стоит отметить, что некоторые дети «перерастают» астму, и ее симптомы не возвращаются.
Астма у взрослых
Согласно исследованиям, при формировании астмы у взрослых ее симптомы будут стойкими и тяжелыми. Стать провоцирующими факторами могут:
Причем эти факторы не только провоцируют заболевание, но и являются его триггерами.
Профессиональная астма
Развивается в результате воздействия аллергена или раздражителя, связанного с профессиональным фактором. В группе риска, люди, работающие:
Осложнять течение астмы может ряд факторов, например, курение, поллиноз и др.
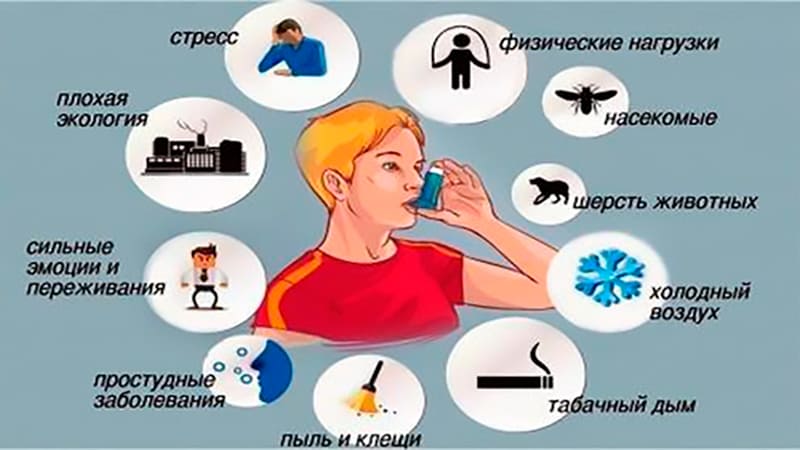
Что вызывает астму и провоцирует приступы
Медицине достоверно неизвестно, что именно вызывает астму. Считается, что это полиэтиологическое заболевание, ведущую роль в котором отводят наследственности. Согласно другим теориям, огромную роль в формировании бронхиальной астмы играет повышенная чувствительность к аллергенам. Причем этот фактор – не только основная причина, но и триггер – пусковой механизм, способный спровоцировать приступ. Что можно отнести к их числу?
Беременность
Согласно ряду исследований, курение во время беременности значительно увеличивает вероятность развития астмы у рожденного ребенка. Если у будущей матери имелись симптомы, то во время беременности может произойти обострение, да и протекает обычно тяжелее.
Ожирение
У людей с лишним весом и ожирением гораздо выше вероятность развития астмы. Как показывают данные, нормализация веса улучшает течение заболевания и снижает тяжесть приступов.
Аллергия
Аллергия – гиперреакция иммунной системы на обычное вещество — аллерген. Как только произошла сенсибилизация, проще говоря, знакомство с аллергеном, реакция возникнет при следующем контакте, даже с минимальными дозами.
Стоит отметить, что далеко не у всех пациентов с диагнозом бронхиальной астмы, есть аллергия. Но согласно данным, около 60-80% детей и подростков, страдающих от астмы, чувствительны, по крайней мере, хотя бы к одному виду аллергенов.
Курение
Курение и астма несовместимы. Ведь любые вредные привычки ухудшают течение астмы, и увеличивается риск развития других болезней легких, например, ХОБЛ – хронической обструктивной болезни легких. Известно, что даже сама астма, без курения – путь к ХОБЛ, но курение его ускоряет.
Факторы окружающей среды
Загрязненный воздух, домашние аллергены – также один из факторов, приводящих к формированию астмы. К числу самых распространенных домашних аллергенов можно отнести:
Стоит помнить, что аллергены постоянно циркулируют в окружающей среде, например, пыльца растений в период их цветения и др.
Хронический стресс
Стресс и сильные эмоции, даже положительные, могут вызывать приступы астмы. Некоторые ученые полагают, что астма более вероятна у людей с психическими расстройствами и депрессией в том числе.
Наследственность и генетическая предрасположенность
Именно генетическая предрасположенность – ключевой фактор, который может сыграть роль в его развитии. Считается, что к заболеванию может привести изменения в генах, к которым приводят факторы окружающей среды.
Гормоны
Если рассмотреть статистику, то среди заболевших, женщин в два раза больше. Симптомы и их выраженность зависит от фазы менструального цикла и даже репродуктивного возраста женщины. Но в пред- и менопаузе симптомы могут исчезать.
Астма – серьезное заболевание, связанное с тяжелыми последствиями для здоровья. И медицинская помощь нужна при появлении первых симптомов. Вылечить астму невозможно, но контролировать ее проявления и избежать приступов вполне.
Список литературы:
Selma B. de Neis, Lizette N. Venekamp, Elizabeth H. Bel. // Asthma in adults: is it really different? // European Respiratory Survey, 2013. 22
Бронхиальная астма
Бронхиальная астма (БА) — хроническое воспалительное заболевание дыхательных путей [1], которое проявляется: полной или частичной обратимой обструкцией дыхательных путей, возникающей вследствие спазма гладкой мускулатуры бронхов, отека и инфильтрации с
Бронхиальная астма (БА) — хроническое воспалительное заболевание дыхательных путей [1], которое проявляется:
БА — наиболее распространенное заболевание детского возраста, частота которого в США составляет 5–12% [2]. Чаще болеют мальчики, чем девочки (6% по сравнению с 3,7%), однако с наступлением пубертатного периода распространенность заболевания становится одинаковой у обоих полов [2]. БА чаще наблюдают у городских жителей, чем у сельских (7,1% и 5,7% соответственно) [3]. Заболевание тяжелее протекает у детей из семей с низким социальным статусом.
Профилактика
Профилактика БА связана с предупреждением развития аллергии у ребенка [4]. Первичная профилактика БА и аллергии направлена на предотвращение возникновения заболевания у лиц из групп риска. В настоящее время не существует эффективных пренатальных мер по первичной профилактике БА [5].
Постнатальная профилактика БА и аллергии предусматривает проведение следующих мероприятий:
Мероприятия по вторичной профилактике БА и аллергии ориентированы на детей, у которых доказано наличие сенсибилизации, возможно наличие астмаподобных симптомов (кашля, свистящих хрипов, затруднения дыхания), но БА еще нет. Это дети из групп риска, у которых удается выявить:
В целях вторичной профилактики БА в группах риска предлагается превентивная терапия цетиризином [10]. В исследовании ETAC показано, что назначение цетиризина в дозе 0,25 мг/кг/сут в течение 18 мес детям из группы высокого риска (с отягощенным аллергоанамнезом и кожными проявлениями аллергии) с бытовой или пыльцевой сенсибилизацией приводит к снижению частоты бронхообструкции с 40 до 20%. В ходе других более ранних исследований [5] была установлена протекторная роль специфической иммунотерапии в группах риска.
Третичная профилактика направлена на уменьшение воздействия провоцирующих факторов с целью улучшения контроля над течением БА у больных детей и уменьшения потребности в лекарственной терапии.
Соблюдение элиминационного режима может способствовать уменьшению тяжести течения уже существующего заболевания. Частый контакт с аллергенами у сенсибилизированных пациентов способствует усилению симптомов БА, развитию бронхиальной гиперреактивности, ухудшению функции легких [11–13].
Из аллергенов, с которыми человек контактирует в быту, следует выделить аллергены клещей домашней пыли, животных (имеющих шерсть или мех), тараканов и грибов. Рекомендуется проведение следующих мероприятий для уменьшения воздействия аллергенов клещей домашней пыли.
Кроме перечисленных мероприятий, для уменьшения контакта с аллергенами домашних животных не следует пускать животное в спальню или основную жилую комнату [23], нужно заменить ковры или ковровые покрытия на линолеум, или деревянные полы, либо паркет. Даже после полного удаления животных из дома может пройти много месяцев, прежде чем концентрация аллергена снизится до приемлемых величин [25].
Причиной аллергической сенсибилизации часто бывают тараканы, особенно в городских домах [26]. Однако мероприятия по борьбе с ними оказывают лишь частичный эффект [27].
Пищевая аллергия является фактором обострения БА редко, главным образом у детей раннего возраста.
Риск аллергической сенсибилизации у детей увеличивает пассивное курение [28, 29]. Оно также повышает частоту и тяжесть симптомов у детей, страдающих БА. Всем пациентам с БА и родителям детей с БА следует воздерживаться от курения.
Важным в плане профилактики БА является ограничение контакта с полютантами внутри и вне помещений. Адекватная вентиляция и вытяжные устройства позволяют снизить концентрацию оксидов азота, угарного и углекислого газа, бытовых аэрозолей. Для ограничения воздействия летучих эфирных соединений не следует проводить ремонт помещений в присутствии больных детей или допускать их в только что отремонтированные квартиры. Необходимо помнить, что иногда в результате погодных и атмосферных условий возникают периоды особо интенсивного загрязнения атмосферного воздуха, когда более предпочтительным является пребывание дома в чистом, хорошо кондиционируемом помещении.
Пищевые факторы, как триггеры БА, могут быть актуальными в группе детей раннего возраста или у больных с пыльцевой сенсибилизацией. В процессе проведения провокационных тестов должны быть выявлены и в дальнейшем исключены из питания больных продукты, вызывающие обострение болезни. У таких больных нельзя использовать ацетилсалициловую кислоту и другие нестероидные противовоспалительные препараты (НПВП), так как они способны запускать особые механизмы аллергии, которые могут привести к тяжелым и угрожающим жизни обострениям БА. Важным является анамнестическое выявление аллергии на пенициллин с последующим исключением этой группы препаратов ввиду угрозы развития анафилактических реакций.
Одной из причин обострений и развития тяжелых форм БА, для которых характерно неконтролируемое течение, могут быть частые вирусные респираторные инфекции, а также сопутствующие риносинуситы. В связи с этим полезной может оказаться ежегодная противогриппозная вакцинация, хотя доказательств этого собрано недостаточно. Данный вопрос нуждается в дальнейшем изучении.
Всем детям старше 5 лет с рецидивирующими свистящими хрипами нужно проводить:
Классификация
Классификация тяжести БА по клиническим признакам построена с учетом количества дневных симптомов в день/неделю, количества ночных симптомов в неделю, кратности применения β2-адреномиметиков короткого действия, значений пиковой скорости выдоха (ПСВ) или объема форсированного выдоха за 1-ю секунду (ОФВ1) и суточных колебаний ПСВ (вариабельности).
– симптомы возникают реже 1 раза в неделю;
– ночные симптомы возникают не чаще 2 раз в месяц;
– ОФВ1 или ПСВ 80% от должных величин;
– вариабельность показателей ПСВ или ОФВ1 30%.
– симптомы возникают ежедневно;
– частые ночные симптомы;
– ограничение физической активности;
– ОФВ1 или ПСВ 60% от должных величин;
– вариабельность показателей ПСВ или ОФВ1 > 30%.
Наличие хотя бы одного признака тяжести состояния позволяет отнести ребенка к данной категории.
Дети с интермиттирующим течением БА, но с тяжелыми обострениями должны получать терапию, как при персистирующей БА средней тяжести.
У детей с любой степенью тяжести, даже с интермиттирующей БА, могут быть тяжелые обострения.
Такой тип классификации, основанный на степени тяжести заболевания, важен в ситуации, когда необходимо решить вопрос о стартовой терапии при оценке состояния пациента.
Диагностика
Анамнез и физикальное обследование. Вероятность БА возрастает, если в анамнезе есть указания:
– кашель, усиливающийся преимущественно в ночное время;
– рецидивирующие свистящие хрипы;
– повторные эпизоды затрудненного дыхания;
– рецидивирующее чувство стеснения в грудной клетке;
– при контакте с: животными; химическими аэрозолями; клещами домашней пыли; пыльцой; табачным дымом;
– при перепадах температуры окружающей среды;
– при приеме лекарственных средств (ЛС) (ацетилсалициловая кислота, β-адреноблокаторы);
– при физической нагрузке;
– при любых острых инфекционных заболеваниях респираторного тракта;
– при сильных эмоциональных нагрузках;
При физикальном обследовании необходимо обратить внимание на следующие признаки, характерные для БА:
Следует учитывать, что в стадии ремиссии патологическая симптоматика может отсутствовать (нормальная физикальная картина не исключает диагноза БА).
У детей в возрасте до 5 лет диагноз БА основывается главным образом на результатах клинического (но не функционального) обследования и анамнеза.
У детей грудного возраста, имевших три и более эпизодов свистящих хрипов, связанных с действием триггеров, следует подозревать БА, проводить обследование и дифференциальную диагностику.
Лабораторные и инструментальные исследования. У детей старше 5 лет необходимо определить ОФВ, форсированную жизненную емкость легких (ФЖЕЛ) и отношение ОФВ1/ФЖЕЛ. Спирометрия позволяет оценить степень обструкции, ее обратимость и вариабельность, а также тяжесть течения заболевания. При оценке показателей ОФВ1 и ФЖЕЛ важно учитывать этнические особенности и возрастные градации. При нормальной функции легких отношение ОФВ1 к ФЖЕЛ составляет более 80%, а у детей, возможно, более 90%. Любые значения ниже приведенных могут предполагать бронхиальную обструкцию. В пользу диагноза БА также свидетельствует подтверждение обратимости бронхиальной обструкции — увеличение ОФВ1 по крайней мере на 12% после ингаляции сальбутамола либо в ответ на пробную терапию глюкокортикоидами [30].
Пикфлоуметрия (определение пиковой скорости выдоха) — важный метод диагностики и последующего контроля за лечением БА. Последние модели пикфлоуметров относительно недороги, портативны, выполнены из пластика и идеально подходят для использования пациентами старше 5 лет в домашних условиях с целью ежедневной оценки течения БА. При анализе показателей ПСВ у детей используют специальные нормограммы, но более информативен ежедневный мониторинг ПСВ в течение 2–3 нед для определения индивидуального наилучшего показателя [31]. ПСВ измеряют утром (обычно наиболее низкий показатель) и вечером перед сном (как правило, наиболее высокий показатель). Заполнение больным дневников самоконтроля с ежедневной регистрацией в них симптомов, результатов ПСВ и лечения играет важную роль в стратегии лечения БА. Мониторинг ПСВ может быть информативен для определения ранних симптомов обострения заболевания. Дневной разброс показателей ПСВ более чем на 20% рассматривается как диагностический признак БА, а величина отклонений прямо пропорциональна тяжести заболевания [32]. Результаты пикфлоуметрии свидетельствуют в пользу диагноза БА, если ПСВ увеличивается по крайней мере на 15% после ингаляции бронхолитика или при пробном назначении глюкокортикоидов [33].
У пациентов c симптомами, характерными для БА, но с нормальными показателями функции легких в постановке диагноза БА может помочь исследование реакции дыхательных путей на физическую нагрузку [34]. В исследовательских целях для выявления бронхиальной гиперреактивности можно использовать тест с метахолином или гистамином. При диагностике БА эти тесты имеют высокую чувствительность, но низкую специфичность [35].
У некоторых детей симптомы БА провоцирует только физическая нагрузка. В этой группе полезно проведение нагрузочного теста (6-минутный протокол нагрузки бегом). Использование этого теста совместно с определением ОФВ1 или ПСВ может быть полезно для постановки точного диагноза БА [36].
Кожные тесты с аллергенами или определение общего или специфических IgE в сыворотке крови мало информативны для диагностики БА. Однако эти исследования помогают выявить аллергический характер заболевания, установить факторы риска и триггеры, на основании чего может быть рекомендован соответствующий контроль факторов окружающей среды [37].
Дифференциальную диагностику БА чаще всего приходится проводить со следующими заболеваниями:
При наличии следующих симптомов следует заподозрить отличное от БА заболевание [38]:
– появление симптомов заболевания в возрасте до 2 лет;
– респираторный дистресс-синдром и/или применение искусственной вентиляции легких (ИВЛ);
– неврологическая дисфункция в неонатальном периоде;
– отсутствие эффекта от применения бронхолитиков;
– свистящие хрипы, связанные с кормлением или рвотой;
– затруднение глотания и/или рецидивирующая рвота;
– плохая прибавка массы тела;
– сохранение потребности в оксигенотерапии в течение более 1 нед после обострения заболевания.
– деформация пальцев рук в виде «барабанных палочек»;
– очаговые изменения в легких;
– крепитация при аускультации;
– очаговые или инфильтративные изменения на рентгенограмме органов грудной клетки;
– необратимая обструкция дыхательных путей;
Основаниями для направления на консультацию к другим специалистам служат:
Лечение
Целями терапии БА являются достижение и поддержание контроля над заболеванием. Контроль БА является комплексным понятием, включающим, согласно рекомендациям GINA (Global Initiative For Asthma, www.ginasthma.com), совокупность следующих показателей:
Достижение контроля БА должно быть целью терапии для всех пациентов вне зависимости от степени тяжести. Поскольку некоторые показатели, определяющие контроль БА неоднозначны и открыты для интерпретации, были разработаны более строгие и четкие характеристики контроля и выделено два его уровня (табл. 1). В исследовании GOAL было показано, что при терапии, направленной на достижение полного контроля, у значительной части пациентов (более 40%) возможно достижение полного контроля, а у большинства — достижение хорошего. Поскольку в исследование GOAL включались дети 12 лет и старше, неизвестно, можно ли экстраполировать полученные данные на младшие возрастные группы.
Показаниями к госпитализации служат:
– затрудненное дыхание в покое, вынужденное положение, речь отдельными словами, отказ от еды у младенцев, возбуждение, сонливость или спутанное сознание, брадикардия или одышка (частота дыхательных движений более 30 в минуту);
– наличие громких свистящих хрипов или их отсутствие;
– ЧСС более 120 в минуту (у детей грудного возраста более 160 в минуту);
– ПСВ менее 60% от должной или наилучшей индивидуальной величины, даже после начальной терапии;
Лекарственная терапия
К средствам базисной терапии относят ЛС с противовоспалительным и/или профилактическим эффектом (глюкокортикоиды, кромоны, антилейкотриеновые, анти-IgE- и антицитокиновые препараты) и длительно действующие бронходилататоры (длительно действующие β2-адреномиметики, препараты теофиллина с медленным высвобождением). Наиболее эффективные средства базисной терапии в настоящее время — это ингаляционные глюкокортикоиды (ИГК).
К средствам, облегчающим течение заболевания, относят ингаляционные короткодействующие β-адреномиметики (наиболее эффективные бронходилататоры), антихолинергические препараты, препараты теофиллина с немедленным высвобождением и пероральные короткодействующие β-адреномиметики.
Выбор терапии основывается на тяжести БА, доступности антиастматических препаратов, особенностях системы здравоохранения, соотношении риск/польза от применения препарата, культуре, личных обстоятельствах пациента и его семьи. При этом следует учитывать, что:
Препараты для лечения БА вводят различными путями: пероральным, парентеральным и ингаляционным. Последний предпочтительнее [39, 40].
При выборе устройства для ингаляции учитывают эффективность доставки ЛС, стоимость/эффективность и удобство применения [41] (табл. 2).
У детей применяют три типа устройств для ингаляции: небулайзеры, дозированные аэрозольные ингаляторы (ДАИ) и дозированные порошковые ингаляторы (ДПИ) [42]. У детей при обострении тяжелой БА предпочтительнее применять небулайзеры. Доставку препаратов с их помощью осуществляют в течение 5 мин [46].
Рассмотрим препараты, контролирующие течение заболевания.
Кромоны. Кромоглициевая кислота менее эффективна, чем ИГК [43–45] в отношении клинических симптомов, функции внешнего дыхания, БА физического усилия, гиперреактивности дыхательных путей. Длительная терапия кромоглициевой кислотой при БА у детей по эффективности не отличается значительно от плацебо [46, 47].
Недокромил, назначенный перед физической нагрузкой, позволяет уменьшить тяжесть и продолжительность вызванной ею бронхоконстрикции [48]. Недокромил так же, как и кромоглициевая кислота, менее эффективен, чем ИГК [49, 50]. Кромоны противопоказаны при обострении БА, когда требуется интенсивная терапия бронхорасширяющими препаратами быстрого действия. Роль кромонов в базисной терапии БА у детей ограничена, особенно у детей дошкольного возраста, в связи с отсутствием доказательств их эффективности. Проведенный в 2000 г. метаанализ не позволил сделать однозначный вывод об эффективности кромоглициевой кислоты как средства базисной терапии БА у детей.
При неэффективности кромонов в течение 4-8 нед следует перейти на ИГК.
ИГК. В настоящее время ИГК являются самыми эффективными препаратами для контроля БА, поэтому их рекомендуют для лечения персистирующей БА любой степени тяжести [5, 51]. У детей школьного возраста поддерживающая терапия ИГК позволяет контролировать симптомы БА, уменьшает частоту обострений и количество госпитализаций, повышает качество жизни, улучшает функцию внешнего дыхания, снижает гиперреактивность бронхов и уменьшает бронхоконстрикцию при физической нагрузке [52–56]. Применение ИГК у детей дошкольного возраста, страдающих БА, приводит к клинически значимому улучшению состояния, включая балльную оценку дневного и ночного кашля, свистящего дыхания и одышки, физической активности, применения препаратов неотложного действия и использования ресурсов системы здравоохранения [57–61]. В настоящее время ИГК являются единственными препаратами базисной терапии у детей младше 3 лет, эффективность которых доказана исследованиями, проведенными в течение длительного периода времени. У детей применяют следующие ИГК: беклометазон, флутиказон, будесонид [62] (табл. 3, 4).
При длительной терапии ИГК (в средней дозе 450 мкг/сут по беклометазону дипропионату (БДП)) никаких побочных эффектов на плотность костной ткани не выявили [63–71]. У больных с легкой БА применение ИГК в дозе 400 мкг/сут по БДП или меньше не влияет на метаболизм костной ткани. Применение более высоких доз (800 мкг/сут по БДП) приводит к обратимому торможению как процесса образования кости, так и ее деградации [72–77].
Применение ИГК в дозе 100–200 мкг/сут по БДП не оказывает никаких статистически или клинически значимых негативных эффектов на рост пациентов [78–81]. Дети, больные БА, получающие лечение ИГК, во взрослом возрасте достигают нормальных итоговых показателей роста [82–84].
Лечение ИГК в дозе менее 400 мкг/сут по БДП обычно не сопровождается значимым угнетением гипоталамо-гипофизарно-надпочечниковой системы у детей [85–87], большей частотой развития катаракты [88–92]. Клинически проявляющаяся молочница редко становится значительной проблемой у детей, получающих ингаляционные или системные глюкокортикоиды. Применение спейсеров уменьшает частоту кандидоза полости рта [93, 94].
Системные глюкокортикоиды. Использование пероральных глюкокортикоидов у детей с БА ограничено обострениями, вызванными вирусными инфекциями [95–97]. Несмотря на то что системные глюкокортикоиды эффективны в отношении БА, необходимо учитывать нежелательные явления при длительной терапии, такие, как угнетение гипоталамо-гипофизарно-надпочечниковой системы, увеличение массы тела, стероидный диабет, катаракта, артериальная гипертензия, задержка роста, иммуносупрессия, остеопороз, психические расстройства [98, 99].
Ингаляционные β2-адреномиметики длительного действия. Препараты этой группы эффективны для поддержания контроля БА, их применяют в комбинации с ИГК [100] и перед интенсивной физической нагрузкой в тех случаях, когда стандартные начальные дозы не позволяют достичь контроля БА. Эффект этих препаратов сохраняется на протяжении 12 ч.
Формотерол в виде ингаляций начинает действовать через 3 мин, максимальный эффект развивается через 30–60 мин после ингаляции [101, 102].
Салметерол в виде ингаляций начинает действовать относительно медленно, значимый эффект отмечают через 10–20 мин после ингаляции однократной дозы 50 мкг [103], а эффект, сопоставимый с таковым сальбутамола, развивается через 30 мин [104]. Из-за медленного начала действия салметерол не следует назначать для купирования острых симптомов БА.
Дети хорошо переносят лечение ингаляционными β2-адреномиметиками длительного действия даже при продолжительном применении, а их побочные эффекты сопоставимы с таковым β2-адреномиметиков короткого действия (в случае их применения по требованию).
Пероральные β2-адреномиметики длительного действия. Препараты этой группы включают лекарственные формы сальбутамола и тербуталина длительного действия. Эти препараты могут помочь в контроле ночных симптомов БА. Их можно использовать в дополнение к ИГК, если последние в стандартных дозах не обеспечивают достаточного контроля ночных симптомов [105, 106]. Возможные побочные эффекты включают стимуляцию сердечно-сосудистой системы, тревогу и тремор.
Комбинированные препараты. Комбинация длительно действующего β2-адреномиметика и ИГК в низкой дозе более эффективна, чем увеличение дозы последнего [107, 108]. Комбинированная терапия салметеролом + флутиказоном через один ингалятор способствует лучшему контролю БА, чем длительно действующий β2-адреномиметик и ИГК в отдельных ингаляторах [109]. На фоне терапии салметеролом + флутиказоном практически у каждого второго пациента можно достичь полного контроля БА. Отмечают значительное улучшение показателей эффективности терапии (ПСВ, ОФВ1, частоты обострений, качества жизни) [110].
Терапия будесонидом + формотеролом в составе одного ингалятора обеспечивает лучший контроль симптомов БА по сравнению с одним будесонидом у пациентов, у которых ранее ИГК не обеспечивали контроля симптомов [111].
Метилксантины. Теофиллин значительно более эффективен, чем плацебо, для контроля симптомов БА и улучшения функции легких даже в дозах ниже обычно рекомендуемого терапевтического диапазона. Применение теофиллинов для лечения БА у детей проблематично из-за возможности тяжелых быстро возникающих (сердечная аритмия, смерть) и отсроченных (нарушение поведения, проблемы в обучении и пр.) побочных эффектов.
Антагонисты лейкотриеновых рецепторов. Антилейкотриеновые препараты (зафирлукаст, монтелукаст) можно использовать для усиления терапии у детей при среднетяжелой и тяжелой БА в тех случаях, когда заболевание недостаточно контролируется применением низких доз ИГК. Несмотря на то что антилейкотриеновые препараты не изучались как средства монотерапии при легкой персистирующей БА у детей, GINA (2002) рекомендует их использование как альтернативный вариант монотерапии при легкой персистирующей БА. При применении антагонистов лейкотриеновых рецепторов в качестве монотерапии у больных с тяжелой и среднетяжелой БА отмечают умеренное улучшение функции легких (у детей 6 лет и старше) и контроля БА (у детей 2 лет и старше) [5]. Зафирлукаст обладает умеренной эффективностью в отношении функции внешнего дыхания у детей 12 лет и старше со среднетяжелой и тяжелой БА.
Антихолинергические препараты. Антихолинергические препараты (ипратропия бромид) при применении отдельно или в комбинации с другими бронходилататорами (в основном β2-адреномиметиками) показаны для терапии бронхоспазма, ассоциированного с БА. Однако препараты этой группы с целью контроля течения БА в педиатрической практике применяют крайне ограниченно.
Безопасность и эффективность ипратропия бромида у детей младше 6 лет не установлены. У детей дошкольного возраста применение ипратропия бромида имеет лишь незначительное влияние на уровень контроля БА, рутинное применение антихолинергических препаратов в дополнение к β2-адреномиметикам не оправдано.
Средства неотложной терапии. Ингаляционные β2-адреномиметики быстрого действия — самые эффективные из существующих бронхолитиков, их считают препаратами выбора для лечения острого бронхоспазма [112, 113].
Антихолинергические препараты имеют ограниченное значение в лечении БА у детей [114].
Комбинация ингаляционного β2-агониста быстрого действия и антихолинергического препарата обеспечивает более выраженный бронхорасширяющий эффект и должна быть назначена до лечения метилксантинами. Применение комбинации сопровождается снижением потребности в госпитализации.
Принципы диагностики обострений приведены в таблице 6.
Ступенчатый подход к лечению БА
Ступень 1, легкая интермиттирующая БА. У пациентов с легкой интермиттирующей БА симптомы болезни появляются только при контакте с аллергеном или триггером. В отсутствие контакта симптомы болезни отсутствуют, а показатели функции легких находятся в пределах нормы. Интермиттирующую форму БА также диагностируют у больных с эпизодами БА физического усилия. Нечастые симптомы и ненарушенная функция легких являются основанием для того, чтобы не рекомендовать при этой форме БА длительную терапию противовоспалительными препаратами (табл. 7). Пациенты нуждаются в лекарственной терапии в периоды обострения болезни.
В качестве средств неотложной помощи используют ингаляционные формы сальбутамола.
Если у пациента необходимость в приеме ЛС появляется чаще 1 раза в неделю на протяжении более 3 мес, его следует расценивать как больного с легкой персистирующей БА. Дети с интермиттирующей БА, но с тяжелыми обострениями должны расцениваться как имеющие персистирующую БА средней степени тяжести.
Ступень 2, легкая персистирующая БА. Препараты выбора у детей любого возраста — ИГК в низких дозах (беклометазон, флутиказон, будесонид). В качестве альтернативных препаратов для контроля БА рассматривают теофиллины замедленного высвобождения и кромоны. В случае сохранения симптомов болезни у пациента, начавшего лечение БА с использования теофиллина медленного высвобождения или кромонов, следует спустя 4 нед назначить ИГК.
Монотерапия другими препаратами (кроме глюкокортикоидов) менее эффективна для контроля воспаления при БА.
Исследование монотерапии b2-адреномиметиками длительного действия у детей выявило некоторую эффективность этих средств, однако результаты исследований противоречивы. Применение антилейкотриеновых препаратов у детей с легкой персистирующей БА не изучалось. У пациентов с более тяжелыми формами заболевания препараты этой группы обладают умеренной эффективностью, поэтому их можно использовать у некоторых пациентов для контроля БА.
У детей старше 12 лет в качестве стартовой терапии может быть выбрана комбинация ИГК и длительно действующего β2-адреномиметика. Как было показано в исследовании GOAL, такой подход способен обеспечить полный контроль БА у большего количества пациентов при меньшей дозе глюкокортикоидов по сравнению с монотерапией ИГК.
Помимо регулярного применения препаратов для контроля БА, пациенту должен быть доступен ингаляционный β2-адреномиметик быстрого действия для купирования симптомов при необходимости, однако частота его применения не должна превышать 3–4 раз в сутки. Применение симптоматических препаратов более 4 раз в сутки указывает на плохой контроль БА по данной схеме терапии, в таких случаях следует считать, что пациент имеет более тяжелую степень БА.
Ступень 3, среднетяжелая персистирующая БА. При среднетяжелой персистирующей БА симптомы возникают ежедневно в течение длительного времени или ночью, чаще 1 раза в неделю. Диагноз персистирующей БА средней тяжести ставят пациенту с исходным значением ПСВ до приема ЛС более 60%, но менее 80% от должного и вариабельностью ПСВ от 20 до 30%. Если течение БА не удается контролировать низкими дозами ИГК (ступень 2), то такую БА следует расценивать как персистирующую средней степени тяжести.
Больные со среднетяжелой персистирующей БА должны ежедневно принимать противовоспалительные препараты с целью установления контроля над течением заболевания. Препаратами выбора у детей старше 5 лет являются ИГК (беклометазон, флутиказон, будесонид) в низких/средних дозах и β2-адреномиметики длительного действия, а у детей младше 5 лет — ИГК в средних дозах. Лучше всего в качестве средств усиливающей терапии изучены ингаляционные β2-адреномиметики длительного действия. Кроме того, можно также применять теофиллин медленного высвобождения и антилейкотриеновые препараты (монтелукаст, зафирлукаст). Эффективность этих препаратов варьирует у отдельных пациентов, поэтому дополнительную терапию следует выбирать индивидуально.
Помимо регулярного применения препаратов для контроля БА, у пациента должен быть ингаляционный β2-адреномиметик быстрого действия, который следует использовать при необходимости для купирования симптомов, но не чаще 3–4 раз в сутки.
Если контроля БА достичь не удается, следует начать лечение, соответствующее ступени 4.
Ступень 4, тяжелая персистирующая БА. Терапией первого ряда при тяжелой персистирующей БА у детей является комбинация ИГК (флутиказон, будесонид) в высоких дозах и ингаляционных длительно действующих β2-адреномиметиков (салметерол, формотерол). С этой целью рекомендованы также препараты комбинированной терапии, так называемые фиксированные комбинации (флутиказон + салметерол, будесонид + формотерол). Дополнительное назначение β2-адреномиметика длительного действия к базисной терапии ИГК при неконтролируемом течении болезни дает больший клинический эффект, чем увеличение дозы ИГК в 2 раза и более. Хотя ингаляционные β2-адреномиметики длительного действия лучше всего изучены и наиболее предпочтительны в качестве дополнительной терапии, однако можно использовать теофиллин медленного высвобождения, антилейкотриеновые препараты.
В некоторых случаях на ступенях 2–4 может потребоваться применение короткого курса системных глюкокортикоидов для быстрого достижения контроля заболевания. По материалам Executive Summary of the NAEPP Expert Panel Report (2002), рекомендуемая доза пероральных глюкокортикоидов для короткого курса составляет 1–2 мг/кг/сут (по преднизолону) и не должна превышать 60 мг/сут. Длительное лечение пероральными глюкокортикоидами следует начинать в минимально возможных дозах, лучше всего в виде однократного приема утром для сведения к минимуму возможных побочных эффектов. При переводе больных с пероральных на ИГК необходимо установить наблюдение в связи с риском развития симптомов надпочечниковой недостаточности. У больных, получающих комбинированную терапию, начать снижение объема лечения следует с уменьшения дозы ИГК примерно на 25% каждые 3 мес. После того как доза глюкокортикоидов будет составлять менее 800 мкг будесонида в сутки (для детей младше 12 лет) или эквивалента, следует отменить дополнительную терапию. На этапе уменьшения интенсивности терапии рекомендуется наблюдать пациента не реже 1 раза в 3 мес.
При тяжелой БА контроль над симптомами достигается далеко не всегда, в таком случае цель лечения заключается в получении наилучших возможных результатов.
В дополнение к базисной терапии используется β2-адреномиметик быстрого действия по потребности для облегчения симптомов, но желательно не чаще 3–4 раз в сутки.
Ступенчатый подход лечения БА подразумевает увеличение уровня терапии при возрастании степени тяжести заболевания. Если пациент уже получает лечение, классификация тяжести БА должна основываться на имеющихся клинических признаках и дозах ежедневно принимаемых ЛС (табл. 9). Например, пациенты с сохраняющимися (несмотря на проведение терапии, соответствующей данной ступени) симптомами легкой персистирующей БА должны рассматриваться как имеющие персистирующую БА средней тяжести. То есть при ступенчатом подходе к терапии переход на более высокую ступень показан в том случае, если контроля не удается достичь или он был утрачен на фоне проводимой терапии, причем необходимо убедиться, что пациент правильно принимает препараты. Целью лечения является достижение контроля над болезнью с применением наименьшего количества препаратов.
Таким образом, комбинация текущего уровня симптомов и текущей ступени лечения дает возможность установить тяжесть БА для пациента и назначить соответствующее лечение. После того как контроль над заболеванием установлен и поддерживается в течение не менее 3 мес, следует попытаться уменьшить объем терапии (ступень вниз) и определить минимальное лечение, необходимое для сохранения контроля. Если контроль поддерживается не менее 3 мес, степень тяжести заболевания должна быть пересмотрена в соответствии с новым лечением.
В ходе лечения необходимо проводить обучение пациента. Обучение пациента подразумевает установление партнерских отношений между ним, его семьей и медицинским работником. Хорошее взаимопонимание очень важно как основа комплаентности [115–118]. Пациентов необходимо обучить:
Персистирующую БА гораздо эффективнее контролировать с помощью длительной противовоспалительной терапии, чем лечением только симптомов обострения заболевания. Существуют два подхода для достижения контроля над БА.
Первый подход более предпочтителен.
Ступень вверх («step up»): если контроль над заболеванием не достигнут. Улучшение состояния должно наступить в течение месяца (обязательно нужно проверить технику ингаляции ребенка, комплаентность, исключить факторы риска).
Ступень вниз («step down»): если контроль над заболеванием сохраняется в течение 3 мес; уменьшение количества ЛС и их дозы (препаратов базисной терапии — примерно на 25%) в соответствии со ступенчатым подходом для достижения минимального объема лечения, необходимого для сохранения контроля. При комбинированной терапии снижение объема терапии должно начинаться с ИГК до достижения дозы, эквивалентной 500 мкг по беклометазону, затем может быть рассмотрена возможность отмены второго препарата комбинации.
Терапию необходимо пересматривать каждые 3–6 мес (если контроль БА достигнут). Дополнительными и крайне важными компонентами ведения пациентов с БА являются постоянный мониторинг симптомов и ПСВ с ведением дневника самоконтроля и разработка индивидуального плана действий.
У детей с повторяющимися эпизодами свистящих хрипов на фоне острой вирусной инфекции, не имеющих признаков атопии и атопических заболеваний в семейном анамнезе, симптомы обычно исчезают в дошкольном возрасте и БА в дальнейшем не развивается, хотя могут сохраняться минимальные изменения функции легких и бронхиальная гиперреактивность. При возникновении свистящих хрипов в раннем возрасте (до 2 лет) вероятность того, что симптомы будут сохраняться и в более позднем возрасте, невелика [119–121]. У детей младшей возрастной группы с частыми эпизодами свистящих хрипов, БА в семейном анамнезе и проявлениями атопии риск развития БА в возрасте 6 лет значительно увеличивается [122]. Мужской пол является фактором риска для возникновения БА в препубертатном периоде, однако существует большая вероятность того, что БА по достижении взрослого возраста исчезнет. Женский пол является фактором риска персистирования БА во взрослом возрасте.
По вопросам литературы обращайтесь в редакцию.
Л. С. Намазова, доктор медицинских наук, профессор
Л. М. Огородова, доктор медицинских наук, профессор
Н. А. Геппе, доктор медицинских наук, профессор
Ю. Г. Левина, кандидат медицинских наук
К. Е. Эфендиева, кандидат медицинских наук
Ф. И. Петровский, кандидат медицинских наук
НЦЗД РАМН, ММА им. И. М. Сеченова, СибГМУ, Москва, Томск