внутрипротоковая карцинома молочной железы in situ что это такое
Внутрипротоковая карцинома молочной железы in situ что это такое
DCIS, называемый также внутрипротоковым раком, — это пролиферация злокачественных эпителиальных клеток в протоковой системе молочной железы.
Характер локализации DCIS близок к таковому инвазивного рака молочной железы (РМЖ). При световой микроскопии нет признаков инвазии в окружающую ткань. Более широкое применение скрининговой маммографии в последние два десятилетия привело к значительному увеличению количества больных с диагнозом DCIS, и сегодня во многих центрах DCIS представляет каждое втором или третье маммографически обнаруженное злокачественное новообразование молочной железы.
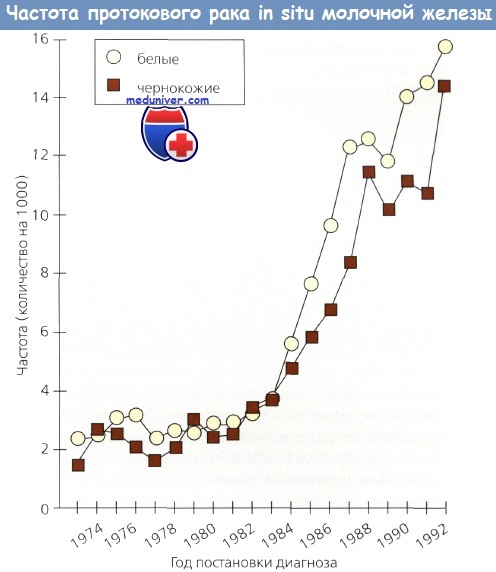
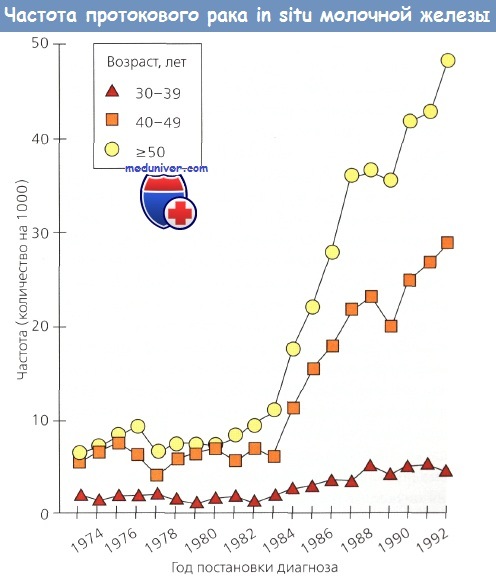
Сегодня около 85 % всех случаев DCIS выявляются на основании только маммографии. Показано, что самый высокий риск этого заболевания у женщин старше 40 лет, которым маммографическое исследование проводится более часто. В 1980 г. только 2 % из 10 000 случаев РМЖ относились к DCIS. Между 1973 и 1992 г. коррелирующая с возрастом частота DCIS возросла почти в 6 раз, тогда как частота инвазивного РМЖ — только на 1/3. Этот рост почти всецело обусловлен проведением скрининговой маммографии.
Необходимо отметить, что данные вскрытий подтверждают, что скрытый DCIS весьма распространен: его обнаруживают у 6—18 % женщин, умерших не от рака молочной железы (РМЖ).
Традиционным способом лечения DCIS была мастэктомия. Однако этот подход подвергся критике, т. к. многим пациенткам с инвазивным раком молочной железы (РМЖ) в настоящее время проводятся органосохраняющие операции, поэтому сложно оправдать применение мастэктомии у всех больных DCIS. К тому же течение DCIS изучено только частично, особенно при небольших, обнаруживаемых при маммографии опухолях.
Микрокальцификаты при DCIS чаще вторичны по отношению обызвествлению некротических масс внутри пораженных протоков. Подозрительные микрокальцификаты обычно отличаются от доброкачественных отложений кальция количеством, распределением и внешним видом. Большие скопления грубых зернистых или линейных кальцификатов чаще свидетельствуют о злокачественном новообразовании.
Вопрос о возможности прогрессирования DCIS в инвазивный рак остается открытым. В связи с тем, что при DCIS ранее применялась мастэктомия, информация о риске прогрессирования в инвазивное заболевание ограничена. В ретроспективном исследовании доброкачественных биоптатов молочной железы у 25 больных затем был выявлен DCIS, у 7 (28 %) за период наблюдения — развитие инвазивного заболевания.
У большинства больных DCIS обнаруживаются непальпируемые, однако маммографически определяемые патологические изменения, поэтому для определения рекомендаций по лечению требуется тщательная маммографическая и гистологическая оценка. Необходимо четко определить распространенность кальцификатов с помощью прицельных маммограмм. Место биопсии должно быть правильно определено и маркировано, а образец ткани — окрашен для гистологической исследования. Особое внимание обращают на степень злокачественности ядер клеток, гистологический подтип рака,распространенность DCIS, а также на расстояние между DCIS и линией резекции.
Органосохраняющая терапия требует удаления всех микрокальцификатов и отсутствия опухолевых клеток в краях резекции; для этого может понадобиться широкое иссечение. Органосохраняющая операция возможна не у каждой больной. Обычно простая мастэктомия рекомендуется женщинам, у которых DCIS значительно распространен и не может быть адекватно резецирован. Подмышечная лимфодиссекция, как правило, не проводится; однако у больных с обширным поражением выполняется ограниченная диссекция.
Проспективное рандомизированное исследование DCIS было проведено NSABP (протокол В-17); пациенток рандомизировали для удаления опухоли или удаления опухоли с последующей ЛТ молочной железы (50 Гр). Было отобрано 818 женщин, операцию у которых выполнили в пределах здоровых тканей. Средняя продолжительность наблюдения составила 90 мес. (диапазон 67—180 мес). Частота неинва-зивной ипсилатеральной опухоли молочной железы снизилась с 13,4 до 8,2 % (р = 0,007), а инвазив-ной — с 13,4 до 3,9 % (р
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Рак in situ (ин ситу) молочной железы: причины, симптомы и лечение
Рак in situ молочной железы является неинвазивной формой онкологического заболевания. Данный вид рака относят к 0 стадии (также его называют «предрак»). Патология не несет опасности для жизни женщины, однако, имеет большой риск перерождения в инвазивный рак даже после выполнения хирургического лечения. Поэтому важным элементом в терапии данного заболевании является снижение риска перерождения патологии. В Юсуповской больнице пациентам оказывают все необходимые медицинские услуги для диагностики и лечения рака in situ. В больнице работают опытные онкологи, которые назначат адекватное лечение и выполняют дальнейшее наблюдение пациенток для предотвращения рецидива заболевания.
Причины
Одной из основных классификаций рака является разделение его на инвазивный и неинвазивный. При инвазивном раке патологические клетки распространяются на различные здоровые ткани, а при неинвазивном (in situ) он остается «на своем месте» и не поражает соседние области.
Наиболее часто данная форма онкологии возникает в протоках молочной железы. Клетки формируются в злокачественное новообразование, но не выходят за пределы протока. Новообразование может нормально существовать рядом со здоровыми тканями, не поражая их и не нарушая их функции. В международной терминологии патология имеет сокращение DCIS.
Другой формой рака in situ является дольковая карцинома молочной железы (LCIS). Для него характерно появление онкологических клеток в дольковой части груди. Они редко выходят за пределы дольки или в другие органы.
Данная патология является достаточно распространенной. За последние несколько десятилетий число женщин с этим диагнозом значительно увеличилось, что связано с ростом количества проведения маммографии. То есть увеличилась диагностируемость заболевания.
Причины появления рака данного вида еще находятся на стадии изучения. Выделяют несколько факторов, которые формируют группы риска развития онкологического заболевания:
Симптомы
Выявить патологию в начале развития достаточно сложно, поскольку она может никак не проявлять себя. Поэтому так важно регулярно посещать гинеколога и выполнять маммографию для ранней диагностики заболевания.
Протоковый рак in situ может иметь следующие симптомы:
Дольковая карцинома in situ может вообще себя никак не проявлять и обнаруживаться случайно (например, при диагностике другого заболевания).
Если на маммографии или МРТ было выявлено подозрительное новообразование, женщине назначают биопсию. Это малоинвазивная процедура, которая выполняется под местным обезболиванием. Это может быть тонкоигольная биопсия (когда аспирация тканей производится с помощью иглы маленького диаметра) или толстоигольная биопсия (используется толстая игла, благодаря чему можно взять больше ткани для исследования). Также назначают исследование для определения рецепторов гормонов клеток (ER и PR).
Лечение
Лечение рака молочной железы in situ будет зависеть от локализации новообразования, его размеров, наличия одной или нескольких пораженных областей, общего состояния здоровья пациентки, наличия опасных онкологических факторов.
В случае дольковой карциномы оперативное вмешательство может не понадобиться. Пациентке необходимо будет только регулярно посещать врача для наблюдения за патологией в динамике. В случае гормон-рецептор-положительной карциномы назначают гормональные препараты, которые связываются с рецепторами раковых клеток и препятствуют их взаимодействию с женскими половыми гормонами. Таким образом можно тормозить развитие раковой опухоли.
При протоковой карциноме обычно рекомендуют хирургическое лечение. Оно может включать резекцию только пораженной области или тотальную мастэктомию. Операция позволяет значительно снизить риск развития инвазивного рака в будущем. Тотальная мастэктомия рекомендуется, если:
При наличии показаний дополнительно может потребоваться радиотерапия.
Прогноз
Несмотря на то, что рак in situ молочной железы не несет угрозы для жизни женщины, его наличие значительно повышает риск развития инвазивного рака. Без лечения в 60% случаев он может перерасти в полноценную раковую опухоль через 5-10 лет после постановки первичного диагноза.
В 25-40% случаев рецидив протокового рака in situ или появление инвазивного рака происходит через 5-10 лет после хирургического лечения без лучевой терапии. Онкология также может возникнуть и спустя десятилетия, поэтому следует внимательно относиться к своему здоровью, вести здоровый образ жизни, регулярно посещать врача для профилактического обследования.
Лечение в Москве
В Юсуповской больнице выполняют все мероприятия для лечения рака in situ молочной железы. В клинике онкологии Юсуповской больнице можно выполнить все необходимые обследования на новейшей аппаратуре, что позволит поставить диагноз наиболее точно. На основании исследования высококвалифицированные врачи назначают терапию, которая будет оптимальной в данном конкретном случае. При составлении лечения обязательно учитываются индивидуальные особенности пациентки, семейный анамнез, история болезни.
Хирургическое лечение проводится на базе широкой партнерской сети Юсуповской больницы с привлечением лучших хирургов Москвы. После операции пациентка проходит лечение в комфортном стационаре Юсуповской больницы.
В дальнейшем здесь можно проходить все профилактические обследования для исключения и своевременной диагностики рецидива патологии.
Лечение протокового рака молочной железы
Протоковый рак молочной железы (протоковая карцинома) – самый распространенный тип онкологического заболевания молочной железы.
Чаще всего диагностируется протоковый рак молочной железы in situ, то есть, неинвазивная форма рака, характеризующаяся ростом опухоли только в просвете молочных протоков, без поражения окружающих тканей.
Это дает возможность говорить о том, что протоковый рак in situ является предраковым состоянием, при котором отмечается усиление клеточной атипии.
Принято выделять три степени протоковой карциномы in situ, классифицируемых по нескольким факторам и, прежде всего, по степени дифференцировки:
Низкая и средняя степень характеризуются низкой скоростью роста злокачественных клеток, высокодифференцированный вариант имеет высокий риск развития инвазивной формы рака.
Инвазивный протоковый рак характеризуется распространением опухолевого процесса за пределы молочного протока и поражением тканей молочной железы. Симптоматика этой формы заболевания более выражена, вплоть до втяжения соска (или кожи вокруг него).
Инвазивная форма протокового рака без лечения может привести к тяжелым последствиям – клетки опухоли метастазируют и с током крови расходятся по всему организму.
Диагностика протокового рака
При стандартном медицинском осмотре протоковый рак чаще всего определить нельзя, поскольку он не дает, как правило, яркой симптоматики. В редких случаях при пальпации можно обнаружить опухолевидное образование.
Основной метод выявления протоковой карциномы – маммография. При проведении обследования видны микрокальцинаты – участки ткани, пропитанные солями кальция (обызвествление в результате распада злокачественных клеток).
Чтобы подтвердить диагноз, проводится биопсия – тонкоигольная или core-биопсия – получение клеток или ткани опухоли для проведения цитологического и гистологического исследования.
Лечение протокового рака молочной железы
Определение курса лечения зависит от различных критериев, в том числе размера опухоли, области поражения, степени дифференцировки, прогноза роста раковых клеток и других факторов, полученных в результате проведенных исследований. Также во внимание принимается семейный анамнез (случаи заболевания в семье) и индивидуальные особенности.
Но в любом случае, к лечению требуется исключительно комплексный подход, основанный на использовании как хирургических методов, так и облучения, химиотерапии, гормональной терапии.
Основные типы операций, проводимых при протоковом раке – лампэктомия (органосохраняющая операция по удалению опухоли и части молочной железы), квандрантектомия (удаление большей части молочной железы), мастэктомия (полное удаление молочной железы). Такой большой объем удаления тканей связан с отсутствием четких границ у опухоли и склонностью распространения раковых клеток по току крови и лимфатической сети.
После мастэктомии проводится восстановление молочной железы (пластика) – либо сразу, либо через год после окончания лечения.
Осуществляется в качестве предоперационной подготовки для локализации ракового очага или (и) после операции для профилактики развития рецидива. Также лучевая терапия проводится в случае невозможности проведения операции.
Химиотерапия проводится в качестве предварительного этапа перед операцией (для прекращения роста образования), а также в качестве основного лечения при имеющихся противопоказаниях к проведению операции.
Затормозить рост опухоли перед оперативным вмешательством (или вместо него) позволяет лечение гормональными препаратами (используется не при всех злокачественных образованиях). Также гормональная терапия используется для снижения риска рецидива после операции.
Протоковая карцинома in Situ: неинвазивный рак молочной железы
Заведующий отделением радио и химиотерапии
Лечение протоковой карциномы in Situ должно быть предельно тщательным: несмотря на кажущуюся «невинность» этой опухоли, нельзя забывать о том, что она склонна рецидивировать, причем уже в инвазивной форме. В клинике Топ Ихилов лечением протокового рака груди занимаются опытные специалисты, которые используют все свои знания и умения для того, чтобы не дать опухоли ни малейшего шанса.
Протоковая карцинома in Situ (протоковый рак, ПКИС) является наиболее распространенной формой неинвазивного рака груди. Многие врачи утверждают, что протоковая карцинома in Situ безопасна для здоровья женщин, поскольку опухоль не распространяется на здоровые ткани груди. Израильские специалисты не согласны с подобным заявлением. Во-первых, карцинома in Situ может перейти в инвазивную форму, во-вторых, неэффективно пролеченный протоковый рак повышает риск развития рецидива заболевания, но уже в агрессивной его форме. Специалисты израильской клиники Топ Ихилов на протяжении многих лет эффективно лечат ПКИС. Комплексное лечение и индивидуальный подход к каждой пациентке являются залогом низкого процента рецидивов рака груди у пациенток МЦ Топ Ихилов.
Лечение протокового рака молочной железы в Израиле

Такой подход к лечению пациенток с протоковым раком груди на сегодняшний день считается самым оптимальным и практикуется в медицински развитых странах, таких как Израиль, Германия, США.
Диагностика протоковой карциномы in Situ
Диагностика протокового рака груди в Израиле осуществляется с помощью высокоинформативных и в то же время безболезненных и атравматичных для пациентки методов. В клинике Топ Ихилов для подтверждения диагноза «протоковая карцинома in Situ» применяется следующая программа диагностики:
Стоимость операции
Точную цену можно назвать только после определения всех необходимых процедур.
Материалы конгрессов и конференций
VII РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
ЛЕЧЕНИЕ ПРОТОКОВОГО РАКА IN SITU МОЛОЧНОЙ ЖЕЛЕЗЫ
В.В. Семиглазов
ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, Санкт-Петербург
Благодаря развитию маммографической техники и внедрению маммографического скрининга значительно возросла частота выявления клинически скрыто протекающих как минимальных форм рака молочной железы (РМЖ), так и карцином in situ (CIS). По данным мировой литературы, в настоящее время CIS составляет 20-40% от всех вновь выявляемых случаев РМЖ.
В 1908 г. Cornil описал схожесть клеток инвазивного рака с клетками, ограниченными эпителием протоков, а Cheatle и Cutler одними из первых предположили, что карцинома in situ является формой рака, представленного изначально пулом злокачественных клеток, ограниченных эпителием, не вовлекающих в процесс базальную мембрану, но потенциально способных к инвазии. Термин CIS молочной железы объединяет два типа заболевания, имеющих различную биологию, отличающихся риском развития инвазивного рака и методами лечения: протоковая карцинома in situ (ductal carcinoma in situ-DCIS) и дольковая карцинома in situ (lobular carcinoma in situ-LCIS). Наиболее часто диагностируют DCIS.
С морфологической точки зрения DCIS сравнительно гетерогенное заболевание. В основе большинства ее классификаций лежит морфологическая структура опухоли, что позволяет выделить два основные типа DCIS – комедо и некомедо DCIS. Такое разделение, с одной стороны, связано с диаметрально противоположной прогностической значимостью этих типов DCIS, а, с другой стороны, определено схожестью некоторых морфологических маркеров некомедо форм DCIS. Последние представлены криброзной, папиллярной, микропапиллярной, солидной и “цепляющейся” формами протокового рака.
Данная классификация, хотя и удобна для клиницистов, так как четко отграничивает прогностически благоприятные (некомедо) и неблагоприятные (комедо) формы DCIS, является чрезвычайно упрощенной, так как не полностью отражает биологические особенности роста внутрипротоковых карцином in situ и не учитывает пограничные формы DCIS.
Для того чтобы преодолеть недостатки традиционной гистологической классификации, в последнее десятилетие предложено множество альтернативных классификаций, в основе которых лежат такие факторы, как упомянутая выше степень злокачественности (основанная на морфологии клеточного ядра, Nuclear grade I, II, III) и наличие комедо-некроза. Используя комбинацию данных факторов, Lagios, Silverstein с соавт. предложили выделить при DCIS три степени гистологической злокачественности: высокую (ВСГЗ), промежуточную (ПСГЗ) и низкую степени (НСГЗ).
Наиболее эффективным методом лечения карциномы in situ по-прежнему остается хирургическое вмешательство. Мастэктомия приводит практически к 100% излечению от заболевания. На данный момент нет убедительных крупных рандомизированных клинических исследований, сравнивающих эффективность мастэктомии и органосохраняющих операций, тем не менее, первая остается “стандартом”, с которым сравнивают остальные методы лечения. Однако в последние два десятилетия большинство больных даже с инвазивной карциномой при определенных показаниях подвергаются органосохраняющему (консервативному) лечению, поэтому рутинное использование мастэктомии у больных с DCIS в настоящее время дискутабельно.
Органосохраняющее лечение. Первоначальным результатом широкого применения сохранных операций (в сочетании с лучевой терапией или без таковой) при DCIS стал значительный рост частоты развития местных рецидивов. Показатель рецидивирования возрос с 1-2% после мастэктомии до 30-50% после органосохраняющего лечения. Полученные данные заставили исследователей искать факторы риска, влияющие на частоту развития рецидивов.
При мультивариантном анализе Fisher с соавт. (1999 г.) определили статистически значимые признаки: гистологическая степень злокачественности, размер опухоли и ширина краев резекции. Silverstein, проанализировав данные по лечению DCIS, отметил значительные отличия в показателях местного рецидивирования в зависимости от степени гистологической злокачественности. Частота рецидивов в течение 84 мес. наблюдения при ВСГЗ, ПСГЗ и НСГЗ составила 41%, 16% и 0% соответственно. По данным Lagios с соавт., увеличение размера опухоли с 15 мм до 40 мм сопровождается удвоением количества рецидивов (25,5% и 57% соответственно), а увеличение ширины краев резекции от 1 мм до 10 мм наоборот приводит к снижению частоты местного рецидивирования практически в 5 раз (от 42% до 8,3%). Silverstein утверждает, что при достаточной ширине резекции (10 мм и более) размер опухоли и степень гистологической злокачественности практически не влияют на частоту развития местного рецидива.
Большинство рецидивов возникает либо в области резекции, либо в непосредственной близости от нее, что говорит о неадекватности хирургического вмешательства (недостаточно широком иссечении опухоли). Однако для достижения адекватной хирургической резекции молочной железы весьма сложно точно определить как истинную распространенность опухоли по протокам, так и необходимую ширину резекции. Еще R. Holland с помощью морфологических исследований показал, что протоковые карциномы in situ почти всегда уницентричные по генезу (т.е. вовлекают в процесс только один проток), но часто мультифокальные (так как множественные фокусы извитого протока попадают в микроскопический срез в одном сегменте молочной железы). Поэтому размеры очагов часто больше, чем ожидают, и они, как правило, распространяются за границы маммографически определяемых микрокальцинатов. В частности R. Holland (1984) отметил, что в 40% случаев микроскопические и рентгенологические размеры DCIS отличаются более чем на 2 см. Неточная ориентировка хирурга на рентгено-маммографические заключения отчасти объясняет высокую частоту местного рецидивирования при сверхэкономных операциях. Остатки внутрипротоковой карциномы in situ являются основным источником рецидивов, а в случае микроинвазии – регионарных метастазов.
Для того чтобы избежать появления рецидива и произвести своевременную “спасительную” повторную резекцию или даже мастэктомию, необходимо сфокусировать внимание на тщательном морфологическом исследовании краев хирургической резекции, так как “чистые” хирургические края – один из основных критериев органосохраняющего лечения DCIS. Кроме того, широкое распространение нашел рентгенологический метод исследования операционного материала, служащий для немедленного решения вопроса о расширении объема операции в случае обнаружения микрокальцинатов в операционном материале по краю резекции (при последующем срочном морфологическом подтверждении наличия остатков опухоли). С этой же целью часто производится постэксцизионная маммография.
Таким образом, такие факторы как степень злокачественности, наличие комедо-некроза, размер опухоли и ширина краев резекции являются важными прогностическими факторами риска развития местного рецидива у больных, подвергшихся органосохраняющему лечению по поводу DCIS. Silverstein и Lagios, используя данные признаки в комплексе, попытались определить группы риска развития местных рецидивов. В результате исследователями предложен Ван Наэский прогностический индекс (Van Nuys Prognostic Index, ВНПИ). В основе ВНПИ лежит 3-балльная градация каждого из вышеперечисленных признаков: 1 – лучший прогноз, 3 – худший. Прогностический индекс равен сумме баллов, полученных при оценке размера опухоли, ширины краев резекции и морфологическом исследовании опухоли. Согласно данной градации, в каждом отдельном случае может быть получено от 3 до 9 баллов. При 3-4 баллах частота местного рецидивирования низкая (I), при 5-7 – умеренная (II), а при 8-9 баллах – высокая (III). Исследование выявило, что показатели безрецидивной выживаемости в каждой из этих групп статистически значимо отличаются друг от друга.
Подмышечная лимфаденэктомия. Подмышечная лимфаденэктомия у больных с DCIS, как правило, не производится, так как количество оккультных инвазивных карцином, сопровождающихся метастазированием в аксиллярные лимфатические узлы, не превышает 1-3%. Больным, которым производится мастэктомия, в последнее время выполняется биопсия сторожевых узлов (sentinel node biopsy). Для идентификации этих узлов используют радиоизотопные щупы, фиксирующие накопление введенных рядом с опухолью радиофармпрепаратов (вместе с красителем blue dye для визуализации их точного расположения).
Лучевая терапия (ЛТ). Результаты исследований по оценке эффективности послеоперационной лучевой терапии больных с DCIS, полученные в настоящее время, весьма противоречивые.
Однако приблизительно для 30-40% больных с протоковой карциномой in situ, которым выполняются органосохраняющие операции, последующая ЛТ, как и мастэктомия, является избыточным лечением. Поэтому в ряде работ делается акцент на тщательном подборе больных, у которых вероятность дополнительного положительного эффекта ЛТ высокая.
Lagios с соавт. в своем исследовании попытался оценить эффективность ЛТ при DCIS с учетом факторов риска развития местных рецидивов. Отмечена высокая эффективность ЛТ при DCIS высокой степени гистологической злокачественности, но не обнаружено никакого преимущества ЛТ при низкой степени гистологической злокачественности. Кроме того, отмечено, что риск развития рецидива при DCIS высокой степени гистологической злокачественности увеличивается пропорционально увеличению объема опухоли, однако проведение ЛТ практически не влияет на показатели безрецидивной выживаемости, за исключением случаев, когда размер опухоли не превышает 15 мм.
В работе Lagios анализ влияния ширины хирургических краев на показатели безрецидивной выживаемости не показал статистически значимых отличий в группах с послеоперационной ЛТ и без нее. Частота местных рецидивов при ширине хирургического края 10 мм или более составила 4,5% без ЛТ и 5% в группе с ЛТ. ЛТ оказала положительный эффект только в группе больных с DCIS высокой степени гистологической злокачественности с шириной края 10 мм и 1-9 мм (частота рецидивов 0% и 29% соответственно против 8,3 % и 40,5% без ЛТ). При ширине края менее 1 мм ЛТ не имела преимущества перед обычной резекцией опухоли. При DCIS низкой и промежуточной степеней гистологической злокачественности ЛТ не оказала положительного эффекта вне зависимости от ширины хирургических краев.
Применение Ван Наэского прогностического индекса послужило основой для разработки алгоритма лечения, в т.ч. лучевой терапии протоковой карциномы in situ. Проанализированы результаты лечения трех групп риска развития местных рецидивов. В группе низкого риска рецидива (3-4 балла) ЛТ не оказала статистически значимого эффекта. В группе умеренного риска рецидива (5-7 баллов) при проведении ЛТ отмечено снижение частоты местных рецидивов на 13%. Наибольшее преимущество ЛТ зарегистрировано в группе высокого риска рецидива (8-9 баллов). Однако в последнем случае частота развития местных рецидивов была крайне высокой вне зависимости от того, проводилась ЛТ или нет.
Исходя из полученных результатов, были даны рекомендации по лечению DCIS. При суммарном индексе в 8-9 баллов, учитывая высокую степень риска развития местных рецидивов (более 60% за 5 лет), рекомендовано выполнять мастэктомию. При индексе в 5-7 баллов необходима широкая резекция с послеоперационной ЛТ, а при индексе в 3-4 балла достаточно секторальной резекции молочной железы.
Таким образом, показания к проведению послеоперационной ЛТ должны быть основаны на тщательном определении факторов риска местного рецидива заболевания.
Адъювантная лекарственная терапия. Адъювантная цитотоксическая терапия у больных с DCIS не проводится. Иначе дело обстоит с гормональным лечением. Рандомизированные клинические испытания, проведенные B. Fisher в проекте NSABP показали, что назначение тамоксифена в дозе 20 мг/сут. в течение 5 лет больным с DCIS, подвергшимся органосохраняющему лечению и ЛТ, снижает частоту инвазивных рецидивов в той же молочной железе. Кроме того, гормонотерапия существенно снижает частоту как инвазивных, так и неинвазивных рецидивов в контралатеральной молочной железе. Тамоксифен улучшает показатели безрецидивной выживаемости вне зависимости от состояния краев резекции и наличия комедо-типа некроза. Однако на показатели общей выживаемости назначение препарата не влияет.
Использовать ли тамоксифен рутинно у всех больных с DCIS или применять его только при рецептороположительных опухолях, пока не ясно. На данный момент нет достаточных данных со статистически значимым эффектом лечения тамоксифеном. В настоящее время исследуется эффективность селективных модуляторов рецепторов эстрогенов при лечении DCIS (ралоксифен).
Лечение больных с рецидивами после органосохраняющего лечения. При инвазивном рецидиве лечение соответствует лечению инвазивного РМЖ аналогичной стадии. Лечение неинвазивного рецидива зависит от первоначального лечения. Если больная подвергалась только локальному иссечению, то методами выбора являются реэксцизия, реэксцизия и ЛТ или мастэктомия. У некоторых больных можно производить повторные попытки локального иссечения опухоли. Если же проводилась лучевая терапия, то при наступлении рецидива, как правило, выполняется мастэктомия.