внутрибрюшная гипертензия что это
Синдром портальной гипертензии
Введение
Кровь, питающая ряд органов брюшной полости, отводится по единому венозному руслу. Эта вена называется (учитывая ее расположение) воротной или портальной веной печени; она имеет множество ответвлений и является наиболее крупной веной в организме человека, достигая в диаметре 8-12 мм. Как и в любом ином магистральном кровеносном сосуде, в воротной вене должно постоянно поддерживаться определенное кровяное давление – здесь оно в норме составляет от 5-7 до 10-12 мм рт. ст. Хроническое превышение этого уровня приводит к общим нарушениям гемо- и гидродинамики брюшной полости, дегенеративным изменениям в тканях и другим тяжелым последствиям, которые в совокупности образуют синдром портальной гипертензии.
По определению, синдром не является самостоятельным заболеванием; это устойчивое, повторяющееся сочетание взаимосвязанных клинических симптомов, которое может формироваться в силу разных причин, но обладает собственными специфическими закономерностями развития и протекания. Это в полной мере касается и синдрома портальной гипертензии.
Причины
Выделяют две основные группы причин развития портальной гипертензии: внепеченочные и внутрипеченочные. На этих же критериях (конкретная локализация блока воротной вены) построены общепринятые ее классификации, обычно включающие под- или предпеченочную форму, внутрипеченочную (с несколькими подтипами), надпеченочную и смешанную.
Согласно доступной медицинской статистике, наиболее распространенной (85-90%) является внутрипеченочная локализация нарушений портально-венозного оттока. В этиологическом плане внутрипеченочная портальная гипертензия чаще всего обусловлена циррозом печени или иным процессом дегенеративного замещения паренхиматозных клеток соединительной тканью.
Предпеченочная форма составляет 10-12% в общем объеме портальной гипертензии и, как правило, развивается вследствие механического давления (например, злокачественной опухолью), врожденных или приобретенных аномалий анатомического строения вены, воспалительного процесса в миокарде, обструктивного тромбоза Бадда-Киари и пр.
Частота надпеченочной (постпеченочной) формы не превышает 3-4%; причинами обычно становятся прорастание опухоли, тромбоз, эндофлебит печеночных вен.
В целом, к перечню этиопатогенетических факторов портальной гипертензии следует добавить все разновидности гепатитов, онкозаболевания, патологию билиарной (желчевыводящей) и сердечнососудистой систем, последствия травм и некоторых хирургических вмешательств, отравления (медикаментами, грибами, соединениями меди и пр.), ожоги. Кроме того, портальная гипертензия нередко развивается на фоне жизнеугрожающих состояний в ходе реанимационных мероприятий.
Симптоматика
Классическая триада симптомов включает варикозное расширение вен пищевода и верхних отделов желудка (в 85% случаев), спленомегалию (селезенка в той или иной степени увеличена практически всегда) и асцит (массивное скопление жидкости в брюшной полости).
Ранние проявления синдрома портальной гипертензии могут быть неспецифическими: признаки диспепсии (абдоминальные боли и тяжесть в животе, тошнота, различные проблемы с дефекацией, метеоризм и т.д.). Кроме того, по мере нарастания выраженности нарушений кровоснабжения печени снижается ее способность к выполнению дезинтоксикационных функций, что отражается и на функционировании мозга, – развивается т.н. печеночная энцефалопатия с присущей ей психоневрологической симптоматикой. При тяжелой печеночной недостаточности наблюдается желтуха. Прямую угрозу жизни несут (и нередко приводят к летальному исходу) внутренние кровотечения из растянутых и истонченных венозных стенок.
Выраженность, стадийность и скорость появления симптомов в значительной мере различаются при разных типах портальной гипертензии. Так, «водянка живота» (асцит) в одних случаях развивается постепенно, в других остро, и т.д.
Диагностика
Диагноз устанавливается путем сопоставления жалоб, анамнестических данных, результатов клинического осмотра и инструментального обследования. В частности, необходимой и обязательной является ФГДС (фиброгастродуоденоскопия), в ходе которой визуализируются вены пищевода и желудка, оценивается их статус и собирается другая клинически значимая информация. Назначают УЗИ в дуплекс-режиме, рентгенографию, по необходимости – дополнительные методы исследования селезенки и гепатобилиарной системы (сканирование печени, спленоманометрия, спленопортография, КТ, МРТ и т.д.).
Лечение
Синдром портальной гипертензии, в целом, весьма проблематичен в терапевтическом плане. Амбулаторное консервативное лечение и курсы поддерживающей терапии могут занимать несколько лет; назначаются «прицельные» гипотензивные средства для снижения давления в воротной, нижней полой и печеночных венах, вазо- и гепатопротекторы. Однако с усугублением ситуации амбулаторное лечение становится все менее эффективным, и пациента приходится госпитализировать, – сроки стационарного лечения варьируют от двух недель до месяца и более.
Масштабы и цели хирургического вмешательства, – если оно целесообразно и необходимо, – определяются особенностями конкретного случая: в различных ситуациях основной задачей может быть восстановление венозной проходимости, коррекция путей отвода крови, удаление из брюшной полости избыточной жидкости при асците, склерозирование расширенных и кровоточащих вен пищевода, и т.д. Однако относительными или абсолютными противопоказаниями к операции могут становиться сопутствующие хронические заболевания, беременность, пожилой возраст, тяжелое общее состояние пациента (обусловленное, например, выраженной печеночной недостаточностью).
Отдаленный прогноз при некоторых формах синдрома портальной гипертензии (внутрипеченочная, надпеченочная) неблагоприятен, особенно при пищеводно-желудочных геморрагиях у больных циррозом печени. В других случаях оперативное вмешательство может значительно улучшить ситуацию. Однако единственным радикальным лечением в настоящее время остается трансплантация печени.
Тактика ведения и лечение больных с интраабдоминальной гипертензией
О патогенезе ИАГ / АКС писалось ранее.
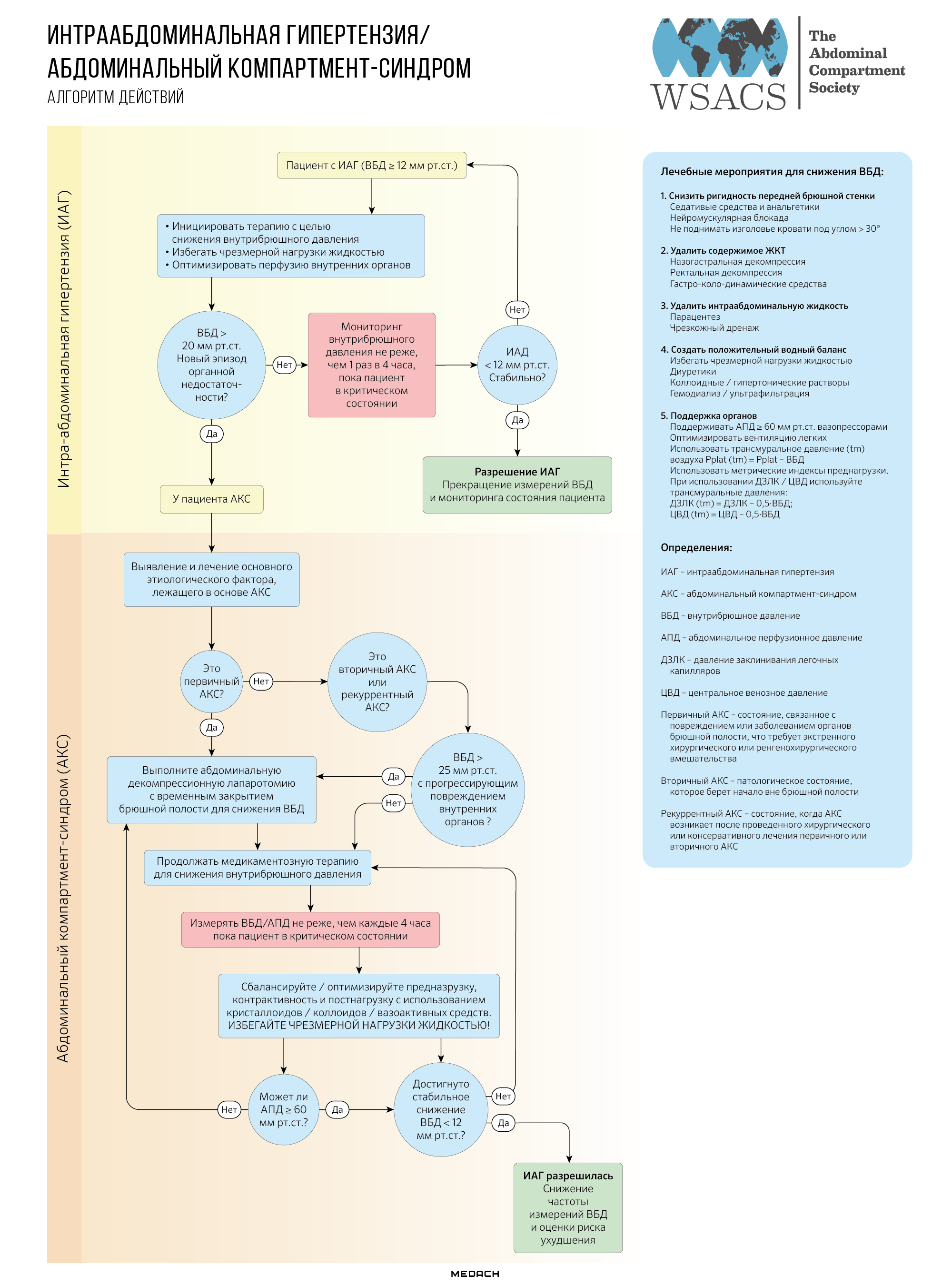
Всемирным обществом абдоминального компартмент-синдрома (WSACS) предложен алгоритм лечения, основанный на этиологии интраабдоминальной гипертензии (ИАГ) и абдоминального компартмент-синдрома (АКС).
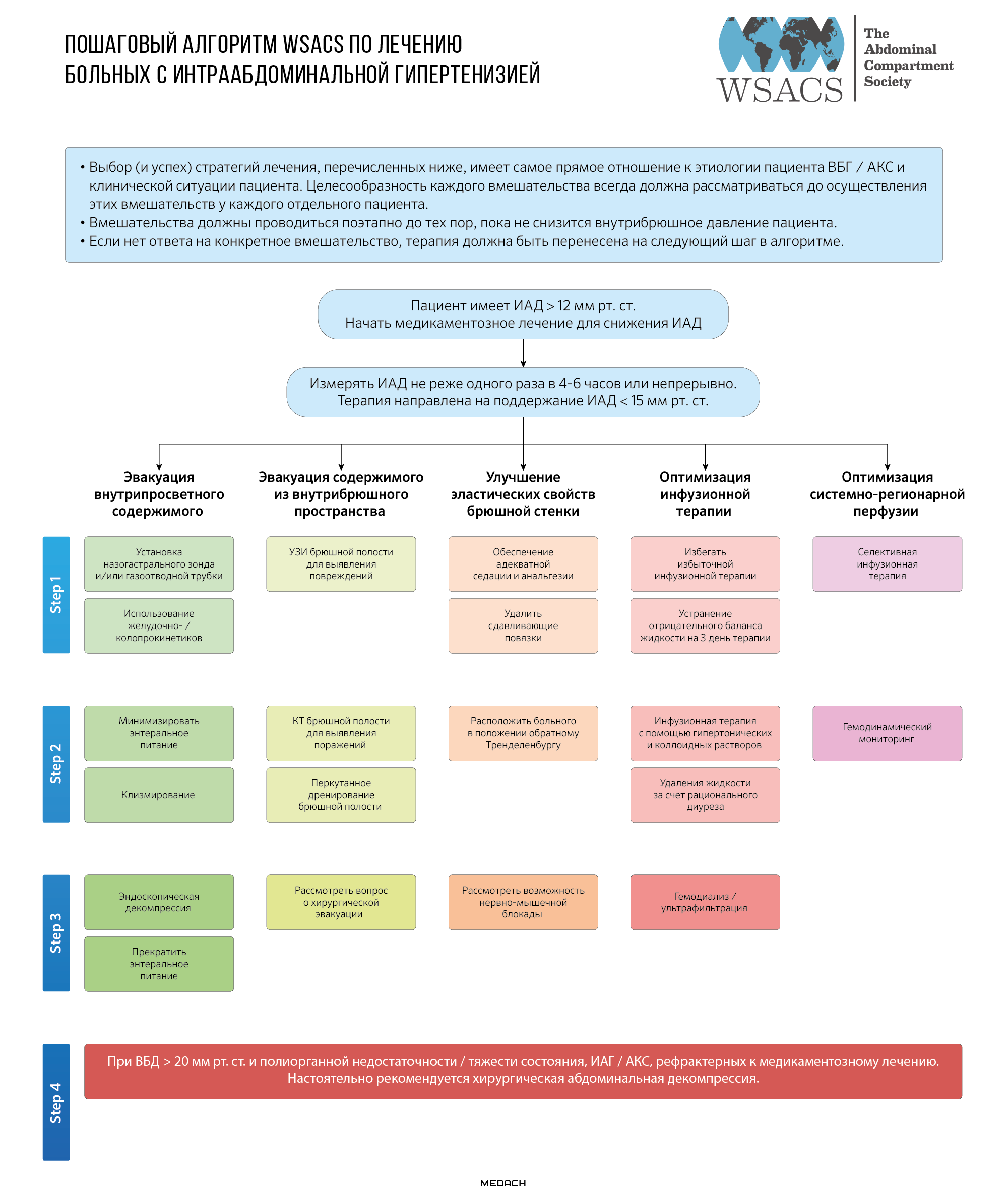
WSACS предлагает следующие варианты лечения:
Также WSACS в 2013 году был создан и утвержден многоуровневый алгоритм, который направлен на улучшение исхода заболевания и снижение затрат на госпитализацию.
Схема №1. Алгоритм WSACS по ведению больных с ИАГ
Схема №2. Пошаговый алгоритм WSACS по лечению больных с ИАГ
Эвакуация кишечного содержимого
Часто у тяжелобольных пациентов, особенно у пациентов с заболеваниями брюшной полости, такими как панкреатит, перитонит, травмы живота, а также у пациентов после операции встречается илеус, что приводит к застою внутрипросветного содержимого. Назогастральное дренирование — первый шаг к снижению интраабдоминального давления (ИАД) у этих пациентов. Введение прокинетиков, таких как метоклопрамид, часто используется для преодоления вздутия живота и подвздошной кишки в частности, что, таким образом, является еще одним вариантом лечения ИАГ. В тех случаях, когда такие фармакологические меры не приводят к уменьшению внутрипросветного объема, может быть рассмотрена эндоскопическая декомпрессия.
Эвакуация внутрибрюшного внепросветного содержимого
Асцит и кровь являются наиболее распространенными компонентами поражений, занимающих внутрибрюшное пространство; абсцессы и свободный воздух также могут способствовать развитию ИАГ. При размещении в свободном внутрибрюшном пространстве эти образования могут быть легкими мишенями для чрескожного дренирования, которое может быть выполнено у постели больного в отделении интенсивной терапии под ультразвуковым контролем.
Улучшение эластических свойств брюшной стенки
Ригидность брюшной стенки является существенным фактором, влияющим на ИАГ. Повышенный тонус мышц живота, чаще всего вызванный болью или возбуждением, может быть снят адекватной анальгезией и седацией, если это необходимо. Следует избегать использования ограничительных повязок. Неоднократно было установлено, что нервно-мышечная блокада эффективна в снижении ИАД у пациентов с ИАГ. Нервно-мышечная блокада может рассматриваться в случаях, когда более простые меры недостаточны или неэффективны.
Оптимизация инфузионной терапии и системной/регионарной перфузии
Инфузионная терапия также может способствовать развитию ИАГ. Особенно актуальным такое осложнение является у пациентов с синдромом капиллярной утечки, при котором жидкость накапливается в стенке кишечника и брыжейке, свободной брюшной полости, забрюшинном пространстве и брюшной стенке. В таком случае борьба с ИАГ предполагает удаление избыточной жидкости из перегруженных объемами пациентов. В зависимости от клинической ситуации можно использовать ультрафильтрацию или диуретики.
Хирургическая декомпрессия
Если попытки уменьшить ИАД с помощью медикаментозного лечения недостаточны, следует рассмотреть возможность декомпрессивной лапаротомии.
Декомпрессивная лапаротомия может быть выполнена в операционной или в кровати в отделении интенсивной терапии. Наиболее распространенным методом является срединная лапаротомия от мечевидного отростка до лобка, однако были разработаны и другие менее инвазивные методы, причем одним из наиболее перспективных подходов является подкожная фасциотомия linea alba. Хирургическая декомпрессия означает, что пациент остается с открытым животом (лапаростомой), что может привести к серьезным потерям жидкости, инфекции, свищам, вентральной грыже и косметическим проблемам. В последние годы методы временного закрытия брюшной полости значительно улучшились, что привело к снижению частоты осложнений и более раннему закрытию фасции. Малоинвазивные методы в настоящее время не являются стандартом лечения первичной или рецидивирующей АКС.
Нужно учитывать, что время проведения вмешательства имеет важное значение: Ментула и соавт. описаны неблагоприятные исходы у больных с тяжелым острым панкреатитом, когда декомпрессия проводилась более чем через 4 дня после поступления в ИАГ.
Вместо заключения
Лечение ИАГ и АКС требует индивидуального, мультидисциплинарного подхода и определенного профессионализма. Последнее связано даже не столько с вынесением определенного решения, сколько с самым сложным в деле врача — умением балансировать между доступными возможностями и необходимыми мероприятиями. Соблюдение этого самого баланса в сочетании с разработанными алгоритмами и принципами позволяет добиться благоприятного исхода для больного.
Интраабдоминальная гипертензия
Интраабдоминальная гипертензия (ИАГ; англ. abdominal compartment) — увеличение давления внутри брюшной полости выше нормы, следствием которой может стать нарушение функций сердца, лёгких, почек, печени, кишечника пациента.
У здорового взрослого человека внутрибрюшное давление составляет от 0 до 5 мм рт.ст. У взрослых пациентов в критическом состоянии внутрибрюшное давление до 7 мм.рт.ст. также считается нормальным. При ожирении, беременности и некоторых других состояниях возможен хронический подъем внутрибрюшного давления до 10–15 мм рт.ст., к которым человек успевает адаптироваться и которые не играют большой роли по сравнению с резким повышением внутрибрюшного давления. При плановой лапаротомии (хирургическом разрезе передней брюшной стенки) может достигать 13 мм рт.ст.
В 2004 году на конференции World Society of the Abdominal Compartment Syndrome (WSACS) было принято следующее определение: интраабдоминальная гипертензия — это устойчивое повышение внутрибрюшного давления до 12 мм рт.ст. и более, которое регистрируется как минимум при трех стандартных измерениях с интервалом в 4–6 часов.
Внутрибрюшное давление отсчитывается от уровня среднеподмышечной линии при положении пациента на спине в конце выдоха при отсутствии мышечного напряжения передней брюшной стенки.
Инттаабдоминальная гипертензия может развиваться вследствие тяжелой закрытой травмы живота, перитонита, панкреонекроза, других заболеваний органов брюшной полости и оперативных вмешательств.
По данным исследования, проведенного в Западной Европы, интраабдоминальная гипертензия выявляется у 32 % пациентов, поступающих в отделений реанимации и интенсивной терапии. У 4,5 % этих пациентов развивается синдром интраабдоминальной гипертензии. При этом развитие интраабдоминальной гипертензии в период нахождения больного в отделениях реанимации и интенсивной терапии является независимым фактором летального исхода, имеющей относительный риск примерно 1,85 %.
Синдром интраабдоминальной гипертензии
Интраабдоминальная гипертензия приводит к нарушениям многих жизненно важных функций органов, находящихся в брюшине и соседствующих с ней (развивается полиорганная неодостаточность). В результате развивается синдром интраабдоминальной гипертензии (СИАГ; англ. abdominal compartment syndrome). Синдром интраабдоминальной гипертензии — симптомокомплекс, развивающийся вследствие повышения давления в брюшной полости и характеризующийся развитием полиорганной недостаточности.
Интраабдоминальная гипертензия не всегда приводит к развитию СИАГ.
Публикации для профессионалов здравоохранения, затрагивающие проблематику СИАГ
Методы измерения внутрибрюшного давления
Измерение давления непосредственно в брюшной полости возможно при лапороскопии, при наличии лапоростомы или при перитониальном диализе. Это наиболее корректный метод измерения внутрибрюшного давления, однако он достаточно сложен и дорог, поэтому на практике используют непрямые методы, при которых производят измерения в полых органах, чья стенка находится в брюшной полости (соседствует с ней): в мочевом пузыре, прямой кишке, бедренной вене, матке и других.
Наибольшее распространение получила методика измерения давления в мочевом пузыре. Метод позволяет осуществлять мониторинг за данным показателем на протяжении длительного срока лечения больного. Для измерения давления в мочевом пузыре используют катетер Фолея, тройник, прозрачную трубку от системы для переливания крови, линейку или специальный гидроманометр. При измерении пациент находится на спине. В асептических условиях в мочевой пузырь вводится катетер Фолея, раздувается его баллончик. В мочевой пузырь, после его полного опорожнения, вводится до 25 мл физиологического раствора. Катетер пережимается дистальнее места измерения, и к нему с помощью тройника подключается прозрачная трубочка от системы. Уровень давления в брюшной полости оценивается по отношению к нулевой отметке – верхнему краю лонного сочленения. Через мочевой пузырь давление в брюшной полости не оценивают при его травме, а также при сдавлении пузыря тазовой гематомой. Измерение пузырного давления не производят, если существует повреждение мочевого пузыря или сдавление его тазовой гематомой. В этих случаях оценивают внутрижелудочное давление. Для этих целей (а также при измерении давления в других полых органах, в том числе, в мочевом пузыре) возможно применение аппаратуры, измеряющих давление по водно-перфузионному принципу, например, прибора «Гастроскан-Д».
Интраабдоминальная гипертензия и абдоминальный компартмент-синдром
Интраабдоминальная гипертензия (ИАГ) (Intra-abdominal Hypertension (IAH)) и абдоминальный компартмент-синдром (АКС) (Abdominal Compartment Syndrome (ACS)) являются тяжелыми осложнениями заболеваний, как у хирургических, так и у нехирургических больных. Однако эти два сопутствующих явления, при своей высокой распространенности, часто остаются непризнанными или не диагностированными. ИАГ воздействует на региональную и общую перфузии, что может привести к полиорганной недостаточности и летальному исходу.
Наиболее ранним проявлением, даже при относительно низком уровне ИАГ, является олигурия и острое повреждение почек (ОПП). Профилактика ИАГ путем раннего выявления и мониторинга пациентов группы риска может полностью исключить развитие АКС. Понимание этиологии и патофизиологии ИАГ и AКС имеет важное значение для выявления патологии и может быть использовано в качестве руководства при его профилактике и осуществлении соответствующей терапии.
Определение
Определение и руководящие принципы ИАГ и АКС установлены Всемирным обществом абдоминального компартмент-синдрома (WSACS).
Интраабдоминальное давление (ИАД) — давление внутри брюшной полости.
В среднем у взрослого человека нормальный уровень ИАД находится в пределах 0–5 мм рт.ст., в то время как у тяжелобольных взрослых он обычно составляет 5–7 мм рт. ст.
Интраабдоминальная гипертензия (ИАГ) — постоянное или рецидивирующее патологическое повышение ИАД больше ≥ 12 мм рт.
Абдоминальный компартмент синдром (АКС) — устойчивая ИАГ (более 20 мм рт.ст.), при абдоминальном перфузионном давлении (АПД) 25 мм рт.
С другой стороны, АКС дополнительно классифицируется в зависимости от причины и продолжительности ИАГ на первичную, вторичную и рецидивирующую.
Эти системы классификационных групп, разработанные WSACS, облегчают последующее управление ИАГ и АКС в рамках организации поэтапного подхода к ведению больных.
Предрасполагающие условия и факторы риска
Наиболее распространенные факторы риска развития ИАГ и/или АКС в соответствии WSACS:
Примечание. Некоторые из этих факторов риска далеки от патофизиологического обоснования и клинического суждения.
Развитие ИАГ у пациентов, которым проводится интенсивная терапия, связано с ухудшением клинического исхода, и это может наблюдаться у пациентов с тяжелым острым панкреатитом, распространенность интраабдоминальной гипертензии у этого типа пациентов составляет около 40–50 %, что обычно является осложнением ранней и агрессивной инфузионной терапии.
Помимо серьезных ожогов и сепсиса, которые являются одними из причин вторичного ИАГ/АКС, травмы и хирургические манипуляции в области живота являются предрасполагающими условиями, влияющими на развитие первичного ИАГ/АКС и, следовательно, послеоперационной почечной недостаточности. В проспективном наблюдательном исследовании, которое включало 263 пациента, ИАГ (определяемая как ИАП, превышающая или равная 18 мм рт.ст.) была независимой причиной нарушения функции почек после абдоминальной операции.
Патофизиология
Чтобы понять основные принципы ИАГ и АКС, мы можем сравнить его в целом с компартмент-синдромом, когда повышение давления ухудшает капиллярный кровоток, в конечном итоге уменьшая приток в артериолы и уменьшая венозный отток. В дальнейшем это вызывает клеточную гипоксию, которая, в свою очередь, предшествует анаэробному дыханию и молочнокислому ацидозу.
Человеческое тело можно рассматривать как сочетания различных анатомических отделов, взаимодействующие друг с другом, по этой причине патофизиология внутриполостной гипертензии и компартмент-синдрома является многофакторной и может наблюдаться почти во всех системах органов.
ИАГ, очевидно, не только вызывает снижение перфузии во всех органах брюшной полости, но и оказывает влияние на внебрюшинные органы, а в некоторых случаях даже оказывает влияние на внутричерепное давление. Проще говоря, когда внутрибрюшное давление повышается, многие органы постепенно начинают отказывать. Было установлено, что ИАГ вызывает ряд патофизиологических изменений, начиная с региональных нарушений кровотока и заканчивая явной недостаточностью систем органов и развитием АКС.
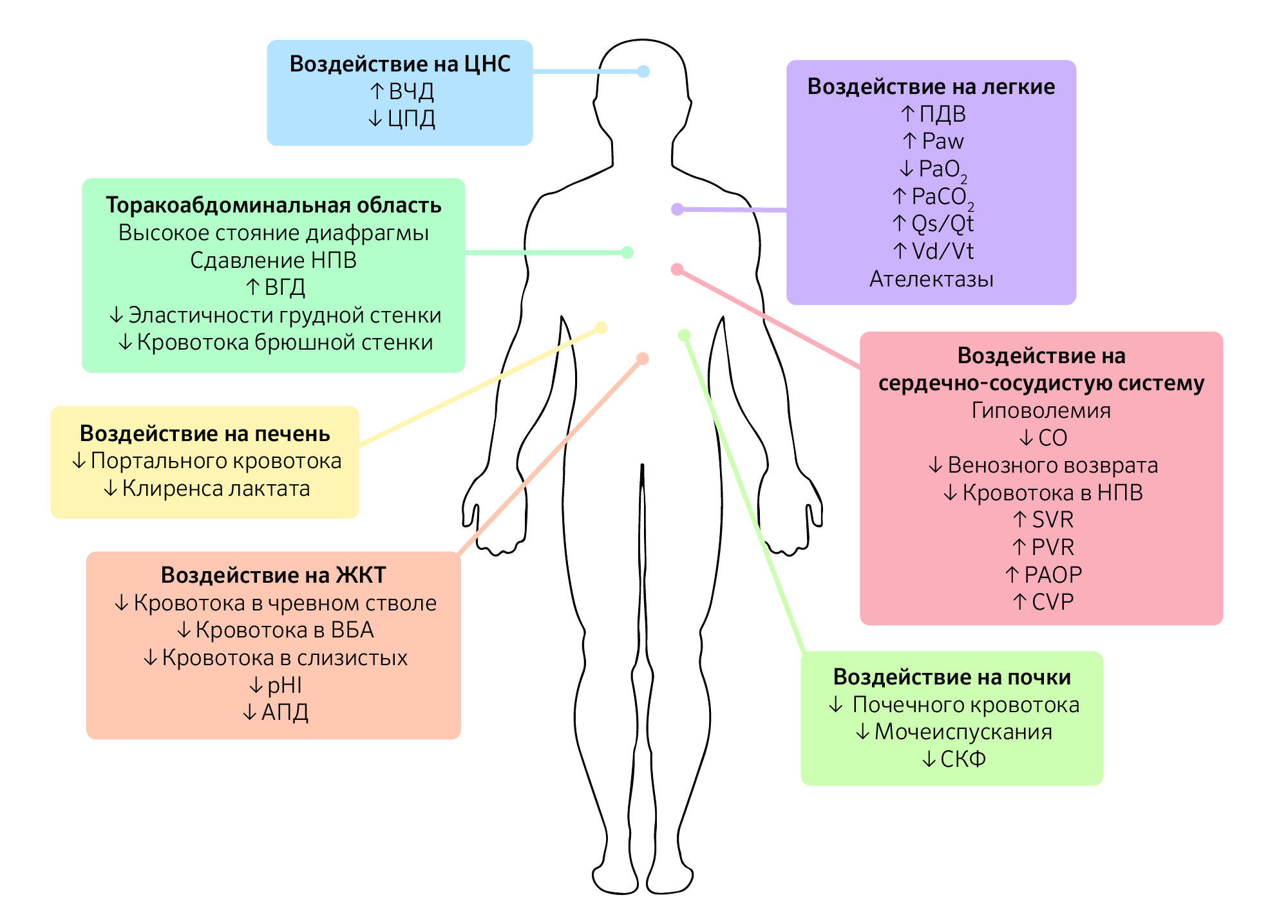
Помимо уровня ИАД и этиологии ИАГ у пациента, схожую по значимости роль играет коморбидность, которую следует принимать во внимание, поскольку это снижает порог ИАД, вызывающий клинические проявления (изображение 1).
Изображение 1 | Патофизиологические последствия интраабдоминальной гипертензии.
Последствия интраабдоминальной гипертензии не ограничиваются только органами брюшной полости, а, скорее, оказывают прямое или косвенное воздействие на каждую систему органов в организме. Схема влияния ИАГ на системы органов.
Сокращения: ВЧД — внутричерепное давление; ЦПД — церебральное перфузионное давление; ВГД — внутригрудное давление; НПВ — нижняя полая вена; ВБА — верхняя брыжеечная артерия; pHI — pH слизистой желудка ; АПД — абдоминальное перфузионное давление; ПДВ — пиковое давление вдоха; Paw, mean airway pressure —среднее давление в дыхательных путях; PaО 2 — парциальное давление кислорода в артериальной крови; PaCO 2 — парциальное давление углекислого газа в артериальной крови; Qs/Qt — внутрилегочный шунт; Vd/Vt — легочное мертвое пространство; CO, cardiac output — сердечный выброс; SVR — системное сосудистое сопротивление; PVR — легочное сосудистое сопротивление; PAOP — окклюзионное давление в легочной артерии; CVP — центральное венозное давление; СКФ — скорость клубочковой фильтрации.
Воздействие ИАГ и АКС на различные системы органов
Сердечно-сосудистая система
Повышение ИАГ увеличивает внутригрудное давление путем брюшно-грудной передачи через краниальное смещение диафрагмы. Это явление создает прямое сжатие внутригрудных органов. Прямая компрессия сердца вызывает снижение сократительной способности, наполнения сердца и эластичности правого желудочка. ИАГ также приводит к нарушению венозного возврата, поскольку давление нижней полой вены увеличивается параллельно увеличению ИАГ, это отмечается даже при ИАД 10 мм рт. ст. Кроме того, отклонение диафрагмы вызывает анатомическое сужение полой вены, что приводит к дальнейшему снижению венозного возврата к сердцу и, в конечном счете, сердечного выброса. С другой стороны, сдавление легочной паренхимы приводит к сдавлению сосудистой сети, тем самым увеличивая легочное, аортальное и системное сосудистое сопротивление. Потому, несмотря на снижение венозного возврата и сердечного выброса, среднее артериальное давление остается стабильным, что делает его неточным гемодинамическим маркером.
Измерение давления на основе внутрисердечного или внутрисосудистого объема также имеет тенденцию быть недостоверным. Это объясняется тем, что, как окклюзионное давление легочной артерии (pulmonary artery occlusion pressure, PAOP), так и центральное венозное давление (central venous pressure, CVP) измеряются пропорционально барометрическому давлению, когда на самом деле эти показатели — сумма внутрисосудистого и внутригрудного давления.
Параметрами, которые более точно отражают состояние внутрисосудистого объема, являются следующие: конечный диастолический объем правого желудочка (right ventricular end-diastolic volume, RVEDV), общий конечный диастолический объем (global end-diastolic volume, GEDV) и ударный объем, поскольку они остаются незатронутыми изменениями внутригрудного давления.
Дыхательная система
Аналогичным образом повышенное ИАД передается в грудную клетку главным образом через отклонение диафрагмы, вызывающее сдавление легочной паренхимы. Паренхиматозное сжатие при ИАД 16 мм рт. ст. снижает эластичность легочной ткани на 50 %. Паренхиматозное давление также вызывает снижение емкости вдоха и функциональной остаточной емкости, в то время как пиковое инспираторное, экспираторное и среднее давление в дыхательных путях увеличиваются. В результате возникает альвеолярный ателектаз, увеличивается альвеолярное мертвое пространство, снижается легочный капиллярный кровоток, что приводит к снижению транспорта кислорода и снижению экскреции углекислого газа, а также увеличению фракции внутрилегочного шунта (Qsp/Qt) и рассогласованию вентиляции и перфузии (VQ) и, в конечном счете, к гипоксемии и гиперкапнии.
Функция почек
Несколько механизмов были предложены в качестве этиологии для ИАГ-индуцированной почечной дисфункции и недостаточности. Компрессия почечных артерий и вен в сочетании с компрессией почечных канальцев — вероятный механизм, лежащий в основе ИАГ/АКС-индуцированной почечной дисфункции и недостаточности, сопровождающейся снижением сердечного выброса. Различные авторы предположили, что прямое сдавление паренхимы провоцирует развитие «синдрома почечного компартмента», при котором почечный артериальный кровоток уменьшается, а почечное венозное давление и почечное сосудистое сопротивление повышается. Это приводит к тому, что кровь шунтируется от коры почек и клубочков, что приводит к нарушению функции клубочков и канальцев, вызывая ишемию почек и последующую почечную недостаточность.
При ИАД более 15 мм рт.ст. отмечается олигурия, в то время как анурия проявляется при ИАД более 30 мм рт. ст. Клинически наблюдаются изменения в функции почек, такие как снижение СКФ, повышение содержания азота мочевины в крови (BUN) и креатинина в сыворотке крови, увеличение фракционной экскреции натрия, снижение концентрации натрия и хлорида в моче и увеличение концентрации калия в моче. Однако все эти изменения, по-видимому, могут быть устранены, если ИАГ диагностируется и успешно управляется до того, как произойдет существенная дисфункция органа.
Желудочно-кишечная система
Высокое давление в брюшной полости вызывает мальперфузию кишечника из-за нарушения артериального и венозного кровотока. Было показано, что повышение ИАД на 10 мм рт. ст. снижает брыжеечный кровоток. Снижение перфузии кишечника вызывает ишемию кишечника и даже отек кишечника и кишечную непроходимость. Перфузия слизистой оболочки кишечника также нарушается, вызывая снижение рН и молочнокислый ацидоз, который в конечном итоге повреждает слизистый барьер кишечника. Потеря слизистого барьера приводит к внутрипросветной бактериальной транслокации, приводящей к сепсису или септическому шоку и последующему ухудшению исхода.
Гепатобилиарная система
Повышенный ИАД существенно влияет на функцию печени. Прямое сжатие печени нарушает печеночный венозный и портальный кровоток. Кроме того, сужение печеночных вен на уровне диафрагмы ослабляет печеночный венозный кровоток, в то время как печеночный артериальный поток нарушается из-за снижения сердечного выброса.
На клеточном уровне микроциркуляторный кровоток также снижается, нарушая метаболизм глюкозы, вызывая увеличение производства лактата и одновременно нарушая механизм его утилизации.
Центральная нервная система
Устойчивое и длительное повышение внутрибрюшного и внутригрудного давлений вызывает повышение внутричерепного давления (ВЧД) и снижение церебрального перфузионного давления (ЦПД). Bloomfield и соавторами в ходе двух различных исследований было установлено, что при повышении внутригрудного давления снижается мозговой венозный поток, что, в свою очередь, вызывает внутримозговой отек.
Диагноз
Раннее выявление пациентов группы риска является первым шагом в диагностике ИАГ и АКС. WSACS рекомендует проводить скрининг на ИАГ/АКС при наличии двух или более факторов риска. Рекомендация состоит в том, чтобы оценить ИАД на исходном уровне, и, если оно повышено, то ИАД необходимо продолжать контролировать каждые 4-6 часов.
Клиническое обследование, такое как пальпация и измерение окружности живота, оказалось крайне неточным и ненадежным в диагностике ИАГ и/или АКС. Радиографический ввод, такой как обычная рентгенография грудной клетки и/или живота, УЗИ брюшной полости, компьютерная томография и МРТ брюшной полости, также оказался ограниченным, поскольку результаты не являются ни чувствительными, ни специфичными для ИАГ и АКС. Тем не менее они могут продемонстрировать наличие возможной причины ИАГ, а также могут выявить воздействие ИАД (высокий уровень стояния диафрагмы, уплощение нижней полой вены, сжатие почечных вен и повышенное усиление стенки кишечника).
Когда комбинация рентгенологических данных сочетается с клинической картиной, тогда рентгенолог и врач-клиницист должны поднять вопрос о возможной ИАГ и/или АКС в качестве дифференциального диагноза.
Лучшим методом установления или исключения факта ИАГ является измерение внутрибрюшного давления. Существуют прямые и косвенные способы определения ИАД. Прямое измерение внутрибрюшного давления может быть выполнено с помощью внутрибрюшинного катетера с датчиком давления. Методы косвенного измерения включают определение любого из следующих давлений:
В связи с положением мочевого пузыря в брюшной полости, внутрипузырный метод считается простым, точным и минимально инвазивным; следовательно, это надежный и воспроизводимый способ измерения ИАД.
Техника внутрипузырного метода измерения ИАД
При выполнении измерения, необходимо соблюдать несколько рекомендаций:
Необходимое оборудование
Изображение 2 | Система мониторинга ИАД ABVISER IPA
Шаги для измерения внутрипузырного давления:
Выводы
Установлено, что измерение ИАП имеет существенное прогностическое значение для тяжелобольных пациентов, так как ИАГ и АКС часто ассоциируются с неблагоприятными исходами. По этой причине ранняя и постоянная оценка, включая серийные измерения ИАД, должна контролироваться у любого пациента, у которого есть подозрение на ИАП/АКС.
Раннее распознавание имеет важное значение в управлении и благоприятном для пациента исходе. Необходимо понять патофизиологию ИАГ и АКС, исходить из более высокой настороженности и проверить наличие ИАГ у всех пациентов, имеющих факторы риска. В идеале хотелось бы иметь возможность диагностировать развивающийся ИАГ и АКС и вмешиваться до начала дисфункции и отказа органов и систем.
Предпочтительно, чтобы раннее терапевтическое вмешательство, будь то медицинские или хирургические попытки уменьшить ИАГ, рассматривалось как можно раньше. Руководящие принципы и рекомендации WSACS дают врачам полезное понимание ИАГ и АКС и их клинического управления для улучшения выживаемости пациентов.