внеклеточные организмы что такое
Что такое внеклеточный матрикс и почему его все изучают
Внеклеточный матрикс — неотъемлемая часть любой ткани.
Автор
Редакторы
Внеклеточный матрикс (ВКМ) — многокомпонентная субстанция, в которую погружены все клетки нашего организма. В последнее десятилетие интерес к внеклеточному матриксу значительно возрос. Это связано с установлением его роли в старении, клеточной дифференцировке, успешной терапии рака и лечении некоторых наследственных заболеваний. Мы подготовили цикл статей, в котором расскажем об организации внеклеточного матрикса, болезнях, связанных с его патологиями, роли ВКМ в старении и подходах к корректировке возрастных изменений.
В первой статье цикла мы рассказываем о компонентах и функциях внеклеточного матрикса, разбираемся, какую практическую пользу может принести его изучение, а также вкратце освещаем самые важные открытия в этой области, совершенные за последний год.
Редакция благодарит Татьяну Голубеву за экспертные консультации и комментарии при подготовке статьи.
Что такое внеклеточный матрикс?
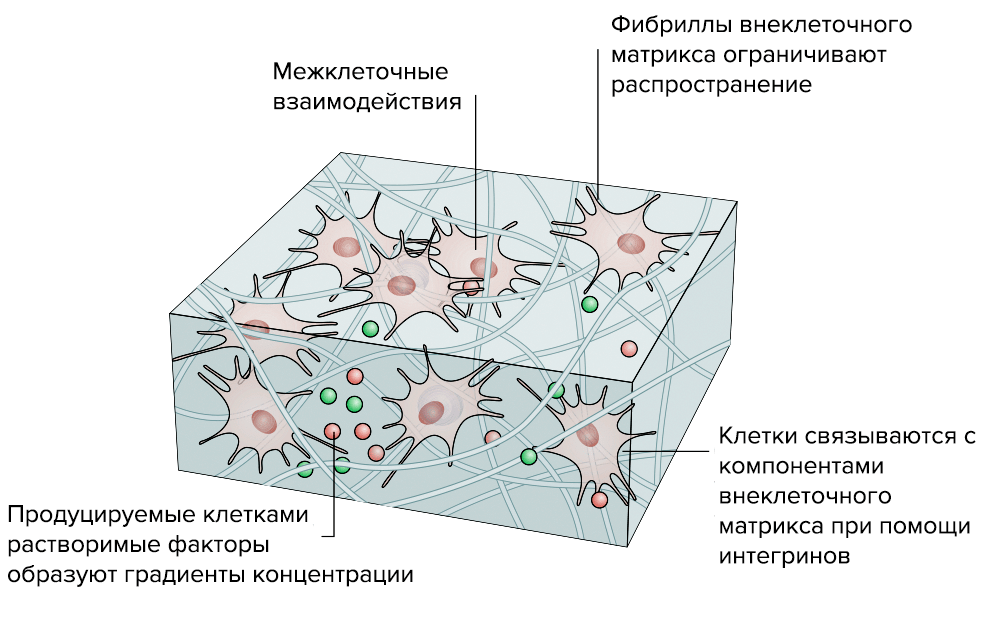
Внеклеточный матрикс (ВКМ, extracellular matrix, ECM) объединяет разрозненные клетки в единый многоклеточный организм. ВКМ похож на государство, в котором живут граждане-клетки: он отвечает за благополучие клеток и управляет всеми аспектами их жизни — от питания и размножения до смерти. Для клеток ВКМ — это и квартира, и магазин, и интернет, и общественный транспорт.
ВКМ: основные игроки
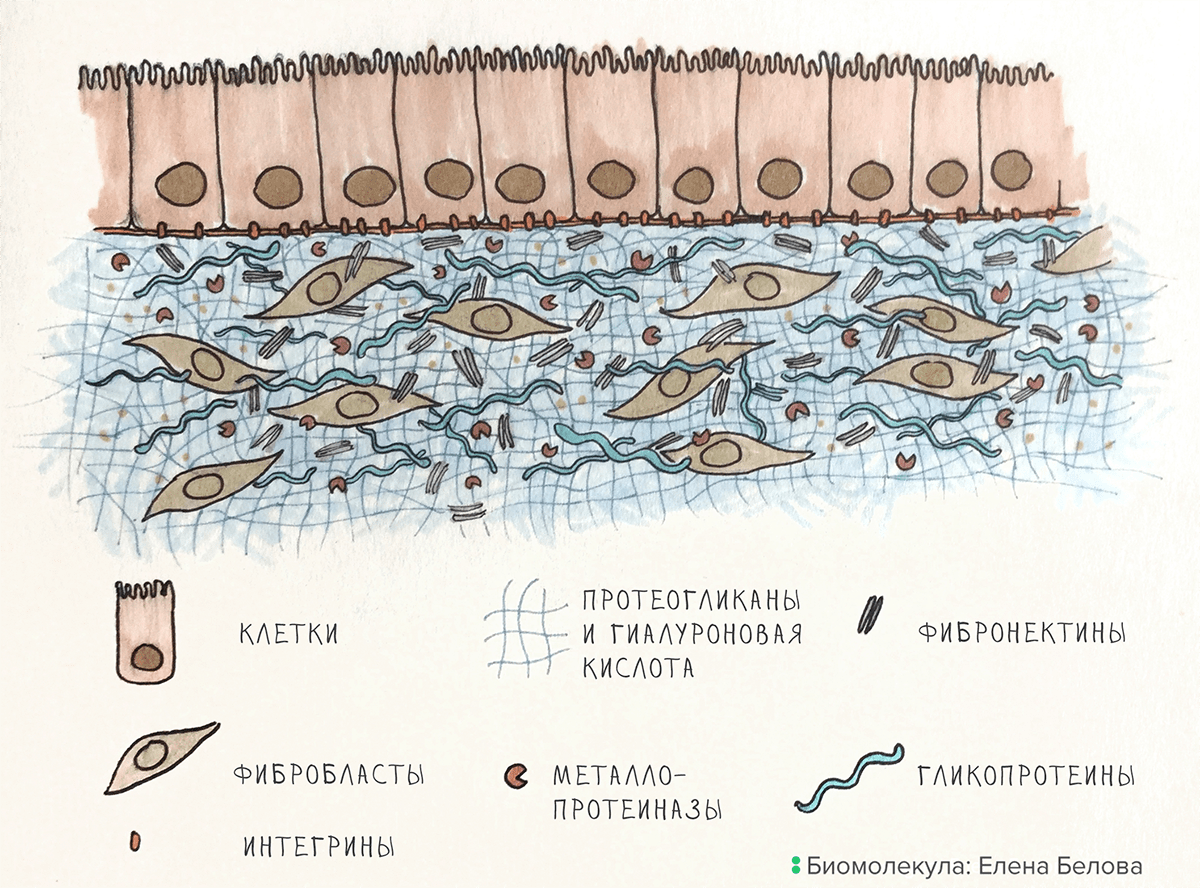
Создатели ВКМ. Компоненты ВКМ синтезируют специализированные клетки. В соединительной ткани наиболее распространены фибробласты, однако создавать ВКМ умеют и другие клетки: в хрящах, например, это хондроциты, а в костях — остеобласты. Компоненты матрикса могут синтезировать и клетки прилегающих органов: например, клетки эпителия сосудов производят компоненты рыхлой соединительной ткани.
Разрушители ВКМ. Порядок в ВКМ наводят белки — разрушители его компонентов. Наиболее важные из них, металлопротеиназы, «расчищают путь» клеткам, которые движутся в ВКМ, и уничтожают старые и «сломанные» компоненты матрикса.
Основное вещество ВКМ. Основу матрикса формируют гиалуроновая кислота и особые белки: гликопротеины и протеогликаны (рис. 1). В состав ВКМ входит и множество других белков со специфической функциональной нагрузкой — интегрины, фибронектины, эластин, — о них мы поговорим в следующем разделе.
Тем, кто хочет узнать больше о построении и разрушении ВКМ, советуем почитать замечательный обзор на эту тему — «Кто рубит коллагеновый лес» [1].
Рисунок 1. Организация ВКМ на примере кожи. Фибробласты создают ВКМ, металлопротеиназы его разрушают. Клетки эпидермиса связаны с ВКМ при помощи интегринов.
Компоненты ВКМ
Выделяют два подкласса белков, содержащих углеводы, — протеогликаны и гликопротеины. Оба подкласса входят в состав ВКМ, однако между ними есть существенные различия.
В гликопротеинах доля углеводов не превышает 20%, углеводные цепи короткие, имеют нерегулярное строение и не содержат уроновых кислот.
К гликопротеинам относятся такие важные структурные белки, как коллаген и эластин. За счет самого распространенного структурного белка в организме — коллагена — ВКМ приобретает прочность, а за счет эластина — гибкость и эластичность.
Протеогликаны — сложные белки с высокой степенью гликозилирования, часто имеющие в своем составе уроновые кислоты. В отличие от гликопротеинов, около 90–95% массы такой молекулы составляют длинные углеводные цепи регулярного строения, а на белки приходится лишь 5–10%. Такое строение обуславливает высокую молекулярную массу протеогликанов. Например, у аггрекана, белка хрящевой ткани, она может достигать 5 МДа [2]! Протеогликаны запасают воду и полезные вещества, то есть работают как «магазин», из которого клетки получают необходимые «продукты». Например, они могут фиксировать ионы кальция в очагах оссификации. Кроме того, они играют роль межтканевых прослоек и смазочного материала в суставах.
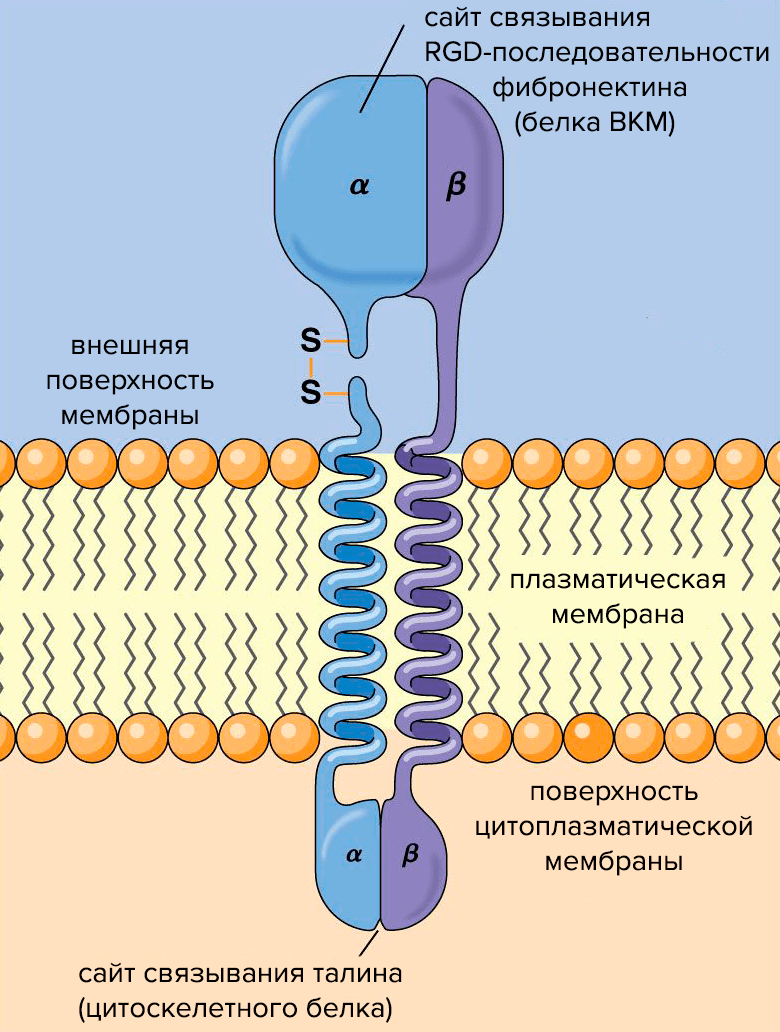
Рисунок 2. Схема строения молекулы интегрина. Субъединицы интегрина (α и β) пронизывают плазматическую мембрану, связывая клетку с внешней средой.
Интегрины — трансмембранные клеточные рецепторы, которые взаимодействуют с ВКМ и участвуют в межклеточной коммуникации. В результате этих взаимодействий в клетках активируются сигнальные каскады, регулирующие экспрессию генов, отвечающие за пролиферацию и дифференцировку клеток, их выживание или апоптоз. То есть система интегрины—ВКМ — нечто среднее между «интернетом» и «рабочим чатом».
Структурно интегрины представляют собой облигатные гетеродимеры: каждый состоит из одной α- и одной β-субъединицы (рис. 2). Альфа-субъединицы определяют специфичность интегрина к лиганду — молекуле, способной образовывать комплекс с интегрином и таким образом воздействовать на клетку. Бета-субъединицы связаны с компонентами цитоскелета и обеспечивают передачу сигнала в клетке. О работе интегринов подробно рассказано в статье «Клетки под давлением» [3].
Интегрины улавливают химические и физические сигналы из внеклеточного матрикса и проводят их в клетку. Сигнал от интегринов передается в ядро через белки цитоскелета и сигнальные белки — так ВКМ управляет экспрессией генов и регулирует клеточную пролиферацию. При посредничестве белков цитоскелета ВКМ также управляет формой и движениями клеток.
Фибронектины — это белки клеточной адгезии. Растворимые предшественники фибронектинов синтезируюся внутри клеток и затем попадают в ВКМ. Интегрины превращают фибронектины в нерастворимые нити — компоненты внеклеточного матрикса [4]. Они помогают клеткам закрепляться на поверхностях и отвечают за их рост и перемещение в ВКМ [5].
Гиалуроновая кислота (ГК) синтезируется встроенными в мембрану белками и затем «выдавливается» через нее в межклеточное пространство. По составу ГК похожа на углеводную часть протеогликана и представляет собой полимер из остатков D-глюкуроновой кислоты и D-N-ацетилглюкозамина. ГК помогает интегринам проводить сигналы в клетку, регулирует клеточный ответ на эти сигналы и, подобно фибронектину, дает клеткам возможность закрепляться на различных поверхностях [6]. Образно говоря, ГК выполняет задачи «интернет-провайдера» и «билета на общественный транспорт».
Почему так важно изучать внеклеточный матрикс?
Внеклеточный матрикс присутствует во всех тканях организма, поэтому сбои в его функционировании ведут к развитию болезней соединительной ткани, преждевременному старению и гибели клеток. Самый очевидный стимул для изучения ВКМ — необходимость лечения заболеваний, связанных с нарушениями структуры соединительной ткани. Таких болезней много, они могут протекать тяжело и значительно ухудшать качество жизни пациентов. Вот несколько примеров.
Мутации в генах, отвечающих за синтез структурных белков ВКМ, приводят к врожденным патологиям [7]. Поскольку соединительная ткань — основа всех систем организма, пострадать от генетических нарушений может любой орган. Такие нарушения приводят:
Преждевременное разрушение ВКМ — еще одна серьезная проблема. Здоровый внеклеточный матрикс постоянно обновляется и реструктурируется. За это отвечает семейство металлопротеиназ, белков — разрушителей ВКМ.
Металлопротеиназы — ферменты, в каталитический центр которых входят ионы металлов, в основном цинка. Отсюда и название с приставкой «металло-». Помимо каталитического центра, который отвечает за разрушение ВКМ, у металлопротеиназ есть регуляторный продомен, оберегающий фермент от преждевременной активации и ложного срабатывания.
Как именно металлопротеиназы разрушают коллаген и «отцепляют» клетки от волокон внеклеточного матрикса, рассказано в статье «Кто рубит коллагеновый лес» [1]. Сейчас же нам важно понять, что если металлопротеиназы «выходят из-под контроля», то они начинают буквально сметать всё на своем пути. Бесконтрольное разрушение ВКМ приводит к фиброзу и может вызвать рак [8] — например, рак предстательной железы [9].
Еще одна патология, вызываемая нарушениями в процессах разрушения и формирования ВКМ, — болезнь Крона (хроническое воспаление кишечника) [10]. По мере ее развития возникает фистулизация и фибростеноз кишечника (рис. 3).
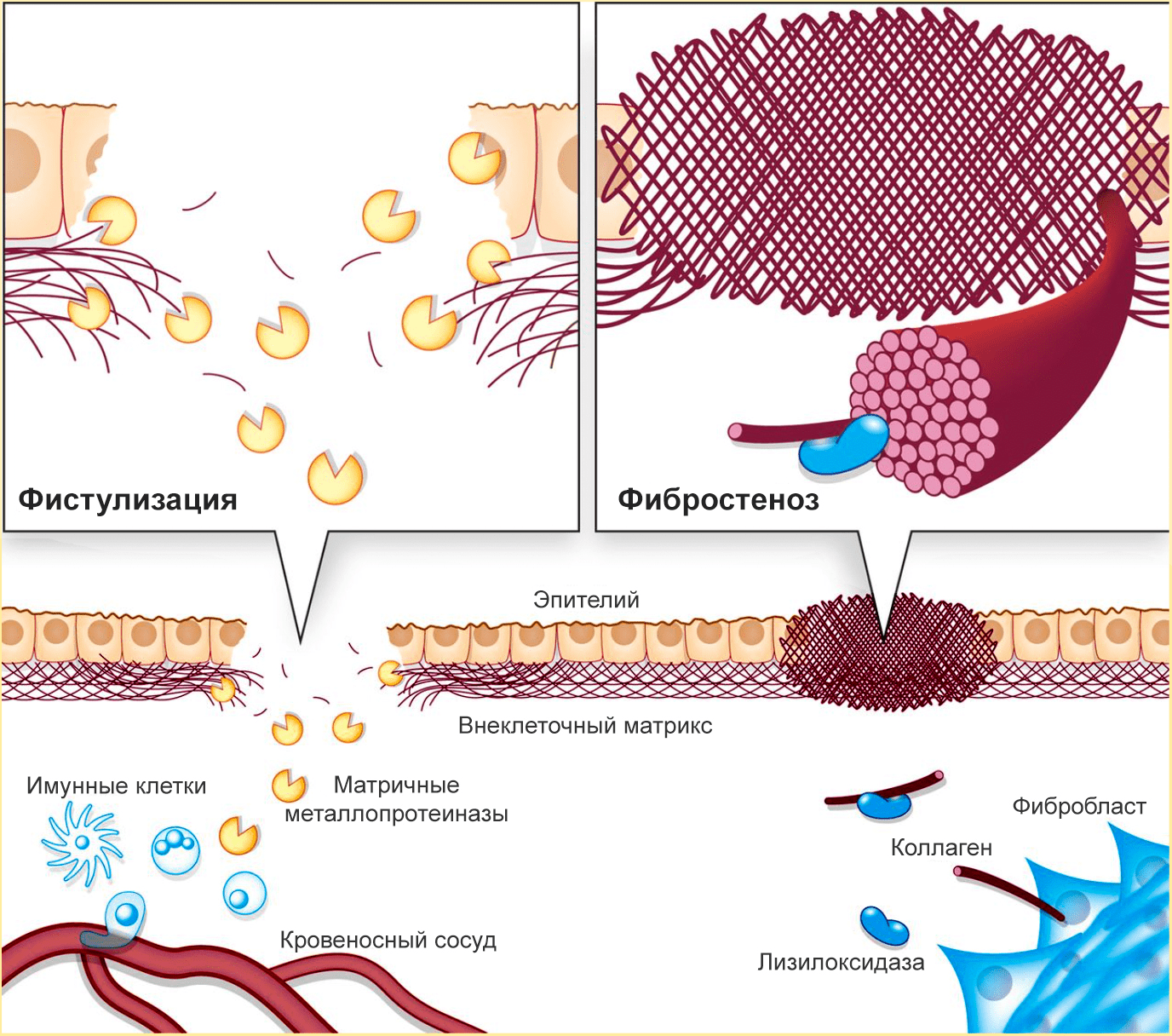
Рисунок 3. При болезни Крона происходит фистулизация и фибростеноз кишечника. Из-за избыточного разрушения ВКМ в кишечной стенке образуются отверстия, а из-за избыточного синтеза коллагена сужается просвет кишечника.
Фистулизация — образование отверстий в кишечной стенке. Этот процесс связан с неконтролируемой активностью металлопротеиназ, разрушающих коллаген слизистой оболочки кишечника. Так как целостность слизистой нарушается, иммунные клетки из кровеносных сосудов проникают в кишечную стенку — так развивается воспаление, а через некоторое время появляется отверстие в стенке кишечника.
Фибростеноз — сужение кишечника. Реагируя на повреждения, фибробласты интенсивно производят коллаген. Затем активируется лизилоксидаза — внеклеточный медьсодержащий фермент, катализирующий образование сложных поперечный связей в коллагене и эластине. Лизиолоксидаза необходима для формирования зрелых коллагеновых волокон, но при ее избытке начинаются проблемы. Этот фермент создает прочную коллагеновую сеть, «запечатывающую» поврежденные кишечные стенки, но из-за избыточной жесткости коллагеновых «печатей» фиброз только усиливается. В результате возникают воспаление и (иногда) непроходимость кишечника. Фистулизация усиливает фибростеноз: неуправляемое разрушение коллагена стимулирует его столь же неуправляемый синтез.
Избыточный синтез ВКМ часто говорит о том, что у человека рак и у этого рака плохой прогноз [11]. Кроме того, сам ВКМ может способствовать росту опухоли и распространению метастазов — это доказано для опухоли головного мозга. Особенно неприятно, что существующие методы лечения — например, лучевая терапия — способны заставить ВКМ послать клеткам сигнал, который может привести к рецидиву опухоли мозга [12].
Состав ВКМ головного мозга уникален: в нём очень много гиалуроновой кислоты и при этом гораздо меньше коллагена, фибронектина и других компонентов, характерных для ВКМ всех остальных тканей. Несмотря на важность ГК для нормальной работы тканей, в некоторых случаях она помогает проводить в клетки опухоли сигналы, делающие их более агрессивными. О том, как именно ГК «дразнит» раковые клетки, мы поговорим в разделе «Что нового мы узнали о внеклеточном матриксе за последний год?»
Лучевая терапия стимулирует работу мембранных белков HAS2, которые отвечают за синтез ГК. В результате они синтезируют больше гиалуроновой кислоты, а чем больше ГК, тем агрессивнее становятся опухолевые клетки. Получается, что лучевая терапия может стимулировать метастазирование опухоли. Таким образом, из-за особенностей ВКМ лучевая терапия помогает только на время: опухоль часто возвращается, становясь еще более опасной. Отчасти по этой причине некоторые виды опухолей мозга так плохо поддаются лечению.
Проблемы с ВКМ — важная причина старения
Первые признаки старения, которые сразу бросаются в глаза, — слабость, хрупкость костей, появление морщин и старческих пятен. Многие из этих проблем связаны с необратимыми изменениями во внеклеточном матриксе.
Одна из причин старения кожи — нарушение работы фибробластов (клеток, синтезирующих компоненты внеклеточного матрикса). При этом благополучие фибробластов зависит от состояния внеклеточного матрикса — получается замкнутый круг.
Рисунок 4. Микрофотография коллагеновых нитей в коже. а — «Целый» коллаген в молодой коже. б — Фрагментированный коллаген в стареющей коже. Стрелки указывают на старые, «разорванные» на кусочки нити коллагена.
Чтобы фибробласты хорошо себя чувствовали, им нужно цепляться за интактные, целые коллагеновые нити. Но со временем эти нити фрагментируются, и фибробластам становится не к чему крепиться, чтобы создать новый, целый коллаген (рис. 4) [13]. Если бы мы научились разрывать этот замкнутый круг, то нам, вполне возможно, больше никогда не понадобились бы антивозрастные услуги косметологов и пластических хирургов.
Старение костной ткани чаще всего связано с нарушением работы остеобластов. Эти клетки создают костный ВКМ, синтезируя коллаген и особые гликопротеины, которые участвуют в первом этапе минерализации коллагена. На втором этапе коллаген превращается в прочный внеклеточный матрикс — основу кости [14].
С течением лет старые остеобласты погибают, а новые делятся хуже и хуже. Оставшимся в живых стареющим клеткам становится всё сложнее справляться с созданием внеклеточного матрикса. Из-за этого кости у пожилых людей становятся очень хрупкими и плохо заживают после переломов.
Если бы мы могли заставить остеобласты делиться или хотя бы выяснили, как помочь им эффективнее минерализовать соединительную ткань, у пожилых людей появилась бы возмножность быстрее восстанавливаться после переломов. Такие работы уже ведутся!
В одной из подобных работ исследователи взяли коллагеновый гель, добавили к нему два неколлагеновых белка, ответственных за минерализацию коллагена (остеокальцин и остеопонтин), и создали на их основе искусственный внеклеточный матрикс. Этот исусственный ВКМ исследователи «предложили» остеобластам, полученным из стволовых клеток костного мозга. В результате активизировалось деление остеобластов, и эти остеобласты начали производить больше компонентов внеклеточного матрикса — правда, пока только в лабораторных условиях [14]. Чтобы искусственный ВКМ появился в кабинете травматолога и оказал содействие в восстановлении костей реальных пациентов, потребуется провести еще много исследований.
Что нового мы узнали о внеклеточном матриксе за последний год?
Над изучением ВКМ работают сотни исследовательских групп по всему миру, и каждый день появляется множество публикаций по этой теме. Давайте рассмотрим несколько свежих работ, чтобы получить представление о ключевых направлениях современных исследований. Вот что мы узнали о компонентах ВКМ в 2018 году.
Металлопротеиназы
Когда металлопротеиназы преждевременно разрушают эластин и коллаген легких, возникает соединительнотканное заболевание легких — эмфизема. Ученые давно стремились узнать, какой генетический компонент влияет на чрезмерную активность металлопротеиназ при этом заболевании.
Исследователи из немецкого Общества имени Макса Планка [15] связали чрезмерную активность металлопротеиназ в легких со снижением активности гена Myh10. Если этот ген «отключали» в мышиных легких, их внеклеточный матрикс формировался неправильно, разрушались межальвеолярные перегородки, с укрупнением альвеол сокращалась суммарная площадь их поверхности, а значит, должен был страдать газообмен. То есть события развивались по сценарию, типичному для человеческой эмфиземы лёгких. Кроме того, авторы работы выявили снижение экспрессии гена MYH10 в легких людей, страдающих эмфиземой.
Не исключено, что в будущем мы научимся управлять процессами, которые протекают в матриксе, используя редактирование генома и генную терапию.
Гликопротеины и металлопротеиназы
Яркий пример коварства металлопротеиназ — образование аневризм. Так, при аневризме брюшной аорты матриксные металлопротеиназы разрушают компоненты, из которых строится ВКМ этого крупного сосуда. Вскоре эта область воспаляется благодаря деятельности иммунных клеток — макрофагов. Механизмы, заставляющие металлопротеиназу разрушать аорту, долгое время оставались неизвестными.
Американским исследователям удалось выяснить, что макрофаги синтезируют нетрин-1 — белок, активирующий клетки гладких мышц сосудов [16]. Под воздействием нетрина-1 гладкомышечные клетки активируют свободные металлопротеиназы, разрушающие соединительную ткань сосуда.
Возможно, когда-нибудь мы научимся использовать иммунные клетки, чтобы управлять разрушением внеклеточного матрикса.
Интегрины и фибронектины
Южноафриканские исследователи обнаружили, что на синтез и деградацию фибронектина влияет внутриклеточный белок теплового шока Hsp90. Этот белок воздействует на фибронектин посредством рецептора LRP1 [4]. Если заблокировать этот рецептор, количество фибронектина, который накапливается во внеклеточном матриксе, уменьшается. И это очень хорошо — ведь из-за избыточного накопления фибронектина развиваются многие патологии ВКМ.
Не исключено, что если мы обнаружим подобные рецепторы в клетках разных тканей и научимся на них воздействовать, то сможем предотвращать болезни, связанные с накоплением ВКМ — например, фиброз легких.
Гиалуроновая кислота
Как компонент внеклеточного матрикса гиалуроновая кислота участвует в передаче сигнала от ВКМ в клетку и даже может превратить здоровую клетку в злокачественную [17]. Гиалуроновая кислота воздействует на клетки через рецептор CD44.
Удалось выяснить, что интенсивность сигнала, запускающего злокачественный процесс в клетке и определяющего, насколько опасна будет получившаяся раковая клетка, зависит от концентрации гиалуроновой кислоты и от ее молекулярной массы.
Гиалуроновая кислота управляет раковыми клетками, связываясь с трансмембранным белком — интегрином CD44. Активация рецептора CD44 подавляет апоптоз, из-за чего клетка становится «бессмертной», то есть раковой. Чем больше гиалуроновой кислоты, тем больше активируется рецепторов CD44 и тем, соответственно, опаснее и агрессивнее будут раковые клетки.
Если мы научимся управлять гиалуронидазами — ферментами, которые отвечают за модификацию и деградацию гиалуроновой кислоты, — мы сможем предотвращать развитие рака и появление метастазов.
Как создавать ВКМ
Когда мы усовершенствуем технологии создания искусственного ВКМ, мы сможем производить полноценные ткани и использовать их в регенеративной медицине. Работы в этом направлении ведутся уже давно, и в прошлом году удалось сделать несколько важных шагов на пути к технологии искусственного ВКМ.
Исследователи уже научились создавать рабочие 3D-модели ВКМ (рис. 5). В отличие от традиционных 2D-моделей, которые, по сути, представляли собой клеточную культуру в чашке Петри, 3D-модели позволяют создать работающий объемный «макет» нужной нам ткани [18].
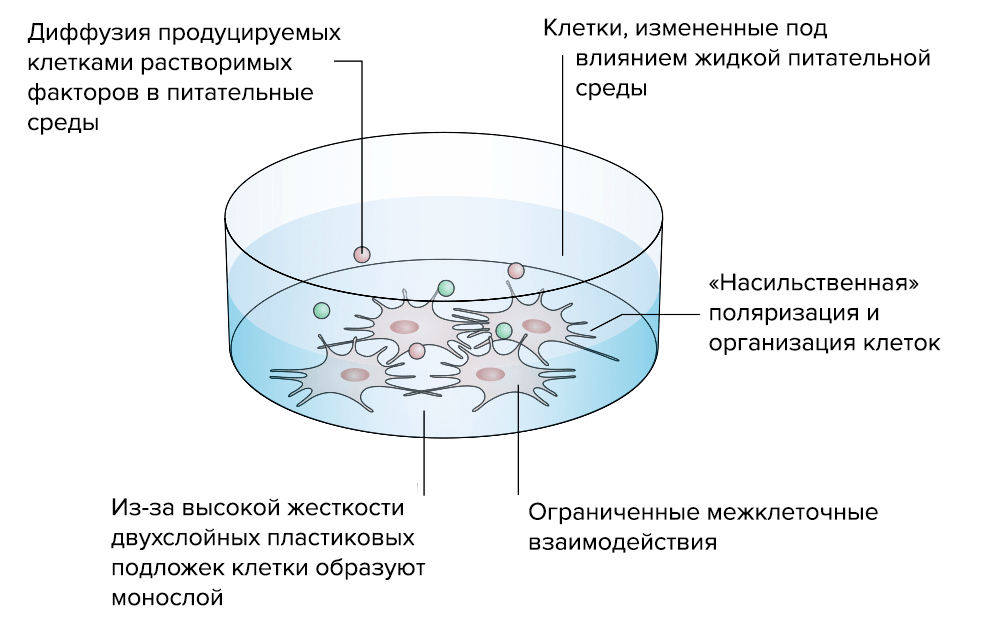
Рисунок 5а. Преимущества «объемной» 3D-модели соединительной ткани перед стандартной «плоской» 2D-моделью. 2D-модель. Клетки, выращенные на двумерной пластиковой подложке, ведут себя неестественно: нарастают в один слой, из-за чего нарушается межклеточное взаимодействие.
Рисунок 5б. Преимущества «объемной» 3D-модели соединительной ткани перед стандартной «плоской» 2D-моделью. 3D-модель. «Живой макет» ведет себя почти так же, как функциональная ткань: клетки растут и располагаются так, как им «нравится», поэтому у них сохраняется способность к полноценному межклеточному взаимодействию.
3D-модели можно модифицировать и дорабатывать. Уже созданы первые гидрогели — биосовместимые синтетические полимеры, способные удерживать воду. С появлением гидрогелей появилась и теоретическая возможность печатать внутренние органы.
Перед тем как первые напечатанные в лаборатории 3D-органы поступят в больницу, ученым придется решить еще множество проблем. Например, исследователям только предстоит разобраться с тем, как «подвести» к искусственным органам кровеносные сосуды. В этом тоже может помочь понимание биологии ВКМ — ведь мы уже знаем, что внеклеточный матрикс управляет в том числе и ростом сосудов [19].
Заключение
Внеклеточный матрикс — огромная тема, которую очень сложно охватить в одной статье. Ясно одно: если мы сумеем разобраться, как ВКМ функционирует и влияет на клетки, медицина сделает огромный шаг вперед.
Новые открытия в области изучения ВКМ помогут нам:
Судя по всему, ждать прорыва в изучении ВКМ осталось недолго.
Познание мира
Внеклеточные и внутриклеточные жидкости
Наше тело состоит из последовательности клеток, тканей, органов, системы органов и жидкостной системы. В организме человека содержится 60% жидкости, в этой жидкости в основном присутствуют вода и другие вещества. В нашем организме содержится 50-75% воды. Процент воды в нашем организме зависит от возраста и пола. На ранних сроках беременности 90% массы тела плода содержит воду. У недоношенных детей содержание воды составляет от 75 до 80% их массы тела. В новорожденном ребенке содержится 70% воды, и этот процент воды быстро уменьшается, в годовалом возрасте ребенок содержит 60% воды. В подростковом и зрелом возрасте вода присутствует в 60% у мужчин и 55% у женщин. Разница между мужчинами и женщинами связана с водой, это результат распределения жира в организме, поскольку жировая ткань в основном не содержит воды.
Большая часть этой жидкости присутствует внутри клетки и вне клетки. Внеклеточная жидкость присутствует вне клетки, а внутриклеточная жидкость присутствует внутри клетки. 2/3 всей воды в организме присутствует во внутриклеточной и 1/3 общей воды в организме присутствует во внеклеточной жидкости. Соотношение внутриклеточной и внеклеточной жидкости полностью зависит от возраста. У эмбриона / плода больше внеклеточной жидкости по сравнению с внутриклеточной. У мужчин высокий уровень внутриклеточной жидкости, потому что они обладают большой мышечной массой.
Внеклеточная жидкость
Внеклеточная жидкость делится на два типа:
Внеклеточная жидкость содержит лимфу, спинномозговую жидкость, водянистую влагу и стекловидное тело, синовиальную жидкость и серозную жидкость. Эти внеклеточные жидкости очень важны для нашего организма, и их количество увеличивается во время инфекционных заболеваний. Повышается уровень внесосудистых компонентов при сердечной недостаточности, энтеропатии с потерей белка, нефротическом синдроме и сепсисе. Уровень внутрисосудистого компартмента снижается при обезвоживании, гипоальбуминемии и анемии.
Внеклеточная жидкость обеспечивает движение в организме, транспортирует кровь и тканевые жидкости путем диффузии через стенку капилляров.
Два типа транспорта внеклеточной жидкости:
Внутриклеточная жидкость
Внутри клетки присутствуют внутриклеточные жидкости. Внутриклеточные жидкости содержат 2/3 части всей воды организма. Внутриклеточные жидкости содержат высокий уровень ионов калия, магния и фосфата. Во внутриклеточную жидкость входят ионы фосфата, просто замещающие ионы хлорида натрия во внеклеточных жидкостях, из-за относительной непроницаемости клеточных мембран, которые отделяют эти ионы. Специальные механизмы транспортировки ионов через клеточную мембрану поддерживают разницу в концентрации ионов между внутриклеточной и внеклеточной жидкостями.
Разница между внеклеточной и внутриклеточной жидкостью
| Внеклеточная жидкость | Внутриклеточная жидкость |
| Присутствует вне камеры. | Присутствует внутри клетки. |
| Главный катион — это натрий, а главный анион — хлорид. | Основным катионом является калий, а основным анионом — фосфат. |
| Насос активно использует клеточную энергию для поддержания натрия во внеклеточной жидкости. | При этом внутриклеточная жидкость использует калий. |
Диснатриемия
В норме концентрация натрия в крови составляет 135-145 ммоль / л. Основное определение концентрации натрия — это концентрация воды в плазме, которая определяется потреблением воды, потерями и разбавлением мочи. Вазопрессин, основной регулятор воды. Вода, гормон вазопрессин, реабсорбируется с помощью почечных канальцев и производит концентрированную мочу. Диснатремия изменяет признаки и симптомы, вторичные по отношению к центральной нервной системе.
Диснатриемия бывает двух типов в зависимости от концентрации натрия в нашем организме.
Гипонатриемия
Состояние гипонатриемии, когда в нашем организме уровень ионов натрия в крови ниже. Снижение уровня натрия в крови и эффективная осмоляльность крови вызывают движение воды в клетки мозга, что приводит к набуханию клеток и повышению внутричерепного давления. Чаще всего гипонатриемия возникает, когда организм пытается сохранить объем внеклеточной жидкости за счет циркулирующего натрия.
Усиление функций мутации гена X-сцепленного рецептора, который опосредует почечный ответ на вазопрессин, что приводит к стойкой активации рецептора. Это заболевание называется наследственным нефрогенным синдромом несоответствующего антидиуреза.
При этом заболевании используют Десмопрессин — синтетический аналог природного антидиуретического гормона. Этот препарат обычно считается безопасным и не вызывает побочных эффектов во время лечения.
Некоторым людям могут также применяться нестероидные противовоспалительные препараты, улучшающие выведение свободной воды.
Тиазиды (препарат, увеличивающий отток мочи), этот препарат блокирует систему реннин-ангиотензин-альдостерон, превращая ингибиторы ферментов или сартаны.
Гипернатриемия
Состояние гипернатриемии, когда в организме повышен уровень ионов натрия в крови. Когда концентрация натрия выше 160 ммоль / л, в организме возникают тяжелые симптомы. Ранние признаки гипернатриемии, такие как мышечная слабость, беспокойство, тошнота, анорексия и рвота. И тяжелые симптомы гипернатриемии психического статуса, вялости, раздражительности, ступора и комы. Гипернатриемия может вызвать сокращение мозга, церебральное кровотечение и субарахноидальное кровоизлияние.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.