витамин дгэа для чего
Дегидроэпиандростерон у мужчин: потенциальные физиологические эффекты с позиции доказательной медицины
Статья посвящена дегидроэпиандростерону (ДГЭА) – представителю класса надпочечниковых андрогенов, которые гораздо реже, чем другие гормоны, обсуждаются в отечественной научной литературе и остаются недостаточно изученными. С момента открытия в середине XX в. ДГЭА рассматривался исключительно как биохимический исходный субстрат для синтеза тестостерона и эстрогенов. Однако исследования, начатые в 1990-х гг. и продолжающиеся в настоящее время, демонстрируют, что биологическое значение ДГЭА в организме человека этим не ограничивается. В представленных автором систематических обзорах и метаанализах раскрывается роль ДГЭА при некоторых заболеваниях и патологических состояниях (стрессе, депрессии, нейродегенерации и т.д.). Несмотря на противоречивый характер современных научных публикаций по ДГЭА, достоверно подтверждено, что он обладает такими эффектами, как антистрессовый, антидепрессивный, иммуномодулирующий, которые крайне необходимы человеку для поддержания здоровья и активного долголетия.
Статья посвящена дегидроэпиандростерону (ДГЭА) – представителю класса надпочечниковых андрогенов, которые гораздо реже, чем другие гормоны, обсуждаются в отечественной научной литературе и остаются недостаточно изученными. С момента открытия в середине XX в. ДГЭА рассматривался исключительно как биохимический исходный субстрат для синтеза тестостерона и эстрогенов. Однако исследования, начатые в 1990-х гг. и продолжающиеся в настоящее время, демонстрируют, что биологическое значение ДГЭА в организме человека этим не ограничивается. В представленных автором систематических обзорах и метаанализах раскрывается роль ДГЭА при некоторых заболеваниях и патологических состояниях (стрессе, депрессии, нейродегенерации и т.д.). Несмотря на противоречивый характер современных научных публикаций по ДГЭА, достоверно подтверждено, что он обладает такими эффектами, как антистрессовый, антидепрессивный, иммуномодулирующий, которые крайне необходимы человеку для поддержания здоровья и активного долголетия.
Дегидроэпиандростерон (ДГЭА) и другие надпочечниковые андрогены были открыты в 1930–40-х гг. Долгое время им не придавалось существенного клинического значения в обеспечении андрогенного фона у мужчин, и они оставались практически не изученными вплоть до 1990-х гг., когда возник настоящий бум вокруг ДГЭА. Именно тогда появились работы, которые продемонстрировали, что назначение ДГЭА в физиологических (50 мг/сут) и фармакологических (200–400 мг/сут) дозах людям после 60 лет принципиально улучшает у них показатели качества жизни. В этой связи многие исследователи стали рассматривать ДГЭА как потенциальный антивозрастной гормон (гормон молодости). К настоящему времени опубликовано множество работ, посвященных физиологии, эндокринологии, клиническому применению ДГЭА. Однако пока, увы, нет однозначного ответа на главный вопрос о биологическом значении этого гормона в организме человека [1].
Сегодня продолжается активное изучение ДГЭА, и с каждым годом появляются все новые данные о важной роли надпочечниковых андрогенов (прежде всего ДГЭА) в обеспечении здоровья и долголетия человека. При этом интерес к ДГЭА особенно силен в США, где он классифицируется как пищевая добавка и продается без рецепта. В большинстве стран ДГЭА доступен только по рецепту врача [2]. В РФ препараты ДГЭА официально не зарегистрированы.
В статье обсуждаются физиологические функции ДГЭА по результатам преимущественно систематических обзоров и метаанализов, поскольку именно они составляют основу аналитической базы доказательной медицины.
Возрастная эндокринология дегидроэпиандростерона
К основным андрогенам, которые вырабатываются в сетчатой зоне коры надпочечников, относятся ДГЭА, его транспортная сульфатная форма ДГЭА-сульфат (ДГЭА-С) и андростендион [1]. В среднем ежедневно синтезируется 15–30 мг надпочечниковых андрогенов. Согласно одним источникам, эти стероидные гормоны не имеют каких-либо циркадианных (суточных) ритмов секреции, по другим данным, циркадианные ритмы секреции ДГЭА-С все же имеют место и пик концентрации ДГЭА-С приходится на ночное время. При этом не вызывает сомнений тот факт, что ДГЭА-С производится в надпочечниках только представителей отряда приматов (человека, высших и низших обезьян) [1].
Секреция ДГЭА надпочечниками впервые повышается у детей в период адренархе в возрасте шести – восьми лет. Максимальный плазменный уровень циркулирующего в крови ДГЭА наблюдается между 20 и 30 годами, после чего его уровень у обоих полов начинает сокращаться примерно на 2% ежегодно. В итоге к 50 годам он уменьшается на 50%, к 70 годам – на 80%, к 90 годам – на 90% по отношению к возрасту 20–30 лет, что ассоциируется как с возрастным снижением устойчивости к стрессу, так и с нейродегенеративными, когнитивными и депрессивными нарушениями (рис. 1) [1, 3].
Ключевые эффекты дегидроэпиандростерона у мужчин с позиции доказательной медицины
С момента открытия в 1930-х гг. и вплоть до 1990-х гг. ДГЭА и его транспортная сульфатная форма ДГЭА-С рассматривались у мужчин как слабые надпочечниковые андрогены. Их функциональный вклад в общий андрогенный фон считался клинически не значимым, в связи с чем физиологическая роль ДГЭА в мужском организме практически не изучалась [4, 5]. Долгое время считалось, что ДГЭА у мужчин выполняет исключительно функции прогормона (биохимического субстрата) в процессе синтеза тестостерона и далее эстрогенов, за что он и получил название «мать всех половых стероидных гормонов» (рис. 2) [6].
Однако современные исследования показали, что по концентрации в периферической крови среди всего спектра веществ стероидной структуры ДГЭА в норме уступает только холестерину, опережая прогестерон (своего предшественника) и кортизол – еще один важный гормон, который вырабатывается в клубочковой зоне коры надпочечников и отвечает за реализацию гормональных адаптационных механизмов организма к любой стрессовой реакции (гормон стресса). Так, концентрация ДГЭА в крови превышает содержание его конечных метаболитов: тестостерона у мужчин в 200–1000 раз, 17-бета-эстрадиола у женщин в 5000–25 000 раз (рис. 3) [1].
Как полагают исследователи, биологически подобное распределение ДГЭА и его метаболитов в крови у человека объясняется тем, что ДГЭА, будучи ключевым буферным гормоном стрессоустойчивости, представляет собой практически единственный естественный антиглюкокортикоидный гормон, противостоящий кортизолу – ключевому гормону стресса, приводящему к «синдрому обкрадывания» синтеза надпочечникового ДГЭА и тестикулярного тестостерона [7, 8].
Соотношение «кортизол – ДГЭА» рассматривается как ключевой маркер устойчивости человека к стрессу. Для адекватной защиты от стресса ДГЭА, который характеризуется протективным эффектом по отношению к центральной нервной системе, всегда должен преобладать над кортизолом, который деструктивно влияет на гиппокамп [9, 10].
По данным некоторых исследований, низкий уровень ДГЭА в крови – одна из причин недостаточной стрессоустойчивости, нарастающей с возрастом, депрессии у подростков и пожилых людей, повышенной частоты суицидов, а снижение уровня циркулирующего ДГЭА и уменьшение соотношения «кортизол – ДГЭА» ассоциированы с ускоренным старением, депрессией, нарушениями памяти, синдромом хронической усталости, болезнью Альцгеймера (рис. 4) [8, 10].
В организме мужчин и женщин кроме традиционной выработки половых стероидных гормонов в половых железах (яичках и яичниках соответственно) есть и другой важный механизм обеспечения клеток периферических тканей необходимыми половыми гормонами – их самостоятельное производство «по требованию» из ДГЭА непосредственно внутри клеток некоторых органов и тканей, без участия системного кровотока и независимо от функциональной способности половых желез (яичек или яичников). Указанный механизм был открыт в 1988 г. канадским профессором Ф. Лабри и получил название интракринного периферического синтеза половых стероидных гормонов [11]. При этом типе гормональной клеточной регуляции половые стероидные гормоны образуются сразу внутри клеток и тут же оказывают соответствующее физиологическое действие [11]. Такой самостоятельный интракринный синтез половых стероидных гормонов происходит в клетках молочной и предстательной желез, головном мозге, мышечной ткани, коже, а у женщин еще и в эпителии влагалища. По мере старения гонад роль ДГЭА в обеспечении гормонозависимых клеток половыми стероидными гормонами за счет внутриклеточного интракринного синтеза возрастает. Так, именно из ДГЭА потенциально образуется до 35% тестостерона в периферических тканях у стареющих мужчин и до 80–100% тестостерона в гормонозависимых клетках у женщин в постменопаузе [12].
Поскольку ДГЭА является биохимическим субстратом для дальнейшего синтеза половых стероидных гормонов (тестостерона и эстрогенов) и подвергается интракринному метаболизму с образованием тестостерона и/или эстрадиола в клетках ряда органов и тканей, некоторые авторы предполагают, что дефицит ДГЭА у мужчин способен приводить к дефициту тестостерона и эстрогенов. Следовательно, назначение ДГЭА-заместительной терапии при возрастном дефиците ДГЭА может рассматриваться как физиологическая альтернатива заместительной терапии тестостероном у мужчин с возрастным дефицитом тестостерона [13, 14].
Однако с позиций доказательной медицины возможность использования ДГЭА-заместительной терапии изучена только у пожилых мужчин, что отражено в единственном доступном метаанализе 2013 г., охватившем результаты 25 клинических рандомизированных исследований (n = 1353) [15]. Средняя длительность терапии препаратами ДГЭА составила 36 недель. По данным метаанализа, ДГЭА-заместительная терапия у пожилых мужчин приводила к достоверному уменьшению жировой массы тела на фоне повышения уровней общего тестостерона и эстрадиола. Однако в мультивариационном регрессивном анализе связь между объемом жировой массы и уровнем ДГЭА не получила статистически значимого подтверждения. Достоверных эффектов ДГЭА-заместительной терапии в отношении липидного и углеводного обменов, костного метаболизма, сексуальной функции и качества жизни по сравнению с плацебо также не выявлено [15].
Тем не менее, согласно результатам исследований, накопленных к настоящему времени, ДГЭА можно рассматривать как самостоятельный полифункциональный гормон с достаточно широким спектром физиологических эффектов в организме, которые еще предстоит оценить с точки зрения доказательной медицины (рис. 5) [16].
С учетом описанных особенностей периферического метаболизма ДГЭА только 60% внутрипростатического 5-альфа-дигидротестостерона, ключевого андрогена предстательной железы, синтезируется из тестикулярного тестостерона, поступающего в железу из яичек с системным кровотоком, а 40% производится ими автономно (независимо от тестикулярного стероидогенеза) из тестостерона, синтезированного внутриклеточно из ДГЭА. При этом интракринный простатический синтез половых стероидных гормонов из ДГЭА выявлен как в железистом эпителии (тестостерон), так и в строме органа (эстрогены). Это объясняется тем, что ДГЭА, будучи биохимическим предшественником тестостерона, в строме простаты под влиянием стромальных ароматаз легко трансформируется в эстрогены [17].
Согласно одной точке зрения, на фоне возрастного снижения уровня тестикулярного тестостерона предстательная железа, чтобы поддержать андрогенный гомеостаз, начинает активно использовать для синтеза 5-альфа-дигидротестостерона именно ДГЭА из крови. Дефицит ДГЭА, как и дефицит тестикулярного тестостерона, способен повышать активность 5-альфа-редуктазы, вызывающей простатическую пролиферацию [17]. Так сформировалась новая полигормональная эндокринно-аутокринно-интракринно-паракринная модель взаимодействия стромы и эпителия предстательной железы с учетом метаболизма в них ДГЭА. Это послужило основой для разработки рабочей гипотезы о том, что в патогенезе простатической пролиферации, характерной для доброкачественной гиперплазии предстательной железы и рака простаты, возрастной дефицит ДГЭА может играть столь же важную роль, как и возрастной дефицит тестикулярного тестостерона (рис. 6) [17].
Уникальность и сложность влияния ДГЭА на процессы пролиферации и воспаления в ткани предстательной железы состоят в том, что он является потенциальным субстратом как для синтеза тестостерона, так и (при необходимости) для трансформации в эстрогены за счет ароматазы стромы предстательной железы [18]. Роль эстрогенов в предстательной железе представляется достаточно сложной, поскольку зависит от локальных сигнальных механизмов, обеспечивающих баланс между эффектами двух типов рецепторов эстрогена – альфа и бета (в отличие от андрогенов, имеющих лишь один тип рецептора). Эстрогены вовлечены в локальную клеточную пролиферацию, воспаление и канцерогенез в предстательной железе путем, отличным от андрогенов. При этом рецепторы эстрогена альфа опосредуют неблагоприятные (негативные), а рецепторы эстрогена бета, соответственно, благоприятные (позитивные) эффекты в отношении воспаления, пролиферации и канцерогенеза в предстательной железе [18, 19].
Несмотря на известный факт о том, что возрастное снижение синтеза тестостерона у мужчин играет важную роль в патогенезе доброкачественной гиперплазии предстательной железы, существует гипотеза, согласно которой одним из гормональных механизмов простатической пролиферации может быть именно прогрессирующая с возрастом адреналовая недостаточность. Она сопровождается постепенным снижением синтеза прогестерона и особенно ДГЭА в надпочечниках, которые, будучи биохимическими предшественниками тестостерона, приводят к его дефициту. Вместе эти факторы, очевидно, запускают механизм активации 5-альфа-редуктазы, вызывающей простатическую железистую пролиферацию и гиперплазию предстательной железы [17, 20, 21].
Различия в функционировании гипоталамо-гипофизарно-адренокортикальной системы у пациентов с посттравматическим стрессовым расстройством (ПТСР) и здоровых людей серьезно изучаются. Активация гипоталамо-гипофизарно-адренокортикальной системы приводит к выбросу в системный кровоток многих стероидных гормонов, включая ДГЭА, который метаболизируется в ДГЭА-С с выраженным антиглюкокортикоидным эффектом [22].
Чтобы выяснить, есть ли достоверные различия в базальных плазменных уровнях ДГЭА и ДГЭА-С на фоне ПТСР и без него, был проведен метаанализ, объединивший результаты ранее опубликованных исследований по этой теме. Были включены девять работ с данными об уровне ДГЭА (n = 486) и восемь работ с данными об уровне ДГЭА-С (n = 501). Анализы подгрупп для изучения связи между ПТСР и временем экспозиции травмы показали, что у пациентов с ПТСР по сравнению с контролем наблюдалась тенденция к более высокому уровню ДГЭА (k = 3, стандартизованная разность средних (СРС) = 1,12, 95%-ный доверительный интервал (ДИ) 0,03–2,52, Z = 1,91, p = 0,06) и достоверно более высокому уровню ДГЭА-С (k = 2, СРС = 0,76, 95% ДИ 0,38–1,13, Z = 3,94, p 0,05). Тем не менее, по заключению авторов, повышение уровня экспрессии белка ДГЭА-С может коррелировать с биологической патофизиологией депрессии, в связи с чем определение уровня ДГЭА-С и дальнейшая ДГЭА-заместительная терапия могут способствовать эффективному лечению депрессии [34].
Последний метаанализ 2018 г. по этой теме основан на электронном поиске статей, опубликованных до июня 2018 г., по ключевым словам «дегидроэпиандростерон и депрессии» в базах данных Medline, Embase, Lilacs и Cochrane. Были включены только рандомизированные клинические исследования. Авторы отмечают значительный эффект лечения ДГЭА по сравнению с плацебо у больных с депрессией. Таким образом, ДГЭА-заместительная терапия может быть эффективной фармакологической альтернативой препаратам, традиционно используемым в лечении депрессии [35].
Многие исследования показали, что ДГЭА и ДГЭА-С связаны с различными аспектами иммунной системы и часто характеризуются как полезные и поддерживающие иммунокомпетентность гормоны (иммуномодуляторы) [36, 37]. Однако при ближайшем рассмотрении обнаруживается путаница в отношении модифицированных иммунологических компонентов, механизмов действия и его выраженности и даже в отношении того, имеют ли эти гормоны прямое влияние или их иммуномодулирующие эффекты опосредованы метаболитами и связями с другими гормонами и гормональными рецепторами. Кроме того, большая часть исследований проводилась на моделях грызунов с использованием высоких концентраций гормональных добавок. В результате они не всегда могут быть репрезентативными для эффектов этих гормонов в естественных концентрациях в циркулирующей крови или экстраполированы на физиологию человека. Тем не менее с учетом данных литературы, а также исследований, изучающих связь естественных циркулирующих уровней ДГЭА и ДГЭА-С и конкретных иммунологических компонентов и заболеваний, была высказана точка зрения, что ДГЭА оказывает достоверное позитивное дифференцированное действие на иммунную функцию человека, а его иммуномодулирующие эффекты зависят от уровня в крови других гормонов (рис. 7) [36].
Согласно результатам ряда доказательных исследований, ДГЭА может быть полезен как терапевтическое средство за счет способности уменьшать синтез провоспалительных цитокинов, в частности при заболеваниях с высоким уровнем системного хронического субклинического воспаления, например при ревматоидном артрите или вторичной гипофункции надпочечников [38–40].
Как продемонстрировал проведенный обзор, доказательные исследования последних десятилетий позволили по-иному взглянуть на роль надпочечниковых андрогенов (прежде всего ДГЭА) как в норме, так и при ряде заболеваний и патологических состояний. ДГЭА уже не рассматривается исключительно как биохимический субстрат для дальнейшего синтеза в организме половых стероидных гормонов (тестостерона, эстрогенов). Исследования эндокринологии ДГЭА позволяют говорить о нем как о полифункциональном гормоне с широким спектром физиологических эффектов, многие из которых пока до конца не понятны и активно изучаются. Однако, опираясь на результаты имеющихся доказательных клинико-экспериментальных исследований, начатых в конце прошлого века и продолжающихся в настоящее время, можно утверждать, что у этого незаслуженно забытого гормона есть уникальные перспективы более активного клинического применения с целью профилактики и терапии ассоциированных с возрастом заболеваний. Вот почему, несмотря на противоречивые данные, изучение интракринологии и эффектов ДГЭА, несомненно, следует активно продолжать, поскольку это направление медицины имеет большое клиническое и научно-прикладное значение для обеспечения здоровья и активного долголетия современного человека.
Дисфункция надпочечников. Человек Уставший, продолжение.
Дисфункция – это как предболезнь. Заболевание еще не развилось, а жалобы есть, но они стертые, поэтому человеку плохо, но он не может понять, что с ним и с каким органом это состояние связать.
В современном обществе формируется неправильная тенденция социального поведения. Тебя постоянно подгоняют «еще, еще. больше работай, будь успешным, делай карьеру, но не забудь про семью, роди 2-3 детей (надо поднимать демографию страны), имей хобби, выучи языки, имей 2 образования, занимайся спортом, путешествуй, не забывай посещать театр (для кого-то ночной клуб, дискотеку), води машину и т.д.»
И как, скажите мне, человеку выдержать такой прессинг? Ни малейшего времени на передышку, на созерцание. Резервы организма ИМЕЮТ ПРЕДЕЛ, и у каждого свой срок «до срыва». И этим пределом часто является истощение функции надпочечников, одного из важнейших эндокринных органов.
Какими же симптомами дисфункция надпочечников может выражаться: (симптомы могут быть разной степени выраженности от минимальных до максимальных)
Как проверить работу надпочечников?
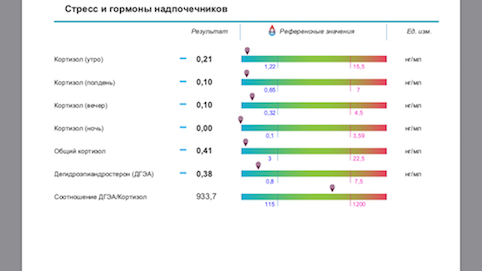
До 2015 года основным способом были: анализ крови на кортизол, АКТГ по часам 8:00- 24:00 (или еще промежуточно 13:00) и сбор суточной мочи на кортизол, кровь на ДГА-С. Это было крайне неудобно. Ни одна лаборатория, кроме расположенных в стационаре, кортизол в 24:00 не брала. А без этого показателя оценить функцию надпочечников правильно не возможно. Собирать суточную мочу не все соглашались, очень трудоемко и может быть не так достоверно.
С 2015-2016 года появился метод оценки кортизола слюны.
Собирается суточный профиль слюны на кортизол по 4 точкам 8:00- 13:00 и 17:00- 24:00.
Ниже привожу материал лаборатории «CHROMOLAB» по исследованию состояния надпочечников и его интерпретации.
«Организм человека постоянно подвергается воздействию различных факторов внешней и внутренней среды. Это могут быть абиотические факторы, такие как холод, жара, атмосферное давление, влажность, недостаток кислорода. Избыток или дефицит поступающих в организм веществ (белков, углеводов, липидов), недостаток витаминов и микроэлементов, вирусная или микробная инфекция, токсины также оказывают определенное влияние. Негативные последствия имеют вредные привычки, физическая перегрузка, переедание, гиподинамия, нарушение ритма сна и бодрствования. Кроме того, к серьезным стрессорам относят техногенные и психологические воздействия: переизбыток компьютерной и телевизионной информации, монотонный труд, конфликты, чрезмерную рабочую нагрузку, эмоциональное истощение, завышенный уровень ответственности, общую неудовлетворенность и прочее. Все эти и многие другие причины ведут к постоянному напряжению физиологических резервов организма, который вынужден приспосабливаться (адаптироваться) к этим факторам или защищаться. Если воздействия носят интенсивный, внезапный или незнакомый («новый») характер, то организм отвечает на них универсальной (в формате «скорой помощи») физиологической реакцией, называемой СТРЕССОМ (стрессорной реакцией). Стрессорная реакция не связана с положительным или отрицательным восприятием внешних раздражителей, с которыми сталкивается человек. Она необходима для скорейшей адаптации организма с целью его защиты от гибели. Стресс – это защитная реакция организма. Однако длительная стрессорная реакция приводит к избыточному нерегулируемому ответу организма на повреждающий фактор и обратному эффекту. Вместо защитных процессов активируются деструктивные, что может стать пусковым механизмом для развития патологических состояний: сахарного диабета, тромбозов, инсультов, инфарктов, аритмии, бесплодия, эректильной дисфункции, аллергии, онкологических заболеваний, иммунодефицитов, ранней менопаузы, остеопороза, гипотиреоза, бессонницы, депрессии, ожирения, анорексии и многого другого. Стресс инициирует различные патологические состояния, и это зависит от провоцирующих факторов внешней и внутренней среды.»
Стадийность стрессорных реакций. Выделяют три стадии стресса (согласно Г. Селье):
Глубокое понимание механизмов регуляции стресса стало возможным благодаря исследованию процессов синтеза, обмена и метаболизма стероидных гормонов коры надпочечников: кортизола и дегидроэпиандростерона (ДГЭА), которые регулируют реализацию стрессорной реакции.
Согласно современным исследованиям, физиологический смысл этого феномена заключается в том, что ДГЭА – это мощный естественный антиглюкокортикоид, противостоящий кортизолу, уровень которого резко повышается при любом стрессе. Известно, что отношение ДГЭА к кортизолу следует рассматривать как ключевой маркер устойчивости организма к любому стрессу, для обеспечения которой в целях адекватной защиты в организме всегда должен превалировать уровень ДГЭА.
Оценку суточного ритма секреции кортизола по его концентрации в слюне (4-кратное определение в течение дня в разных порциях слюны) применяют для отличия стрессорной реакции от иных патологических состояний, связанных с дисфункцией секреции стероидных гормонов.
Оценка проводится только врачом.
Известно, что уровень кортизола – величина непостоянная, и он подвержен колебаниям в течение суток.
С 7 до 9 часов утра концентрация кортизола максимальна, в связи с чем утренний уровень этого гормона считается хорошим индикатором для определения функционального состояния надпочечников.
С 11 часов утра до 13 часов дня концентрация кортизола возвращается к среднему значению, что служит показателем адаптивной функции надпочечников.
С 15 до 17 часов дня уровень кортизола постепенно опускается.
С 22 часов вечера до полуночи концентрация гормона находится на самом низком уровне, что отражает нормальную надпочечниковую функцию.
Такое развернутое исследование надпочечников поможет определиться с диагнозом, нет ли здесь дебюта надпочечниковой недостаточности или это просто дисфункция и определиться с лечебной тактикой. Ведь кому-то надо будет отдохнуть и правильно питаться. А кому-то понадобится подобрать препараты гормонов надпочечников сроком от 1,5-3-х месяцев до пожизненной терапии при выявленной надпочечниковой недостаточности. Радует то, что надпочечниковая недостаточность встречается очень редко.
НО очень часто встречается дисфункция.
Особенную благодарность в идее составления этой статьи выражаю своему учителю Гострому Андрею Владимировичу.