вилочковая железа что это такое у взрослых симптомы
Что нужно знать о патологии тимуса
Внутренний секрет
Вилочковая железа — источник популяции тимусзависимых лимфоцитов (Т-лимфоцитов), которые отвечают за распознавание антигенов, регуляцию и другие функции иммунного ответа. Именно в тимусе происходит их клонирование и дифференцировка. Для обеспечения защиты созревающих Т-лимфоцитов от воздействия разнообразных антигенов даже существует гемато-тимусный барьер.
Еще одной особенностью вилочковой железы является ее «недолговечность» — с пубертатного периода начинается инволюция, и у взрослых практически вся железистая ткань заменяется жировой.
Значимость этой железы трудно переоценить. При ее недоразвитии происходит снижение клеточного и гуморального иммунитета, в следствие чего возникают септические осложнения в первую очередь вирусной и грибковой природы. В детском возрасте возможно и увеличение вилочковой железы (тимомегалия), которое часто сопровождается экссудативно-катаральным диатезом, тяжелым и длительным течением бронхолегочных заболеваний. Правда, следует учитывать возможность частого физиологического увеличения вилочковой железы на первом году жизни, которое может наблюдаться почти у половины детей.
Отдельно стоят болезни тимуса у взрослых. В большинстве случаев речь идет о различных опухолях вилочковой железы, которые носят общее название — тимомы. Они являются наиболее частыми новообразованиями средостения (комплекс органов, расположенных между правой и левой плевральными полостями), хотя и составляют менее 1 % всех онкологических заболеваний. Чаще всего встречаются доброкачественные образования (65—70 %), но и они могут доставлять большие проблемы больному. Правда, на начальных стадиях и при медленном росте эти опухоли не сопровождаются какими-либо патологическими симптомами, поэтому выявить их можно только случайно, при компьютерной томографии грудной клетки. Однако значительное увеличение объема патологически измененной вилочковой железы приводит к сдавлению и нарушению функции близлежащих органов. Поскольку тимус расположен в средостении, за грудиной, его ближайшими «соседями» являются трахея, пищевод, сердце, аорта, легочная артерия, большая полая вена и нервные волокна.
Характерные симптомы при развитии опухоли тимуса — затруднение дыхания и глотания, кашель, отеки и цианоз верхней части туловища и лица, боль за грудиной, шум и тяжесть в голове, возможен сбой сердечного ритма. Нарушение работы тимуса, которое возможно даже при доброкачественном течении опухоли, часто приводит к развитию миастении — нарушению функции мускулатуры тела. Это нервно-мышечная патология, которая имеет аутоиммунную природу и сопровождается быстрой слабостью и утомляемостью в первую очередь скелетных мышц. Больному человеку трудно встать со стула, подняться по лестнице, руки становятся «ватными». Усталость нарастает к вечеру: нарушается речь, опускаются веки, появляется двоение в глазах, сложно сфокусировать взгляд. При выраженной симптоматике нарушается процесс жевания и глотания, изменяется голос (становится гнусавым). Характерна связь физической нагрузки одних групп мышц с нарушением других функций мышечной системы. Так, после некоторого усилия слабость ощущается не только в мышцах, которые были задействованы, но и во всех остальных. Для злокачественных опухолей, особенно на поздних стадиях, характерны отдаленные метастазы и нарастающая интоксикация.
Лечение болезни комплексное, после хирургической операции назначается лучевая и химиотерапия. Оперативные вмешательства в настоящее время могут в ряде случаев проводиться эндоскопически (торакоскопия), что позволяет значительно сократить послеоперационный период. Современные методы лечения позволяют вернуть здоровье в 60—90 % случаев в зависимости от степени развития патологии.
ЗАБОЛЕВАНИЯ ВИЛОЧКОВОЙ ЖЕЛЕЗЫ И ИХ ЛЕЧЕНИЕ
В. Л. Маневич, В. Д. Стоногин, Т. Н. Ширшова, И. В. Шуплов, С. В. Момотюк
Публикация посвящается памяти Василия Дмитриевича Стоногина (1933-2005)
Заболевания вилочковой железы изучаются врачами различных специальностей: невропатологами, эндокринологами, иммунологами, гемато¬логами, хирургами, патогистологами и др. Проблема миастении является относительно изученной; в последние годы установлено участие вилочковой железы в таком жизненно важном процессе, как выработка (регулировка) иммунитета.
Опухоли и кисты вилочковой железы, миастения и некоторые аутоиммунные заболевания требуют хирургического лечения. Значительный вклад в этот сложный раздел внесли отечественные и зарубежные хирурги (А. Н. Бакулев и Р. С. Колесникова; В. Р. Брайцев; Б. К. Осипов; Б. В. Петровский; М. И. Кузин и соавт.; С. А. Гаджиев и В. Васильев; Viets, и др.).
Из 66 больных 65 были оперированы: 62 произведена радикальная и 3 эксплоративная операция.
Клиника миастении хорошо известна, однако правильный диагноз больному с миастенией нередко ставят после продолжительного наблюдения. У 32 из 44 наших больных правильный диагноз был поставлен только через 6-8 месяцев после появления первых признаков заболевания. Это объяс¬няется малой выраженностью клинической картины миастении в начальной стадии и плохой осведомленностью практических врачей, к которым впервые обращаются за помощью больные миастенией (невропатологи, окулисты, отоларингологи, терапевты).
При выраженной генерализованной форме миастении диагноз не труден. В начальной стадии и в случаях, когда миастения носит локализован¬ный характер (бульбарная, глазная, скелетно-мышечная, глоточно-лицевая), у наших больных предполагались самые разнообразные диагнозы, вплоть до подозрения на симуляцию. Считаем необходимым подчеркнуть особую важность прозериновой пробы, имеющей дифференциально-диагностическое значение. У больных миастенией внутримышечная инъекция 1-2 мл 0,05% раствора прозерина устраняет мышечную слабость и быструю утомляемость, в то время как при миопатиях и мышечной слабости, вызванных другими причинами, инъекция прозерина не дает эффекта. Имеют значение динамометрия, эргометрия и электромиография.
Общепризнано, что лечение миастении должно проводиться комплексно с участием 3-4 специалистов: невропатолога, терапевта-эндокринолога, анестезиолога-реаниматолога и хирурга. На основании большого клинического материала (сотни оперированных и наблюдаемых в отдаленном периоде) авторы подчеркивают преимущество оперативного лечения миастении перед консервативным (М. И. Кузин; А. С. Гаджиев и соавт., и др.). Результаты оперативного лечения лучше, если операцию производят впервые 2-2,5 года от начала заболевания. В более поздние сроки операция оказывается менее эффективной. Отсюда вытекает особая важность ранней диагностики миастении.
Наличие у больного выраженной клинической картины прогрессирующей миастении является показанием к операции, так как все консервативные методы лечения, включая и рентгенотерапию, дают лишь временное улучшение.
Вопрос о необходимости предоперационной рентгенотерапии нельзя считать окончательно решенным. Только 5 из наших больных перед операцией получали рентгеновское облучение, причем каких-либо улучшений в течении послеоперационного периода мы у них не отметили. У больных, оперированных по поводу злокачественной тимомы с явлениями миастении, предоперационное облучение играет важную роль в ближайшем исходе операции и в какой-то степени влияет на сроки наступления рецидива заболевания (М. И. Кузин и соавт.).
Большинство операций по поводу миастении нами выполнено из переднего доступа путем полной срединной продольной стернотомии. Наиболее ответственным моментом операции является отделение железы от левой плечеголовной вены. Ранение этого сосуда опасно из-за массивного кровотечения и возможной воздушной эмболии. В одном случае произошло ранение этой вены, закончившееся благополучно (был наложен боковой сосудистый шов). При операции следует избегать наложения зажимов на железистую ткань, раздавливания её.
У 3 наших больных было сочетание миастении и загрудинного зоба. Произведены тимэктомия и субтотальная струмэктомия.
У 26 больных во время операции была повреждена медиастинальная плевра, в том числе у 8 больных с обеих сторон. Осложнений, связанных с операционным пневмотораксом, не было. Если во время операции плевра не повреждена, переднее средостение дренируется одной резиновой трубкой, конец которой выводят в нижний угол раны или через отдельный прокол ниже мечевидного отростка и соединяют с отсосом. Вслед за тимэктомией трахеостома (превентивно) была наложена 5 больным.
Если сама операция тимэктомии по сравнению с другими торакальными операциями не представляет особой сложности, то течение послеоперационного периода у ряда больных сопровождается осложнениями, на 1-м месте среди которых стоит миастенический криз. Поэтому операции по поводу миастении возможны только в тех учреждениях, где можно обеспечить круглосуточное наблюдение анестезиолога-реаниматолога, а также многодневную аппаратную вентиляцию лёгких.
Вопрос о назначении антихолинэстеразных препаратов в послеоперационном периоде окончательно не решен. С целью уменьшения гиперсекреции бронхов лучше назначать прозерин с небольшими дозами атропина.
Тяжелый миастенический криз с расстройством дыхания, сердечной деятельности, глотания и т. д. наблюдали в первые дни после операции у 26 больных. Вывести из криза консервативными мероприятиями удалось 7 больных; 19 больным была наложена трахеостома с переводом их на аппаратное дыхание, длительность которого составляла от 3 до 40 суток. Через трахеостому систематически круглосуточно аспирируют слизь из трахеобронхиального дерева. Питание больных, находящихся на аппаратном дыхании, осуществляется через зонд. Помимо медикаментозного лече¬ния, применения кислорода, использования дыхательной гимнастики, в последние годы всем больным миастенией в послеоперационном периоде проводится лечебный массаж всего тела, повторяемый несколько раз в день.
Трахеостомическую трубку удаляют после того, как у больного стойко восстанавливается самостоятельное дыхание.
Среди наших больных мы наблюдали 3 (2 мужчин и 1 женщину, все старше 40 лет) с липотимомой. У них опухоль была небольших размеров, с ровными четкими границами; опухоль была расценена нами как доброкачественная. Заболевание сопровождалось умеренно выраженными явлениями миастении. Один из этих больных поступил с жалобами на слабость и быструю утомляемость; при дальнейшем обследовании у него была выявлена тяжелая гипопластическая анемия. Больной оперирован; в ближайшем послеоперационном периоде отмечены благоприятные результаты.
Из 15 наших больных с доброкачественными тимомами у 9 (4 мужчин и 5 женщин) были явления миастении, у остальных опухоль ничем себя не проявляла и была выявлена случайно.
Больной М., 19 лет, поступил 17.III.1966 года. Жалоб нет. После окончания средней школы при прохождении медицинского обследования для поступления в учебное заведение у него рентгенологически было выявлено опухолевое образование в переднем средостении. Признаков миастении нет. Пневмомедиастинография: в переднем средостении со всех сторон окутанное газом образование продолговатой формы размером 15*5 см, с участками просветления в центре; заключение: опухоль вилочковой железы, возможно, с участками распада. Произведена тимэктомия. Гистологически: злокачественная тимома ретинулоклеточного типа. Проведена послеоперационная рентгенотерапия. Осмотрен через 4 года после операции:, жалоб нет, состояние хорошее, признаков рецидива нет.
Дифференциальный диагноз доброкачественных и злокачественных тимом нередко бывает трудным. Злокачественная тимома по рентгенологическим признакам напоминает лимфогранулематоз и лимфосаркому. В отличие от этих образований тимома располагается непосредственно за грудиной, обычно бывает овально-сплющенной или конусовидной формы. Всякая тимома, протекает она с явлениями миастении или без них, подлежит удалению, В литературе имеются указания, что каждую тимому следует рассматривать как потенциально злокачественную опухоль (Б. В. Петровский; Seybold и соавт., и др.).
Вопрос о возможности изолированного поражения вилочковой железы лимфогранулематозом представляется спорным. Мы наблюдали 2 больных, у которых до операции был установлен диагноз “опухоль вилочковой железы”. После операции, при гистологическом исследовании препаратов, диагноз был изменен: изолированное поражение лимфогранулематозом вилочковой железы. Принимая во внимание указания о возможности изолированного поражения вилочковой железы на ранних стадиях заболевания (С. А. Гаджиев и В. В. Васильев), оба эти наблюдения мы отнесли к патологии вилочковой железы. После операции за больными ведётся наблюдение в течение 5 лет. Признаков рецидива и генерализации процесса нет.
Заболевание, заключающееся в сочетании патологии вилочковой желе¬зы и гипопластической анемии, которая возникает вследствие избирательного поражения костного мозга без изменения продукции лейкоцитов и тромбоцитов, впервые описано Кацнельсоном в 1922 году. Позже было предположено, что вилочковая железа влияет на гемопоэтическую функцию костного мозга, регуляцию состава белковых фракций, состояние лимфоидной системы и т. д. (Soutter и соавт.). С тех пор опубликованы данные некоторых авторов об отдельных операциях на вилочковой железе при различных болезнях крови (А. Н. Бакулев, 1958; Chaemers и Boheimer, и др.). К настоящему времени нами произведены 4 операции тимэктомии у больных гипопластической анемией. О результатах этих операций говорить пока рано, так как после них прошел небольшой срок. Ближайшие результаты удовлетворительные у 3 больных.
1) Бакулев А. Н., Колесникова Р. С. Хирургическое лечение опухолей и кист средостения. М., 1967.
2) Брайцев В. Р. Врожденные дизонтогенетические образования средостения и легких. М., 1960.
3) Гаджиев С. А., Догель Л. В., Ваневский В. Л. Диагностика и хирургическое лечение миастении. Л., 1971.
4) Гаджиев С. А., Васильев В. Мед газета, 1973, №15.
5) Кузин М. И. Клин мед, 1969, № 11, с. 6.
6) Кузин М. И., Успенский Л. В., Волков Б. П. Вести, хир., 1972, №7, с.48.
7) Осипов Б. К. Хирургические заболевания легких и средостения. М., 1961.
8) Петровский Б. В. Хирургия средостения. М., 1960.
9) Andгus W., Fооt N., J. thorac. Surg., 1937, v. 6. p. 648.
10) Chaemers G., Boheimer K., Brit. med. J., 1954, v.2, p.1514.
11) Pope R., О s g о о d R., Am. J. Path., 1953, v. 20, p. 85.
12) S е у b о 1 d W., D о n a 1 d М. С., J. thorac. Surg. Clagett C. et al., 1950, v. 20, p.195.
13) Soutter G., Sommers Sh. R e 1 m о n Ch. et al. Ann. Surg., 1957, v. 146, p. 426.
14) Viets H., Brit. med. J., 1950, v. 1, p.139.
| 1) Виктор Львович Маневич – профессор, доктор медицинских наук, 2-я кафедра клинической хирургии ЦОЛИУв. |  |
| 2) Василий Дмитриевич Стоногин – доцент 2-й кафедры хирургии ЦОЛИУв, заведующий учебной частью кафедры, кандидат медицинских наук. E-mail: svas70@mail.ru |  |
Любое копирование материала запрещено без письменного разрешения авторов и редактора.
Работа защищена Федеральным законом о защите авторских прав РФ.
Заболевания вилочковой железы
11.05.2011 Вилочковая железа или тимус является важным органом иммунной системы, который в детском возрасте отвечает за формирование первичного иммунитета. Он расположен сразу за грудиной в переднем отделе средостения (средостение — пространство в грудной полости, ограниченное легкими с двух сторон) и частично распространяется на шею. У взрослых в 20-25 лет функционирование вилочковой железы прекращается, и она постепенно превращается в жировую клетчатку.
В тимусе могут появляться опухоли, кисты, метастазы рака других органов, лимфомы. Тимомы — наиболее часто встречающиеся опухоли вилочковой железы. Они могут прорастать в окружающие ткани или нет. По гистологическому строению тимомы относят к опухолям с неопределенным поведением.
Часто пациенты не предъявляют никаких жалоб, и тимомы оказываются случайной находкой при КТ исследовании грудной клетки. У некоторых пациентов появляются ряд симптомов (см. новообразования средостения).
Однако особым свойством заболеваний вилочковой железы, выделяющих их среди других новообразований, являются так называемые «паратимические синдромы». К ним относятся гипогаммаглобулинемия, гипоплазия красного костного мозга, дерматомиозит, системная красная волчанка, апластическая анемия, ревматоидный артрит и другие аутоиммунные заболевания. Однако наиболее распространенным из них является неврологическое заболевание – аутоиммунная миастения, которая встречается более чем у 40% больных тимомами.
Миастения — заболевание, которое характеризуется аутоиммунным поражением нервно-мышечного соединения, приводящим к затруднению или к полной блокаде передачи сигнала от нерва к мышечному волокну. Оно проявляется слабостью и патологической утомляемостью различных групп скелетной мускулатуры. Вилочковая железа у больного миастенией вырабатывает аутоантитела, блокирующие ацетилхолиновые рецепторы и, тем самым, передачу сигнала о движении от нерва к мышце.
Миастенический криз (развивается у 10-15% больных) — крайняя степень миастении, характеризующаяся быстрым усугублением двигательных расстройств, приводящих к нарушению дыхания и глотания. Если в это время не оказать больному экстренную помощь, возникает реальная угроза для жизни.
Некоторые лекарственные препараты могут провоцировать обострение миастении. К ним относятся некоторые антибиотики, β-адреноблокаторы, ботулотоксин, антагонисты кальция, курареподобные миорелаксанты, соли магния, лидокаин, прокаинамид, хинин, хинидин, рентгеноконтрастные средства, D-пеницилламин, дифенин, гормоны щитовидной железы, а также глюкокортикоиды.
При подозрении на миастению необходима консультация невропатолога и госпитализация в специализированную клинику, владеющую всем комплексом диагностических (в том числе КТ и МРТ) и лечебных возможностей, включая хирургическое лечение — удаление вилочковой железы (тимэктомия).
Для лечения тимом используют хирургический метод. Часто операцию можно выполнить торакоскопически, однако при больших размерах новообразования (более 8 см) используют стернотомию. При прорастании опухоли в соседние ткани и органы лечение следует продолжить лучевой терапией.
Тимома
Тимома – гетерогенная группа новообразований, различных по гистогенезу и степени зрелости, берущих начало из эпителиальной ткани вилочковой железы. Варианты клинического течения тимомы могут быть различны: от бессимптомного до выраженного (компрессионный, болевой, миастенический, интоксикационный синдром). Топографо-анатомический и этиологический диагноз устанавливается с помощью лучевых методов (рентгенография, КТ средостения), трансторакальной пункции, медиастиноскопии, исследования биоптата. Лечение хирургическое: удаление тимомы вместе с вилочковой железой и жировой клетчаткой переднего средостения, дополненное по показаниям химиолучевой терапией.
Общие сведения
Тимома – органоспецифическая опухоль средостения, происходящая из клеточных элементов мозгового и коркового вещества тимуса. Термин «тимома» был введен в употребление в 1900 году исследователями Grandhomme и Scminke для обозначения различных опухолей вилочковой железы. Тимомы составляют 10-20% всех новообразований медиастинального пространства. В 65-70% случаев тимомы имеют доброкачественное течение; инвазивный рост с прорастанием плевры и перикарда отмечается у 30% пациентов, отдаленное метастазирование – у 5%. Несколько чаще тимомы развиваются у женщин, болеют преимущественно лица 40-60 лет. На детский возраст приходится менее 8% опухолей тимуса.
Причины формирования опухолей вилочковой железы неизвестны. Предполагается, что тимомы могут иметь эмбриональное происхождение, быть связаны с нарушением синтеза тимопоэтина или иммунного гомеостаза. Факторами, провоцирующими рост и развитие опухоли, могут служить инфекционные заболевания, радиационное воздействие, травмы средостения. Замечено, что тимомы часто сочетаются с различными эндокринными и аутоиммунными синдромами (миастенией, дерматомиозитом, СКВ, диффузным токсическим зобом, синдромом Иценко-Кушинга и др.).
Строение и функции вилочковой железы
Вилочковая железа, или тимус располагается в нижней части шеи и переднем отделе верхнего средостения. Орган образован двумя асимметричными долями – правой и левой. В свою очередь, каждая доля представлена множеством долек, состоящих из коркового и мозгового вещества и заключенных в соединительнотканную строму. В вилочковой железе различают два типа ткани – эпителиальную и лимфоидную. Эпителиальные клетки секретируют тимические гормоны (тимулин, a-, b-тимозины, тимопоэтины и пр.), лимфоидная ткань состоит из Т-лимфоцитов различной степени зрелости и функциональной активности.
Таким образом, вилочковая железа одновременно является железой внутренней секреции и органом иммунитета, обеспечивающим взаимодействие эндокринной и иммунной систем. После 20 лет тимус подвергается возрастной инволюции; после 50 лет паренхима тимуса на 90% замещается жировой и соединительной тканью, сохраняясь в виде отдельных островков, лежащих в клетчатке средостения.
Классификация тимом
В онкологии различают три типа тимом: доброкачественную, злокачественную тимому 1-го типа (с признаками атипии, но относительно доброкачественным течением) и злокачественную тимому 2-го типа (с инвазивным ростом).
В зависимости от удельного веса лимфоидного компонента в тимоме дифференцируют лимфоидные (более 2/3 всех клеток опухоли представлено Т-лимфоцитами), лимфоэпителиальные (Т-лимфоциты составляют от 2/3 до 1/3 клеток) и эпителиальные тимомы (Т-лимфоцитами представлено менее 1/3 всех клеток).
Основываясь на степени инвазивного роста, выделяют 4 стадии тимомы:
Симптомы тимомы
Клинические проявления и течение тимомы зависит от ее типа, гормональной активности, размеров. Более чем в половине случаев опухоль развивается латентно и обнаруживается во время профилактического рентгенологического исследования.
Инвазивные тимомы вызывают компрессионный медиастинальный синдром, который сопровождается болями за грудиной, сухим кашлем, одышкой. Сдавление трахеи и крупных бронхов проявляется стридором, цианозом, дыхательной недостаточностью. При синдроме компрессии верхней полой вены возникает одутловатость лица, синюшность верхней половины туловища, набухание шейных вен. Давление растущей опухоли на нервные узлы обусловливает развитие синдрома Горнера, осиплость голоса, элевацию купола диафрагмы. Сдавливание пищевода сопровождается расстройством глотания – дисфагией.
По различным данным, от 10 до 40% тимом сочетаются с миастеническим синдромом. Больные отмечают снижение мышечной силы, быструю утомляемость, слабость мимических мышц, двоение в глазах, поперхивание, нарушения голоса. В тяжелых случаях может развиться миастенический криз, требующий перехода к ИВЛ и зондовому питанию.
В поздних стадиях злокачественной тимомы появляются признаки раковой интоксикации: лихорадка, анорексия, снижение массы тела. Нередко тимоме сопутствуют различные гематологические и иммунодефицитные синдромы: апластическая анемия, тромбоцитопеническая пурпура, гипогаммаглобулинемия.
Диагностика
Диагностика тимомы проводится торакальными хирургами с привлечением онкологов, рентгенологов, эндокринологов, неврологов. При клиническом осмотре может выявляться расширение вен грудной клетки, выбухание грудины в проекции опухоли; увеличение шейных, надключичных, подключичных лимфоузлов; признаки компрессионного синдрома и миастении. Физикальное исследование обнаруживает расширение границ средостения, тахикардию, свистящие хрипы.
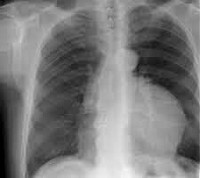
На рентгенограмме грудной клетки тимома имеет вид объемного образования неправильной формы, расположенного в переднем средостении. КТ грудной клетки значительно расширяет объем информации, полученный при первичной рентгендиагностике и в ряде случаев позволяет поставить морфологический диагноз. Уточнение локализации и взаимоотношения новообразования с соседними органами при КТ средостения позволяет в дальнейшем выполнить трансторакальную пункцию опухоли средостения, что чрезвычайно важно для гистологического подтверждения диагноза и верификации гистологического типа тимомы.
Для визуального исследования средостения и выполнения прямой биопсии проводится диагностическая медиастиноскопия, парастернальная торакотомия или торакоскопия. Диагноз миастении уточняется с помощью электромиографии с введением антихолинэстеразных препаратов. Дифференциально-диагностические мероприятия позволяют исключить другие объемные процессы в средостении: загрудинный зоб, дермоидные кисты и тератомы средостения.
Лечение тимом
Лечение опухолей вилочковой железы проводится в отделениях торакальной хирургии и онкологии. Хирургический метод является основным в лечении тимомы, поскольку только тимэктомия обеспечивает удовлетворительные отдаленные результаты. При доброкачественных тимомах оперативное вмешательство заключается в удалении опухоли вместе с вилочковой железой (тимомтимэктомия), жировой клетчаткой и лимфатическими узлами средостения. Такой объем резекции диктуется высоким риском рецидива опухоли и миастении. Операция выполняется из срединного стернотомического доступа.
При злокачественных новообразованиях тимуса операция может дополняться резекцией легкого, перикарда, магистральных сосудов, диафрагмального нерва. Послеоперационная лучевая терапия показана при II и III стадиях тимомы. Кроме этого, облучение является ведущим методом лечения неоперабельных злокачественных тимом IV стадии. В настоящее время большее значение в лечении инвазивных тимом получает трехэтапное лечение, включающее неоадъювантную химиотерапию, резекцию опухоли и лучевую терапию.
В послеоперационном периоде у больных, перенесших тимэктомию, может случиться миастенический криз, который требует проведения интенсивной терапии, трахеостомии, ИВЛ, длительного назначения антихолинэстеразных препаратов.
Отдаленные результаты лечения доброкачественных тимом хорошие. После удаления опухоли исчезают или значительно уменьшаются симптомы миастении. У больных злокачественной тимомой, прооперированных на ранних стадиях, 5-летняя выживаемость достигает 90%, на III стадии – 60-70%. Неоперабельные формы онкологического заболевания имеют плохой прогноз с летальностью 90% в течение ближайших 5 лет.