верифицированное заболевание что это
Морфологическая верификация опухолей
— Соскобы и мазки-отпечатки. Являются распространенным способом диагностики поверхностных изъязвленных опухолей.
— Открытая биопсия. Открытая биопсия опухоли выполняется, как правило, после неудачных попыток верифицировать диагноз вышеуказанными методами или из-за необходимости получить больше ткани для выполнения некоторых специфических исследований, например для определения рецепторов гормонов при опухолях молочной железы, иммуногистохимического исследования при гематосаркомах. Биопсия инцизионная предполагает получение участка ткани непосредственно из патологического очага, выполняется под местной анестезией (из опухоли молочной железы, мягких тканей) или под наркозом (из костных опухолей). Биопсия эксцизионная выполняется как хирургическое вмешательство с удалением опухоли в пределах здоровых тканей. Трепанобиопсия в основном используется для исследования новообразований молочной железы, костей, мягкотканных опухолей. При невозможности верифицировать злокачественность опухоли на диагностическом этапе планируют срочное гистологическое исследование во время операции.Эти способы обычно дают достаточно материала для морфологической верификации диагноза. Наиболее информативный материал получают из участков опухоли на границе со здоровой тканью.
— Трепан-биопсия. Гистологическая верификация может быть получена при использовании специальной иглы или трепана, при этом изымается столбик измененной ткани, пригодный для гистологического исследования. Особенно важным в плане адекватной диагностики распространенности опухолей бывает исследование сомнительных по клиническим данным образований в зонах регионарного метастазирования. В большинстве же случаев сопоставление клинических проявлений опухоли с ее симптомами вне основного очага не требует верификации всех обнаруженных метастазов. Производят морфологическое исследование наиболее доступных вторичных опухолей, что само по себе делает ясным представление об истинной распространенности заболевания. Верификация диагноза осуществляется путем чрезкожной пункции метастаза или забора материала при лапаро- или торакоскопии.
Верифицированное заболевание что это
Аутоиммунные заболевания: важность верификации диагноза, успехи грамотного подбора лечения
«Существует два направления, по которым может развиваться патология иммунной системы:
На сегодняшний день, несмотря на то, что для большинства аутоиммунных заболеваний ключевой триггерный причинный фактор не установлен, мы знаем, за счет каких именно звеньев иммунной системы реализуется механизм прогрессирования атаки иммунитета против собственного организма (патогенез). В основном в этом процессе задействован не отдельно взятый компонент иммунной системы, а группа таких компонентов, причем для каждой конкретной болезни (или хотя бы «подкласса» болезней) механизм может отличаться.
Этот аспект определяет исключительную значимость корректной верификации диагноза на максимально возможно раннем этапе. По крайней мере, необходимо понять, какой общий характер патогенеза лежит в основе совокупности симптомов пациента, и начать универсальное лечение, действующее на ключевые «точки» механизма заболевания.
Процесс подтверждения диагноза аутоиммунного заболевания в современных реалиях представляет собой оценку наличия у пациента комбинации клинических симптомов, лабораторных сдвигов (в том числе определение аутоиммунных антител различных типов), сопоставление их с данными морфологического исследования биопсийного материала (важнейший диагностический шаг при многих аутоиммунных клинических ситуациях) и с результатами проводимого пробного лечения, если таковое имело место. Далее происходит сопоставление этой комплексной информации с наборами диагностических критериев, которые разработаны экспертными сообществами практически для каждого заболевания, и если количество необходимых критериев набирается, это позволяет подтвердить (верифицировать) точный диагноз.
Верификация диагноза, в свою очередь, уже делает возможным применение терапии, которая воздействует прицельно на некорректно функционирующие звенья иммунной системы.
В последние десятилетия, благодаря успехам фармакологии в лечении аутоиммунных заболеваний, без лишнего преувеличения можно утверждать о прорыве, связанном с появлением так называемых биологических препаратов. В отличие от традиционных синтетических лекарственных средств, такие препараты представляют собой биологические субстанции (в основном – тоже антитела), целью которых становится «точечное» блокирование именно тех компонентов иммунитета, которые наиболее задействованы в механизме развития того или иного заболевания.
Тем самым, не происходит «выключения» сразу нескольких линий иммунной защиты и обеспечивается высокая эффективность лечения при значительно меньшей частоте специфических и неспецифических нежелательных явлений, хотя, безусловно, в виде нюансов они присутствуют и для таких лекарственных агентов. Стоит также отметить, что в настоящее время биологическая терапия с успехом используется и в онкологии, онкогематологии, аллергологии, кардиологии, и даже в лечении инфекционных заболеваний (здесь, собственно, следует упомянуть эффективные подходы к блокированию цитокинового шторма при тяжелом течении коронавирусной инфекции с помощью антител к – одному из основных медиаторов иммунитета, запускающему системное воспаление).
Резюмируя, следует сказать, что аутоиммунные заболевания остаются одной из самых сложных областей медицины внутренних болезней, и работа с ними требует от врача исключительного внимания к индивидуальности каждого пациента, тщательного анализа и синтеза диагностической концепции, применения принципов доказательной медицины и глубоких фактических знаний, постоянно обновляемых терапевтических подходов к лечению таких болезней».
Основные системные и «локализованные» аутоиммунные заболевания
Проблема верификации в доказательной медицине
Виноградов М.А. Московская медицинская академия имени И.М. Сеченова
Термин «медицина, основанная на доказательствах» или «доказательная медицина» (evidence based medicine) появился в лексиконе современных медицинских специалистов совсем недавно, однако за сравнительно небольшой период времени, основные принципы, вкладываемые в значение этого термина, составили доминирующую идеологию медицины XXI века. Возможно, это произошло потому, что современная клиническая медицина увидела в медицине «доказательной» возможный способ выхода из кризиса, в котором она находится с середины ХХ века. С помощью «доказательности» появилась возможность если не сделать медицину точной наукой, то по крайней мере, приблизить её к таковой.
Определение, данное в 1993 году Рабочей группой по доказательной медицине, звучит так: «Доказательная медицина – это раздел медицины, основанной на доказательствах, предполагающий поиск, сравнение и широкое распространение полученных доказательств для использования в интересах больных». Таким образом, доказательная медицина является новым подходом, к технологиям сбора, анализа, обобщения и трактовки медицинской информации. Внедрение принципов доказательной медицины в практику здравоохранения предусматривает оптимизацию качества медицинской помощи с точки зрения безопасности, эффективности, стоимости и др. В узком смысле, задача доказательной медицины, – преобразовать результаты научных исследований в конкретные клинические рекомендации для врачей.
Важным аспектом доказательной медицины стало установление степени достоверности и значимости, т.е. «доказательности» медицинской информации. Значимость любого медицинского исследования определяется рядом факторов, среди которых особое место принадлежит научному обоснованию этого исследования и возможности практического применения его результатов. По мнению ряда авторов, именно эти два фактора и составляют основу доказательной медицины [1].
Научная обоснованность медицинского исследования является мерой доверия к его результатам. Стандарты научной обоснованности включают строго определенные требования к проведению исследования, обработке его результатов и оценке достоверности. Необходимость создания единого подхода к оценке результатов медицинских исследований привела к выработке единых критериев научной обоснованности. На данный момент в литературе, посвященной доказательной медицине, можно встреть подробные алгоритмы оценки достоверности результатов клинических исследований [1]. Считается, что на основе этих результатов врач должен основывать свои клинические решения, пока в его распоряжение не поступят новые, более совершенные данные: «Какова бы ни была сила наиболее надежного из имеющихся фактов, врач должен брать его за основу для действий, будучи в то же время готовым к переоценке фактов» [Цит. по 1].
Можно утверждать, что доказательная медицина является логическим продолжением и этапом развития традиционной клинической медицины Запада, ориентированной на принципы позитивизма – философского направления ХХ века, оказавшего огромное влияние на современную науку.
Позитивизм ставит во главу угла тот постулат, что все подлинное, положительное («позитивное») знание о действительности может быть получено лишь в виде результатов отдельных специальных наук или их «синтетического» объединения. Согласно этому принципу, традиционная клиническая медицина обосновывала диагноз исходя из совокупности проанализированных данных, полученных различными дополнительными методами, заимствованными из различных отраслей науки – физическими, химическими, биологическими и т.д. С развитием современных технологий медицинской визуализации, физико-химического анализа, на второй план отошел собственно сам сбор анамнеза, который по сути своей, стал формальностью.
Антитеоретическая направленность позитивизма привела к появлению устойчивого мнения о том, что «настоящая» наука может опираться только на факты, а теория должна служить лишь для систематизации и классификации этих фактов. Отсюда убеждение, что на основании методов клинического наблюдения можно сделать лишь отдельные умозаключения о фактах, но не обобщенные гипотезы. Недостаток теоретических обоснований традиционной медицины привел к появлению многочисленных бесполезных и даже противоречащих принципам логики классификаций, а следование методологическим традициям позитивизма привело к явлениям классического атомизма, ассоциационизма, механицизма и крайнего эмпиризма в медицине. В качестве примера можно привести классические учебники, в которых патология базируется на разделении её на элементы (атомизм), существующие отдельно или соединенные друг с другом по принципу ассоциации (ассоциационизм). Для воплощения идеи, требующей исходить из данного в опыте, применяется метод клинического наблюдения, который должен стать непосредственной проверкой отдельных суждений («атомов» знания) путем сравнения с элементарными единицами опыта (эмпиризм) [6].
Накопление больших массивов данных в результате многочисленных клинических исследований привело к избытку частной информации, находящейся в «теоретическом» вакууме. Можно сказать, что клиническая медицина стала проявлять типичные симптомы ненаучности: избыток фактов и недостаток теории. Ведь суть науки в систематической интеграции данных, а не только в регистрации фактов. Потребность в объяснении накопленных данных вызвала усилия, направленные на создание небольших теорий на очень низком уровне обобщения. Эти отрывочные теоретические концепции малоприменимы даже при интерпретации даже узкой проблематики, так как ведут не к согласованности фактов, а скорее к росту числа новых концепций [6].
Попытки создания серьезных научных теорий с высоким уровнем обобщений явили ещё одну проблему – отбор эмпирических фактов, подтверждающих данную теорию. Следует отметить, что массив накопленных медициной теоретических фактов весьма неоднороден. Он включает исследования как правильно спланированные и выполненные с соблюдением всех требований в строго контролируемых условиях, так и работы, в которых требования к планированию и проведению строго не соблюдались. Тем не менее, оба вида исследований представляют собой научные факты. Для того, чтобы теория имела все признаки «доказательности», факты, отобранные для её подтверждения должны выдержать строгую проверку (верификацию с позиций доказательной медицины) на предмет научной обоснованности. Считается, что только массив эмпирических данных, единых по своим характеристикам (требования к проведению исследований, оценке результатов и достоверности) может стать научной базой для выдвижения той или иной теории. Именно принцип верификации философии позитивизма взяла на вооружение доказательная медицина, правда, придав ему несколько другое значение. Этот принцип в доказательной медицине четко не сформулирован, но рекомендации для определения «доказательности» научных исследований, предлагаемые экспертами доказательной медицины, являются ни чем иным, как верификацией.
Интересно, что впервые критерии верификации для определения роли инфекционного агента как причины болезни были четко сформулированы Робертом Кохом в 1882 году, т.е. до появления собственно философии позитивизма. Выдвинутая им гипотеза о том, что каждая болезнь имеет одну причину, а конкретная причина вызывает одну болезнь, подтверждалась следующими «протокольными постулатами»:
Данный подход способствовал существенному развитию понятия причины в медицине. Постулат о том, что конкретный микроорганизм является причиной заболевания, послужил основой для многих открытий. Однако, для установления большинства болезней недостаточно одних постулатов Коха. Особенно при верификации гипотез заболеваний с множественными, неинфекционными факторами риска.
Формулирование гипотезы предшествует началу любого исследования. Формирование массива данных, служащих для её подтверждения, происходит по следующему примерному алгоритму верификации:
На каждом из этих этапов имеется ряд факторов, оказывающих влияние на ход верификации, и в конечном итоге способных вызвать искажение результатов. Например, на этапе поиска информации могут быть найдены не все значимые источники по интересующей теме из-за плохого индексирования или нежелания фирм-спонсоров публиковать отрицательные результаты клинических испытаний. Сложности корректной трактовки, связанные с различиями в подходах, стандартах и способах оценки также могут оказывать влияние на результат.
Но возможно, что именно в виде подобного алгоритма, доказательная медицина представляет себе логико-методологический анализ медицинского знания, цель которого – формирование базы эмпирических данных в виде фактов науки, представленных языком, не допускающим двусмысленности.
Подводя итоги, можно сделать заключение, что принцип верификации в доказательной медицине является мощным инструментом установления научной значимости выдвигаемых гипотез. Однако, при его использовании необходимо учитывать, те недостатки, которые обозначили критики позитивизма. В ряде случаев, например, при оценке факторов с окончательно не установленным значением, принцип верификации может стать основополагающим в создании научных теорий.
Литература
Верифицированное заболевание что это
Злокачественные новообразования яичников эпителиального происхождения в настоящее время остаются одной из фатальных нозологических форм онкологического профиля у женского населения не только в нашей стране, но и во всем мире. Среди онкологической патологии женщин в России удельный вес этой патологии приближается к 5 %. Показатель заболеваемости, рассчитанный на 100 000 женщин, в 1990 году равнялся 9,2, а в 2005 году уже достиг 10,7. Общее увеличение за представленный период составило 5,1 %, в том числе это связано и с изменением численности и возраста женского населения и с возросшим риском заболеть [1]. Известен факт, что на момент обращения женщины за специализированной помощью в большинстве случаев диагностируются поздние стадии заболевания. Эта нозологическая форма считается распространенной уже на Iс стадии, а после проведённого лечения по стандартной схеме часто подвергается прогрессии. Все вышеизложенное ухудшает прогноз этого заболевания. Известно, что метастазирование злокачественной опухоли активно влияет на картину клинического течения, выбор метода лечения и исход заболевания [3, 6]. Большинство авторов сегодня признают особую роль стадии заболевания по FIGO в прогнозе рака яичников. Например, ранний рак женских гонад на стадиях Ia и II характеризуется хорошим прогнозом, а выживаемость больных приближается к 90 %. Однако практические онкологи в большинстве случаев сталкиваются с проблемой адекватного стадирования заболевания, даже после проведенной операции. Это в первую очередь связано с невозможностью диагностировать микрометастазы на макроскопическом уровне [7]. Среди патогистологических критериев низкодифференцированные новообразования и светлоклеточный гистологический вариант карциномы рассматриваются в качестве неблагоприятных прогностических факторов у больных [8]. И здесь имеются объективные трудности с гистологической верификацией неоплазмы. Связано это с многообразием микроскопических вариантов рака яичников, а зачастую и сочетанием опухолевых структур разного гистогенеза в пределах одного опухолевого узла.
Цель исследования. С учетом актуальности обозначенной научно-практической проблемы наше исследование направлено на поиск критериев, определяющих течение рака яичников, для совершенствования хирургического лечения и активизацию разработки новых лекарственных форм и их комбинаций, изучения эффектов при таргетной терапии.
Материал и методы исследования
В качестве материала мы использовали клинические истории болезни, операционные журналы, амбулаторные карты и сведения об отдалённых результатах наблюдения за больными раком яичников от 103 пациенток, первично леченных в БУ «Республиканский клинический онкологический диспансер» МЗ и СО Чувашской республики в период с 2000 по 2010 год. Для микроскопической диагностики получали образцы опухолевой ткани. Гистологические срезы окрашивались пикрофуксином и гематоксилин-эозином. В соответствии с рекомендациями ВОЗ верифицировался гистологический тип рака яичников [5]. Степень тканевой зрелости (дифференцировки) овариальной карциномы диагностироваласть по рекомендациям A.С. Broders. Проводилась морфометрия опухолевых клеток и определялось стромально-паренхиматозное взаимоотношение в раковом узле. Цифровые результаты, полученные в ходе научной работы, подвергались статистической обработке. При определении значимости между переменными в двух группах использовали Манна – Уитни, между тремя группами и более – Крускала – Уоллиса. Силу корреляционной связи между параметрами определяли ранговой корреляцией Спирмена.
Результаты исследования и их обсуждение
В процессе морфометрического исследования было выявлено, что рак яичников различных гистологических типов имеет характерные, свойственные только этому типу цито-кариометрические параметры (р
Чем отличается доброкачественная опухоль от злокачественной
В медицине понятие доброкачественности означает лёгкое течение болезни, хорошие результаты лечения и неопасность для жизни. Под злокачественным процессом подразумевают разрушительное течение, сложность терапии, высокий риск смертности.
Для опухолей такое разделение условно. Тем не менее пациентам и врачам крайне важно определить вид опухоли. От этого зависят тактика лечения и прогноз.
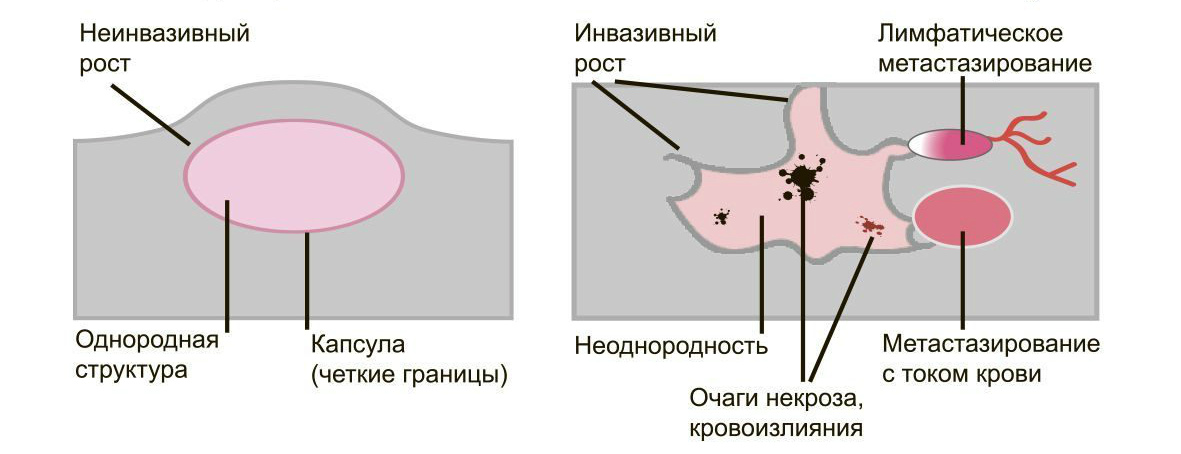
Характеристика доброкачественных и злокачественных опухолей
Существуют чёткие критерии:
Доброкачественные опухоли чётко отграничены от здоровых тканей, часто имеют капсулу. Рак прорастает окружающие ткани, внедряется в сосуды, его контуры более аморфны.
Большинство доброкачественных опухолей могут расти годами, не проявляя симптомов. Карциномы растут быстро, нарушая функции органов и отравляя организм. Рост сопровождается утомляемостью, слабостью, потерей веса, болью.
Доброкачественные образования “сидят” на одном месте, постепенно растут и раздвигают здоровые ткани, подвижны при прощупывании. Раковые клетки слабо скреплены друг с другом, легко отделяются и разносятся лимфой и кровью по организму. Они оседают в лимфоузлах, костях, внутренних органах, образуя новые опухолевые очаги — метастазы. При пальпации узел спаян с тканями и не сдвигается.
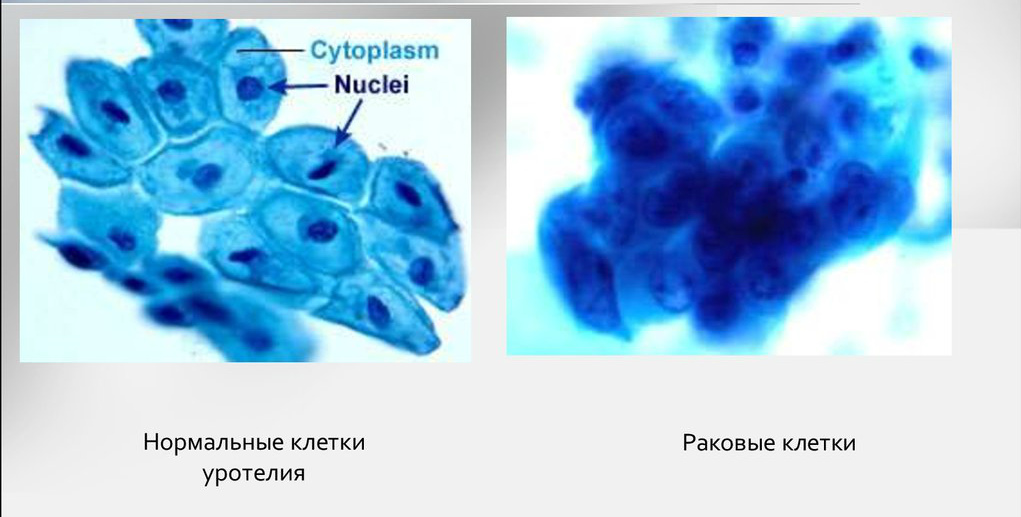
Много информации даёт биопсия. Исследование показывает, что доброкачественные клетки похожи на здоровые, их структура более чёткая. Структура злокачественных клеток сильно изменена из-за выраженных мутаций. Чем меньше клетки напоминают ткань, из которой выросли, тем хуже прогноз для лечения и жизни.
Доброкачественную опухоль, такую как аденома простаты, можно удалить и добиться полного излечения. Если возникнет рецидив, он будет на том же месте, где нашли первичный очаг. Злокачественные образования трудно удалить полностью. Даже одна оставшаяся клетка даст новую опухоль либо на старом месте, либо там, куда она попала по сосудам. Выживаемость больных существенно ниже.
Общие свойства доброкачественных и злокачественных опухолей
Есть моменты, объединяющие оба вида новообразований:
Тяжесть симптомов зависит не только от степени сдавления тканей опухолью, но и от неспособности новообразования выполнять функцию здоровых клеток.
Виды опухолей
Различия не всегда очевидны. Нужна тщательная диагностика для поиска атипичных клеток.
Может ли доброкачественная опухоль стать злокачественной
Любая опухоль способна к малигнизации. Миомы, липомы, фибромы редко переходят в рак. Кисты — крайне редко. Невусы, аденомы, полипы в желудке или кишечнике — очень часто. Многое зависит от условий, в которых находится опухоль, питания, экологии, уровня стресса, гормональных сбоев, наличия предраковых болезней.
В Клинике урологии имени Р. М. Фронштейна доступна современная диагностика опухолей, разработаны эффективные методики лечения. Обращайтесь на консультацию и наши специалисты вам помогут.