вектор вируса что это
Вектор вируса что это
Идеальный вектор для генотерапии должен быть безопасным, легко изготавливаемым, легко вносимым в подходящую целевую ткань, при этом он должен экспрессировать нужный ген пожизненно. В настоящее время нет ни одного известного вирусного или невирусного вектора, удовлетворяющего всем этим критериям.
На самом деле, вероятно, нет единственного вектора, удовлетворительного во всех отношениях для всех типов генотерапии, и потребуется набор векторов. Здесь мы кратко рассмотрим три широко используемых класса вирусных векторов, производных от ретровирусов, аденовирусов и адено-ассоциированных вирусов. Основное преимущество вирусных векторов — то, что они способны проникнуть фактически в каждую клетку в целевой популяции.
Один из наиболее широко используемых классов векторов — производные от ретровирусов, простых РНК-вирусов всего с тремя структурными генами, которые могут быть удалены и заменены нужным геном. Текущее поколение ретровирусных векторов создано так, чтобы лишить их способности к репликации.
Другие их достоинства: нетоксичны в клетке; в геном хозяина внедряется (с передаваемым геном) только небольшое количество копий вирусной ДНК; встроенная ДНК стабильна; ретровирусные векторы могут встраивать вплоть до 8 килобаз дополнительной ДНК, что достаточно для многих передаваемых генов.
Основное ограничение большинства ретровирусных векторов в том, что для интеграции вируса в ДНК хозяина целевая клетка должна делиться, а это ограничивает использование таких векторов для неделящихся клеток, например нейронов. Тем не менее ретровирусы одного класса — лентивирусы, включающие ВИЧ, способны встраивать свою ДНК во множество медленно делящихся и даже неделящихся клеток, включая нейроны. Эти векторы могут оказаться пригодными для лечения неврологических заболеваний.
Адено-ассоциированные вирусы имеют большое преимущество — они не имеют никаких неблагоприятных эффектов у больных и широко распространены в популяциях человека. Кроме того, они заражают как делящиеся, так и неделящиеся клетки и могут существовать в виде эписом или стабильно интегрироваться в хромосому хозяина.
Их основной недостаток состоит в том, что имеющиеся на настоящий момент адено-ассоциированные вирусные векторы могут встраивать не более 5 килобаз дополнительной ДНК.
Аденовирусные векторы имеют свои преимущества — их можно получать в высоком титре; они заражают множество типов клеток, как делящихся, так и неделящихся; они могут встраивать в себя от 30 до 35 килобаз ДНК. Тем не менее, помимо других ограничений, их применение недавно было связано по крайней мере с одной смертью при испытании генотерапии вследствие развития сильной иммунной реакции. Следовательно, возможность их использования в целях генотерапии в настоящее время тщательно проверяется.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Генная терапия против рака
иллюстрация автора статьи
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Благодаря стремительному развитию медицины создаются инновационные техники, лекарства, оборудование, направленные на лечение сложных заболеваний, таких как рак. В последнее время большое внимание уделяется генной терапии как перспективному методу лечения онкозаболеваний, который в будущем станет особо важным инструментом для предотвращения и снижения смертности от рака. В данной статье кратко рассматриваются пути развития болезни, а также применение инновационных техник генной терапии в онкологии.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучший обзор».
Главный спонсор конкурса — дальновидная компания «Генотек».
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Смертельные клешни
Человечество столкнулось с этой загадочной болезнью еще до нашей эры. Ее пытались понять и лечить ученые мужи в самых различных уголках мира: в Древнем Египте — Еберс, в Индии — Сушрута, Греции — Гиппократ. Все они и многие другие медики вели борьбу с опасным и серьезным противником — раком. И хоть эта битва продолжается до сих пор, сложно определить, есть ли шансы на полную и окончательную победу. Ведь чем больше мы изучаем болезнь, тем чаще возникают вопросы — можно ли полностью излечить рак? Как избежать болезни? Можно ли сделать лечение быстрым, доступным и недорогим?
Благодаря Гиппократу и его наблюдательности (именно он увидел сходство опухоли и щупалец рака) в древних врачебных трактатах появился термин «карцинома» (грец. carcinos), или «рак» (лат. cancer). В медицинской практике по-разному классифицируют злокачественные новообразования: карциномы (из эпителиальных тканей), саркомы (из соединительной, мышечной тканей), лейкемия (в крови и костном мозге), лимфомы (в лимфатической системе) и другие (развиваются в других типах клеток, например, глиома — рак головного мозга). Но в быту более популярен термин «рак», который подразумевает любую злокачественную опухоль.
Мутации: погибнуть или жить вечно?
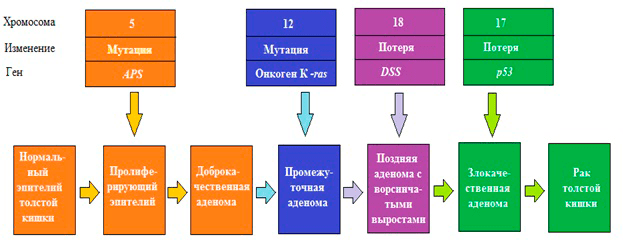
Многочисленные генетические исследования выявили, что возникновение раковых клеток — это результат генетических изменений. Ошибки в репликации (копировании) и репарации (исправлении ошибок) ДНК приводят к изменению генов, в том числе и контролирующих деление клетки. Основными факторами, которые способствуют повреждению генома, а в дальнейшем — приобретению мутаций, — являются эндогенные (атака свободных радикалов, образующихся в процессе обмена веществ, химическая нестабильность некоторых оснований ДНК) и экзогенные (ионизирующее и УФ-излучение, химические канцерогены). Когда мутации закрепляются в геноме, они способствуют трансформации нормальных клеток в раковые. Такие мутации в основном случаются в протоонкогенах, которые в норме стимулируют деление клетки. В результате может получиться постоянно «включенный» ген, и митоз (деление) не прекращается, что, фактически, означает злокачественное перерождение. Если же инактивирующие мутации происходят в генах, которые в норме ингибируют пролиферацию (гены-супрессоры опухолей), контроль над делением утрачивается, и клетка становится «бессмертной» (рис. 1).
Рисунок 1. Генетическая модель рака: рак толстой кишки. Первый шаг — потеря или инактивация двух аллелей гена АРS на пятой хромосоме. В случае семейного рака (familiar adenomatous polyposis, FAP) одна мутация гена АРС наследуется. Потеря обоих аллелей ведет к образованию доброкачественных аденом. Последующие мутации генов на 12, 17, 18 хромосомах доброкачественной аденомы могут привести к трансформации в злокачественную опухоль.
Очевидно, что развитие определенных видов рака включают в себя изменение большинства или даже всех этих генов и может проходить различными путями. Из этого следует, что каждую опухоль следует рассматривать как биологически уникальный объект. На сегодняшний день существуют специальные генетические информационные базы по раку, содержащих данные о 1,2 млн. мутаций из 8207 образцов тканей, относящихся к 20 видам опухолей: атлас Ракового Генома (Cancer Genome Atlas) и каталог соматических мутаций при раке (Catalogue of Somatic Mutations in Cancer, COSMIC) [2].
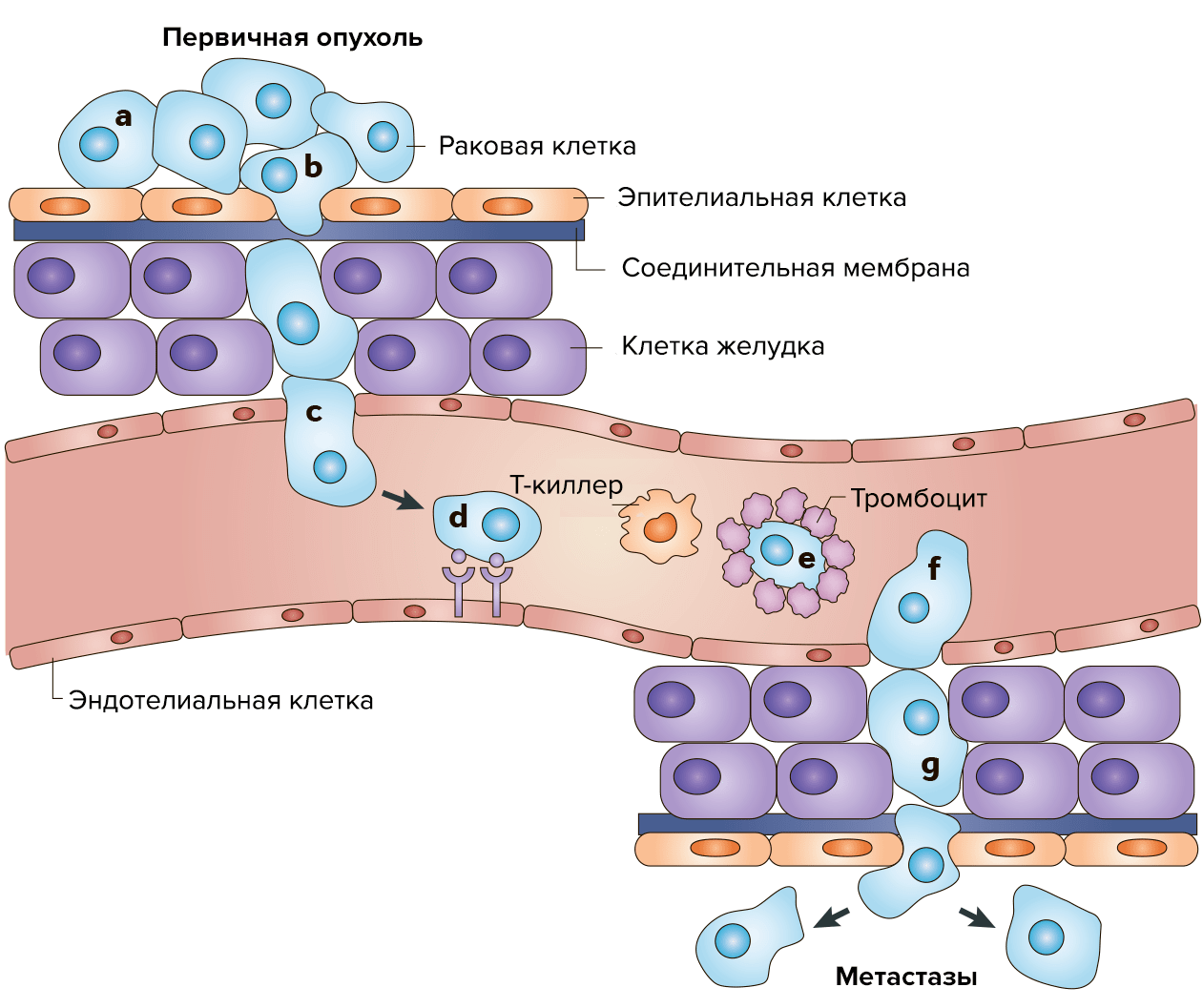
Результатом сбоя работы генов становится неконтролируемое деление клеток, а на последующих стадиях — метастазирование в различные органы и части тела по кровеносным и лимфатическим сосудам. Это достаточно сложный и активный процесс, который состоит из нескольких этапов. Отдельные раковые клетки отделяются от первичного очага и разносятся с кровью по организму. Затем с помощью специальных рецепторов они прикрепляются к эндотелиальным клеткам и экспрессируют протеиназы, которые расщепляют белки матрикса и образуют поры в базальной мембране. Разрушив внеклеточный матрикс, раковые клетки мигрируют вглубь здоровой ткани. За счет аутокринной стимуляции они делятся, образуя узел (1–2 мм в диаметре). При недостатке питания часть клеток в узле погибает, и такие «дремлющие» микрометастазы могут достаточно долго оставаться в тканях органа в латентном состоянии. В благоприятных условиях узел разрастается, в клетках активируются ген фактора роста эндотелия сосудов (VEGF) и фактора роста фибробластов (FGFb), а также инициируются ангиогенез (формирование кровеносных сосудов) (рис. 2).
Рисунок 2. Распространение метастазов
Однако клетки вооружены специальными механизмами, защищающими от развития опухолей:
Традиционные методы и их недостатки
Если системы защиты организма не справились, и опухоль все-таки начала развиваться, спасти может только вмешательство медиков. На протяжении длительного периода врачами используются три основные «классические» терапии:
Вышеописанные подходы не всегда могут избавить больного от рака. Часто при хирургическом лечении остаются единичные раковые клетки, и опухоль может дать рецидив, а при химиотерапии и лучевой терапии возникают побочные эффекты (снижение иммунитета, анемия, выпадение волос и др.), которые приводят к серьезным последствиям, а часто и к смерти пациента. Тем не менее, с каждым годом улучшаются традиционные и появляются новые методы лечения, которые могут победить рак, такие как биологическая терапия, гормональная терапия, использование стволовых клеток, трансплантация костного мозга, а также различные поддерживающие терапии. Наиболее перспективной считается генная терапия, так как она направлена на первопричину рака — компенсацию неправильной работы определенных генов.
Генная терапия как перспектива
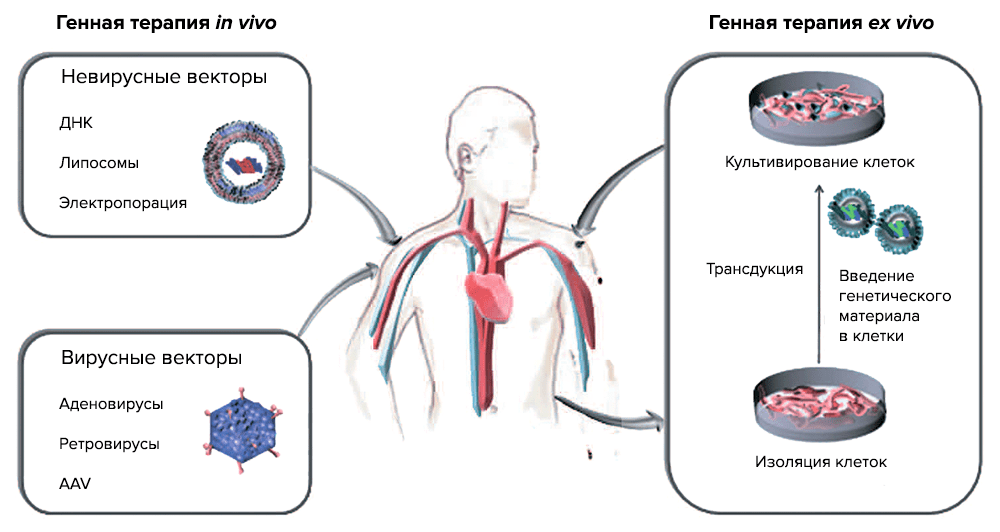
По данным PubMed, интерес к генной терапии (ГТ) раковых заболеваний стремительно растет, и на сегодняшний день ГТ объединяет ряд методик, которые оперируют с раковыми клетками и в организме (in vivo) и вне его (ex vivo) (рис. 3).
Рисунок 3. Две основные стратегии генной терапии. ex vivo — генетический материал с помощью векторов переносится в клетки, выращиваемые в культуре (трансдукция), а затем трансгенные клетки вводят реципиенту; in vivo — введение вектора с нужным геном в определенную ткань или орган.
Генная терапии іn vivo подразумевает перенос генов — введение генетических конструкций в раковые клетки или в ткани, которые окружают опухоль [9]. Генная терапия ex vivo состоит из выделения раковых клеток из пациента, встраивания терапевтического «здорового» гена в раковый геном и введения трансдуцированных клеток обратно в организм пациента. Для таких целей используются специальные векторы, созданные методами генной инженерии. Как правило, это вирусы, которые выявляют и уничтожают раковые клетки, при этом оставаясь безвредными для здоровых тканей организма, или невирусные векторы.
Вирусные векторы
В качестве вирусных векторов используют ретровирусы, аденовирусы, аденоассоциированные вирусы, лентивирусы, вирусы герпеса и другие. Эти вирусы отличаются по эффективности трансдукции, по взаимодействию с клетками (распознавание и заражение) и ДНК. Главным критерием является безопасность и отсутствие риска неконтролируемого распространения вирусной ДНК: если гены вставляются в неправильном месте генома человека, они могут создать вредные мутации и инициировать развитие опухоли. Также важно учитывать уровень экспрессии перенесенных генов, чтобы предотвратить воспалительные или иммунные реакции организма при гиперсинтезе целевых белков (табл. 1).
| Вектор | Краткое описание |
|---|---|
| Вирус кори (measles virus) | содержит отрицательную последовательность РНК, которая не вызывает защитного ответа в раковых клетках |
| Вирус простого герпеса (HSV-1) | может переносить длинные последовательности трансгенов |
| Лентивирус | производный от ВИЧ, может интегрировать гены в неделящиеся клетки |
| Ретровирус (RCR) | не способный к самостоятельной репликации, обеспечивает эффективное встраивание чужеродной ДНК в геном и постоянство генетических изменений |
| Обезьяний пенистый вирус (SFV) | новый РНК-вектор, который передает трансген в опухоль и стимулирует его экспрессию |
| Рекомбинантный аденовирус (rAdv) | обеспечивает эффективную трансфекцию, но возможна сильная иммунная реакция |
| Рекомбинантный аденоассоциированный вирус (rAAV) | способен к трансфекции многих типов клеток |
Невирусные векторы
Для переноса трансгенных ДНК также применяют невирусные векторы. Полимерные переносчики лекарственных средств — конструкции из наночастиц — используются для доставки препаратов с низкой молекулярной массой, например, олигонуклеотидов, пептидов, миРНК. Благодаря небольшим размерам, наночастицы поглощаются клетками и могут проникать в капилляры, что очень удобно для доставки «лечебных» молекул в самые труднодоступные места в организме. Данная техника часто используется для ингибирования ангиогенеза опухоли. Но существует риск накопления частиц в других органах, например, костном мозге, что может привести к непредсказуемым последствиям [11]. Самыми популярными невирусными методами доставки ДНК являются липосомы и электропорация.
Синтетические катионные липосомы в настоящее время признаны перспективным способом доставки функциональных генов. Положительный заряд на поверхности частиц обеспечивает слияние с отрицательно заряженными клеточными мембранами. Катионные липосомы нейтрализуют отрицательный заряд цепи ДНК, делают более компактной ее пространственную структуру и способствуют эффективной конденсации. Плазмидно-липосомный комплекс имеет ряд важных достоинств: могут вмещать генетические конструкции практически неограниченных размеров, отсутствует риск репликации или рекомбинации, практически не вызывает иммунного ответа в организме хозяина. Недостаток этой системы состоит в низкой продолжительности терапевтического эффекта, а при повторном введении могут появляться побочные эффекты [12].
Электропорация является популярным методом невирусной доставки ДНК, довольно простым и не вызывающим иммунного ответа. С помощью индуцированных электрических импульсов на поверхности клеток образуются поры, и плазмидные ДНК легко проникают во внутриклеточное пространство [13]. Генная терапия іn vivo с использованием электропорации доказала свою эффективность в ряде экспериментов на мышиных опухолях. При этом можно переносить любые гены, например, гены цитокинов (IL-12) и цитотоксические гены (TRAIL), что способствует развитию широкого спектра терапевтических стратегий. Кроме того, этот подход может быть эффективным для лечения и метастатических, и первичных опухолей [14].
Выбор техники
В зависимости от типа опухоли и ее прогрессии, для пациента подбирается наиболее эффективная методика лечения. На сегодняшний день разработаны новые перспективные техники генной терапии против рака, среди которых онколитическая вирусная ГТ, пролекарственная ГТ (prodrug therapy), иммунотерапия, ГТ с использованием стволовых клеток.
Онколитическая вирусная генная терапия
Для этой методики используются вирусы, которые с помощью специальных генетических манипуляций становятся онколитическими — перестают размножаться в здоровых клетках и воздействуют только на опухолевые. Хорошим примером такой терапии является ONYX-015 — модифицированный аденовирус, который не экспрессирует белок Е1В. При отсутствии этого белка вирус не может реплицироваться в клетках с нормальным геном p53 [15]. Два вектора, сконструированных на базе вируса простого герпеса (HSV-1) — G207 и NV1020 — также несут в себе мутации нескольких генов, чтобы реплицироваться только в раковых клетках [16]. Большим преимуществом техники является то, что при проведении внутривенных инъекций онколитические вирусы разносятся с кровью по всему организму и могут бороться с метастазами. Основные проблемы, которые возникают при работе с вирусами — это возможный риск возникновения иммунного ответа в организме реципиента, а также неконтролируемое встраивание генетических конструкций в геном здоровых клеток, и, как следствие, возникновение раковой опухоли.
Геноопосредованная ферментативная пролекарственная терапия
Базируется на введении в опухолевую ткань «суицидных» генов, в результате работы которых раковые клетки погибают. Данные трансгены кодируют ферменты, активирующие внутриклеточные цитостатики, ФНО-рецепторы и другие важные компоненты для активации апоптоза. Суицидная комбинация генов пролекарства в идеале должна соответствовать следующим требованиям [17]: контролируемая экспрессия гена; правильное превращение выбранного пролекарства в активное противораковое средство; полная активация пролекарства без дополнительных эндогенных ферментов.
Минус терапии состоит в том, что в опухолях присутствуют все защитные механизмы, свойственные здоровым клеткам, и они постепенно адаптируются к повреждающим факторам и пролекарству. Процессу адаптации способствует экспрессия цитокинов (аутокринная регуляция), факторов регуляции клеточного цикла (отбор самых стойких раковых клонов), MDR-гена (отвечает за восприимчивость к некоторым медикаментам).
Иммунотерапия
Благодаря генной терапии, в последнее время начала активно развиваться иммунотерапия — новый подход для лечения рака с помощью противоопухолевых вакцин. Основная стратегия метода — активная иммунизация организма против раковых антигенов (ТАА) с помощью технологии переноса генов [18].
Главным отличием рекомбинантных вакцин от других препаратов является то, что они помогают иммунной системе пациента распознавать раковые клетки и уничтожать их. На первом этапе раковые клетки получают из организма реципиента (аутологичные клетки) или из специальных клеточных линий (аллогенные клетки), а затем выращивают их в пробирке. Для того чтобы эти клетки могли узнаваться иммунной системой, вводят один или несколько генов, которые производят иммуностимулирующие молекулы (цитокины) или белки с повышенным количеством антигенов. После этих модификаций клетки продолжают культивировать, затем проводят лизис и получают готовую вакцину.
Широкое разнообразие вирусных и невирусных векторов для трансгенов позволяет экспериментировать над различными типами иммунных клеток (например, цитотоксическими Т-клетками и дендритными клетками) для ингибирования иммунного ответа и регрессии раковых клеток. В 1990-х годах было высказано предположение, что опухолевые инфильтрирующие лимфоциты (TIL) являются источником цитотоксических Т-лимфоцитов (CTL) и естественных киллеров (NK) для раковых клеток [19]. Так как TIL можно легко манипулировать ex vivo, они стали первыми генетически модифицированными иммунными клетками, которые были применены для противораковой иммунотерапии [20]. В Т-клетках, изъятых из крови онкобольного, изменяют гены, которые отвечают за экспрессию рецепторов для раковых антигенов. Также можно добавлять гены для большей выживаемости и эффективного проникновения модифицированных Т-клеток в опухоль. С помощью таких манипуляций создаются высокоактивные «убийцы» раковых клеток [21].
Когда было доказано, что большинство видов рака имеют специфические антигены и способны индуцировать свои защитные механизмы [22], была выдвинута гипотеза, что блокировка иммунной системы раковых клеток облегчит отторжение опухоли. Поэтому для производства большинства противоопухолевых вакцин в качестве источника антигенов используют опухолевые клетки пациента или специальные аллогенные клетки. Основные проблемы иммунотерапии опухолей — вероятность возникновения аутоиммунных реакций в организме больного, отсутствие противоопухолевого ответа, иммуностимуляция роста опухоли и другие.
Стволовые клетки
Мощным инструментом генной терапии является использование стволовых клеток в качестве векторов для передачи терапевтических агентов — иммуностимулирующих цитокинов, «суицидных» генов, наночастиц и антиангиогенных белков [23]. Стволовые клетки (СК), кроме способности к самообновлению и дифференцировке, имеют огромное преимущество по сравнению с другими транспортными системами (нанополимерами, вирусами): активация пролекарства происходит непосредственно в опухолевых тканях, что позволяет избежать системной токсичности (экспрессия трансгенов способствует разрушению только раковых клеток). Дополнительным позитивным качеством является «привилегированное» состояние аутологичных СК — использованные собственных клеток гарантирует 100%-совместимость и повышает уровень безопасности процедуры [24]. Но все же эффективность терапии зависит от правильной ex vivo передачи модифицированного гена в СК и последующего переноса трансдуцированных клеток в организм пациента. Кроме того, прежде чем применять терапию в широких масштабах, нужно детально изучить все возможные пути трансформации СК в раковые клетки и разработать меры безопасности для предупреждения канцерогенного преобразования СК.
Заключение
Если подвести итоги, можно с уверенностью говорить, что наступает эпоха персонализированной медицины, когда для лечения каждого онкобольного будет подбираться определенная эффективная терапия. Уже разрабатываются индивидуальные программы лечения, которые обеспечивают своевременный и правильный уход и приводят к значительному улучшению состояния пациентов. Эволюционные подходы для персонализированной онкологии, такие как геномный анализ, производство таргетных препаратов, генная терапия рака и молекулярная диагностика с использованием биомаркеров уже приносят свои плоды [17].
Особенно перспективным методом лечения онкозаболеваний является генная терапия. На данный момент активно проводятся клинические испытания, которые часто подтверждают эффективность ГТ в тех случаях, когда стандартное противораковое лечение — хирургия, лучевая терапия и химиотерапия — не помогает. Развитие инновационных методик ГТ (иммунотерапии, онколитической виротерапии, «суицидной» терапии и др.) сможет решить проблему высокой смертности от рака, и, возможно, в будущем диагноз «рак» не будет звучать приговором.
Видео. Рак: узнать, предупредить и устранить болезнь
Вирусные векторы для доставки генетического материала в клетку и их использование в нейробиологии (обзор)
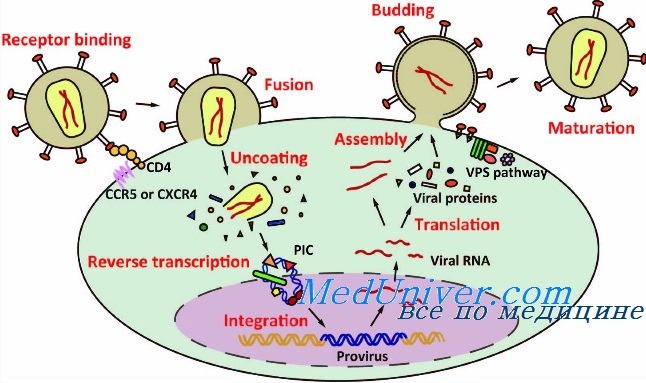
В настоящее время вирусные векторы — распространенный инструмент для доставки генетического материала в клетку. Именно благодаря особенностям жизненного цикла вирусов первые векторы (носители трансгенов) стали разрабатывать на их основе [1]. Вирусы переносят чужеродные гены, которые способны экспрессироваться в зараженных клетках [2]. Сейчас вирусы эволюционировали в специализированные молекулярные механизмы, способные эффективно транспортировать их геномы внутрь клеток, которые они заражают [3].
Разнообразие вирусных векторов велико, и каждый имеет свои преимущества и недостатки. Сейчас значительные усилия направляются на разработку вирусных векторов с улучшенными характеристиками безопасности и большей эффективностью доставки нуклеиновой кислоты в клетки, а также на обеспечение длительной и тканеспецифичной экспрессии введенного генетического материала. Потенциально вирусные векторы могут применяться как один из способов доставки генов в генной терапии новообразований и наследственных заболеваний.
Рекомбинантные аденоассоциированные вирусы (рААВ) являются одними из наиболее перспективных векторов доставки для генной терапии благодаря своим непатогенным свойствам, отсутствию иммуногенности со стороны хозяина и тропности к большинству клеток и тканей [4]. Аденоассоциированные вирусные векторы по своим характеристикам приближаются к идеальному вектору [5].
Вирусные векторы нашли свое применение и в нейробиологии в качестве систем эффективной доставки генов в нейроны и другие нейрональные клетки in vitro и in vivo. Вирусные векторы позволяют вести наблюдение за нейробиологическими функциями, изменять экспрессию целевых генов, метить клетки для определения их судьбы и менять физиологическое состояние специфических клеточных популяций. Использование вирусных векторов для доставки генов в нервную систему имеет большие перспективы как для фундаментальных исследований, так и для терапевтического применения.
Типы вирусных векторов, используемых в нейробиологии
Существуют вирусные и невирусные системы доставки генетического материала. Вирусные системы включают векторы, разработанные на основе ретровирусов, аденовирусов, аденоассоциированных вирусов, лентивирусов и вирусов простого герпеса. Невирусные системы включают «голую» ДНК и липиды или полиэтилгликоль [4]. Независимо от того, какой геном имеют вирусные векторы в своем составе — ДНК или РНК, у них похожий жизненный цикл, который начинается с взаимодействия со специфическим рецептором на поверхности клетки. После адсорбции вириона на клеточной поверхности в процессе проникновения геном вирусов подвергается «раздеванию». При реализации внутриклеточной стадии жизненного цикла вирус осуществляет три молекулярных процесса: репликацию геномной нуклеиновой кислоты, транскрипцию и трансляцию. На каждой стадии вирус вмешивается в клеточные синтетические механизмы и подчиняет их своим задачам, создавая приоритеты для вирусных нуклеиновых кислот [6].
Ни ДНК, ни РНК не могут быть использованы в «голом» виде для доставки генов в клетки-мишени. Сахарофосфатный остов молекул нуклеиновых кислот располагается по их периферии полярными группами наружу, придавая им анионные свойства [7]. При физиологических значениях рН нуклеиновая кислота несет отрицательный заряд, отталкивающий ее от отрицательно заряженной наружной поверхности клеточной мембраны. Еще одно ограничение при проникновении в клетку нуклеиновой кислоте создает ее гидрофильность [8]. Все ее гидрофобные основания «повернуты» вовнутрь молекулы, поэтому она не может проникнуть через гидрофобный барьер клетки-мишени [9]. В сыворотке крови нуклеиновая кислота быстро деградирует под воздействием нуклеаз. Период полужизни немодифицированной интерферирующей РНК в сыворотке крови укладывается в 5–60 мин, для ДНК он составляет не более 10 мин [10]. Кроме того, нуклеиновые кислоты не способны специфически узнавать клетки-мишени. Поэтому для доставки генов в эукариотические клетки с начала 1980-х гг. разрабатываются векторные генетические конструкции [11].
Ретровирусные векторные системы
Ретровирусы относятся к группе вирусов, РНК-геном которых в инфицированных клетках конвертируется в ДНК. Геном ретровирусов образован плюс-цепью РНК и включает три структурных гена (gag, pol и env), фланкированных длинными терминальными повторами (LTR, long terminal repeat) [12]. В LTR содержатся регуляторные элементы, которые играют роль во встраивании ретровируса и необходимы для интеграции ДНК-копии генома вируса с геномом хозяина, а также определяют начало и конец вирусного генома. LTR также контролируют экспрессию вирусных генов [13]. Оболочка ретровирусов состоит из цитоплазматической мембраны зараженной клетки и вирусных белков [14]. Особенностью жизненного цикла ретровирусов является обратная транскрипция в зараженной клетке на матрице вирусной РНК с образованием двухцепочечной ДНК (провирус), которая затем встраивается в клеточный геном. Вирус встраивается в клеточный геном случайным образом, поэтому возрастает риск инсерционного мутагенеза. Так как эти вирусы заражают только делящиеся клетки (для проникновения в ядро необходимо разрушение ядерной оболочки клетки, происходящее в ходе митоза), ретровирусные векторы используют в основном для трансфекции клеток ex vivo или для лечения злокачественных опухолей [15]. Сами ретровирусные векторы получают на основе провируса, из которого удаляются гены gag, pol и env для предотвращения репродукции вируса и освобождения места для желаемого генетического материала. В вектор на основе ретровируса может быть включено до 8 тыс. пар оснований ДНК-вставки. Для репродукции вируса удаленные вирусные гены (gag, pol, env), которые кодируют вирусные белки и обеспечивают репродукцию вируса, встраивают в геном упаковывающей клеточной линии на разные хромосомы так, чтобы снизить вероятность обратной рекомбинации вирусных генов в исходный вирусный геном и образования вирусов, которые могут репродуцироваться [16].
Лентивирусные векторные системы
Лентивирусы относятся к семейству ретровирусов и в отличие от других ретровирусов инфицируют не только делящиеся, но и неделящиеся клетки. Наиболее исследованным лентивирусом является вирус иммунодефицита человека (ВИЧ). В связи со способностью лентивирусов включать большое количество генетического материала (до 8 тыс. пар оснований) и инфицировать делящиеся и неделящиеся клетки, эти вирусы являются перспективным вектором для доставки генов в условиях in vivo [17]. Геном ВИЧ включает три гена структурных белков (gag, pol и env) и 6 генов регуляторных белков (tat, rev, vpr, vpu, nef и vif) [18, 19]. Некоторые гены могут быть исключены из генома вируса и при этом не вызвать снижения вирусной способности к размножению и инфицированию клеток. Лентивирусный жизненный цикл похож на жизненные циклы других ретровирусов, за исключением способности заражать и неделящиеся клетки. Эта способность обеспечивается взаимодействием вирусного преинтеграционного комплекса с ядерной оболочкой и транспортом через нее [20]. Сборка лентивирусного вектора происходит в упаковывающих клетках — это перевиваемые клетки, осуществляющие синтез вирусоспецифических белков [21]. Упаковывающие клетки включают в себя пакующую, векторную и оболочечную кассеты, которые вместе позволяют собрать функциональную вирусную частицу [22, 23]. При этом их одновременная экспрессия не вызывает образования ретровирусных частиц, способных инициировать инфекционный процесс у человека [24].
Лентивирусы имеют сравнительно небольшой объем вставки целевого гена (до 8 тыс. пар оснований), могут обеспечить длительную экспрессию трансгена и индуцируют минимальный иммунный ответ организма-хозяина [25]. Некоторые авторы считают эти векторы малоподходящими для доставки in vivo, так как они увеличивают риск инсерционного мутагенеза. Однако при использовании лентивирусов для трансдукции дифференцированных клеток риск инсерционного мутагенеза меньше, чем при использовании других ретровирусов [26].
Векторные системы на основе аденовирусов
Аденовирусы — семейство ДНК-вирусов, несущих в своем составе одну двуцепочечную молекулу ДНК и лишенных липидной оболочки. Аденовирусы разделены на основе связывания со специфическими сыворотками на 51 серотип [27], а по способности агглютинировать эритроциты у людей, кроликов и мышей и по онкогенности для грызунов — еще на 6 субгрупп (от A до F) [28]. Аденовирусы разных субгрупп поражают различные органы и ткани человека [29].
Создание рекомбинантных аденовирусных векторов во многом схоже с созданием лентивирусных векторов. Аденовирусы, дефектные по репликации, получали за счет замены гена Е1, необходимого для репликации, на ген интереса, промотор и энхансер [30]. При этом такие рекомбинантные векторы эффективно размножаются в пакующих клетках, экспрессирующих продукт гена Е1. Неспособные к репликации вне пакующих клеток аденовирусные векторы используют для введения трансгенов в условиях in vivo [31]. Рекомбинантные аденовирусные векторы обеспечивают очень высокую экспрессию клонированных генов, но на короткое время (5–10 сут) — из-за иммунного ответа организма-реципиента [32]. Для решения этой проблемы было создано второе поколение аденовирусных векторов, у которых дополнительно к гену Е1 удалили гены, отвечающие за репликацию вируса, и оставили только элементы, определяющие начало и конец генома и вирусную пакующую последовательность [33]. Такие векторы способны к более длительной экспрессии генов [14].
Аденовирусы способны инфицировать большинство типов клеток (делящиеся и неделящиеся). Объем для вставки целевого гена составляет 20 тыс. пар оснований, что является достаточно большой емкостью рекомбинантных аденовирусных векторов. Аденовирусы реплицируются в ядре инфицированной клетки как эписомные элементы и обладают высокой эффективностью трансдукции. Так, например, после прямой внутричерепной инъекции рекомбинантного аденовируса была обнаружена его способность заражать нейроны, астроциты, олигодендроглию, эпендимоциты, хориоидальный эпителий и микроглию [34, 35].
Векторные системы на основе вируса простого герпеса
Вирусные векторы на основе вируса простого герпеса (herpes simplex virus, HSV) имеют конструкцию проще, чем векторы на основе аденовирусов. Сам вирус включает около 80 генов, один из которых (IE3) чаще всего замещается при создании вектора [36]. Исключены могут быть и другие гены, что позволяет увеличить объем вектора или заклонировать несколько генов интереса. Недостатками векторов на основе вирусов простого герпеса являются кратковременная экспрессия клонированных генов, токсичность для клеток-мишеней, низкая эффективность трансдукции и способность заражать только неделящиеся клетки [37].
Для создания вирусных векторов сейчас активно используются ампликоны — многократно повторяющиеся последовательности вируса простого герпеса, которые включают мономерные последовательности, организованные как конкатемеры [38]. Каждый мономер включает хотя бы один участок начала репликации вирусной ДНК (oriS или oriL) и последовательность для упаковки ДНК в вирусную частицу (pac) [39]. Молекулярное клонирование этих последовательностей в бактериальную плазмиду позволяет получить вектор, который упаковывает ДНК в вирион HSV. Такие векторные системы способны включать до 150 тыс. пар оснований чужеродной ДНК, что предоставляет возможность одним вектором доставлять в клетку-мишень несколько транскрипционных единиц, не вызывая при этом иммунного ответа и цитопатического эффекта [40]. Особенность жизненного цикла вирусов простого герпеса — наличие двух стадий инфицирования: активной (проникновение и репродукция в клетках эпителия, приводящие к лизису клеток) и латентной (внедрение и репродукция в нервных клетках) [41]. Лизис клеток происходит за счет того, что при репликации вируса сформировавшиеся вирионы покидают клетку путем почкования ядерной мембраны.
Вирусы простого герпеса — нейротрофичны и высокоэффективны при изучении ретроградного и антероградного транспорта в ЦНС, могут быть введены в неопасном латентном состоянии. HSV-векторы имеют большую генетическую емкость и могут обеспечить долгосрочную экспрессию трансгена, однако, как отмечалось выше, основным недостатком их являются токсичность для клеток и низкая эффективность трансдукции [24].
Векторные системы на основе поксвирусов
Поксвирусы — крупные вирусы, которые содержат двунитевую ДНК. Поксвирусный вектор позволяет включить до 25 тыс. пар нуклеотидов ДНК интереса без исключения генов самого вируса. Векторные системы на основе поксвирусов не имеют такого широкого применения, поскольку эукариотические промоторы неэффективно распознаются транскрипционными механизмами поксвирусов и для эффективной экспрессии рекомбинантных генов в клетке-реципиенте нужно использовать поксвирусные промоторы [42]. Поксвирусные транскрипты не подвергаются сплайсингу, из-за чего ДНК интереса обязательно должна быть представлена в форме комплементарной ДНК. Особенностью жизненного цикла поксвирусов является наличие собственной ДНК-зависимой РНК-полимеразы, которая обеспечивает считывание более половины вирусного генома в течение начальной и ранней стадий репродуктивного цикла. Вследствие большого размера и неинфекционной природы поксвирусной ДНК чужеродные гены клонируются в поксвирусах путем рекомбинации в условиях in vivo. Поксвирусы обладают природным тропизмом к опухолевой ткани [43].
Главными недостатками поксвирусов являются высокая иммуногенность, кратковременная продолжительность экспрессии и сложности репликации в эукариотических клетках. При этом положительными сторонами поксвирусов служат высокая эффективность трансдукции, емкость и способность заражать большинство типов клеток [44].
Аденоассоциированные вирусные системы и их преимущества
Рекомбинантные аденоассоциированные вирусы (ААВ) являются одними из наиболее перспективных векторов доставки для генной терапии и нейробиологии благодаря своим непатогенным свойствам, низкой иммуногенности со стороны хозяина, тропности к большинству клеток и тканей, высокой эффективности трансдукции и продолжительной экспрессии [45]. Основной их недостаток — небольшая емкость вектора (до 5 тыс. пар оснований).
Всего у ААВ известно 8 различных серотипов. ААВ2, ААВ3 и ААВ5 первоначально были выделены у обезьян [46]. Полагают, что ААВ6 был сформирован путем рекомбинирования ААВ2 и ААВ1, а именно 5’-конец ААВ2 слился с 3’-концом ААВ1 (включая две открытые рамки считывания) [47, 48]. ААВ7 и ААВ8 были выделены от макаки-резуса при ПЦР-амплификации с использованием праймеров, полученных из консервативных областей серотипов ААВ1–ААВ6 [49]. Среди всех восьми серотипов ААВ2 является наиболее изученным и широко используется в качестве вектора доставки генов [5].
ААВ принадлежит к семейству Parvoviridae. Это группа безоболочечных вирусов, содержащих одноцепочечную ДНК. Вирусная частица имеет икосаэдрическую (20 граней) симметрию с диаметром 18–26 нм и молекулярную массу 5,5–6,2 МДа [50].
Наиболее характерными особенностями ядерной структуры являются группы тройных выступов и выступающих петель, расположенных между двумя смежными субъединицами [51]. Положительно заряженные группы, расположенные вдоль одной стороны каждого выступа, отвечают за связывание с клеточным рецептором — гепарансульфат протеогликаном (HSPG) [52]. В связи с высокой экспрессией данного рецептора в разных тканях связывание с HSPG определяет широкий спектр клеточной специфичности к ААВ2-инфекции [53]. Петля, расположенная в соседней субъединице, также участвует в связывании с клеточным рецептором HSPG и содержит эпитоп для нейтрализующих антител [5]. Нейтрализация иммунного ответа определяет возможность будущего успешного повторного попадания вирусных векторов. Анализ структуры вирусных частиц ААВ2 с помощью рентгеновского излучения открыл возможность изменения эпитопа, содержащегося в вирусных белках капсида, и нейтрализующего антитела и осуществления других модификаций, применимых для реадмиссии в генной терапии [54].
ААВ2 имеет одноцепочечную геномную ДНК, состоящую из 4680 оснований. Инвертированные концевые повторы, состоящие из 145 оснований с высоким содержанием пар GC и способные образовывать палиндромную структуру, расположены как на 5’-конце, так и на 3’-конце [55]. ААВ2-геном синтезируется с мРНК, начиная от промотора p19 [56]. Ген cap кодирует три вирусных белка: VP1 (735 аминокислот, 90 кДа), VP2 (598 аминокислот, 72 кДа) и VP3 (533 аминокислот, 60 кДа), образующих вирусный капсид в соотношении 1:1:20 соответственно, при этом капсид имеет икосаэдрическую симметрию и состоит из 60 субъединиц [57]. Три капсидных белка синтезируются с одной мРНК, начиная с промотора р40, и отличаются друг от друга благодаря альтернативному сплайсингу и разным кодонам инициации [58]. Все три белка капсида имеют одни и те же карбоксиконцевые последовательности и стоп-кодоны (рис. 1).
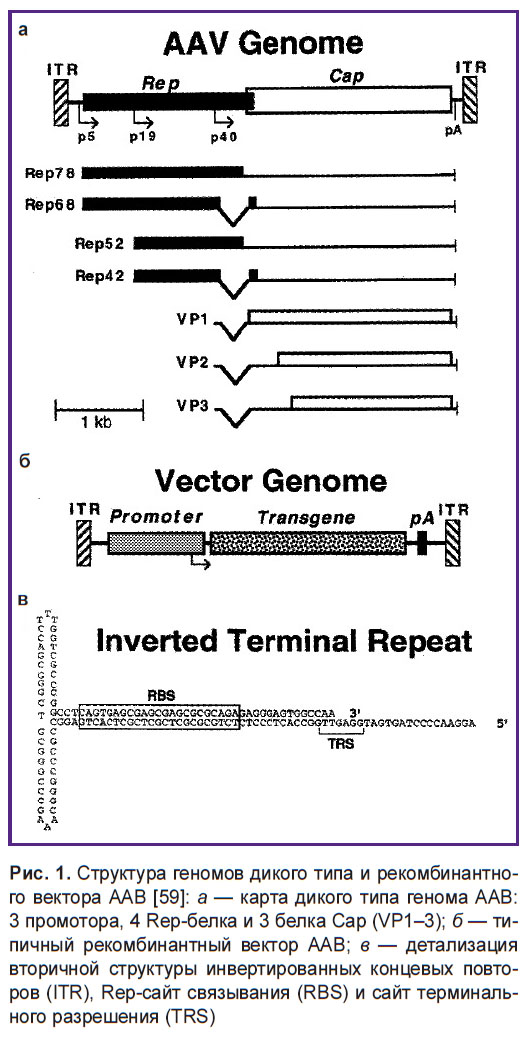 | Рис. 1. Структура геномов дикого типа и рекомбинантного вектора ААВ [59]: а — карта дикого типа генома ААВ: 3 промотора, 4 Rep-белка и 3 белка Cap (VP1–3); б — типичный рекомбинантный вектор ААВ; в — детализация вторичной структуры инвертированных концевых повторов (ITR), Rep-сайт связывания (RBS) и сайт терминального разрешения (ТRS) |
Инвертированные концевые повторы на обоих концах выполняют по крайней мере следующие три функции. Во-первых, 3’-конец служит в качестве праймера для синтеза новой нити ДНК. Во-вторых, он имеет Rep-связывающий сайт (RBS) для Rep78 и Rep68, которые обладают хеликазной, цепьспецифической и сайтспецифической эндонуклеазной активностью [60]. В-третьих, там находится концевой сайт прикрепления (ТRS), который идентичен последовательности в 19-й хромосоме и выступает в качестве последовательности для интеграции с вирусным геномом [61].
Инфекционный путь ААВ2 включает несколько стадий (рис. 2). Вирусные частицы сначала прикрепляются к клеточной поверхности путем связывания с рецептором и корецептором, что в свою очередь ведет к интернализации и включению во внутриклеточный транспорт [62]. Затем эти частицы проникают через ядерную мембрану и либо интегрируют свои геномы с геномом клетки-хозяина, либо реплицируют свой геном внутри ядра [63]. Общепризнано, что основным клеточным рецептором для связывания ААВ2 является HSPG [64].
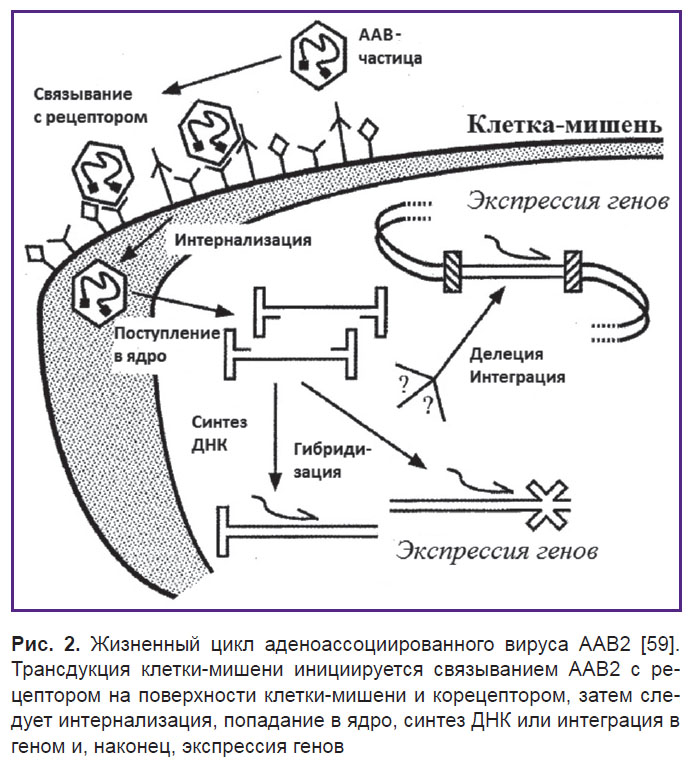 | Рис. 2. Жизненный цикл аденоассоциированного вируса ААВ2 [59]. Трансдукция клетки-мишени инициируется связыванием ААВ2 с рецептором на поверхности клетки-мишени и корецептором, затем следует интернализация, попадание в ядро, синтез ДНК или интеграция в геном и, наконец, экспрессия генов |
Благодаря анализу сайтнаправленного мутагенеза была обнаружена важность основных аминокислот в связывании капсида ААВ2 с гепарином [65].
HSPG выступает в качестве основного рецептора, но ААВ2 также связывается с корецепторами — рецептором 1 фактора роста фибробластов (FGFR1) и αvβ5-интегрином [66, 67]. FGFR1, как полагают, увеличивает степень прикрепления вируса к клетке, в то время как αvβ5-интегрин необходим при эндоцитозе [68, 69]. После эндоцитоза вирусные частицы ААВ2 освобождаются от эндосомы при низком рН [70, 71]. Низкий рН, вероятно, вызывает конформационные изменения вирусных белков, которые играют решающую роль в успешном выходе из эндосомы и проникновении в ядро [72, 73].
В одних ядрах геном ААВ интегрирует в 19-ю хромосому в качестве провируса, а в других вирусные геномы могут оставаться как эписомы [5].
Хелперные плазмиды. Трансфекция
Трансфекция — процесс введения нуклеиновой кислоты в клетки человека и животных невирусным методом. Плазмидную ДНК наиболее часто трансфецируют в клетки, но и другие макромолекулы могут также быть введены внутрь клетки, такие как малые интерферирующие РНК, олигонуклеотиды, РНК и белки [74]. Трансфекция может состоять из нескольких стадий, но обязательным этапом является образование в плазматической мембране пор, через которые внутрь клетки способен проникать внеклеточный материал [75, 76].
Стандартный метод получения рААВ включает в себя котрансфекцию клеток рААВ плазмидой и упаковочной плазмидой, кодирующей гены Rep и белки VP (variol protein) [77]. Кроме того, клетки могут быть коинфицированы вирусом-помощником, например аденовирусом, который обеспечивает выполнение различных функций в производстве ААВ [78, 79]. Как следствие, клетки производят не только ААВ, но и аденовирусы, которые загрязняют конечный продукт (рис. 3, а).
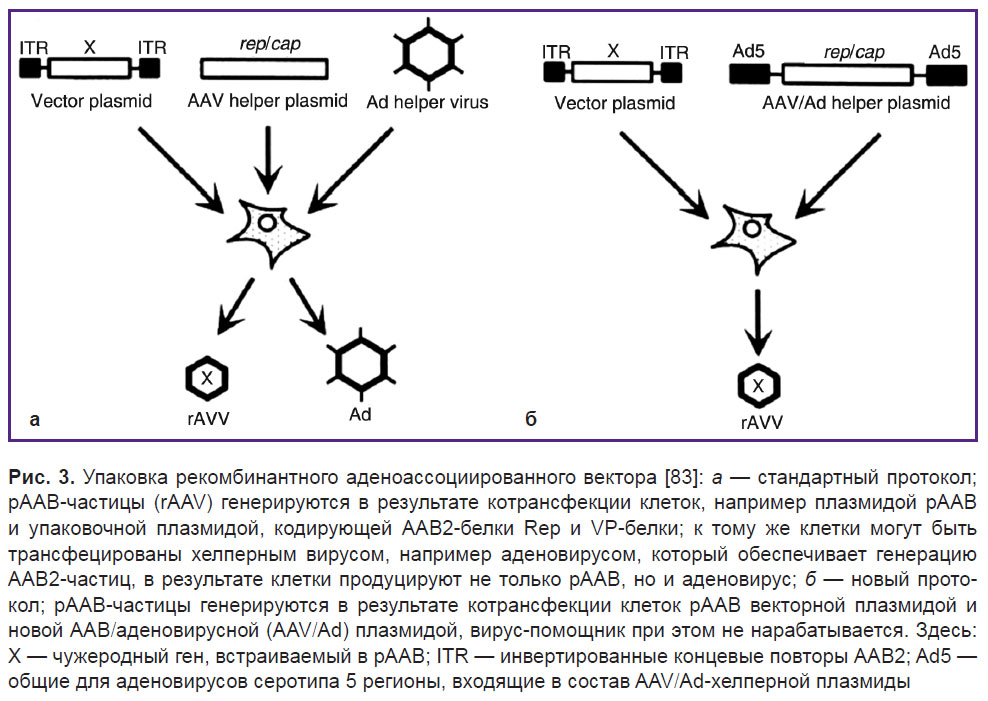 | Рис. 3. Упаковка рекомбинантного аденоассоциированного вектора [83]: а — стандартный протокол; рААВ-частицы (rAAV) генерируются в результате котрансфекции клеток, например плазмидой рААВ и упаковочной плазмидой, кодирующей ААВ2-белки Rep и VP-белки; к тому же клетки могут быть трансфецированы хелперным вирусом, например аденовирусом, который обеспечивает генерацию ААВ2-частиц, в результате клетки продуцируют не только рААВ, но и аденовирус; б — новый протокол; рААВ-частицы генерируются в результате котрансфекции клеток рААВ векторной плазмидой и новой ААВ/аденовирусной (AAV/Ad) плазмидой, вирус-помощник при этом не нарабатывается. Здесь: Х — чужеродный ген, встраиваемый в рААВ; ITR — инвертированные концевые повторы ААВ2; Ad5 — общие для аденовирусов серотипа 5 регионы, входящие в состав AAV/Ad-хелперной плазмиды |
Передовой же метод получения рААВ основан на котрансфекции клеток рААВ и хелперной плазмидой, полученной из ААВ и аденовируса [80–82]. При этом производства аденовируса не происходит (рис. 3, б) [83].
Хелперная плазмида, или плазмида-помощник, обладает одной или несколькими функциями, которые отсутствуют у дефектной плазмиды [84]. Трансформированные клетки должны быть инфицированы также вспомогательным вирусом, например аденовирусом, что обеспечивает множество необходимых преимуществ для производства рААВ [85–87].
Типичные методы производства рААВ-векторов требуют котрансфекции клеток плазмидным вектором ААВ2 и вспомогательной плазмидой (хелперной) [88].
Хелперная плазмида экспрессирует гены rep и cap, а также гены, кодирующие продукты, важные для производства ААВ2 (рис. 4). Простой котрансфекции клеток с хелперной плазмидой и ААВ2-вектором достаточно для успешной наработки рААВ [83, 89].
Рекомбинантные векторы, полученные из ААВ2, — перспективный инструмент для генной терапии и нейробиологии, так как они являются непатогенными и могут долгосрочно экспрессироваться в различных тканях [91–93].
Основные свойства отдельных вирусных векторов, такие как размер вирусных частиц, размер генома и емкость вставки, иммуногенность, а также эффективность трансдукции и экспрессии вируса в клетках-мишенях, отражены в таблице (см. таблицу).
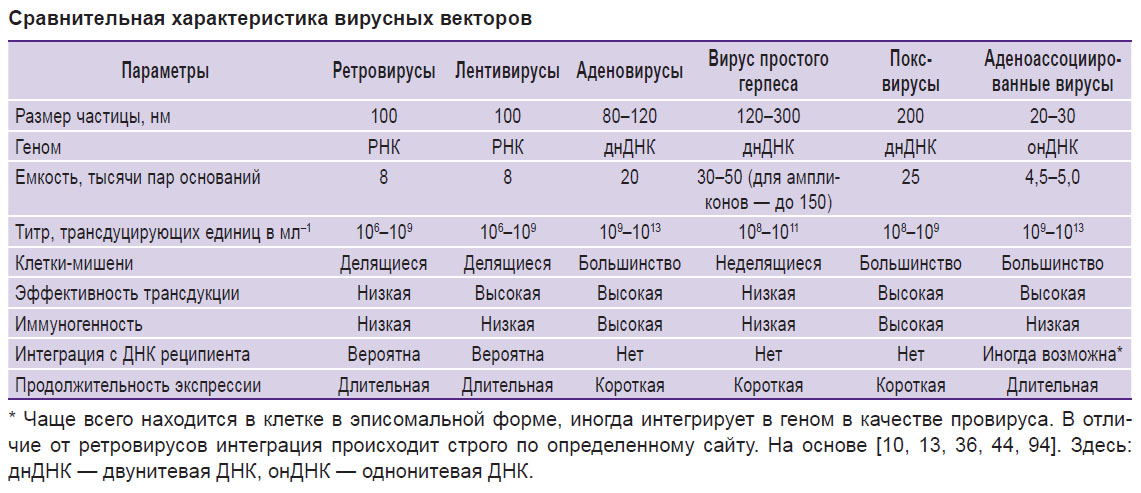 Сравнительная характеристика вирусных векторов Сравнительная характеристика вирусных векторов |
Применение генетических вирусных векторов в нейробиологии
Перенос генетической информации в клетки центральной нервной системы имеет большие перспективы для фундаментальных и клинических исследований в нейробиологии [95, 96]. Так как мозг представляет собой сложноорганизованную структуру, это делает затруднительным генетические манипуляции в нем [97]. В настоящее время вирусные векторы являются наиболее широко используемыми транспортными средствами для переноса генов в зрелые клетки мозга млекопитающих [98, 99]. Тем не менее не существует «универсального идеального вектора» и любые исследования мозга требуют использования определенных векторных систем [100–102]. Кроме того, все вирусные векторные системы имеют свои недостатки и преимущества в зависимости от выбранных клеток-мишеней и специфики каждого исследования [103]. Причем количество векторов, подходящих для фундаментальных исследований, превосходит количество тех, которые могут применяться в клинических испытаниях [104, 105]. Сейчас наиболее широко используемыми векторами в нейробиологии являются аденоассоциированные, аденовирусные, герпесвирусные и лентивирусные векторы [106].
Рекомбинантные ААВ представляют собой векторы нескольких серотипов со специфическим клеточным тропизмом. Например, AАВ2 заражает преимущественно нейроны, но не все виды нейронов заражаются одинаково хорошо. Другие серотипы, такие как ААВ4 и ААВ5, демонстрируют различный тропизм и способность к диффузии [25].
Cre-рекомбиназа в сочетании с Cre-зависимой экспрессией белков и рААВ используется для достижения экспрессии трансгена в различных нейронных популяциях. При этом Cre-зависимые векторы показали надежную способность к ретроградной инфекции и экспрессии трансгена [82].
Генетически кодируемые нейрональные сайленсеры используются для проверки участия нейрональных популяций в поведенческих функциях [107]. Например, соматостатин-экспрессирующие клетки (SST) в комплексе Бетцингера (структура заднего мозга, которая регулирует дыхание) селективно выключались, чтобы проверить их участие в дыхании [108]. В этом исследовании использовались G-белки, связывающиеся с рецепторами аллатостатина (AlstR) дрозофилы, которые могут заставить «замолчать» нейроны млекопитающих при образовании комплекса рецептор–лиганд путем активации проводимости калия. Отдельно лиганд и его рецептор, как полагают, не могут повлиять на нейроны млекопитающих. Использование рААВ2 позволило добиться специфической экспрессии AlstR в субпопуляции клеток SST.
Оценка электрической активности нейронов широко исследовалась для изучения функции нейронов, а в последнее время — для характеристики нейронных сетей. Мониторинг активности нейрона — сложная задача, которая чаще всего сводится к крупномасштабной, мультинейронной визуализации уровня кальция, отражающего электрическую активность [109]. Рекомбинантные ААВ могут доставить генетически закодированные индикаторы кальция для визуализации динамики кальция в естественных условиях с достаточными уровнями экспрессии для эффективного обнаружения. Так, рААВ-экпрессия кальциевого индикатора camgaroo-2 под контролем тетрациклинового трансактиваторного промоторного элемента была осуществлена в обонятельной луковице трансгенных мышей CaMKIIa-tTA [110]. Это вызвало экспрессию в обонятельных сенсорных аксонах и позволило контролировать динамику кальция в ответ на различные ароматические вещества.
Другой кальциевый индикатор GCaMP3 был экспрессирован в клетках моторной коры мыши с использованием рAAВ2/рААВ5, что позволило контролировать динамическую активность нескольких нейронов у бегущей мыши [111].
Также ААВ применяются для выявления и оценки синаптических связей между нейронами разных типов. К примеру, такой подход был использован, чтобы отличить проекционные модели двух смешанных нейронных популяций, которые различаются по экспрессии типов дофаминовых рецепторов 1 или 2 (D1R или D2R) [109]. Применение Cre-зависимого вирусного вектора и сильного промотора EF-1α позволило управлять GFP-трансгеном в сочетании с наличием генетической модификации в мышах, что раскрыло поразительно четкие различия стрионигральной и стриопаллидарной субстанций [111].
Ампликоны вируса простого герпеса применяются для экспрессии генов большого размера или генов с повышенной копийностью. Так, например, мутантная форма торсина А, который ответственен за развитие торсионной дистрофии и формирует витые включения в цитоплазматической мембране [112], может быть экспрессирована в культуре клеток глиомы с помощью ампликона вируса простого герпеса [113].
В лабораторной практике применяются лентивирусные векторы с синапсиновым промотором, способствующим экспрессии заданного гена в любых типах нейрональных клеток [114–117]. Также используются лентивирусные векторы с промотором, содержащим кальций-кальмодулин-зависимую протеинкиназу II альфа, с экспрессией в возбуждающих глутаматергических нейронах [118, 119]. Применяются данные векторы для оптического и электрофизиологического мониторинга их активности, а также для оптогенетической стимуляции, например при остром паркинсонизме, индуцированном посредством медикаментов.
Аденовирусные векторы также применяются в нейробиологии, например в оптогенетике. Так, лабораторией S. Kasparova был создан оптогенетический активатор, который управляет астроцитарной активностью через экспрессию разных вариантов чанелродопсина-2 (ChR2), с целью запуска внеклеточных событий, таких как внеклеточное увеличение концентрации ионов Ca 2+ [120].
Заключение
На данный момент не существует универсального «идеального» вектора, и разные исследования требуют использования определенных векторных систем. У всех вирусных векторных систем будут свои недостатки и преимущества в зависимости от выбираемых клеток-мишеней и специфики каждого исследования. В частности, преимущества рекомбинантных аденоассоциированных векторов (способность интегрировать целевой ген в геном хозяина в нужное место, что предотвращает нежелательные мутации; встраивание как в делящиеся, так и в покоящиеся клетки; широкий профиль трансдукции; низкий иммунный ответ; сильная и устойчивая экспрессия трансгена) выделяют их среди остальных вирусных векторов и делают эти векторы популярным и универсальным инструментом для доставки гена in vitro и in vivo.
Финансирование исследования. Работа выполнена при поддержке Федеральной целевой программы «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2014–2020 годы» Министерства образования и науки России, соглашение 14.581.21.0016 («Разработка методов, технологий и платформ для исследований функционирования нервных систем на основе создания высокоразрешающей информационной модели кортикальных структур мозга», уникальный идентификатор ПНИЭР RFMEFI58115X0016).
Конфликт интересов. Авторы декларируют отсутствие конфликта интересов.