вазопрессорное действие что это
Cochrane
В этом обзоре предпринята попытка получить несмещенные доказательства о влиянии различных лекарств, повышающих артериальное давление, на риск смерти у тяжелобольных пациентов с нарушением кровообращения.
● Циркуляторный шок (шок кровообращения) в широком смысле определяется как опасное для жизни состояние нарушения кровообращения, приводящее к неспособности организма поддерживать доставку крови в ткани организма и удовлетворять потребности в кислороде.
● Типичные признаки шока включают низкое кровяное давление, учащенное сердцебиение и слабую перфузию органов, о чем свидетельствует низкий уровень выделения мочи, спутанность сознания или потеря сознания.
Доказательства актуальны по июнь 2015 года.
Авторы обзора нашли 28 рандомизированных контролируемых исследований с участием 3497 критически больных пациентов с недостаточностью кровообращения, из которых 1773 умерли. Пациенты находились под наблюдением до одного года.
Следующие лекарства, вводимые отдельно или в комбинации, были изучены в 12 различных сравнениях: дофамин, норадреналин, адреналин, фенилэфрин, вазопрессин и терлипрессин.
Таким образом, исследователи не обнаружили существенных различий в риске смерти ни в одном из сравнений различных лекарств, вводимых отдельно или в комбинации, при учёте последней зарегистрированной смерти.
Нарушения ритма сердца наблюдали чаще у людей, получавших дофамин, чем у людей, получавших норадреналин.
Качество доказательств было высоким для сравнения норадреналина и дофамина и было очень низким или умеренным для других сравнений.
Результаты немногих крупных исследований и исследований различного качества были согласованными (единообразными) между собой.
Применение вазопрессоров повышает риск внутригоспитальной смертности при травматическом геморрагическом шоке (Critical Care Medicine, сентябрь 2018)
Обзор
В журнале Critical Care Medicine 07 сентября 2018 г. опубликована статья: «Применение вазопрессоров повышает риск внутригоспитальной смертности при травматическом геморрагическом шоке».
Вазопрессоры могут применяться у пациентов с травматическим геморрагическим шоком для повышения АД и для снижения объема жидкостной инфузии. Европейские руководства, на основании ограниченных доказательств, рекомендуют применение вазопрессоров у пациентов с травматическим геморрагическим шоком только при наличии жизнеугрожающей гипотензии. Однако, в других клинических руководствах нет рекомендаций по раннему применению вазопрессоров у пациентов с травматическим геморрагическим шоком.
Польза от применения вазопрессоров у пациентов с травматическим геморрагическим шоком была показана в ограниченных экспериментальных данных, и только одно клиническое исследование показало, что применение вазопрессоров у пациентов с травмами было связано с повышенным риском смертности.
В представленном ретроспективном когортном исследовании, которое прошло в Японии, участвовали 3551 пациент старше 16 лет (средний возраст 59 лет, мужчины 64%) с травмами из 260 больниц страны, у которых при поступлении в стационар была систолическая гипотензия ( 3 баллов по шкале Abbreviated Injury Scale для головы),
— пациенты с повреждениями спинного мозга (5 баллов по шкале Abbreviated Injury Scale для позвоночника),
— остановка сердечной или легочной деятельности на догоспитальном этапе,
— пациенты с сердечно-легочной реанимацией.
Из 3551 пациентов после поступления в стационар:
— 459 пациентов получили лечение вазопрессорами.
— 3092 пациента не получили вазопрессоры при лечении.
Первичным исходом исследования являлась внутригоспитальная смертность. Вторичным исходом являлась смертность в отделении неотложной помощи (Emergency Department mortality).
По результатам исследования:
— внутригоспитальная смертность составила 43% в группе с вазопрессорами и 16% в группе без них.
— смертность в отделении неотложной помощи составила 6,8% в группе с вазопрессорами и 2,5% в группе без них.
После проведения тщательного анализа с исключением других факторов (причина травмы и механизм травмы, данные жизненных показателей в отделении неотложной помощи, тяжесть травмы по шкале Injury Severity Score, догоспитальное применение внутривенных жидкостей, и объем трансфузий крови в первые 24 часа), авторы заключают, что применение вазопрессоров было связано более высокой смертностью.
Авторы отмечают, что результаты данного исследования показывают, что пациентам, которым применялись вазопрессоры в больнице, потребовались более большие объемы жидкостных инфузий, что потенциально привело данных пациентов к смерти в стационаре.
Авторы отмечают, что таким образом врачам советуется быстрее обеспечить остановку кровотечения без применения вазопрессоров.
Подробнее смотрите в прикрепленном файле.
Вазопрессорное действие что это
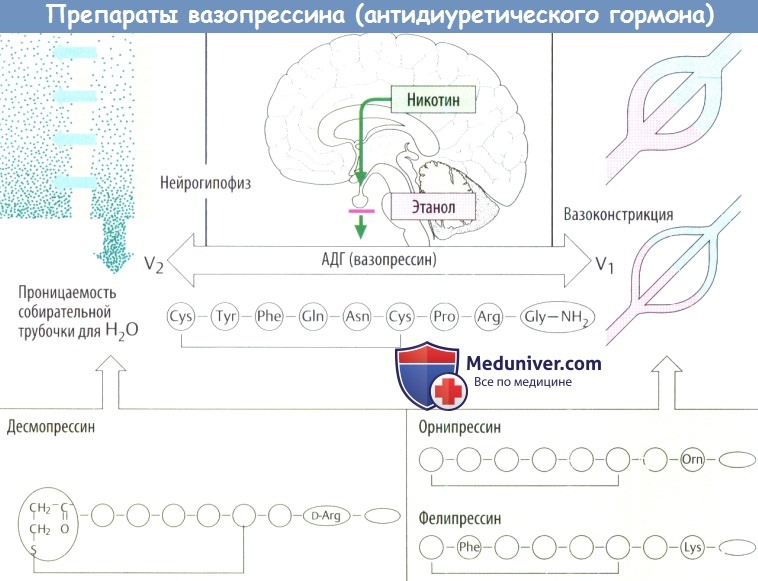
Вазопрессин (АДГ), нонапептид, который высвобождается из задней доли гипофиза и усиливают реабсорбцию воды в почках. Этот эффект опосредован рецепторами вазопрессина V1-подтипа. АВГ (аргинин-вазопрессин) увеличивает проницаемости для Н2О в соединительных канальцах и собирательных трубочках мозгового вещества почки следующим образом.
Белки водных каналов (аквапорины 2-го типа) хранятся внутри клетки в везикулах. Когда АВП связывается с V2-рецепторами, эти везикулы сливаются с клеточной мембраной, обращенной в просвет канальца, позволяя Н2O входить по ее осмотическому градиенту (область мозгового вещества гиперосмолярна). АВП сокращает объем мочи в этом месте нефрона с 15 л/сут до окончательного 1,5 л/сут.
Аквапорины этого типа могут использоваться повторно после интернализации. Никотин увеличивает, а этанол уменьшает выброс АВП. В концентрациях, выше вызывающих антидиурез, АВП стимулирует гладкую мускулатуру, в т. ч. кровеносных сосудов. Вазопрессорный эффект опосредован V1-рецепторами. Повышается АД; сужение коронарных артерий может вызвать приступ стенокардии.
Липрессин (8-L-лизин-вазопрессин) действует подобно АВП. Другие производные могут оказываютлишь одно действие из двух.
Десмопрессин используют для лечения несахарного диабета (дефицит АВП), первичного ночного энуреза и болезни фон Виллебранда; его вводят инъекционно либо через слизистую оболочку носа (как нюхательный табак).
Фелипрессин и орнипрессин добавляют к местным анестетикам в качестве сосудосуживающих средств.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Вазопрессоры и кардиотоники в анестезиологии
Вазопрессоры и кардиотоники в анестезиологии используются при интенсивной терапии и профилактике периоперационных осложнений, связанных с сердечно-сосудистой недостаточностью. При работе с данной группой препаратов от анестезиолога требуются хорошие знания физиологии и фармакологии, достаточный клинический опыт и умение правильно оценить динамику в состоянии пациента. Что общего и какие отличия между вазопрессорной и инотропной поддержкой? Подробнее о других препаратах в анестезиологии и реаниматологии здесь…
Уважаемые коллеги! Приглашаем Вас принять участие в опросе посвященному проблеме вазопрессорной поддержки при септическом шоке (это займёт не более 1 мин).
Понятие, определение, классификация вазопрессоров и кардиотоников
Вазопрессоры (vasopressor, сосудосуживающий) — группа препаратов, основной задачей которых является повышение среднего артериального давления за счет сосудосуживающего эффекта. Примеры: адреналин, норадреналин, мезатон. К счастью, вазопрессоры используются не настолько часто в плановой анестезиологии, чтобы их можно было легко включить в стандартный набор препаратов, применяемых во время общей или регионарной анестезии. Однако следует знать и помнить показания к их назначению, особенно это касается экстренной анестезиологии. С другой стороны, вазопрессоры должны и обязаны быть в арсенале препаратов при проведении любой анестезии (анестезиологического пособия), так как никто не застрахован от возникновения, например, анафилактического шока.
Кардиотоники (инотропы) — группа препаратов, обладающие положительным инотропным эффектом, т.е. способные увеличивать силу сокращения миокарда и тем самым повышать среднее артериальное давление. Кардиотоники редко используются в плановой анестезиологии, исключение составляют больные с хронической сердечной недостаточностью (например, левосимендан применяется для предоперационной подготовки; допамин — при вводной анестезии и на этапах поддержания). Основные показания к назначению кардиотоников — экстренная анестезиология и ранний послеоперационный период. Из ниже перечисленных препаратов, входящих в данную группу, у анестезиолога всегда должен быть под рукой допамин.
Классификация кардиотонических средств:
Понимание физиологии является ключом к правильному выбору инотропной или вазопрессорной поддержки в клинической практике анестезиолога-реаниматолога. Принято считать, что катехоламины влияют на сердечно-сосудистую систему посредством вазопрессорной активности, которой обладают адренергические рецепторы α1, β1 и β2, а также дофаминовые рецепторы.
Альфа-адренергические рецепторы. Активация α1-адренергических рецепторов, расположенных в сосудистых стенках, вызывает существенную вазоконстрикцию (повышение системного сосудистого сопротивления).
Бета-адренергические рецепторы. Стимулирование β1-адренергических рецепторов, расположенных в миокардиоцитах, приводит к усилению сократимости миокарда. Стимуляция β2-адренергических рецепторов кровеносных сосудов приводит к увеличению поглощения Ca 2+ саркоплазматическим ретикулумом и вазодилатации.
Дофаминергические рецепторы. Стимуляция D1 и D2 дофаминергических рецепторов приводит к увеличению почечной перфузии и расширению мезентериальных, коронарных и мозговых сосудов.
Вазопрессиновые рецепторы V1 и V2
V1-рецепторы — расположены в гладкой мускулатуре внутренних органов, в частности в сосудах; V2-рецепторы — расположены в почечных канальцах.
Вазоконстрикция происходит за счет сокращения гладкомышечной стенки сосудов, а увеличение ОЦК за счет реабсорбции воды в почечных канальцах.
Таким образом, общая цель вазопрессоров и кардиотоников — интенсивное повышение артериального давления, а отличие между ними находится в решении поставленной задачи, т.е. на разных патофизиологических уровнях. Поэтому правильнее говорить о преимуществе того или иного эффекта (вазопрессорного или инотропного) у данного препарата в конкретной клинической ситуации. Не следует забывать, что при выборе вазопрессорной и/или инотропной поддержки, в первую очередь необходимо найти причину и следствие возникновения сердечно-сосудистой недостаточности.
Фармакологическая классификация
Клиническая классификация
Обратите внимание! Данная классификация является условной!
Применение вазопрессоров и кардиотоников в анестезиологии
Клиническое применение вазопрессоров и кардиотоников базируется на понимании фармакологии и патофизиологии.
Клинические ситуации
Ниже Вы найдете показания, противопоказания, дозы и способ введения, а так же калькулятор для расчета дозы вазопрессоров и кардиотоников в зависимости от массы тела пациента.
Современная вазопрессорная терапия септического шока (обзор)
Полный текст:
Аннотация
Септический шок, как наиболее тяжелая форма течения сепсиса, характеризуется высокой летальностью, достигающей 40%, несмотря на использование самых современных стандартов диагностики и лечения. В патогенезе септического шока ведущая роль принадлежит вазоплегии, соответственно, и терапия обсуждаемого состояния предполагает использование вазоконстрикторов, наряду со стандартным назначением инфузионной терапии, антибиотиков и симптоматическим лечением. Выбор конкретного вазоактивного препарата — сложная задача для практикующего анестезиолога, т. к. наряду с, несомненно, положительными свойствами, каждый вазоконстриктор обладает своим спектром нежелательных побочных эффектов, что, конечно же, необходимо учитывать при определении тактики лечения.
Цель обзора: комплексная оценка многофакторного воздействия на пациента различных вазоконстрикторов для определения критериев выбора оптимального препарата (или комбинации препаратов) при септическом шоке.
Поиск проводили по базам данных PubMed и Scopus, окончательный отбор 89 источников осуществили в соответствии со следующими критериям: отношение к теме данного обзора и характер статьи — в окончательный анализ вошли только рандомизированные контролируемые исследования, рекомендации и аналитические обзоры.
Рассмотрели внешние и внутренние механизмы регуляции сосудистого тонуса, включая факторы вырабатываемые эндотелием (оксид азота, простациклин, эндотелин); вазоактивные метаболиты и аутокоиды — сигнальные молекулы локального действия (серотонин, простагландины, тромбоксан А2). Соответственно, проанализировали препараты, механизм действия которых связан с влиянием на адренергические (адреналин, дофамин, норадреналин, фенилэфрин, добутамин), вазопрессиновые (вазопрессин, терлипрессин, селепрессин) рецепторы, синтетические аналоги ангиотензина (ангиотензин II) и препараты, вазопрессорный эффект которых не связан с рецепторным аппаратом (метиленовый синий, левосимендан, гидрокортизон).
Заключение. Высокая эффективность норадреналина, его положительные гемодинамические эффекты делают этот препарат, во многом, универсальным средством для купирования септического шока. Однако рефрактерный шок обуславливает использование высоких доз норадреналина, что приводит к увеличению риска неблагоприятных реакций. Предотвратить подобные осложнения призвана сочетанная стимуляция адренергических и лиганда V — рецепторов терлипрессином. Однако, на сегодняшний день не существует четких рекомендаций по применению терлипрессина при септическом шоке, что ограничивает его использование в клинической практике.
Ключевые слова
Об авторах
Александр Александрович Кочкин
129110, г. Москва, ул. Щепкина, д. 61/2
129110, г. Москва, ул. Щепкина, д. 61/2; 119991, г. Москва, ул. Трубецкая, д. 8, стр. 2
Список литературы
1. Burgdorff A.-M., Bucher M., Schumann J. Vasoplegia in patients with sepsis and septic shock: pathways and mechanisms. J Int Med Res. 2018; 46 (4): 1303–1310. PMID: 29332515, DOI: 10.1177/0300060517743836
2. Rhodes A., Evans L.E., Alhazzani W., Levy M.M., Antonelli M., Ferrer R., Kumar A., Sevransky J.E., Sprung C.L., Nunnally M.E., Rochwerg B, Rubenfeld G.D., Angus D.C., Annane D., Beale R.J., Bellinghan G.J., Bernard G.R., Chiche J.D., Coopersmith C., De Backer D.P., French C.J., Fujishima S., Gerlach H., Hidalgo J.L., Hollenberg S.M., Jones A.E, Karnad D.R., Kleinpell R.M., Koh Y., Lisboa T.C., Machado F.R., Marini J.J., Marshall J.C., Mazuski J.E., McIntyre L.A., McLean A.S., Mehta S., Moreno R.P., Myburgh J., Navalesi P., Nishida O., Osborn T.M., Perner A., Plunkett C.M., Ranieri M., Schorr C.A., Seckel M.A., Seymour C.W., Shieh L., Shukri K.A., Simpson S.Q., Singer M., Thompson B.T., Townsend S.R., Van der Poll T., Vincent J.L., Wiersinga W.J., Zimmerman J.L., Dellinger R.P. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock. 2016. Intensive Care Med. 2017; 43: 304–377. PMID: 28101605, DOI: 10.1007/s00134-017-4683-6.
3. Malbrain M.L., Marik P.E., Witters I., Cordemans C., Kirkpatrick A.W., Roberts D.J., Van Regenmortel N. Fluid overload, de-resuscitation, and outcomes in critically ill or injured patients: a systematic review with suggestions for clinical practice. Anaesthesiol Intensive Ther. 2014; 46 (5): 361–380. PMID: 25432556, DOI: 10.5603/AIT.2014.0060
4. Colling K.P., Banton K.L., Beilman G.J. Vasopressors in Sepsis. Surg Infect (Larchmt). 2018; 19 (2): 202–207. PMID: 29336676, DOI: 10.1089/sur.2017.255
5. Сепсис: классификация, клинико-диагностическая концепция и лечение. Под редакцией академика РАН Б.Р. Гельфанда — 4-е издание, дополненное и переработанное — Москва: ООО «Медицинское информационное агенство». 2017 г. ISBN 978-5-8948-1988-4
6. Lambden S., Creagh-Brown B.C., Hunt J., Summers C., Forni L.G. Definitions and pathophysiology of vasoplegic shock. Critical Care. 2018; 22: 174–181. DOI: 10.1186/s13054-018-2102-1
7. Ильина Я. Ю., Фот Е. В., Изотова Н. Н., Сметкин А. А., Волков Д. А., Яковенко Э. А., Чернова Т. В., Кузьков В. В., Киров М. Ю. Взаимосвязь эндотелиального гликокаликса с гемодинамикой и метаболизмом у пациентов с септическим шоком и при кардиохирургических операциях с искусственным кровообращением. Вестник анестезиологии и реаниматологии. 2018; 15 (6): 10–19. DOI: 10.21292/2078-5658-2018-15-6-10-19
8. Seddon M.D., Chowienczyk P.J., Brett S.E., Casadei B., Shah A.M. Neuronal nitric oxide synthase regulates basal microvascular tone in humans in vivo. Circulation. 2008; 117 (15): 1991–1996. PMID: 18391107, DOI: 10.1161/CIRCULATIONAHA.107.744540
9. Lange M., Enkhbaatar P., Nakano Y., Traber D.L. Role of nitric oxide in shock: the large animal perspective. Front Bioscie. 2009; 14: 1979– 1989. PMID: 19273179, DOI: 10.2741/3357
10. Palmer R.M., Ferrige A.G., Moncada S. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature. 1987; 327 (6122): 524–526. PMID: 3495737, DOI: 10.1038/327524a0
11. Landry D.W., Oliver J.A. The pathogenesis of vasodilatory shock. N Engl J Med. 2001; 345: 588–595. DOI: 10.1056/NEJMra002709
12. Riedo F.X., Munford R.S., Campbell W.B., Reisch J.S., Chien K.R., Gerard R.D. Deacylated lipopolysaccharide inhibits plasminogen activator inhibitor-1, prostacyclin, and prostaglandin E2 induction by lipopolysaccharide but not by tumor necrosis factor-alpha. J Immunol. 1990; 144 (9): 3506–3512. PMID: 2109778
13. Parkington H.C., Coleman H.A., Tare M. Prostacyclin and endothelium dependent hyperpolarization. Pharmacol Res. 2004; 49 (6): 509–514. PMID: 15026028, DOI: 10.1016/j.phrs.2003.11.012.
14. Narumiya S., Sugimoto Y., Ushikubi F. Prostanoid receptors: structures, properties, and functions. Physiol Rev. 1999; 79 (4): 1193–1226. PMID: 10508233, DOI: 10.1152/physrev.1999.79.4.1193
15. Yanagisawa M., Kurihara H., Kimura S., Tomobe Y., Kobayashi M., Mitsui Y., Yazaki Y., Goto K., Masaki T. A novel potent vasoconstrictor peptide produced by vascular endothelial cells. Nature. 1988; 332 (6163): 411–415. PMID: 2451132, DOI: 10.1038/332411a0
16. Luscher T.F., Barton M. Endothelins and endothelin receptor antagonists: therapeutic considerations for a novel class of cardiovascular drugs. Circulation. 2000; 102 (19): 2434–2440. PMID: 11067800, DOI: 10.1161/01.cir.102.19.2434
17. Ильина Я.Ю., Фот Е.В., Кузьков В.В., Киров М.Ю. Сепсис-индуцированное повреждение эндотелиального гликокаликса (обзор литературы). Вестник интенсивной терапии имени А.И. Салтанова. 2019; 2: 32–39 DOI: 10.21320/1818-474X-2019-2-32-39
18. Yeager M.E., Belchenko D.D., Nguyen C.M., Colvin K.L., Ivy D.D., Stenmark K.R. Endothelin-1, the unfolded protein response, and persistent inflammation: role of pulmonary artery smooth muscle cells. Am J Respir Cell Mol Biol. 2012; 46 (1): 14–22. PMID: 21778413, DOI: 10.1165/rcmb.2010-0506OC.
19. Kimmoun A., Novy E., Auchet T., Ducrocq N., Levy B. Hemodynamic consequences of severe lactic acidosis in shock states: from bench to bedside. Crit Care. 2015; 19: 175–187. PMID: 25887061, DOI: 10.1186/s13054-015-0896-7
20. Russell J.A. Bench-to-bedside review: vasopressin in the management of septic shock. Crit Care. 2011; 15 (4): 226–244. PMID: 21892977, DOI: 10.1186/cc8224
21. Velissaris D., Karamouzos V., Ktenopoulos N., Pierrakos C., Karanikolas M. The use of sodium bicarbonate in the treatment of acidosis in sepsis: a literature update on a long term debate. Crit Care Res Pract. 2015; 2015: 605–830. PMID: 26294968, DOI: 10.1155/2015/605830
22. Förstermann U., Münzel T. Endothelial nitric oxide synthase in vascular disease: from marvel to menace. Circulation. 2006; 113 (13): 1708–1714. PMID: 16585403, DOI: 10.1161/CIRCULATIONAHA.105.602532
23. Marik P.E., Khangoora V., Rivera R., Hooper M.H., Catravas J. Hydrocortisone, vitamin C and thiamine for the treatment of severe Sepsis and septic shock: a retrospective before-after study. Chest. 2017; 151 (6): 1229–1238. PMID: 27940189, DOI: 10.1016/j.chest.2016.11.036.
24. Liaudet L., Rosenblatt-Velin N., Pacher P. Role of peroxynitrite in the cardiovascular dysfunction of septic shock. Curr Vasc Pharmacol. 2013; 11 (2): 196–207. PMID: 23506498, DOI: 10.2174/1570161111311020009.
25. Szabo C. Hydrogen sulphide and its therapeutic potential. Nat Rev Drug Discov. 2007; 6 (11): 917–935. PMID: 17948022, DOI: 10.1038/nrd2425
27. Ali M.Y., Ping C.Y., Mok Y.Y., Ling L., Whiteman M., Bhatia M., Moore P.K. Regulation of vascular nitric oxide in vitro and in vivo; a new role for endogenous hydrogen sulphide? Br J Pharmacol. 2006; 149 (6): 625–634. PMID: 17016507, DOI: 10.1038/sj.bjp.0706906
28. Keung E.C., Li Q. Lactate activates ATP-sensitive potassium channels in Guinea pig ventricular myocytes. J Clin Invest. 1991; 88 (5): 1772– 1777. PMID: 1939661, DOI: 10.1172/JCI115497
29. Levy B., Fritz C., Tahon E., Jacquot A., Auchet T., Kimmoun A. Vasoplegia treatments: the past, the present, and the future. Crit Care. 2018; 22 (1): 52–62. PMID: 29486781, DOI: 10.1186/s13054-018-1967-3.
30. Kimmoun A., Ducrocq N., Levy B. Mechanisms of vascular hyporesponsiveness in septic shock. Curr Vasc Pharmacol. 2013; 11: 139–149. PMID: 23506493, DOI: 10.2174/1570161111311020004
31. Ghosh S., Liu M.S. Changes in alpha-adrenergic receptors in dog livers during endotoxic shock. J Surg Res. 1983; 34 (3): 239–245. PMID: 6300552, DOI: 10.1016/0022-4804(83)90066-5.
32. Barrett L.K, Singer M., Clapp L.H. Vasopressin: mechanisms of action on the vasculature in health and in septic shock. Crit Care Med. 2007; 35: 33–40. PMID: 17133186, DOI: 10.1097/01.CCM.0000251127.45385.CD
33. Morales D., Madigan J., Cullinane S., Chen J., Heath M., Oz M., Oliver J.A., Landry D.W. Reversal by vasopressin of intractable hypotension in the late phase of hemorrhagic shock. Circulation. 1999; 100: 226–229. PMID: 10411844, DOI: 10.1161/01.cir.100.3.226
34. Spink J., Cohen J., Evans T.J. The cytokine responsive vascular smooth muscle cell enhancer of inducible nitric oxide synthase. Activation by nuclear factor-kappa B. J Biol Chem. 1995; 270 (49): 29541–7. PMID: 7493996, DOI: 10.1074/jbc.270.49.29541
35. Boillot A., Massol J., Maupoil V., Grelier R., Bernard B., Capellier G., Berthelot A., Barale F. Myocardial and vascular adrenergic alterations in a rat model of endotoxin shock: reversal by an antitumor necrosis factor-alpha monoclonal antibody. Crit Care Med. 1997; 25: 504–511. PMID: 9118669, DOI: 10.1097/00003246-199703000-00021
36. Сапичева Ю.Ю., Лихванцев В.В., Петровская Э.Л., Лопатин А.Ф. Тактика ведения пациентов с сепсисом и септическим шоком в многопрофильном стационаре. Москва: Москва; 2015. 35 с. ISBN 978-5-98511-299-3
37. Rachoin J.-S. and Dellinger R. Timing of norepinephrine in septic patients: NOT too little too late. Crit Care. 2014; 18 (6): 691–692. PMID: 25672524, DOI: 10.1186/s13054-014-0691-x.
38. Arslantas M.K., Gul F., Kararmaz A., Sungur F., Ayanoglu H.O., Cinel I. Early administration of low dose norepinephrine for the prevention of organ dysfunctions in patients with sepsis. Intensive Care Med Exp. 2015; 3 (1): A417–418. PMCID: PMC4798466, DOI: 10.1186/2197-425X-3-S1-A417-418
39. Dubin A., Lattanzio B., Gatti L. The spectrum of cardiovascular effects of dobutamine — from healthy subjects to septic shock patients. Rev Bras Ter Intensiva. 2017; 29 (4): 490–498. PMID: 29340539, DOI: 10.5935/0103-507X.20170068
40. Avni T., Lador A., Lev S., Leibovici L., Paul M., Grossman A. Vasopressors for the treatment of septic shock: systematic review and metaanalysis. PLoS One. 2015; 10 (8): e0129305. PMID: 26237037, DOI: 10.1371/journal.pone.0129305
41. Myburgh J.A., Higgins A., Jovanovska A., Lipman J., Ramakrishnan N., Santamaria J. A comparison of epinephrine and norepinephrine in critically ill patients. Intensive Care Med. 2008; 34 (12): 2226–2234. PMID: 18654759, DOI 10.1007/s00134-008-1219-0.
42. Zhou F., Mao Z., Zeng X., Kang H., Liu H., Pan L., Hou P.C. Vasopressors in septic shock: a systematic review and network meta-analysis. Ther Clin Risk Manag. 2015; 11: 1047–1059. PMID: 26203253, DOI: 10.2147/TCRM.S80060
43. Nagendran M., Maruthappu M., Gordon A.C., Gurusamy K.S. Comparative safety and efficacy of vasopressors for mortality in septic shock: A network meta-analysis. J Intensive Care Soc. 2016; 17 (2): 136–145. PMID: 28979478, DOI: 10.1177/1751143715620203
44. De Backer D., Biston P., Devriendt J., Madl C., Chochrad D., Aldecoa C., Brasseur A., Defrance P., Gottignies P., Vincent J.L. Comparison of dopamine and norepinephrine in the treatment of shock. N Engl J Med. 2010; 362 (9): 779–789. PMID: 20200382, DOI: 10.1056/NEJ-Moa0907118
45. Galley H.F. Renal-dose dopamine: will the message now get through? Lancet. 2000; 356 (9248): 2112–2113. PMID: 11191531, DOI: 10.1016/S0140-6736(00)03484-X
46. De Backer D., Aldecoa C., Njimi H., Vincent J.L. Dopamine versus norepinephrine in the treatment of septic shock: a meta-analysis. Crit Care Med. 2012; 40 (3): 725–730. PMID: 22036860, DOI: 10.1097/CCM.0b013e31823778ee
47. Stratton L., Berlin D.A., Arbo J.A. Vasopressors and Inotropes in Sepsis. Emerg Med Clin North Am. 2017; 35 (1): 75–91. PMID: 27908339, DOI: 10.1016/j.emc.2016.09.005.
48. Jain G., Singh D.K. Comparison of phenylephrine and norepinephrine in the management of dopamine-resistant septic shock. Indian J Crit Care Med. 2010; 14 (1): 29–34. PMID: 20606906, DOI: 10.4103/0972-5229.63033.
49. Дмитриева Н.В., Петухова И.Н., Громова Е.Г. Сепсис: избранные вопросы диагностики и лечения. Москва: ИД «АБВпресс». 2018: 416 с. ISBN 978-5-903018-55-0
50. Beurton A., Ducrocq N., Auchet. T, Joineau-Groubatch F., Falanga A., Kimmoun A., Girerd N., Fay R., Vanhuyse F., Tran N., Levy B. Beneficial effects of norepinephrine alone on cardiovascular function and tissue oxygenation in a pig model of cardiogenic shock. Shock. 2016; 46 (2): 214–218. PMID: 26849625, DOI: 10.1097/SHK.0000000000000579
51. Khanna A., English S.W., Wang X.S., Ham K., Tumlin J., Szerlip H., Busse L.W., Altaweel L., Albertson T.E., Mackey C., McCurdy M.T., Boldt D.W., Chock S., Young P.J., Krell K., Wunderink R.G., Ostermann M., Murugan R., Gong M.N., Panwar R., Hästbacka J., Favory R., Venkatesh B., Thompson B.T., Bellomo R., Jensen J., Kroll S., Chawla L.S., Tidmarsh G.F., Deane A.M. Angiotensin II for the treatment of vasodilatory shock. N Engl J Med. 2017; 377 (5): 419–430. PMID: 28528561, DOI: 10.1056/NEJMoa1704154
52. Bassi E., Park M., Azevedo L.C. Therapeutic strategies for high-dose vasopressor-dependent shock. Crit Care Res Pract. 2013; 2013: 654– 708. PMID: 24151551, DOI: 10.1155/2013/654708
53. Jentzer J.C., Coons J.C., Link C.B., Schmidhofer M. Pharmacotherapy update on the use of vasopressors and inotropes in the intensive care unit. J Cardiovasc Pharmacol Ther. 2015; 20 (3): 249–260. PMID: 25432872, DOI: 10.1177/1074248414559838
54. Auchet T., Regnier M.-A., Girerd N., Levy B. Outcome of patients with septic shock and high-dose vasopressor therapy. Ann Intensive Care. 2017; 7: 43–51. PMID: 28425079, DOI: 10.1186/s13613-017-0261-x
55. Shin J.Y., Roh S.G., Lee K.M., Yang K.M. Ischemic Necrosis of Upper Lip, and All Fingers and Toes After Norepinephrine Use. J Craniofac Surg. 2016; 27 (2): 453–454. PMID: 26854781, DOI: 10.1097/SCS.0000000000002463.
56. Cox J., Roche S. Vasopressors and development of pressure ulcers in adult critical care patients. Am J Crit Care. 2015; 24 (6): 501–510. PMID: 26523008, DOI: 10.4037/ajcc2015123
57. Medina-Concepción A., del Cristo Acosta-Ramos M., Pérez-García I., García-Díaz A., Plasencia-Hernández C., Díaz-Melián A., Jiménez-Sosa A. Effect of infused norepinephrine dosage on pressure ulcers in perianesthesia care unit patients: a pilot study. J Perianesth Nurs. 2011; 26 (1): 25–34. PMID: 21276546, DOI: 10.1016/j.jopan.2010.11.002
58. Theaker C., Mannan M., Ives N., Soni N. Risk factors for pressure sores in the critically ill. Anaesthesia. 2000; 55 (3): 221–224. PMID: 10671839, DOI: 10.1046/j.1365-2044.2000.01216.x
59. Yamamura H., Kawazoe Y., Miyamoto K., Yamamoto T., Ohta Y., Morimoto T. Effect of norepinephrine dosage on mortality in patients with septic shock. J Intensive Care. 2018; 6: 12–18. PMID: 29497535, DOI: 10.1186/s40560-018-0280-1
60. Martin C., Medam S., Antonini F., Alingrin J., Haddam M., Meyssignac B., Vigne C., Zieleskiewicz L., Leone M. Norepinephrine: not too much, too long. Shock. 2015; 44 (4): 305–309. PMID: 26125087, DOI: 10.1097/SHK.0000000000000426.
61. Jenkins C.R., Gomersall C.D., Leung P., Joynt G.M. Outcome of patients receiving high dose vasopressor therapy: a retrospective cohort study. Anaesth Intensive Care. 2009; 37 (2): 286–289. PMID: 19400494, DOI: 10.1177/0310057X0903700212.
62. Wu J.Y., Stollings J.L., Wheeler A.P., Semler M.W., Rice T.W. Efficacy and Outcomes After Vasopressin Guideline Implementation in Septic Shock. Ann Pharmacother. 2017; 51 (1) 13–20. PMID: 27630192, DOI: 10.1177/1060028016669163
63. Козлов И. А., Тюрин И. Н., Раутбарт С. А. Ранние гемодинамические предикторы летального исхода абдоминального сепсиса. Вестник анестезиологии и реаниматологии. 2018; 15 (2): 6–15. DOI: 10.21292/2078-5658-2018-15-2-6-15
64. Enrico C., Kanoore Edul V.S., Vazquez A.R., Pein M.C., Pérez de la Hoz R.A., Ince C., Dubin A. Systemic and microcirculatory effects of dobutamine in patients with septic shock. J Crit Care. 2012; 27 (6): 630– 638. PMID: 23084135, DOI: 10.1016/j.jcrc.2012.08.002
65. Sato R., Nasu M. A review of sepsis-induced cardiomyopathy. J Intensive Care. 2015; 3: 48–54. PMID: 26566443, DOI: 10.1186/s40560-015-0112-5
66. Marks J.A., Pascual J.L. Selepressin in septic shock: sharpening the VASST effects of vasopressin? Crit Care Med. 2014; 42 (7): 1747–1748. PMID: 24933060, DOI: 10.1097/CCM.0000000000000420.
67. Russell J.A., Fjell C., Hsu J.L., Lee T., Boyd J., Thair S., Singer J., Patterson A.J., Walley K.R. Vasopressin compared with norepinephrine augments the decline of plasma cytokine levels in septic shock. Am J Respir Crit Care Med. 2013; 188: 356–364. PMID: 23796235, DOI: 10.1164/rccm.201302-0355OC
68. Dünser M.W., Mayr A.J., Tür A., Pajk W., Barbara F., Knotzer H., Ulmer H., Hasibeder W.R. Ischemic skin lesions as a complication of continuous vasopressin infusion in catecholamine resistant vasodilatory shock: incidence and risk factors. Crit Care Med. 2003; 31 (5): 1394– 1398. PMID: 12771608, DOI: 10.1097/01.CCM.0000059722.94182.79.
69. Patel B.M., Chittock D.R., Russell J.A., Walley K.R. Beneficial affects of short-term vasopressin infusion during severe septic shock. Anesthesiology. 2002; 96 (3): 576–582. PMID: 11873030, DOI: 10.1097/00000542-200203000-00011
70. Xiao X., Zhang J., Wang Y., Zhou J., Zhu Y., Jiang D., Liu L., Li T. Effects of terlipressin on patients with sepsis via improving tissue blood flow. J Surg Res. 2016; 200 (1): 274–282. PMID: 26253455, DOI: 10.1016/j.jss.2015.07.016
71. Bihari S., Prakash S., Bersten A. Low-dose vasopressin in addition to noradrenaline may lead to faster resolution of organ failure in patients with severe sepsis/septic shock. Anaesth Intensive Care. 2014; 42 (2): 671–674. PMID: 25233186
72. Hammond D.A, Ficek O.A., Painter J.T., McCain K., Cullen J., Brotherton A.L., Kakkera K., Chopra D., Meena N. Prospective, open-label trial of early, concomitant vasopressin and norepinephrine therapy versus initial norepinephrine monotherapy in septic shock. Pharmacotherapy. 2018; 38 (5): 531–538. PMID: 29600824, DOI: 10.1002/phar.2105.
73. Morelli A., Ertmer C., Rehberg S., Lange M., Orecchioni A., Cecchini V., Bachetoni A., D’Alessandro M., Van Aken H., Pietropaoli P., Westphal M. Continuous terlipressin versus vasopressin infusion in septic shock (TERLIVAP): a randomized, controlled pilot study. Crit Care. 2009; 13 (4): R130–143. PMID: 19664253, DOI: 10.1186/cc7990
74. Zhou F.H., Song Q. Clinical trials comparing norepinephrine with vasopressin in patients with septic shock: a meta-analysis. Mil Med Res. 2014; 1: 6–12. PMID: 25722864, DOI: 10.1186/2054-9369-1-6
75. Russell J.A., Walley K.R., Singer J., Gordon A.C., Hebert P.C., Cooper D.J., Holmes C.L., Mehta S., Granton J.T., Storms M.M., Cook D.J., Presneill J.J., Ayers D. Vasopressin versus norepinephrine infusion in patients with septic shock. N Engl J Med. 2008; 358 (9): 877–887. PMID: 18305265, DOI: 10.1056/NEJMoa067373.
76. O’Brien A., Clapp L., Singer M. Terlipressin for norepinephrine-resistant septic shock. Lancet. 2002; 359 (9313): 1209–1210. PMID: 11955542, DOI: 10.1016/S0140-6736(02)08225-9
77. Svoboda P., Scheer P., Kantorova I., Doubek J., Dudra J., Radvan M., Radvanova J. Terlipressin in the treatment of late phase catecholamine-resistant septic shock. Hepato-gastroenterology. 2012; 59 (116): 1043–1047. PMID: 22580654, DOI: 10.5754/hge10550
78. Asfar P., Hauser B., Ivanyi Z., Ehrmann U., Kick J., Albicini M., Vogt J., Wachter U., Bruckner U.B., Radermacher P., Bracht H. Low-dose terlipressin during long-term hyperdynamic porcine endotoxemia: effects on hepatosplanchnic perfusion, oxygen exchange, and metabolism. Crit Care Med. 2005; 33 (2): 373–380. PMID: 15699842, DOI: 10.1097/01.ccm.0000152253.45901.fb
79. Morelli A., Donati A., Ertmer C., Rehberg S., Kampmeier T., Orecchioni A., Di Russo A., D’Egidio A., Landoni G., Lombrano M.R., Botticelli L., Valentini A., Zangrillo A., Pietropaoli P., Westphal M. Effects of vasopressinergic receptor agonists on sublingual microcirculation in norepinephrine-dependent septic shock. Crit Care. 2011; 15 (5): R217– 226. PMID: 21929764, DOI: 10.1186/cc10453
80. Choudhury A., Kedarisetty C.K., Vashishtha C., Saini D., Kumar S., Maiwall R., Sharma M.K., Bhadoria A.S., Kumar G., Joshi Y.K., Sarin S.K. A randomized trial comparing terlipressin and noradrenaline in patients with cirrhosis and septic shock. Liver Int. 2017; 37 (4): 552–561. PMID: 27633962, DOI: 10.1111/liv.13252.
81. Morelli A., Ertmer C., Lange M., Dunser M., Rehberg S., Van Aken H., Pietropaoli P., Westphal M. Effects of short-term simultaneous infusion of dobutamine and terlipressin in patients with septic shock: the DOBUPRESS study. Br J Anaesth. 2008; 100 (4): 494–503. PMID: 18308741, DOI: 10.1093/bja/aen017
82. Zhu Y., Huang H., Xi X., Du B. Terlipressin for septic shock patients: a meta-analysis of randomized controlled study. Journal of Intensive Care. 2019; 7: 16–24. DOI: 10.1186/s40560-019-0369-1
83. Russell J.A., Vincent J.L., Kjolbye A.L., Olsson H., Blemings O., Spapen H., Carl P., Laterre P.-F., Grundermar L. Selepressin, a novel selective vasopressin V1A agonist, is an effective substitute for norepinephrine in a phase IIa randomized, placebo-controlled trial in septic shock patients. Crit Care. 2017; 21 (1): 213–222. PMID: 28807037. DOI: 10.1186/s13054-017-1798-7.
84. Gutteling J., Armand R.J. Girbes. Vasoactive medication and RCTs: an impossible marriage. ICU Management & Practice. 2018; 18 (3): 164–170.
85. Chawla L.S., Busse L., Brasha-Mitchell E., Davison D., Honig J., Alotaibi Z., Seneff M.G. Intravenous angiotensin II for the treatment of high-output shock (ATHOS trial): a pilot study. Crit Care. 2014; 18 (5): 534–542. PMID: 25286986, DOI: 10.1186/s13054-014-0534-9
86. Jentzer J.C., Vallabhajosyula S., Khanna A.K., Chawla L.S., Busse L.W., Kashani K.B. Management of Refractory Vasodilatory Shock. Chest. 2018; 154 (2): 416–426 PMID: 29329694, DOI: 10.1016/j.chest.2017.12.021.
87. Kwok E.S., Howes D. Use of methylene blue in sepsis: a systematic review. J Intensive Care Med. 2006; 21: 359–363. PMID: 17095500, DOI: 10.1177/0885066606290671
88. Kirov M.Y., Evgenov O.V., Evgenov N.V., Egorina E.M., Sovershaev M.A., Sveinbjørnsson B., Nedashkovsky E.V., Bjertnaes L.J. Infusion of methylene blue in human septic shock: a pilot, randomized, controlled study. Crit Care Med. 2001; 29: 1860–1867. PMID: 11588440, DOI: 10.1097/00003246-200110000-00002
89. Волков В.Е., Волков С.В. Роль глюкокортикойдных гормонов и вазопрессоров в комплексной терапии септического шока. Acta medica Eurasica. 2018; 4: 1–8
Для цитирования:
Кочкин А.А., Яворовский А.Г., Берикашвили Л.Б., Лихванцев В.В. Современная вазопрессорная терапия септического шока (обзор). Общая реаниматология. 2020;16(2):77-93. https://doi.org/10.15360/1813-9779-2020-2-77-93
For citation:
Kochkin A.A., Yavorovskiy A.G., Berikashvili L.B., Likhvantsev V.V. Modern Vasopressor Therapy of Septic Shock (Review). General Reanimatology. 2020;16(2):77-93. https://doi.org/10.15360/1813-9779-2020-2-77-93