васкуляризация лимфоузлов что это такое
Метастатическое поражение шейных лимфатических узлов
Шейные лимфатические узлы являются частым местом метастазирования злокачественных опухолей, первичный очаг которых располагается в области головы и шеи. К ним, например, относятся плоскоклеточный рак верхних отделов дыхательных путей, а также метастазы рака слюнных желез и щитовидной железы.
Наиболее распространенным клиническим признаком является увеличивающееся образование шеи, которое обычно обнаруживается пациентом или его врачом. При подозрении на метастатическое поражения лимфатических узлов шеи для диагностики и определения наилучшей тактики лечения потребуется осмотр врачом-онкологом, инструментальные методы и биопсия.
Иногда новообразования вне области головы и шеи могут неожиданно метастазировать в шейные лимфатические узлы, что требует особенно тщательной диагностики для выявления первичного очага.
Лечение будет зависеть от типа и локализации первичной опухоли, которая распространилась в лимфатические узлы шеи, и, скорее всего, будет включать в себя комбинацию хирургического вмешательства, лучевой терапии и/или химиотерапии.
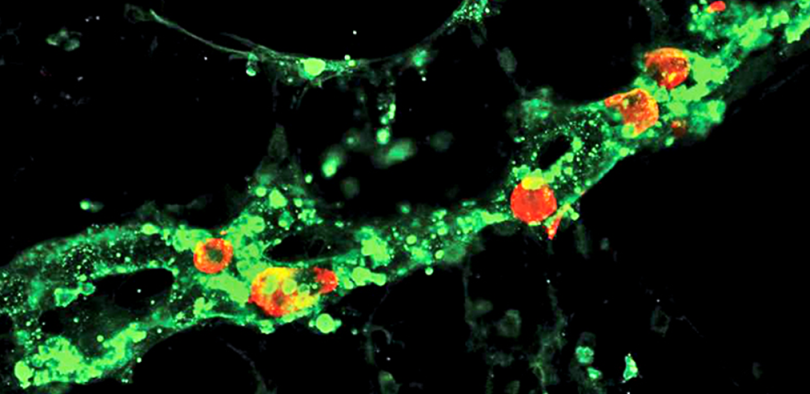
Иммунофлюоресцентная визуализация метастатических клеток меланомы (красные) внутри лимфатических сосудов (зеленые). Масштабная линейка: 100 мкм
(Science Advances/Michael Detmar Group ©)
Из чего состоит лимфатическая система шеи
Лимфатическая система шеи включает в себя сосуды и узлы.
Лимфатические капилляры — это тонкостенные структуры, состоящие из одного слоя эндотелиальных клеток. Они находятся во всех тканях организма и, объединяясь друг с другом, способствуют оттоку лимфатической жидкости в более крупные лимфатические сосуды.
Стенка лимфатических сосудов состоит из трех слоев: внутреннего слоя эндотелиальных клеток, среднего мышечного слоя и внешнего слоя соединительной ткани. В лимфатических сосудах гораздо больше клапанов, чем в венозных, при этом циркуляция лимфы полностью зависит от сжатия сосудов окружающими мышцами. Лимфатические сосуды дренируют лимфу в лимфатические узлы.
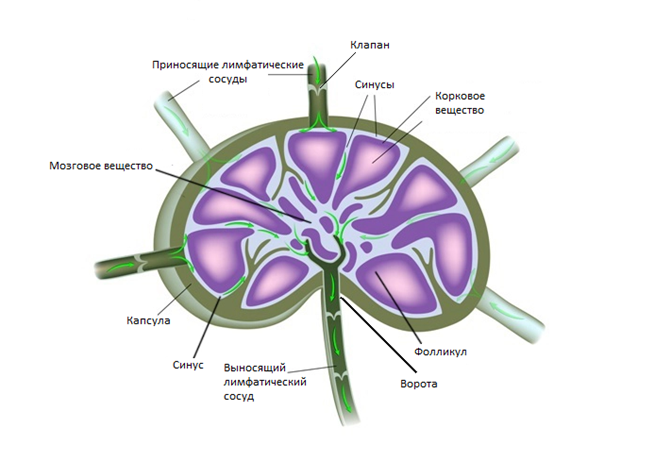
В среднем на каждой стороне шеи расположено до 75 лимфатических узлов. Снаружи узел покрывает капсула, под которой располагается субкапсулярные синусы – место куда попадает лимфатическая жидкость из приносящих лимфатических сосудов. Жидкость проходит сквозь ткань лимфатического узла, которая состоит из коркового и мозгового вещества, а затем выходит через ворота лимфатического узла и попадает в отводящие лимфатические сосуды. В итоге лимфа попадает в венозную систему в месте соустья внутренней яремной и подключичной вены.
Анатомическая структура лимфатического узла (Alila Medical Media/ Shutterstock ©)
Классификация лимфатических узлов шеи
На данный момент во всем мире рекомендована к использованию классификация Американского объединенного комитета по раку (American Joint Committee on Cancer (AJCC)) 8 издания от 2018 года:
Уровни лимфатических узлов шеи (Tenese Winslow LLC ©)
Диагностика
Осмотр
При пальпации шеи врач обращает внимание на расположение, размер, плотность и подвижность каждого узла. Особое внимание уделяется узлам, которые кажутся фиксированными к подлежащим сосудисто-нервным структурам и внутренним органам. Описание каждого узла становится важной частью медицинской документации, которая в дальнейшем может использоваться для оценки эффекта лечения.
Лучевые методы
Преимуществами УЗИ перед другими методами визуализации являются цена, скорость исследования и низкая лучевая нагрузка на пациента.
Ультразвуковыми признаками метастатического поражения лимфатических узлов может быть образование сферической формы, нарушение структуры, нечеткие границы, наличие центрального некроза и др.
Поскольку не всегда по УЗИ можно с уверенностью сказать является лимфатический узел пораженным или нет, иногда одновременно выполняют тонкоигольную аспирационную биопсию под ультразвуковым контролем с последующим цитологическим исследованием материала из этого узла. Результат цитологического исследования зависит от навыков врача УЗИ и качества образца (т.е. наличия достаточного количества репрезентативных клеток).
С появлением систем высокого разрешения и специальных контрастных веществ КТ позволяет обнаруживать лимфатические узлы, которые могли быть пропущены при иных методах диагностики.
Ценность МРТ – превосходная детализация мягких тканей. МРТ превосходит КТ в качестве предпочтительного исследования при оценке ряда новообразований головы и шеи, таких как основание языка и слюнные железы. Размер, наличие нескольких увеличенных узлов и центральный некроз – критерии, общие для протоколов исследования КТ и МРТ.
Этот новый метод визуализации все чаще используется для определения стадии опухолей головы и шеи. Метод основан на поглощении 2-фтор-2-дезокси-D-глюкозы (ФДГ) метаболически активными тканями. Исследование также может быть объединено с КТ, чтобы улучшить разрешение получаемого изображения и более точно определить расположение образования.
Биопсия
Биопсия — это удаление небольшого кусочка ткани для исследования под микроскопом или для тестирования в лаборатории на предмет наличия признаков злокачественности. В подавляющем большинстве случаев проводится тонкоигольная аспирационная биопсия. Врач, выполняющий биопсию, может использовать УЗИ или КТ для выполнения процедуры. Иногда тонкоигольная аспирационная биопсия не позволяет поставить окончательный диагноз, и требуются другие виды биопсии, такие как трепан-биопсия или эксцизионная биопсия.
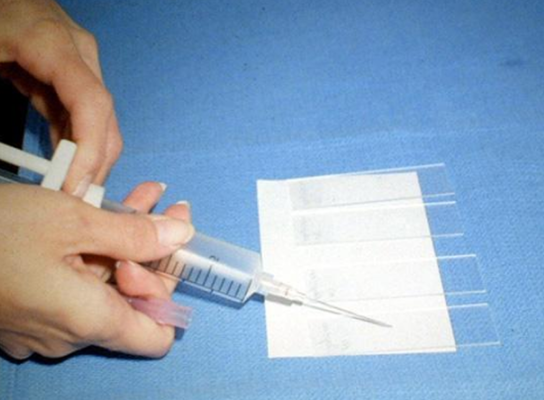 | 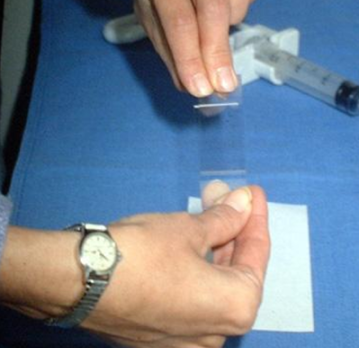 |
| Процесс приготовления предметных стекол для цитологического исследования. Материалом служит содержимое шприца после выполнения тонкоигольной аспирационной биопсии | |
План лечения
После определения диагноза и проведения всех диагностических исследований врач порекомендует оптимальный для пациента курс лечения. В конечном итоге лечение метастатического поражения лимфатических узлов зависит от типа и локализации первичной опухоли.
Существует три различных варианта лечения, которые могут быть использованы отдельно или в комбинации:
Хирургическое лечение
Хирургическое лечение обычно включает удаление лимфатических узлов шеи (лимфодиссекция) и последующее гистологическое исследование для точного определения стадии, так как это может существенно повлиять на дальнейшую тактику лечения. Хоть и не всегда, но чаще всего лимфодиссекция выполняется одновременно с удалением первичной опухоли.
Существуют различные виды лимфодиссекций:
Лучевая терапия
Лучевая терапия может быть назначена в качестве самостоятельного метода лечения в послеоперационном периоде, чтобы снизить вероятность рецидива либо в комбинации с химиотерапией в качестве самостоятельного или адъювантного лечения. Обычно адъювантная лучевая терапия необходима, если по результатам гистологического исследования обнаруживается несколько пораженных лимфатических узлов.
Химиотерапия
Химиотерапия обычно добавляется к лучевой терапии в качестве самостоятельного или адъювантного (послеоперационного) лечения. В некоторых случаях может использоваться индукционная химиотерапия с целью уменьшения объема образования и последующего хирургического вмешательства.
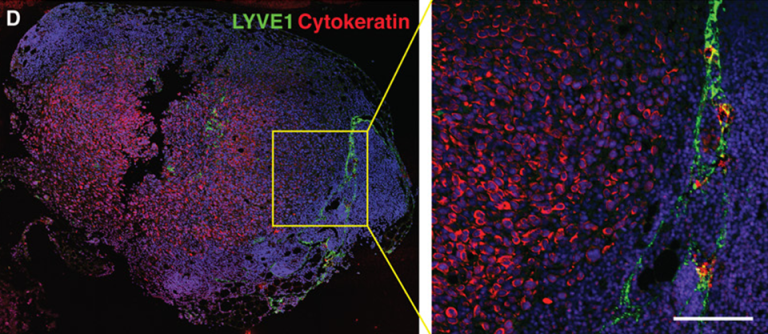
Иммунофлюоресцентная визуализация метастатически пораженного лимфатического узла с окраской на Цитокератин (красный) – маркер характерный для опухолевых клеток эпителиального происхождения. Масштабная линейка: 50 мкм
(Science Advances/Michael Detmar Group ©)
Прогноз
Метастазы в лимфатические узлы шеи могут возникать при онкологических заболеваниях различных локализаций, поэтому давать прогностические оценки для этой группы пациентов следует только после выявления первичной опухоли.
Факторы, влияющие на прогноз:
Наблюдение после лечения
Пациенты должны регулярно посещать своего специалиста по опухолям головы и шеи для оценки состояния на предмет любых признаков рецидива заболевания.
Стандартный график наблюдения
В первые 1–2 года осмотр и сбор жалоб рекомендуется проводить каждые 3–6 месяца, на сроке 3–5 лет – один раз в 6–12 месяцев. После 5 лет с момента операции посещать врача необходимо один раз в год или при появлении жалоб. У пациентов с высоким риском рецидива перерыв между обследованиями может быть сокращен.
Список литературы:
Авторская публикация:
Амиров Николай Сергеевич
Клинический ординатор НМИЦ онкологии им. Н.Н. Петрова
Под научной редакцией:
Раджабова З.А.
Заведующий отделением опухолей головы и шеи
НМИЦ онкологии им. Н.Н. Петрова,
врач-онколог, научный сотрудник, кандидат медицинских наук, доцент
Васкуляризация лимфоузлов что это такое
Рак молочной железы (РМЖ) продолжает оставаться одной из наиболее значимых медико-социальных проблем, поскольку за последние десятилетия не отмечено ни значительного снижения первичного выявления этой патологии (по среднемировым оценкам – 46,3 на 100 тыс. населения, более 40% от всех злокачественных опухолевых процессов у женщин) [1, 2], ни существенного прогресса в предотвращении рецидивов РМЖ, метастазирования опухолевых клеток, что влияет на качество жизни пациентов и их выживаемость (смертность – 13,0 на 100 тыс.). Следует отметить, что около 19% случаев РМЖ диагностируется у женщин в возрасте от 30 до 49 лет, 44% случаев – у женщин в возрасте 65 лет и старше [2]. Одним из безусловных достижений последних десятилетий является снижение смертности от РМЖ в ряде развитых стран, особенно в молодом возрасте, что в основном связывают с внедрением программ раннего скрининга РМЖ с помощью маммографии и разработкой новых, более эффективных противоопухолевых препаратов [3]. В то же время важно подчеркнуть, что во многих развивающихся странах смертность от РМЖ не снижается или растет, что обусловливает общее увеличение смертности от РМЖ в мире в последние десятилетия.
Такая динамика заболеваемости и смертности от РМЖ обусловливает необходимость всестороннего изучения данной патологии, особенно факторов риска, генетической предрасположенности, молекулярных механизмов прогрессирования опухолевого роста, метастазирования опухолевых клеток, а также выделения маркеров прогноза исхода заболевания после проведения хирургического и/или химиотерапевтического лечения [4, 5]. К ценным прогностическим маркерам выживаемости при РМЖ наряду с гистологическим типом опухоли и степенью ее злокачественности относят так называемую вовлеченность регионарных лимфатических узлов в опухолевый процесс, а именно наличие или отсутствие в них метастазов [6]. По данным некоторых авторов, при вовлеченности в опухолевый процесс 10 и более аксиллярных лимфатических узлов риск смерти от РМЖ в течение 10 лет возрастает на 70% по сравнению с теми индивидами, у которых в патологический процесс вовлечены 1–3 лимфатических узла [7]. В связи с этим большое внимание в последнее время уделяется выяснению значимости, надежности и безопасности биопсии аксиллярных лимфатических узлов при РМЖ для установления их метастатического статуса до и после неоадъювантной химиотерапии и, как следствие, для оценки эффективности лечения и определения возможной продолжительности жизни [8–10]. Не все авторы одинаково высоко оценивают диагностическую и прогностическую значимость биопсий лимфатических узлов, нередко подчеркивают, что она разнится в зависимости от гистологических вариантов РМЖ, эффективности химиотерапии или статуса лимфатических узлов после химиотерапии [8, 11], но все исследователи считают необходимым продолжение детального изучения лимфатических узлов при РМЖ с целью получения дополнительной информации о характере их структурной реорганизации, в том числе и при отсутствии в них метастазов.
Анализ литературы свидетельствует о том, что основное внимание при изучении регионарных лимфатических узлов уделяется выяснению их метастатического статуса и его изменению после химиотерапии. Другие структурные преобразования лимфатических узлов, как правило, не оцениваются, что не позволяет устанавливать весь спектр негативных эффектов злокачественного опухолевого роста, в том числе РМЖ, на функционально и анатомически связанные с неопластическими очагами органы и ткани. Значительная структурная реорганизация лимфатических узлов, которые относятся к периферическим органам иммунной системы, может негативно влиять на созревание иммунокомпетентных клеток и, как следствие, на развитие иммунных реакций, что может усугублять состояние онкологических больных, снижать качество их жизни после химиотерапевтического и хирургического лечения [12]. Следует также отметить недостаточное использование структурно-функциональных характеристик лимфатических узлов без метастазов для разработки прогностических критериев не только долгосрочной выживаемости, но и развития коморбидной патологии с учетом агрессивности опухолевого процесса.
Цель работы – с помощью комплексного патоморфологического анализа с применением методов морфометрии и иммуногистохимии изучить выраженность склеротических процессов и интенсивность ангиогенеза в аксиллярных лимфатических узлах пациентов на разных стадиях РМЖ.
Материал и методы исследования
Исследования выполнены в соответствии с этическими принципами проведения медицинских исследований с участием людей в качестве субъектов исследования, изложенных в Хельсинкской декларации Всемирной медицинской ассоциации.
Подмышечные лимфатические узлы фиксировали в 10%-ном растворе нейтрального формалина и обрабатывали по стандартной методике для заключения в парафин. Срезы окрашивали гематоксилином и эозином и по ван Гизону. Для иммуногистохимической оценки степени выраженности ангиогенеза использовали моноклональные антитела к CD34-антигену Dako reagents kit. Обработку срезов проводили в соответствии с рекомендациями производителя (Dako, Дания). Окрашенные срезы изучали в световом микроскопе Axioimager M1 (Zeiss, Германия).
Морфометрический анализ структурных компонентов подмышечных лимфатических узлов проводили с использованием объективов х10 (тестовая площадь – 1 400 000 мкм2) и х20 (тестовая площадь – 350 000 мкм2) с использованием программного обеспечения морфологического модуля Axiovision (Zeiss, Германия). На каждом срезе проводили по 5 измерений. Определяли объемную плотность CD34-позитивных структур во всем органе и раздельно в корковом и мозговом веществе, краевом синусе, корковом плато, паракортексе; аналогичным образом оценивали объемную плотность соединительной ткани (при окраске по ван Гизону).
Статистическую обработку результатов проводили с использованием статистической программы MS Excel 7.0 (Microsoft, USA). Вычисляли среднее значение, ошибку среднего, а также коэффициент корреляции по Пирсону (для оценки корреляционных связей между показателями васкуляризации и склеротической трансформации, а также между стадией РМЖ и уровнем развития соединительной ткани или показателями васкуляризации в лимфатических узлах в целом и отдельно в каждой из их структур). Межгрупповые различия определяли по критерию Стьюдента; статистически значимыми считали различия при p