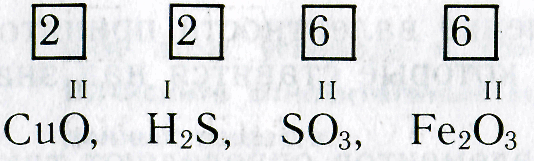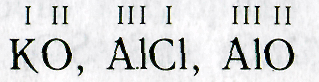валентность и ковалентность чем отличаются
Разница между валентностью и ковалентностью
Главное отличие
Основное различие между валентностью и ковалентностью заключается в том, что валентность — это количество электронов, присутствующих на внешней оболочке атома, тогда как ковалентность — это количество электронных пар, которые может разделить атом.
Валентность против ковалентности
Валентность рассматривается как количество электронов, которое атом приобретает или теряет, чтобы стать стабильным, в то время как ковалентность — это максимальное количество ковалентных связей, которое атом может создать, используя свои свободные орбитали. Валентность может быть равна количеству электронов, присутствующих в валентной оболочке, или наоборот, тогда как ковалентность определяется только количеством электронов, присутствующих в валентной оболочке.
Валентность обычно обеспечивает необходимое количество электронов для завершения всех свободных орбиталей; с другой стороны, ковалентность определяется количеством свободных электронов, существующих в атоме. Валентность устанавливается для элементов, которые могут образовывать ковалентную или ионную связь; напротив, ковалентность может присутствовать только для элементов, которые могут создавать ковалентную связь между ними.
Валентность может иметь положительное или отрицательное значение; и наоборот, ковалентность всегда имеет положительное значение. Валентность серы в SF 6 равна 2; с другой стороны, ковалентность серы в SF 6 равна 6.
Сравнительная таблица
| Валентность | Ковалентность |
| Валентностью считается количество электронов, которые могут быть потеряны или получены для завершения своей октетной оболочки. | Обычно считается, что ковалентность заключается в том, что она содержит наибольшее количество электронов, которые можно разделить с другими атомами. |
| Связь с валентными электронами | |
| Может быть равно количеству электронов, присутствующих в валентной оболочке, или наоборот. | Только определяться количеством электронов, присутствующих в валентной оболочке. |
| Пустые орбитали | |
| Обычно обеспечивает необходимое количество электронов для завершения всех свободных орбиталей. | Определяется количеством свободных электронов в атоме. |
| Тип склеивания | |
| Набор для элементов, которые могут образовывать ковалентную или ионную связь. | Может присутствовать только для элементов, которые могут создавать ковалентную связь между ними. |
| Численная величина | |
| Может иметь положительное или отрицательное значение | Обычно положительное значение |
| Пример | |
| Валентность серы — 2 | Ковалентность серы — 6. |
Что такое валентность?
Термин валентность означает количество электронов, которое атом может потерять или получить, чтобы завершить свою октетную оболочку. Электроны, которые присутствуют в самой внешней оболочке атома, являются валентными электронами. Таким образом, количество электронов, присутствующих в валентной оболочке атома, считается валентностью конкретного атома. Например, рассмотрим атом водорода H, валентность которого такова, что он может потерять или разделить больше электронов от другого атома, чтобы стать стабильным.
Валентность хлора одна, и у него есть 7 электронов, присутствующих в его внешней оболочке, но хлор получает на один электрон больше от другого элемента, чтобы получить свойства благородного газа и стать более стабильным, потому что для атома хлора легко получить электрон от другого элемента. элемент скорее теряет свои электроны. Валентность конкретного атома или элемента также можно было наблюдать с помощью метода электронной конфигурации.
Валентность может иметь положительное или отрицательное значение, что означает, что положительный знак на атоме указывает, что атом получит электроны, чтобы стать стабильным, в то время как отрицательный знак на атоме указывает, что атом удалит свои электроны, чтобы стать стабильным. В периодической таблице в химии также указывается валентность атома. Примеры валентности серы в SF 6 : 2; в H 1 валентность равна 1 и т. д.
Что такое ковалентность?
Термин «ковалентность» определяется таким образом, что это максимальное количество ковалентных связей, которое может образовать атом, используя свои свободные орбитали. Количество валентных электронов, присутствующих во внешней оболочке атома, является причиной зависимости ковалентности. Например, количество электронов, присутствующих в валентной оболочке водорода, равно одному, и его ковалентность также рассматривается как та, которая разделяется с другими атомами, образуя ковалентную связь.
Ковалентность обычно всегда положительная величина. Из-за ограниченных ковалентных возможностей атомов это основная причина насыщения ковалентных связей. Следовательно, ковалентность элемента описывается общим числом электронов, присутствующих в валентной оболочке, способствующих развитию ковалентных связей.
Не только количество электронов, присутствующих в валентной оболочке, но также количество свободных орбиталей атома является обязательным для определения ковалентности. Типы ковалентности — это постоянная ковалентность и переменная ковалентность. Примеры ковалентности серы в SF 6 — 6.
Ключевые отличия
Заключение
Из приведенного выше обсуждения делается вывод о том, что валентность — это количество электронов, присутствующих во внешней оболочке атома, которые приобретают или теряют свои электроны, чтобы стать стабильными, тогда как ковалентность — это количество комбинированных электронов, которые атом может разделить, чтобы образовать ковалентную связь.
Химические связи. Валентность и ковалентность.
Когда такой электроположительный элемент, как натрий, встречает такой электроотрицательный элемент, как хлор, атом натрия легко отдает один электрон, который атом хлора так же легко принимает. Получаются атом натрия с положительным зарядом (ион натрия), и атом хлора с отрицательным зарядом (ион хлора). Тут же возникает и мощное электрическое притяжение между этими двумя ионами, в результате чего вокруг каждого иона натрия толпится куча ионов хлора, и, соответственно, вокруг каждого иона хлора тусуется кучка ионов натрия. В результате получается сложный и очень упорядоченный строй ионов, крепко цепляющихся друг за друга. Такой вид связи называется «валентной». Иногда такую связь еще называют «ионной».
Валентность – это и есть способность атомов химических веществ образовывать электрические связи с атомами других элементов, отдавая или присоединяя электроны. Величина валентности определяется числом присоединенных или отданных электронов.
Электроны, расположенные на последней оболочке, в основном и определяют химические свойства атомов, и называются валентными. Число валентных электронов определяет валентность элемента. Так, все щелочные металлы (Li, Na, K, Rb, Cs, Fr) – одновалентны. Все щелочноземельные элементы (Mg, Ca, Sr, Ba) – двухвалентны. Атомы с целиком заполненными оболочками не имеют валентных электронов и химически неактивны. Они образуют инертные газы – гелий, неон, аргон и т.д. и составляют нулевую группу, так как их валентность равна нулю.
Химическая связь – это явление взаимодействия атомов, обусловленное перекрыванием их электронных оболочек, т.е. пересечением траекторий движения их электронов.
Если сделать температуру достаточно высокой, то энергии колебаний хватает на то, чтобы оторвать ионы друг от друга, преодолевая силу электрического притяжения. И тогда вещество начинает «плавиться», т.е., как говорят, «переходит в жидкую фазу», то есть переходит в жидкое состояние, становится жидкостью. В жидкой фазе ионы больше не удерживаются строго на своих местах и свободно путешествуют.
А что происходит, когда встречаются два электроположительных атома? Например, два атома натрия, встречаясь, попросту начинают обладать двумя электронами совместно поскольку каждый готов отдать свой электрон, и уж тем более никто не хочет захватывать дополнительный. Возникает совместное владение электронами.
Точно то же самое происходит, когда встречаются два электроотрицательных атома – например два атома фтора. Каждый из них так сильно хочет схватить лишний электрон, что они делают то же самое – передают друг другу по одному электрону в совместное пользование, и из-за этого тоже становятся связанными друг с другом. Такой вид химической связи называется «ковалентной» (возможно, буквы «ко» от слова «кооперация»).
Существуют и другие виды химической связи, например «металлическая». При этом виде связи свободные электроны, то есть не привязанные ни к какому конкретному атому, бродят между атомов, осуществляя роль цемента.
Если ковалентную связь образуют одинаковые атомы, например как в молекуле Cl2, то силы, с которой каждый атом тянет на себя общий электрон, одинаковы, и в результате электроны не смещены в сторону одного из них. Такую ковалентную связь называют «неполярной». Если же атомы разные, то один из них может сильно перетянуть общие электроны в свою сторону, и тогда на стороне более сильного атома возникнет избыточный отрицательный заряд, а на стороне другого – равный ему избыточный положительный, и молекула станет полярной. Такой вид ковалентной связи называют «полярной».
Разница между валентностью и ковалентностью
Содержание:
Ключевые области покрыты
1. Что такое валентность
— определение, свойства, примеры
2. Что такое ковалентность
— определение, свойства, примеры
3. В чем разница между валентностью и ковалентностью
— Сравнение основных различий
Ключевые слова: атом, ковалентность, ковалентная связь, электрон, орбиталь, оболочка, валентность
Что такое валентность
Валентность может быть определена как число электронов, которые атом потеряет или получит, чтобы стабилизировать себя. Электроны на самой внешней орбите атома известны как валентные электроны. Иногда число валентных электронов рассматривается как валентность этого элемента. Например, валентность водорода (H) равна 1, поскольку атом водорода можно стабилизировать либо потерей, либо получением 1 электрона. Атом хлора имеет 7 электронов на самой внешней орбите (число валентных электронов равно 7), но, получив еще 1 электрон, он может получить конфигурацию электрона в благородном газе аргона (Ar), которая является более стабильной. Легко получить один электрон, а не потерять 7 электронов, поэтому валентность хлора считается равной 1.
Электронная конфигурация элемента дает валентность конкретного элемента. В следующей таблице показаны некоторые элементы с их значениями.
Элемент
Электронная конфигурация
Электроны должны быть получены или выпущены, чтобы подчиняться правилу октета
Валентность
1s 2 2s 2 2р 6 3s 1
1s 2 2s 2 2р 6 3s 2 3p 6 4s 2
1s 2 2s 2 2р 6 3s 2 3p 5
Таблица выше показывает валентность некоторых элементов. Там (-) отметка указала количество электронов, которые необходимо удалить, чтобы стабилизироваться. Знак (+) указывает количество электронов, которые необходимо получить для стабилизации.
Рисунок 1: Периодическая таблица элементов
Кроме того, периодическая таблица элементов также может дать представление о валентности элемента. Элементы группы 1 всегда имеют валентность 1, а для элементов группы 2 валентность равна 2.
Что такое ковалентность
Валентные электроны углерода;
Распространение электронов на пустые орбитали;
Теперь есть 4 неспаренных электрона для углерода, чтобы поделиться с другими атомами, чтобы сформировать ковалентные связи.
Разница между валентностью и ковалентностью
Определение
Связь с валентными электронами
Валентность: Валентность может быть либо равна числу валентных электронов, либо нет.
ковалентность: Ковалентность зависит от количества валентных электронов.
Пустые орбитали
Валентность: Валентность дает количество электронов, необходимое для заполнения пустых орбиталей.
ковалентность: Ковалентность зависит от числа пустых орбиталей, присутствующих в атоме.
Тип склеивания
Валентность: Валентность может быть дана для элементов, которые могут образовывать ионные или ковалентные связи.
ковалентность: Ковалентность может быть дана только для элементов, которые могут образовывать ковалентные связи.
Заключение
Валентность может иногда равняться числу валентных электронов атома, но чаще всего они разные. Однако ковалентность полностью зависит от числа валентных электронов атома. Это потому, что валентные электроны определяют количество ковалентных связей, которые может иметь атом. Таким образом, важно знать разницу между валентностью и ковалентностью.
Рекомендации:
1. «Ковалентность». Химия-ковалентность и молекулярные структуры. Н.п., н.д. Web.
Разница между электровалентностью и ковалентностью
Ключевое различие между электровалентностью и ковалентностью заключается в том, что электровалентность — это число электронов, которое атом либо получает, либо теряет при образовании иона, тогда как ковалентность — это количество электронов, которое атом может разделить с другим атомом.
Хотя термины электровалентность и ковалентность звучат одинаково, они отличаются друг от друга согласно своим определениям. Преимущественно, электровалентность объясняет образование иона, тогда как ковалентность объясняет образование ковалентной связи.
Содержание
Что такое электровалентность?
Электровалентность — это число электронов, полученных или потерянных при образовании иона из этого атома. Так как, термин электровалентность относится к числу электронов, которые атом либо получает, либо теряет при образовании электовалентной связи, то это называется ионной связью.Следовательно на ионе, появляется чистый электрический заряд. Более того, если атом теряет электроны при образовании ионной связи, это указывает на положительную электровалентность, а если атом приобретает электроны при образовании ионной связи, это указывает на то, что атом имеет отрицательную электровалентность. Соединения с атомами, имеющими электровалентность, являются ионными соединениями.
Например, давайте рассмотрим образование хлорида натрия (NaCl). Там атом натрия теряет один электрон, таким образом, он имеет положительную электровалентность. Атом хлора получает этот электрон. Таким образом, он имеет отрицательную электровалентность. Однако, поскольку число электронов, которые либо теряются, либо приобретаются, равно одному, электровалентность натрия (или хлора) равна единице. Мы должны указать электровалентность с соответствующим знаком, чтобы указать, является ли она положительной или отрицательной электровалентностью.
Что такое ковалентность?
Ковалентность — это максимальное количество электронов, которое может быть разделено с другим атомом. Следовательно, ковалентность указывает максимальное количество ковалентных связей, которые атом может образовать, используя свои пустые орбитали. Значение этого параметра зависит от числа валентных электронов атома и числа пустых орбиталей, присутствующих в атоме.
Например, атом водорода имеет только один электрон, таким образом, он может делить один электрон с другим атомом. Следовательно, ковалентность водорода равна 1. В отличие от электровалентности, тут не используются знаки плюс или минус, потому что нет потери или усиления электронов, только электроны делятся друг с другом.
В чем разница между электровалентностью и ковалентностью?
Электровалентность — это число электронов, полученных или потерянных при образовании иона из этого атома. Это объясняет образование ионной связи. Более того, соединения, имеющие атомы с этим параметром, являются ионными соединениями. С другой стороны, ковалентность — это максимальное количество электронов, которое может быть разделено с другим атомом. Это объясняет образование ковалентной связи. Кроме того, соединения, имеющие атомы с ковалентностью, являются ковалентными соединениями.
Заключение — Электровалентность против Ковалентности
Хотя термины электровалентность и ковалентность звучат достаточно похоже, они имеют отличия, четкие определения и характеристики. Разница между электровалентностью и ковалентностью заключается в том, что электровалентность — это число электронов, которое атом либо получает, либо теряет при образовании иона, тогда как ковалентность — это количество электронов, которое атом может разделить с другим атомом.
Как определить валентность если она переменная. Что такое валентность
1. Постоянная валентность
2. Переменная валентность
§ 11. Валентность химических элементов
НС1 Н 2 О NH 3 СН 4
Хлороводород вода аммиак метан
Как видно из приведенных примеров, атомы элементов хлора, кислорода, азота, углерода обладают свойством присоединять не любое, а только определенное число атомов водорода. Таким же свойством обладают и другие элементы в различных соединениях. Понятию «валентность» можно дать следующее определение:
(Численное значение валентности принято обозначать римскими цифрами, которые ставятся над знаками химических элементов.)
Ответьте на вопросы 1-3 (с. 32).
§12. Определение валентности элементов по формулам их соединений. Составление химических формул по валентности
Определение валентности элементов по формулам их соединений.
Зная формулы веществ, состоящих из двух химических элементов, и валентность одного из них, можно определить валентность другого элемента. Например, если дана формула оксида меди СuО, то валентность меди можно определить следующим образом. Валентность кислорода равна двум, а на один атом кислорода приходится один атом меди. Следовательно, валентность меди тоже равна двум.
При определении валентности элемента по формуле следует учитывать, что число единиц валентности всех атомов одного элемента должно быть равно числу единиц валентности всех атомов другого элемента.
Итак, валентность элементов по формулам можно определить следующим образом:
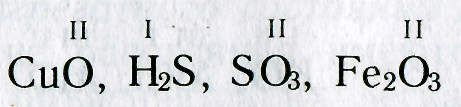
2. Находят и записывают общее число валентностей (наименьшее общее кратное) известного элемента:
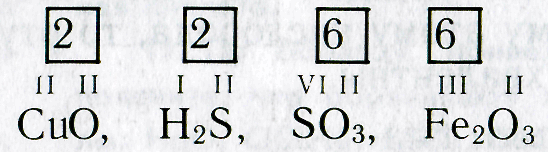
Составление химических формул по валентности. Чтобы составить химическую формулу, необходимо знать валентность элементов, образующих данное химическое соединение. Сведения о валентности некоторых элементов приведены в таблице 3.
Таблица 3. Валентность некоторых элементов в химических соединени
При составлении химических формул можно соблюдать следующий порядок действий:
1. Пишут рядом химические знаки элементов, которые входят в состав соединения:
2. Над знаками химических элементов проставляют валентность:
3. Определяют наименьшее общее кратное чисел, выражающих валентность обоих элементов: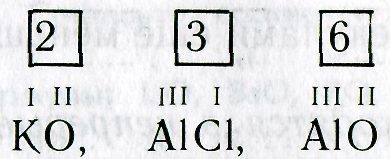
4. Делением наименьшего общего кратного на валентность соответствующего элемента находят индексы (индекс «1» не пишут):
Однако относительные молекулярные массы вычисляются как для веществ с молекулярным, так и для веществ с немолекулярным строением. Для последних понятия «молекула» и «относительная молекулярная масса» употребляют условно.
Основные положения атомно-молекулярного учения можно сформулировать так:
1. Существуют вещества с молекулярным и немолекулярным строением.
2. Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры. Наибольшие расстояния имеются между молекулами газов. Этим объясняется их легкая сжимаемость. Труднее сжимаются жидкости, где промежутки между молекулами значительно меньше. В твердых веществах промежутки между молекулами еще меньше, поэтому они почти не сжимаются.
3. Молекулы находятся в непрерывном движении. Скорость движения молекул зависит от температуры. С повышением температуры скорость движения молекул возрастает.
5. Молекулы состоят из атомов, которые, как и молекулы, находятся в непрерывном движении.
6. Атомы одного вида отличаются от атомов другого вида массой и свойствами.
7. При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются.
9. У веществ с немолекулярным строением в узлах кристаллических решеток находятся атомы или другие ча c тицы (с. 14). Между этими частицами существуют сильные химические связи, для разрушения которых требуется много энергии. Поэтому вещества с немолекулярным строением имеют высокие температуры плавления.
Сущность химических реакций заключается в разрушении химических связей между атомами одних веществ и в перегруппировке атомов с образованием других веществ.
Ответьте на вопросы 8-12 (с. 33).
1. Что такое валентность химических эле ментов? Поясните это на конкретных примерах.
2. Почему валентность водорода принята за единицу?
3. В реакции железа с соляной кислотой один атом металла вытесняет два атома водорода. Как это можно объяснить, пользуясь понятием о валентности?
5. Даны химические символы элементов и указана их валентность. Составьте соответствующие химические формулы:
I II V IV I III VII II III II IV III I
LiO, ВаО, РО, SnO, КО, РН, MnO, FeO, BO, HS, NO, CrCI.
6. Пользуясь данными таблицы 3 (с. 30), составьте химические формулы соединений с кислородом следующих химических элементов: Zn, В, Be, Co, РЬ, Ni. Назовите их.
7. Составьте формулы оксидов: меди (I), железа (III), вольфрама (VI), железа (II), углерода (IV), серы (VI), олова (IV), марганца (VII).
8. Изложите сущность основных положений атомно-молекулярного учения.
9. Какие явления подтверждают: а) движение молекул; 6) наличие между молекулами промежутков?
10. Чем отличается движение молекул в газах, жидкостях, твердых веществах?
11. Чем отличаются по своим физическим свойствам твердые вещества с молекулярным и немолекулярным строением?
12. Как объяснить физические и химические явления с точки зрения атомно-молекулярного учения?
1. Вычислите относительные молекулярные массы: а) оксида железа (III); б) оксида фосфора (V); в) оксида марганца (VII).
2. Определите массовые доли элементов в оксиде меди (I) и в оксиде меди (II). Найденные массовые доли выразите в процентах.
1. Что такое валентность химических эле- рода. Как это можно объяснить, пользуясь ментов? Поясните это на конкретных примерах. понятием о валентности?
2. Почему валентность водорода принята 4. Определите валентность элементов по за единицу? формулам: HgO, K 2 S, B2O3, ZnO, МпОг, NiO,
один атом металла вытесняет два атома водо- 5. Даны химические символы элементов и
Для отдельных классов соединений, где преобладает какой-либо один тип химического взаимодействия, полезную информацию о способности атомов к образованию связей могут дать перечисленные ниже частные понятия (частные определения В.).
1. Определение понятия «валентность» и связь его с другими понятиями химии
Ковалентность равна числу неспаренных электронов атома, участвующих в образовании связи, и часто может принимать все значения от 1 до максимальной, которая для большого числа элементов совпадает с номером их группы в периодической системе Менделеева (подробно см. разделы 2 и 3).
Однако по своему определению ОЧ, в отличие от ковалентности и ионной В., имеющих чёткий физический смысл, носит в общем случае условный характер и, за исключением весьма ограниченного класса соединений с чисто ионной связью, не совпадает ни с эффективными зарядами атомов в соединениях, ни с фактическим количеством связей, которые атом образует. Кроме того, в ряде случаев, в частности, когда электроотрицательности двух разных связанных атомов близки и связь между ними имеет почти чисто ковалентный характер, возникает неопределённость, к какому из них следует целиком относить электронную пару (см. Окислительное число).
2. Эволюция понятия «валентность» и его роль в истории химии
Первый камень преткновения изучающих химию. Большой ошибкой является подход, когда учащийся не пытается понять валентность, ожидая, что знания об этом потом приложатся сами собой. Но этот подход неверный, так как без понимания этого мы упираемся в тупик неспособности составить даже простейшую формулу.
Что такое «валентность» элементов?
Обозначают валентность элемента всегда только римскими цифрами. Посмотреть ее значение для разных атомов можно в специальной таблице.
Какие бывают характеристики у валентности элементов?
Влияние валентности элементов в химических реакциях.
Даже того как ученые узнали, что атом — это не мельчайшая частица в мире, они уже оперировали этим понятием. Они понимали, что есть внутренний фактор, который влияет на протекание химической реакции различных веществ. Из-за того, что ученые по-разному видели строение молекулы, понятие «валентность элемента » пережило несколько метаморфоз.
Валентность вещества определяется количеством внешних электронов атома. Каким количеством электронов атом обладает, столько максимально соединений он способен совершить. Таким образом «валентность» подразумевает собою число электронных пар атомов.
Хотя электронная теория появилась намного позже, после «разделения» атома на более мелкие частицы, до этого ученые все равно вполне успешно определяли валентность в большинстве случаев. Удавалось им это благодаря химическому анализу веществ.
Это была тяжелая работа: прежде всего, требовалось определить массу элемента в чистом виде. Далее, с помощью химического анализа, ученые определяли каков состав соединения, и только потом могли высчитать, сколько атомов содержит в себе молекула вещества.
Этот метод все еще используется, но не является универсальным. Так удобно определять элемент в простом соединении веществ. Например, с одновалентным водородом, или двухвалентным кислородом.
Но уже при работе с кислотами метод не особо удачный. Нет, мы можем частично использовать его, например, при определении валентности соединений кислотных остатков.
Валентность элементов в формулах.
Как мы уже говорили выше, понятие «валентность элементов » связанно с электронной структурой атома. Но это не единственный вид связи, которые существуют в природе. Химики знакомы еще с ионными, кристаллическими и другими формами структуры вещества. Для таких структур валентность уже не столь актуальна, но вот работая с формулами молекулярных реакций, мы обязательно должны ее учитывать.
Для того, чтоб сделать формулу мы должны расставить все индексы, которые уравновешивают количество атомов, вступающие в реакцию. Только зная валентность веществ, мы можем правильно расставить индексы. И наоборот, зная молекулярную формулу и имея индексы, можно узнать валентность элементов, что входят в состав вещества.
Для произведения подобных расчетов важно помнить, что валентности обоих элементов, вступивших в реакцию, будут равны, а значит, для поиска необходимо найти наименьшее общее кратное.
Необычные способы определения валентности элементов.
Наглядность.
Спонсор размещения P&G Статьи по теме «Как определить валентность» Как доказать амфотерность гидроксидов Как вычислить валентность Как определить химическую формулу
Возьмите на заметку, что обозначается показатель валентности римскими цифрами и ставится над знаком элемента.
Обратите внимание: если формула двухэлементного вещества написана правильно, то,
при умножении числа атомов каждого элемента на его валентность, у всех элементов
должны получиться одинаковые произведения.
Заметьте, что в молекулах водородных соединений вычислить валентность очень просто.
Водород всегда одновалентен, а этот показатель у связанного с ним элемента будет равняться количеству атомов водорода в данной молекуле. К примеру, в CaH2 кальций будет двухвалентен.
Запомните главное правило определения валентности: произведение показателя валентности атома какого-либо элемента и количества его атомов в какой-либо молекуле всегда равно произведению показателя валентности атома второго элемента и количества его атомов в данной молекуле.
Рассмотрите пример с молекулой оксида серы SО2. Кислород во всех соединениях двухвалентен, поэтому, подставляя значения в пропорцию: Vкислорода х Кислорода = Vсеры х Ксеры, получаем: 2 х 2 = Vсеры х 2. От сюда Vсеры = 4/2 = 2. Таким образом, валентность серы в данной молекуле равна 2.
Другие новости по теме:
Химическая формула – это запись, сделанная с использованием общепринятых символов, которая характеризует состав молекулы какого-либо вещества. Например, формула всем известной серной кислоты – H2SO4. Легко можно увидеть, что каждая молекула серной кислоты содержит два атома водорода, четыре атома
Химия для каждого школьника начинается с таблицы Менделеева и фундаментальных законов. И уже только потом, уяснив для себя, что же изучает эта сложная наука, можно приступать к составлению химических формул. Для грамотной записи соединения нужно знать валентность атомов, составляющих его. Спонсор
Валентность – один из основных терминов, употребляемых в теории химического строения. Это понятие определяет способность атома образовывать химические связи и количественно представляет собой число связей, в которых он участвует. Спонсор размещения P&G Статьи по теме «Что такое валентность» Что
Со школы или даже раньше каждый знает, всё вокруг, включая и нас самих, состоит их атомов – наименьших и неделимых частиц. Благодаря способности атомов соединяться друг с другом, многообразие нашего мира огромно. Способность эта атомов химического элемента образовывать связи с другими атомами