валацикловир или фамцикловир при герпесе что лучше
Фамцикловир в лечении герпетических инфекций
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Центральный научно-исследовательский кожно-венерологический институт МЗ РФ, Москва
В инфекционной патологии человека герпесвирусам отводится важная роль ввиду их широкого распространения в популяции, склонности к пожизненному персистированию в организме и способности вызывать острую, хроническую и латентную форму заболевания. Многочисленными исследованиями показано, что вирусами простого герпеса инфицировано 65–90% взрослого и детского населения планеты. По сравнению с 1980–ми годами к концу тысячелетия число зарегистрированных больных герпесом возросло в США на 13–40%, в странах Европы – на 7–16%. Так, за 1999 год в мире зарегистрировано 86 млн. больных генитальным герпесом – наиболее распространенного заболевания среди инфекций, передающихся половым путем (ИППП). В России обращаемость к врачам различных специальностей (дерматологам, гинекологам, урологам) по поводу генитального герпеса составляет не более 15% от реальной частоты. Заболеваемость за последние 5 лет увеличилась более чем в 2 раза, а общее число больных составляет около 8 млн человек (Хахалин Л.Н.,1999).
| В России насчитывается 8 млн больных генитальным герпесом. |
За последние годы были достигнуты значительные успехи в лечении герпеса благодаря внедрению в клиническую практику синтетических нуклеозидов, среди которых перспективным является фамцикловир (Фамвир).
Фамцикловир является предшественником пенцикловира и обладает рядом существенных преимуществ по сравнению с ацикловиром:
• высокое сродство к тимидинкиназе вируса (в 100 раз выше) и более выраженное блокирование репликации вируса между приемами препарата;
• фамцикловир обладает самой высокой биодоступностью (77% против 10–20% у ацикловира) и самым длительным периодом нахождения в инфицированной вирусом клетке (до 20 часов);
• постоянная концентрация препарата в инфицированных клетках обеспечивает длительный противовирусный эффект и дает возможность реже принимать препарат;
• фамцикловир обладает свойством проникать в шванновские клетки, окружающие нервные волокна. В клетках, инфицированных ВЗВ, периоды полувыведения составляют 9 часов для фосфорилированного пенцикловира и 0,8 часа для фосфорилированного ацикловира [6,7,8]. Поэтому фамцикловир является единственным противовирусным препаратом, уменьшающий длительность постгерпетической невралгии при опоясывающем лишае (на 100 дней по сравнению с плацебо) (рис. 1).
Рис. 1. Длительность постгерпетической невралгии при опоясывающем лишае.
Для врачей–клиницистов важное практическое значение имеет высокая клиническая эффективность Фамвира при генитальном герпесе:
• фамвир уменьшает количество рецидивов на 80% (рис. 2) [11];
• обусловливает отсутствие рецидивов почти у одной трети пациентов;
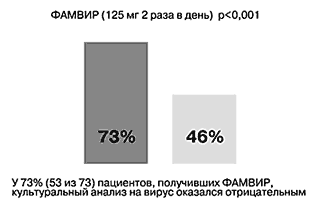
• предупреждает распространение вируса (у 73% пациентов, получавших фамвир, культуральный анализ на вирус оказался отрицательным по сравнению с 46% пациентов, получавших плацебо) (рис. 3) [12];
• уменьшает сроки распространения вируса до 1,8 дня по сравнению с 3,4 днями в группе плацебо (Р Рис. 2. Фамвир уменьшает количество рецидивов на 80%.
Рис. 3. Фамвир способен останавливать распространение вируса.
Стратегия лечения больных генитальным герпесом определяется рядом факторов: частотой рецидивов и тяжестью клинических проявлений заболевания, а также наличием психосоциальных проблем и риска передачи инфекции половому партнеру или новорожденному.
В настоящее время существует два подхода к лечению: эпизодическая или профилактическая (супрессивная) терапия. Целями лечения являются купирование острых симптомов заболевания, уменьшение частоты и тяжести рецидива, предупреждение реактивации вируса и улучшение качества жизни пациента. Эпизодическая терапия проводится только в период обострения заболевания и значительно уменьшает боль, дискомфорт в зоне поражения, сокращает время заживления герпетических высыпаний, а также сокращает период вирусовыделения до 1,8 дня по сравнению с 3,4 днями в группе плацебо.
В США Центром по контролю и профилактике заболеваний (CDC) Фамцикловир одобрен как средство эпизодического лечения рецидивов генитального герпеса в дозе 125 мг два раза в день в течение 5 дней, при первом эпизоде генитального герпеса фамвир рекомендован по 250 мг 3 раза в день в течение 5–10 дней [5,9,10].
По результатам многоцентрового исследования, проведенном Merz с сотр. (1997), включавшем 375 женщин, имевших в анамнезе не менее 6 рецидивов генитального герпеса, прием фамцикловира в дозе 250 мг два раза в день в течение 4 месяцев оказался наиболее эффективным: предотвращение рецидивов наблюдалось у 90 % пациенток данной группы в сравнении с другими режимами дозирования и приема препарата, а также с группой плацебо [9,10].
В другом исследовании, проведенном Diaz–Mitoma с сотр. (1998), подавляющую (супрессивную) терапию фамцикловиром осуществляли в течение 1 года введением 125 мг препарата 3 раза в день, 250 мг 2 раза в день, 250 мг 3 раза в день или плацебо. Все три дозы фамцикловира значительно отдаляли появление клинически подтверждаемого рецидива. В группе, получавшей 250 мг 2 раза в день, медиана интервала времени до появления первого рецидива составила 336 дней в сравнении с группой плацебо, в которой аналогичный показатель был равен 47 дням. У 72% больных, получавших терапию фамцикловиром, рецидивы генитального герпеса в течение 1 года после начала лечения не наблюдались. В группе без лечения (плацебо) таких больных было всего 22%. Таким образом было показано, что фамцикловир эффективен в качестве средства профилактической терапии рецидивов генитального герпеса в дозе 250 мг 2 раза в день [9,10].
Назначение фамцикловира дает возможность уменьшения суточной и курсовой доз препарата в 5 раз, по сравнению с ацикловиром: курсовая доза у фамцикловира – 5,25 г, у ацикловира – 28,0 г. Данное обстоятельство особенно актуально при лечении пожилых пациентов. Необходимо отметить, что лечение наиболее эффективно при назначении фамвира в первые 48 ч с момента появления высыпаний [3,8].
В ГУ ЦНИКВИ МЗ РФ также было проведено клинико–лабораторное изучение эффективности фамцикловира при генитальном герпесе [2]. Монотерапия рецидивов была проведена у 110 больных (62 мужчин и 48 женщин) в возрасте от 18 до 50 лет. Давность заболевания варьировала от нескольких месяцев до 10 лет, длительность рецидивов составила от 5 до 21дней. 79 больных (71,8%) имели тяжелое течение генитального герпеса (рецидивы 1–2 раза в месяц и ремиссии менее 6 недель), 28 пациентов (25,5%) – заболевание средней тяжести (обострения 1 раз в 2–3 месяца и ремиссии 2–3 месяца), легкое течение заболевания (1–3 рецидива в год, ремиссии не менее 4 месяцев) наблюдалось только у 3 пациентов (2,7%).
Результаты исследования подтвердили высокую эффективность фамвира в лечении генитального герпеса. Монотерапия рецидивов ГГ фамцикловиром в курсовой дозе 2,5 г сокращала длительность рецидивов герпеса более, чем в 2 раза – с 8,7 до 3,8 дней (Р Выводы
1.Фамцикловир является высокоэффективным препаратом для лечения и профилактики рецидивов генитального герпеса и опоясывающего лишая.
2. Фамцикловир обладает анальгезирующим действием, особенно выраженном при опоясывающем лишае.
3. Фамцикловир является единственным противовирусным препаратом, уменьшающим длительность постгерпетической невралгии при опоясывающем лишае.
4. Супрессивная терапия фамвиром в течение 1 года уменьшает количество рецидивов генитального герпеса на 80% и отсутствие рецидивов почти у трети пациентов.
5. При генитальном герпесе фамвир предупреждает распространение вируса и уменьшает сроки распространения вируса.
6. 30% штаммов вирусов, резистентных к ацикловиру, чувствительны к терапии фамвиром.
1. Яцуха М.В., Губанова Е.И., Масюкова С.А. Динамика заболеваемости генитальным герпесом и деятельность ЛПУ в Москве и Московской области. Актуальные проблемы дерматологии и венерологии.Сб.научных работ.Москва, 2000, с.94–95
2. Владимирова Е.В. Эффективность фамцикловира в лечении рецидивирующего генитального герпеса (клинико–лабораторное исследование).Дисс. канд.мед.наук., Москва, 1998, 110 с.
3. Gross G. Herpes – simplex – Virus und Varicella – Zoster – Virus – Infektionen // “Dermatologie, heutiger Stand”, Stuttgart – New – York, Georg Thieme Verlag, – 1995, s.43 – 50.
5. Centers for Disease Control and Prevention. 1998.CDC 1998. Guidelines for treatment of Sexually Transmitted Diseases. Morb.Mortal.Wkly.Rep.47,1–118.
6. Earnshaw D.L., Bacon T.H., Darlison S.J. et al. Penciclovir mode of action studies in HSV – I. HSV – 2 and VZV infected MRC – 5 cells, providing a rationale for its persistent antiviral activity.// Antimicrob Agents Chemother, 1992, 36: p.2747 – 57.
7. Pue M.A., Benet L2.Pharmacokinetiks of famciclovir in man // Antiviral Chem Chemother, – 1993, – (Suppl. 1) – p.47 – 55.
8. Degreef H, Famciclovir Herpes Zoster Clinical Study Group. Famciclovir, a new oral antiherpes drug: results of the first controlled clinical study demonstrating its efficacy and safety in the treatment of uncomplicated herpes zoster in immunocompetent patients // Int.J. Antimicrob Agents, – 1994, – 4: p.241 – 6.
9. Stanberry L. et al. Antiviral Research 42(1999), 1–14
10. Leung D.T, Sacks S.L. Current Recomendations for the treatment of genital herpes//Drags, 2000, Dec;60 (6): 1329–1352
11. Diaz–Mitoma F et al. Oral famciclovir for the supression of recurrent genital herpes: a randomized controlled trial. JAMA. 1998; 280: 887–892
12. Saks SL et al. Patient–initiated, twice–daily oral famciclovir for early recurrent genital herpes: a randomized double–blind multicenter trial. JAMA. 1996; 276: 44–49.
Валацикловир или фамцикловир при герпесе что лучше
ГНЦ «Институт иммунологии» ФМБА России, Москва, Россия, 115478; ФГБУ «Московский государственный медико-стоматологический университет им. А.И. Евдокимова», Москва, Россия, 127473
ГНЦ «Институт иммунологии» ФМБА России, Москва, Россия, 115478
ГНЦ «Институт иммунологии» ФМБА России, Москва, Россия, 115478
Рецидивирующая герпес-вирусная инфекция: стратегия противовирусной терапии
Журнал: Клиническая дерматология и венерология. 2015;14(3): 29-36
Шульженко А. Е., Зуйкова И. Н., Щубелко Р. В. Рецидивирующая герпес-вирусная инфекция: стратегия противовирусной терапии. Клиническая дерматология и венерология. 2015;14(3):29-36.
Shul’zhenko A E, Zuykova I N, Shchubelko R V. Recurrent herpes virus infection: the strategy of antiviral therapy. Klinicheskaya Dermatologiya i Venerologiya. 2015;14(3):29-36.
https://doi.org/10.17116/klinderma201514329-36
ГНЦ «Институт иммунологии» ФМБА России, Москва, Россия, 115478; ФГБУ «Московский государственный медико-стоматологический университет им. А.И. Евдокимова», Москва, Россия, 127473
Генитальная форма герпес-вирусной инфекции широко распространена и встречается во всех популяционных группах. Самая высокая заболеваемость зарегистрирована у лиц в репродуктивном возрасте, что в значительной мере влияет на материнскую заболеваемость, рождаемость, перинатальные потери и на здоровье нации в целом. Цель исследования — изучение клинической эффективности Валвира (генерического валацикловира компании «Actavis») в терапии генитальной формы хронической рецидивирующей герпесвирусной инфекции (ХРГВИ). Материал и методы. В 2014 г. в клинике Института иммунологии Федерального медико-биологического агентства России проведено сравнительное исследование клинической эффективности препарата Валвир в лечениии иммунокомпетентных пациентов с генитальной формой ХРГВИ. Пациентам основной группы (20 мужчин и женщин) был назначен препарат валацикловир (Валвир), больным группы сравнения (20 человек) — Ацикловир (производство России). Результаты. На фоне 5-дневного курса терапии Валвиром в дозе по 500 мг 2 раза в сутки у пациентов с генитальной формой ХРГВИ отмечено сокращение длительности течения рецидива и ускорение реэпителизации (в среднем с 6,4 сут до лечения до 3,8 сут на фоне терапии), эффективное купирование местных симптомов рецидива (до 2,5±0,3 сут) и сокращение периода начала эпителизации герпетических повреждений (до 1,9 сут) по сравнению с контрольной группой, получавшей ацикловир. Выводы. Валвир — препарат с доказанной клинической эффективностью в отношении генитальной формы ХРГВИ. Показано сокращение продолжительности местных симптомов рецидива и периода реэпителизации. Препарат Валвир обладает хорошей переносимостью и безопасностью как у молодых пациентов, так и пациентов старшего возраста.
ГНЦ «Институт иммунологии» ФМБА России, Москва, Россия, 115478; ФГБУ «Московский государственный медико-стоматологический университет им. А.И. Евдокимова», Москва, Россия, 127473
ГНЦ «Институт иммунологии» ФМБА России, Москва, Россия, 115478
ГНЦ «Институт иммунологии» ФМБА России, Москва, Россия, 115478
Спектр клинических проявлений герпес-вирусной инфекции (ГВИ) отличается значительным разнообразием. Они зависят от локализации патологического процесса, его распространенности, состояния противовирусного звена иммунного ответа. Вирусы простого герпеса 1-го и 2-го типов наиболее часто поражают кожные покровы, слизистые оболочки, центральную нервную систему. Кроме того, клинические проявления ГВИ определяют:
1) особенности вируса простого герпеса (ВПГ): его типа, антигенности и вирулентности;
2) локализацию поражения (тканевое или органное);
3) стадию и фазу заболевания (обострение или ремиссии);
4) тяжесть течения и длительность инфекционного процесса;
5) пол, возраст и степень иммунокомпетентности пациента;
6) проводимую терапию.
Одна из наиболее распространенных локализаций поражения ВПГ — урогенитальный тракт. Генитальный герпес встречается во всех популяционных группах, и самая высокая заболеваемость зарегистрирована в возрасте 20—29 лет, а второй пик приходится на возраст 35—40 лет [1—3].
ВПГ проникает в организм через кожу или слизистые оболочки путем прямого контакта с естественными барьерами и/или биологическими жидкостями инфицированного человека. Показано, что заражение может происходить от инфицированного пациента вне зависимости от наличия или отсутствия симптомов заболевания. Только 10—25% серопозитивных по отношению к ВПГ людей имеют анамнез генитального герпеса, что предполагает наличие у большинства людей нераспознанной атипичной или бессимптомно протекающей инфекции. В 70% случаев инфицирование генитальным герпесом происходит при контакте с партнером, имеющим бессимптомную форму ГВИ [1, 3].
Существует несколько классификаций ГВИ, которые отражают различные варианты течения и формы заболевания. Все они учитывают основные виды клинических проявлений генитального герпеса (Н.В. Шперлинг и соавт., 2010) [4]:
— легкое течение — частота рецидивов 1—2 раза в год, ремиссия не менее 6 мес;
— средней степени тяжести — частота рецидивов 3—5 раз в год, ремиссия не менее 3 мес;
— тяжелое течение — частота рецидивов более 6 раз в год, ремиссия от нескольких дней до 6 нед;
При первичном инфицировании поражения часто имеют множественную локализацию, сопровождаются увеличением и болезненностью паховых лимфатических узлов. Следует отметить, что первый клинический эпизод генитального герпеса является истинным проявлением первичной ГВИ, если пациент ранее никогда не отмечал у себя симптомов заболевания, а в его крови отсутствуют антитела к ВПГ. Инкубационный период первичного герпеса половых органов колеблется от 2 до 12 дней (в среднем 6 дней). Типичная картина проявлений генитального герпеса характеризуется появлением на слизистых оболочках половых органов и прилежащих участках кожи единичных или множественных везикулезных элементов, возникающих на эритематозном фоне. Через 1—2 дня везикулы вскрываются, образуя мокнущие эрозии, реже язвочки, эпителизирующиеся под коркой или без ее образования. У людей обоих полов первичная атака обычно протекает тяжело, с выраженными симптомами общей интоксикации: у большинства пациентов отмечается лихорадка, недомогание, чувство ломоты в мышцах, головная боль. Вирусные частицы выделяются из инфицированных тканей 10—12 дней. Длительность острого периода при первичном генитальном герпесе может достигать 10 дней. Однако в большинстве случаев инфицирование протекает скрытно, переходя сразу в латентный период [1, 3, 5].
Типичные поражения у мужчин располагаются на коже лобковой области, теле полового члена или в перианальной области. Реже высыпания появляются на головке полового члена, венечной борозде, мошонке, в промежности, на бедрах или ягодицах. Герпетические поражения у женщин могут находиться на половых губах, коже промежности, перианальной и ягодичной областей. При присоединении вторичной бактериальной инфекции возможны поражения шейки матки в виде диффузного воспаления с эрозиями, больших изолированных язв и иногда тяжелых некротических изъязвлений.
У большинства женщин и мужчин при первичном генитальном герпесе возникают дизурические расстройства. Сильная боль и деструкция тканей могут вызвать задержку мочи (синдром Элеберга) [3, 5].
Помимо описанного, к первичному эпизоду относят те случаи заболевания, при которых первые клинические проявления развиваются на фоне серопозитивности к ВПГ-инфекции. Симптоматика при этом, как правило, менее интенсивна, чем при истинном первичном герпесе, но более выражена, чем при рецидивирующей форме болезни [3].
Вторичная герпес-вирусная инфекция встречается у больных любого возраста, перенесших первичный герпес. Реактивация ВПГ происходит обычно в первые несколько месяцев после первичного эпизода заболевания. Проявления рецидива генитального герпеса могут быть различными: от бессимптомного выделения вируса или легких симптомов до очень болезненных сливных изъязвлений с четкими границами. В большинстве случаев рецидивирующего генитального герпеса клинические симптомы последующих обострений менее тяжелые и продолжительные по сравнению с первичным эпизодом. Продромальная фаза, включающая зуд, жжение или кожную гиперчувствительность в местах последующих поражений, наблюдается приблизительно у половины больных с рецидивирующим герпесом половых органов. Частота рецидивов у мужчин и женщин, как правило, одинакова, однако их проявления различны. У мужчин рецидивы длятся дольше и характеризуются наличием большего числа очагов поражения, чем у женщин, в то время как у женщин клиническая симптоматика более острая, чем у мужчин [1, 3].
С увеличением длительности заболевания и под воздействием местной терапии клиническая картина генитального герпеса часто изменяется. Высыпания в очаге поражения могут миновать отдельные стадии развития. Сохраняются лишь эрозии, папулезные элементы и отечные пятна на фоне эритемы. При атипичных формах генитального герпеса характерные очаги поражения на слизистых оболочках и коже гениталий могут отсутствовать, отмечаются лишь гиперемия и диффузный отек слизистой, редко возникают рецидивирующие болезненные трещины. Описана также рецидивирующая форма генитального герпеса, для которой характерен лишь зуд, а в ряде случаев субъективные ощущения отсутствуют.
Распространена также бессимптомная форма генитального герпеса (60% от всех случаев), которая характеризуется реактивацией ВПГ без развития классических симптомов заболевания. Важно, что именно больные с бессимптомным генитальным герпесом чаще всего становятся источником инфицирования для своих половых партнеров [1, 3, 5].
При рецидиве ГВИ во время беременности риск передачи вируса новорожденному и развития заболевания невелик. Первичный же эпизод генитального герпеса у беременной может стать причиной трансплацентарной передачи вируса плоду, при этом исход первичной ГВИ во многом определяется сроком гестации, на котором произошло инфицирование [2].
Частые рецидивы, вызывающие дискомфорт в области половых органов, небольшая эффективность многих назначенных схем лечения нередко приводят к значительному ухудшению физического и психического состояния пациентов. У больных генитальным герпесом нередко отмечают депрессию, гневливость, уменьшение чувства собственного достоинства и враждебность к человеку, послужившему вероятным источником заражения. Таким образом, у пациентов с генитальным герпесом отмечается рост психосексуальных и социальных психических расстройств [3].
Задачами лечения рецидивирующей ГВИ являются сокращение частоты обострений, уменьшение их выраженности и длительности, улучшение качества жизни пациентов, а также предупреждение инфицирования половых партнеров и новорожденного.
Основным направлением в лечении является применение высокоспецифичных противовирусных препаратов — ациклических нуклеозидов, которые блокируют репликацию ВПГ. В настоящее время, согласно международным стандартам лечения герпес-вирусных инфекций, препаратами выбора являются ацикловир, валацикловир и фамцикловир [6—8].
Ацикловир — первый противовирусный препарат системного действия — проявляет свою активность против клеток, пораженных ВПГ. Поскольку ацикловир является аналогом 2’-деоксигуанозина, для функционирования ему необходима активация клеточной тимидинкиназой, измененной вирусом, с последующим его превращением в ацикловир-трифосфат. Такая форма ацикловира необратимо, конкурентно с деоксигуанозинтрифосфатом, ингибирует ДНК-полимеразу вируса, что предотвращает возможность элонгации цепи вирусной ДНК. Отсутствие в здоровой клетке специфических изменений, вызванных ферментом вируса, превращающим исходную форму ацикловира в ацикловир-трифосфат, обусловливает специфичность действия ацикловира.
К сожалению, при высокой избирательности действия ацикловира его биодоступность при пероральном приеме остается весьма низкой. В связи с этим для достижения желаемого эффекта в клинической практике зачастую приходится назначать достаточно высокие дозы данного препарата. Именно поэтому пероральное использование ацикловира ограничено при лечении тяжелых стадий заболеваний, вызванных вирусами герпеса.
В отличие от противовирусного препарата первого поколения ацикловира, валацикловир имеет исключительно высокую биодоступность, превышающую аналогичный параметр ацикловира в 3—5 раз. Кроме того, даже при пероральном применении средства его уровень в плазме крови достигает высоких величин, сравнимых со значениями, полученными при введении ацикловира в вену. Такое свойство валацикловира обусловлено его химической структурой. Ее уникальность заключается в том, что валацикловир представляет собой соединение L-валина и ацикловира эфирной связью. Эта особенность позволяет доставлять проацикловир в неизмененном виде в плазму крови. Метаболизируясь в печени гидролазой, валацикловир распадается на валин и ацикловир, который в свою очередь уже обладает антивирусным эффектом. Кроме того, некоторая часть валацикловира гидролизуется в тонком кишечнике с высвобождением активной формы ацикловира. Особенности фармакокинетики данного препарата позволяют назначать его вне зависимости от приема пищи.
Выделяют два основных способа применения противовирусных химиопрепаратов: эпизодическое назначение (по мере необходимости, при обострениях ГВИ) и пролонгированная терапия. В первом случае препарат назначают коротким курсом в течение 5—10 дней, во втором пациенты принимают препарат ежедневно в течение нескольких месяцев или лет, не только для купирования данного рецидива, но и для профилактики последующих обострений [7—9].
Эпизодическая терапия предпочтительна для пациентов, имеющих слабо выраженные и редкие обострения инфекционного заболевания. Целью лечения в этом случае является уменьшение выраженности симптомов рецидива. Для наибольшей эффективности прием препарата необходимо начинать во время продромального периода или 1-х суток клинических проявлений. Согласно Российским клиническим рекомендациям, при рецидивах генитального герпеса назначают ацикловир по 200 мг 5 раз в день (или по 400 мг 3 раза в день) в течение 5 дней, или валацикловир 500 мг 2 раза в день в течение 5 дней, или фамцикловир по 125 мг 2 раза в день в течение 5 дней [6] (табл. 1).

Своевременный прием ациклических нуклеозидов позволяет прервать репликацию вируса, и в таком случае рецидив протекает в абортивной форме. Для своевременного начала приема препаратов пациентам рекомендовано всегда иметь при себе небольшое количество таблеток ациклических нуклеозидов, а в случае рецидива, на стадии предвестников заболевания, принять препарат.
Для пациентов с частотой рецидивов более 6 раз в год рекомендована пролонгированная схема приема противовирусных препаратов. По данным литературы, она эффективна у 70—80% пациентов. Для такой терапии обязательным является индивидуализированный подход, который включает оценку частоты, тяжести обострений у данного пациента, а также его индивидуальные потребности в контроле рецидивов заболевания [7—9].
Супрессивная терапия предпочтительна в случаях частого рецидивирования генитального герпеса, особенно при тяжелом течении обострений. Также подчеркивается целесообразность использования супрессивной схемы лечения при выраженных эмоциональных реакциях пациента на возобновление симптомов заболевания. Применяемые дозировки при использовании супрессивной схемы лечения зависят от клинического течения рецидивов генитального герпеса. В случае, если у пациента с данным заболеванием количество рецидивов не превышает 10 раз в год, суточная доза валацикловира должна составлять 500 мг. При количестве рецидивов более 10 в год используется суточная дозировка валацикловира 1000 мг [7—9].
Преимущества применения валацикловира:
— в отличие от других противовирусных препаратов валацикловир не приостанавливает, а блокирует размножение вируса простого герпеса;
— меньшее количество приема таблеток в сутки улучшает комплаентность терапии у пациента и уменьшает риск пропуска приема препарата, а значит, повышает эффективность лечения и снижает лекарственную нагрузку на организм;
— валацикловир сочетается с большинством лекарственных средств, не влияет на память, внимание и скорость реакции;
— не обладает тератогенными и мутагенными эффектами.
В последнее время на российском рынке появляется большое количество препаратов валацикловира. Одним из таких средств является европейский аналог валациловира компании «Actavis» — Валвир. Форма выпуска — таблетки, покрытые пленочной оболочкой, в стандартной дозе 500 мг (валацикловира гидрохлорида гидрат 611, 70 мг), а также в дозе 1000 мг (валацикловира гидрохлорида гидрат 1223, 40 мг). Для изучения препарата проведено исследование его клинической эффективности у пациентов с хронической рецидивирующей герпесвирусной инфекцией (ХРГВИ).
Материал и методы
Исследование проводилось у пациентов, обратившихся в клинику Института иммунологии Федерального медико-биологического агентства России в 2014 г. В основную группу вошли иммунокомпетентные пациенты (без установленного первичного иммунодефицита и ВИЧ-инфекции), мужчины и женщины старше 18 лет с клинической картиной обострения генитальной герпетической инфекции. Критериями исключения были: беременность, лактация, применение другой противовирусной или иммунотропной терапии, наличие декомпенсированных заболеваний или острых состояний, способных существенно повлиять на результат исследования.
На визите скрининга специалисты собирали анамнез заболевания, отмечая частоту и продолжительность обострений инфекции, ранее применяемое лечение. Всем пациентам были даны рекомендации по своевременному началу приема препарата валацикловир (Валвир) в течение первых 6 ч от момента появления симптомов обострения или в период продромальных симптомов.
В процессе наблюдения за пациентами, получавшими терапию в момент обострения генитального герпеса, обращали внимание на длительность и выраженность местных симптомов (зуд, боль, жжение в месте поражения), характер элементов высыпаний, площадь поражения, сроки заживления и продолжительность симптомов интоксикации.
Выраженность субъективных симптомов (зуд, боль, жжение) во время обострения оценивали в баллах по следующей шкале: 0 баллов — отсутствие жалоб, 1 балл — незначительные ощущения зуда, жжения или боли в месте высыпаний, не мешающие повседневной жизни, 2 балла — умеренно выраженные симптомы, создающие ежедневный дискомфорт, 3 балла — жалобы на выраженные субъективные ощущения в области высыпаний с иррадиацией в другие анатомические области (бедра, крестец, промежность и т. д.).
Пациенты основной группы (20 мужчин и женщин с генитальной ХРГВИ) получали препарат валацикловир (Валвир) по схеме 500 мг 2 раза в сутки в течение 5 дней. Для оценки эффективности и безопасности терапии пациентов осматривали в клинике на 1-е, 3-и, 5-е сутки лечения, а также через 14 дней после завершения терапии. В случае появления новых высыпаний пациент являлся в клинику на незапланированный визит. В группу сравнения вошли 20 пациентов, получавших терапию ацикловиром (производство Россия) по стандартной схеме — 400 мг 3 раза в сутки в течение 5 дней.
Всем пациентам во время каждого визита проводили объективное обследование, включающее регистрацию следующих параметров: локализация очага поражения; площадь очага поражения (см 2 ); характеристика элементов высыпаний с указанием времени появления (гиперемия, везикулы, эрозии, начало эпителизации, полная реэпителизация).
Оценку эффективности исследуемого препарата проводили на основании следующих критериев:
— уменьшение степени тяжести клинического течения рецидива;
— время продолжительности местных симптомов (зуд, боль, жжение в области поражения);
— время, необходимое для начала эпителизации;
— время достижения полного выздоровления (полная эпителизация).
Кроме объективных данных, эффективность терапии оценивали согласно субъективным ощущениям пациента в баллах: 5 баллов — очень хорошая; 4 балла — хорошая; 3 балла — удовлетворительная; 2 балла — неудовлетворительная; 1 балл — крайне неудовлетворительная.
Побочные реакции от приема препарата оценивали согласно объективным данным и субъективным ощущениям пациента. Выраженность побочных реакций исследуемого препарата оценивали по следующей шкале в баллах: 5 баллов — не отмечается побочных эффектов; 4 балла — наблюдаются незначительные побочные эффекты, не причиняющие серьезных проблем пациенту и не требующие отмены препарата; 3 балла — отмечаются побочные эффекты, оказывающие влияние на состояние пациента, но не требующие отмены препарата; 2 балла — имеет место нежелательный побочный эффект, оказывающий значительное отрицательное влияние на состояние пациента, требующий отмены препарата; 1 балл — побочный эффект, требующий отмены препарата и применения дополнительных медицинских мероприятий.
Переносимость препарата оценивалась как лечащим врачом, так и самими пациентами согласно следующей шкале: 5 — очень хорошая, 4 — хорошая, 3 — удовлетворительная, 2 — плохая, 1 — очень плохая.
Полученные результаты были статистически обработаны методами вариационной статистики с использованием критериев Стьюдента и представлены в виде таблиц.
Результаты и обсуждение
В основную группу вошли 20 пациентов (7 мужчин и 13 женщин) в возрасте от 18 до 65 лет с клинической картиной рецидивирующего генитального герпеса (табл. 2). Клиническое течение генитальной ГВИ у пациентов основной группы характеризовалось высокой частотой обострений (до 1 раза в 1—1,5 мес), выраженными местными симптомами обострения (зуд, жжение, боль в области поражения). Группу сравнения составили 20 пациентов с аналогичной формой ГВИ, сопоставимые по полу, возрасту и характеру течения заболевания. Более 50% пациентов, вошедших в исследование, в течение последних 3—6 мес применяли только местную терапию (мазь с ацикловиром, интерфероном, растворы антисептиков) герпетических поражений в период рецидива.

Все пациенты, участвующие в исследовании, предъявляли жалобы на появление локальной гиперемии, отека, пузырьковых или эрозивных высыпаний, сопровождавшихся зудом, жжением, болезненностью. До лечения все больные были обследованы для идентификации типа ВПГ (1-й или 2-й) методом полимеразной цепной реакции. Положительный результат получен в 100% случаев. Приблизительно 1/3 пациентов (27,5—37,5%) имели симптомы общей интоксикации в период обострения (головная боль, повышение температуры тела до субфебрильных цифр, слабость). У 45—50% больных присутствовал болевой синдром по ходу пораженных нервов (табл. 3).

На фоне лечения пациентов с генитальной формой ХРГВИ Валвиром длительность рецидива и период полной эпителизации сократились в среднем с 6,4 до 3,8 сут, что достоверно отличается от аналогичных показателей у пациентов, которым был назначен ацикловир (р 
Хорошо известно, что обострение ХРГВИ вызывает появление физической боли, дискомфорта в области поражения и, как следствие, психологическое напряжение больного. Значительное сокращение периода эпителизации (полное заживление) с 6,4 до 3,8 сут на фоне приема валацикловира (Валвира) в дозе 500 мг 2 раза в сутки позволило уменьшить выраженность местных симптомов рецидива и улучшить психологический фон у пациентов в период обострения простого герпеса. При лечении ацикловиром эти показатели изменяются менее значимо с 6,7 до 4,6 дня, что составляет достоверно больший период физического и психологического дискомфорта у обследованных лиц при рецидиве инфекции. Положительным моментом является существенное сокращение продолжительности местных симптомов (зуд, боль, жжение) до 2,5 сут при приеме валацикловира (Валвира) (p