вакцина sars cov 2 что это значит
Вакцины против SARS-CoV-2: светлые и темные стороны
Аннотация
Вакцины для предотвращения инфицирования коронавирусом 2 острого респираторного синдрома (SARS-CoV-2) стимулируют нейтрализующий иммунный ответ. Относительно безопасности вакцин против SARS-CoV-2 были высказаны некоторые опасения, основанные главным образом на сообщениях о серьезных тромбоэмболических событиях после вакцинации. Был сделан ряд предположений о механизмах, которые могли бы объяснить неблагоприятные реакции со стороны сердечно-сосудистой системы в ответ на введение вакцин против SARS-CoV-2. В настоящее время доступны различные типы вакцин, включая живые аттенуированные вакцины, инактивированные вакцины, вакцины на основе рекомбинантного белка, векторные вакцины, ДНК-вакцины и РНК-вакцины. Вакцины усиливают эндогенный синтез S-белка SARS-CoV-2 в различных клетках. После синтеза молекулы S-белка собираются в цитоплазме, мигрируют к поверхности клетки и выделяются в конформации, сходной с нативной. Эти белки распознаются иммунной системой, в которой быстро развивается иммунный ответ. Такой ответ представляется довольно сильным в случае ДНК-вакцин, кодирующих вирусные векторы, а также у лиц, иммунизированных вследствие предшествующего контакта с SARS-CoV-2. В результате патологические проявления могут напоминать таковые при активном коронавирусном заболевании. При проникновении вируса синтезированные в клетках свободно плавающие молекулы S-белка циркулируют в кровотоке и регулярно взаимодействуют с рецепторами ангиотензинпревращающего фермента 2 (АПФ2), которые экспрессируются множеством клеток, включая тромбоциты, что способствует интернализации и деградации АПФ2. Эти реакции в конечном счете могут приводить к агрегации тромбоцитов, тромбозу и воспалению, которые опосредуются рядом механизмов, в том числе с участием рецепторов АПФ2 тромбоцитов. В то время как из фазы III клинических испытаний вакцин участники, иммунизированные ранее, обычно исключаются, вакцинация крупных популяций в реальной жизни неизбежно затронет людей с уже присутствующим иммунитетом. Это может привести к чрезмерному усилению воспалительной и тромботической реакции у отдельных лиц. Данная проблема остро нуждается в дальнейших исследованиях.
1. Введение
Коронавирус 2 острого респираторного синдрома (SARS-CoV-2) быстро распространяется по миру и уже привел к смерти 4,3 миллионов людей и 202 миллионам случаев заражения, подтвержденных лабораторными тестами (на 9 августа 2021, https://covid19.who.int/). В связи с этим продолжаются поиски терапевтических средств, которые могли бы окончательно остановить переход от инфицирования к развитию тяжелой формы коронавирусного заболевания (COVID-19).
Под пристальным вниманием находятся различные терапевтические стратегии, среди которых предотвращение связывания SARS-CoV-2 с рецепторами на клетках человека, блокировка синтеза и репликации вирусной рибонуклеиновой кислоты (РНК), восстановление врожденного иммунитета хозяина и регуляция специфических рецепторов или ферментов хозяина [1]. Тем не менее, наиболее многообещающим подходом для сдерживания пандемии считаются вакцины, предотвращающие инфицирование SARS-CoV-2.
На сегодняшний день всего доступно семь вакцин против SARS-CoV-2 на основе трех разных платформ [2–4], и на 16 апреля 2021 года всего было введено 734 121 870 доз вакцины (на 9 августа 2021 — 3 984 596 440 доз, https://covid19.who.int/).
Однако недавно возникли некоторые опасения, касающиеся безопасности вакцин против SARS-CoV-2; они основаны, главным образом, на отдельных сообщениях о тромбоэмболических событиях [5–8].
В свете этого целью данной статьи было обобщить основные механизмы действия вакцин против SARS-CoV-2 и их потенциальное влияние на сердечно-сосудистую систему.
2. Краткий обзор вакцин, одобренных в Европе
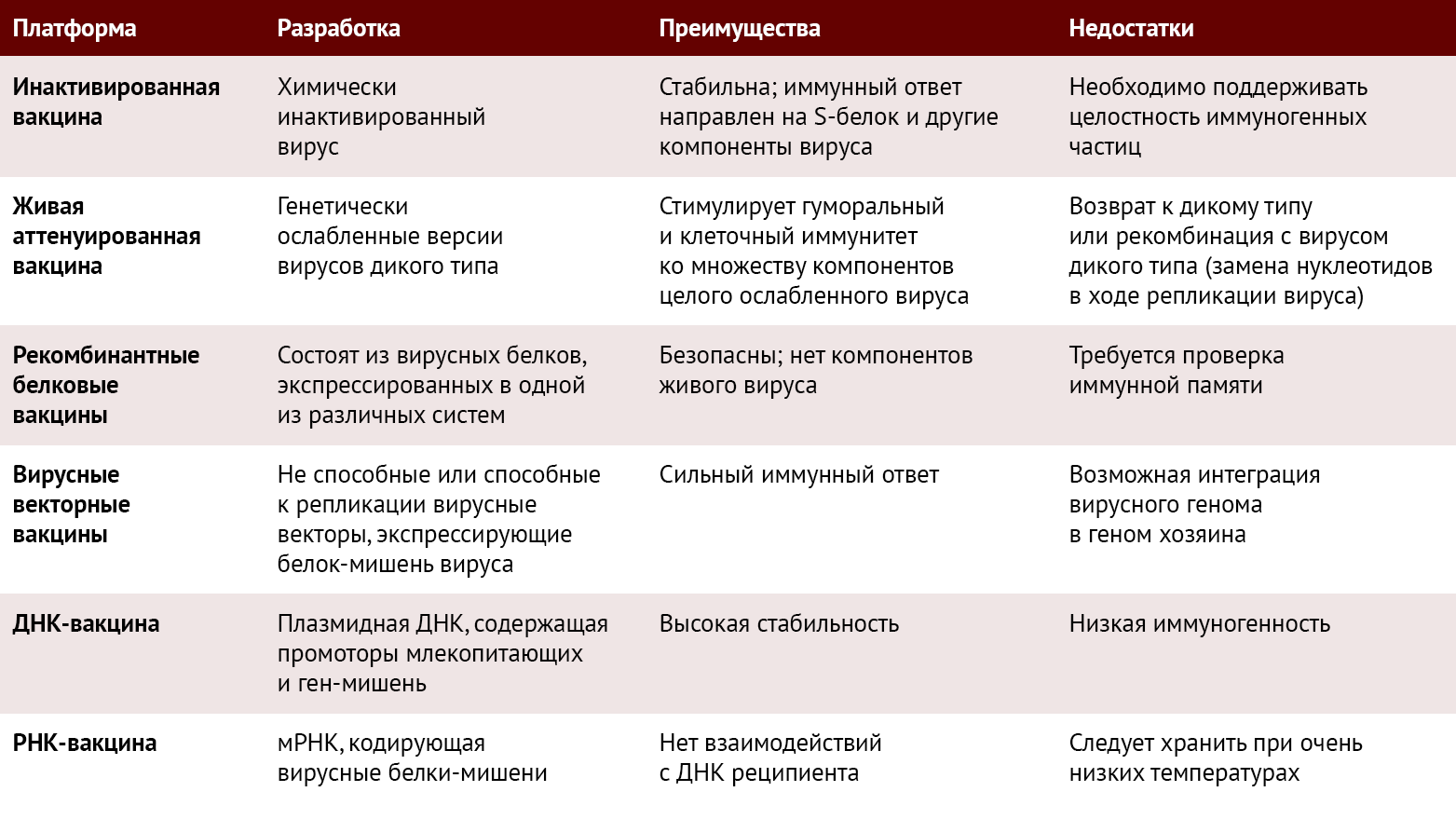
Вакцины против SARS-CoV-2 разрабатываются на основе нескольких платформ (таблица 1). К ним относятся живые аттенуированные вакцины, инактивированные вакцины, вакцины на основе рекомбинантного белка, векторные вакцины (векторные вакцины, не способные к репликации; векторные вакцины, способные к репликации и векторные вакцины на основе инактивированного вируса), ДНК-вакцины и РНК-вакцины (таблица 1).
Taблица 1 | Различные платформы, используемые для разработки вакцин против SARS-CoV-2. Для каждой платформы также указаны преимущества и недостатки
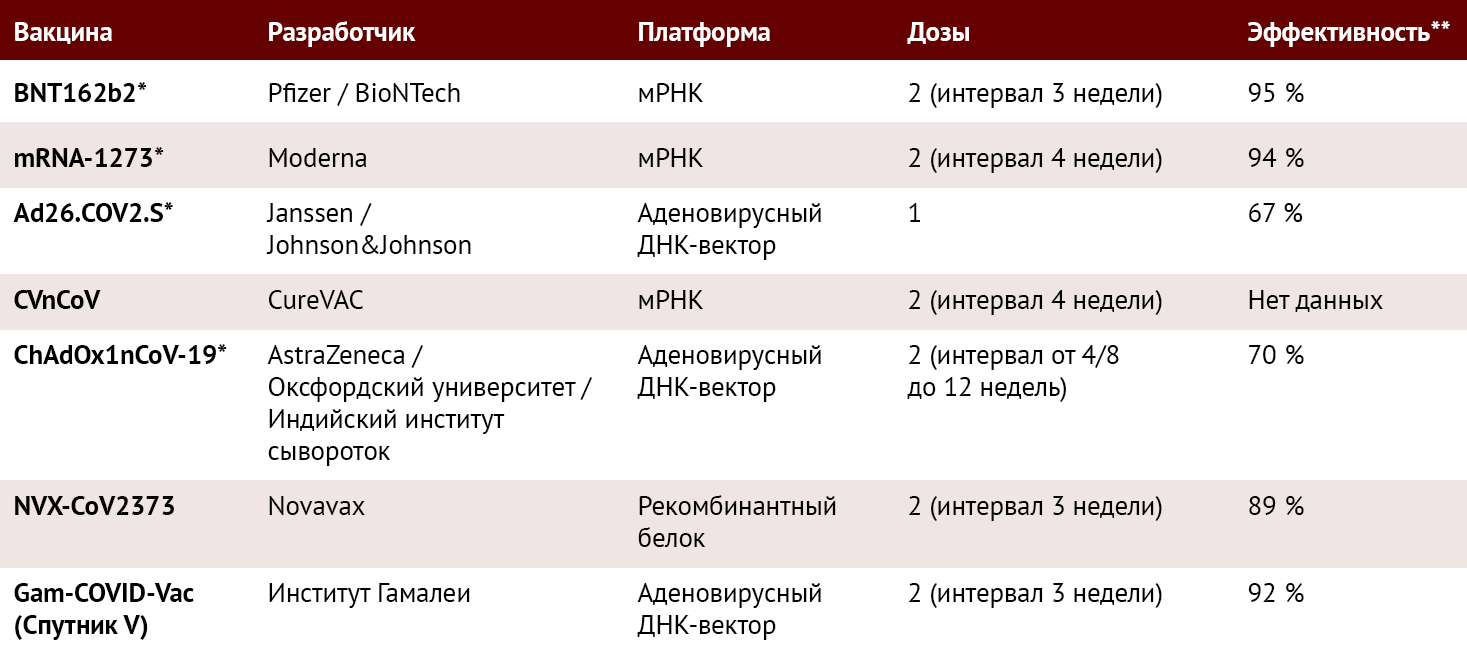
Основные характеристики вакцин против SARS-CoV-2, включая те, что одобрены Европейским агентством лекарственных средств (EMA), приведены в таблице 2.
Таблица 2 | Основные характеристики вакцин против COVID-19. По данным [2, 9–11, 18, 19] и www.clinicaltrials.gov
* = вакцины, одобренные Европейским Союзом; ** = эффективность против симптомного/умеренного/тяжелого COVID-19 (см. ссылки для дополнительной информации); мРНК = матричная рибонуклеиновая кислота
Как будет описано ниже, два основных типа коронавирусных (COVID-19) вакцин одобрены для экстренного использования (технология мРНК с системой доставки на основе липидных наночастиц и технология ДНК с нереплицирующейся рекомбинантной аденовирусной системой).
2.1. ChAdOx1nCoV-19
COVID-19 Vaxzeria (вакцина против COVID-19 AstraZeneca) — моновалентная вакцина, состоящая из единственного рекомбинантного не способного к репликации ДНК-вектора аденовируса шимпанзе (ChAdOx1), кодирующего S-гликопротеин SARS-CoV-2 (ChAdOx1-S, AZD1222) [2, 3]. SARS-CoV-2 S-иммуноген в вакцине экспрессируется в тримерной конформации «до слияния»; кодирующая последовательность для стабилизации S-белка в этом состоянии не была модифицирована [2, 3].
Курс вакцинации Vaxzevria состоит из введения двух отдельных доз по 0,5 мл. Вторую дозу следует вводить через 4–12 недель после первой. Каждая доза (в виде суспензии для инъекции) состоит из не менее чем 2,5 × 10 8 инфекционных единиц ChAdOx1-S. Вакцина предназначена только для внутримышечного введения, предпочтительно в дельтовидную мышцу плеча.
Согласно показаниям EMA, защитное действие от COVID-19 появляется примерно через три недели после первой дозы вакцины Vaxzevria, и люди могут не быть защищенными полностью до прошествия 15 дней после введения второй дозы.
Клиническая эффективность вакцины Vaxzevria была оценена путем промежуточного анализа данных четырех текущих слепых рандомизированных контролируемых испытаний, проведенных в Великобритании, Бразилии и Южной Африке [9]. Участники возрастом от 18 лет были случайно разделены в отношении 1 : 1 на группы вакцины ChAdOx1 nCoV-19 или контрольную (группы конъюгированной вакцины от менингококка A, C, W и Y или солевого раствора).
Из исследований исключались участники с тяжелыми и/или неконтролируемыми сердечно-сосудистыми, желудочно-кишечными, печеночными, почечными, эндокринными/метаболическими заболеваниями и неврологическими нарушениями, а также лица с тяжелой иммуносупрессией, беременные женщины и участники с доказанной инфекцией SARS-CoV-2 в анамнезе [9].
Первичный анализ эффективности включал симптоматический COVID-19 у исходно сероотрицательных участников с ПЦР-положительным результатом мазка более, чем через 14 дней после введения второй дозы вакцины.
Общая эффективность составила 70,4 % (95 % доверительный интервал [ДИ]: 54,8–80,6) в предотвращении симптоматического COVID-19 (131 подтвержденный случай COVID-19 cреди более 11 000 участников; 30 — в группе вакцины и 101 — в контрольной группе [9].
Начиная с 21 дня после первой дозы было госпитализировано 10 пациентов — все из контрольной группы. У двоих из этих пациентов COVID-19 протекал в тяжелой форме, один пациент умер [9].
Сходные результаты были получены в фазе III рандомизированного двойного слепого плацебо-контролируемого многоцентрового исследования, в котором оценивались безопасность, эффективность и иммуногенность AZD1222 при предотвращении COVID-19 по сравнению с плацебо. Данные по 32 449 участникам из 88 испытательных центров в США, Перу и Чили показали эффективность вакцины против симптоматического COVID-19, равную 76 %; эффективность вакцины повышалась до 100 % и 85 % против тяжелого или критического течения болезни и госпитализации и против симптоматического COVID-19 у участников от 65 лет и старше, соответственно [10].
2.2. BNT162b2
Одна доза вакцины Pfizer/BioNTech (0,3 мL) содержит 30 мкг одноцепочечной, кэпированной с 5′-конца матричной РНК (мРНК) SARS-CoV-2, произведенной in vitro в бесклеточной системе с помощью транскрипции соответствующих матриц ДНК, кодирующих вирусный S-белок [2]. мРНК специфично заключена в липидные наночастицы. Она кодирует заякоривающийся в мембране полноразмерный S-белок с двумя точечными мутациями внутри центральной спирали. В результате мутации в этих сайтах оказывается пролин, что удерживает S-белок в конформации «до слияния», предпочтительной с точки зрения его антигенных свойств [2]. Вакцину после разведения следует вводить внутримышечно; предпочтительным местом введения является дельтовидная мышца плеча [2].
В текущем многонациональном плацебо-контролируемом базовом испытании эффективности лица возрастом от 16 лет и старше случайным образом распределяются в отношении 1 : 1 для получения двух доз с интервалом в 21 день или в группу плацебо или вакцины-кандидата BNT162b2 [11].
Вкратце, всего рандомизации подверглись 43 548 участников, из которых 43 448 получили инъекции (21 720 — BNT162b2 и 21 728 — плацебо). В целом было выявлено восемь случаев COVID-19 с началом по крайней мере через семь дней после второй дозы среди участников, получавших BNT162b2, и 162 случаях среди тех, кто получал плацебо (95 % эффективности, 95 % ДИ: 90,3–97,6) [11]. Сходная эффективность вакцины также наблюдалась в подгруппах, в которые участников распределяли по возрасту, полу, расе, национальности, базовому индексу массы тела и наличию сопутствующих заболеваний. Частота серьезных побочных эффектов была низкой и сходной в группе вакцины и плацебо [11].
Следует отметить, что ряд наблюдательных исследований из разных стран показал похожие результаты [12–16].
2.3. mRNA-1273
Вакцина mRNA-1273, выпускаемая компанией Moderna, представляет собой вакцину на основе мРНК SARS-CoV-2 с модификацией нуклеотидов, которая заключена в липидную наночастицу и кодирует антиген S-2P, состоящий из S-гликопротеина c трансмембранным «якорем» и интактным сайтом расщепления S1–S2 [17]. Капсула из липидных наночастиц состоит из четырех липидов и приготовлена так, чтобы отношение мРНК и липидов в ней было фиксированным. Вакцина mRNA-1273 представляет собой стерильную жидкость для инъекции с концентрацией 0,5 мг/мл. Для приготовления вводимых доз в качестве растворителя использовался изотонический раствор хлорида натрия [17].
Фаза III рандомизированного слепого для наблюдателя испытания проводилась в 99 центрах в США [18]. Всего 30 420 лиц были случайным образом распределены в отношении 1 : 1 для получения двух внутримышечных инъекций mRNA-1273 (100 мкг) или плацебо с интервалом в 28 дней. Первичной конечной точкой считалось предотвращение COVID-19, начавшегося по крайней мере через 14 дней после второй инъекции у участников, которые прежде не были инфицированы SARS-CoV-2 [18].
Симптоматическое заболевание COVID-19 было подтверждено у 185 участников в группе плацебо и 11 — в группе mRNA-1273 (эффективность вакцины: 94,1 %, 95 % ДИ: 89,3–96,8 %) [18].
Тяжелая форма COVID-19 возникла у 30 участников, с одним летальным исходом; все 30 случаев были в группе плацебо. Умеренная, преходящая реактогенность после вакцинации более часто возникала в группе mRNA-1273. Серьезные побочные эффекты были редки, а их частота — близкой в обеих группах [18].
2.4. Ad26.COV2.S
Вакцина против COVID-19 компании Janssen — это рекомбинантный, не способный к репликации аденовирусный вектор (ДНК) серотипа 26 (Ad26), кодирующий полноразмерный стабилизированный S-белок вируса SARS-CoV-2. Вакцина была получена из первого клинического изолята уханьского штамма (Ухань 2019; полная геномная последовательность, NC_045512) [19].
В фазах I–IIa клинических испытаний участвовали здоровые взрослые (N = 805) в возрасте от 18 до 55 лет (когорта 1) и ≥ 65 лет (когорта 2), которые были случайным образом распределены по группам получающих вакцину Ad26.COV2.S в количестве 5 × 10 10 вирусных частиц (низкая доза) или 1 × 10 11 вирусных частиц (высокая доза) на миллилитр или плацебо в соответствии с расписанием, предусматривающим одну или две дозы [19]. Нейтрализующие антитела против вируса дикого типа обнаруживались у не менее 90 % всех участников на 29 день после введения первой дозы вакцины. Вторая доза привела к увеличению титра в 2,6–2,9 раза [19].
Как сообщает Управление по контролю за качеством пищевых продуктов и медикаментов (FDA) [20], в фазе III клинического испытания эффективности участвовало 40 000 человек в возрасте от 18 лет, и вакцина вводилась в единственной дозе. Испытание показало эффективность 66,9 % (95 % ДИ: 59,0–73,4) при предотвращении умеренного, тяжелого или критического течения COVID-19 (464 случаев, из которых 116 — в группе вакцины и 348 — в группе плацебо). Вакцина приобретала эффективность через 28 дней после вакцинации, и она была сходна с таковой через 14 дней [20].
3. Различия в платформах и перспективах
Вакцины, одобренные в настоящее время или рассматриваемые для применения, были разработаны с применением различных новейших технологий (тaблица 1) [3, 4]. Как упоминалось ранее, вакцины, на текущий день одобренные EMA, созданы на основе двух различных платформ (а именно — нереплицирующихся вирусных векторов и мРНК).
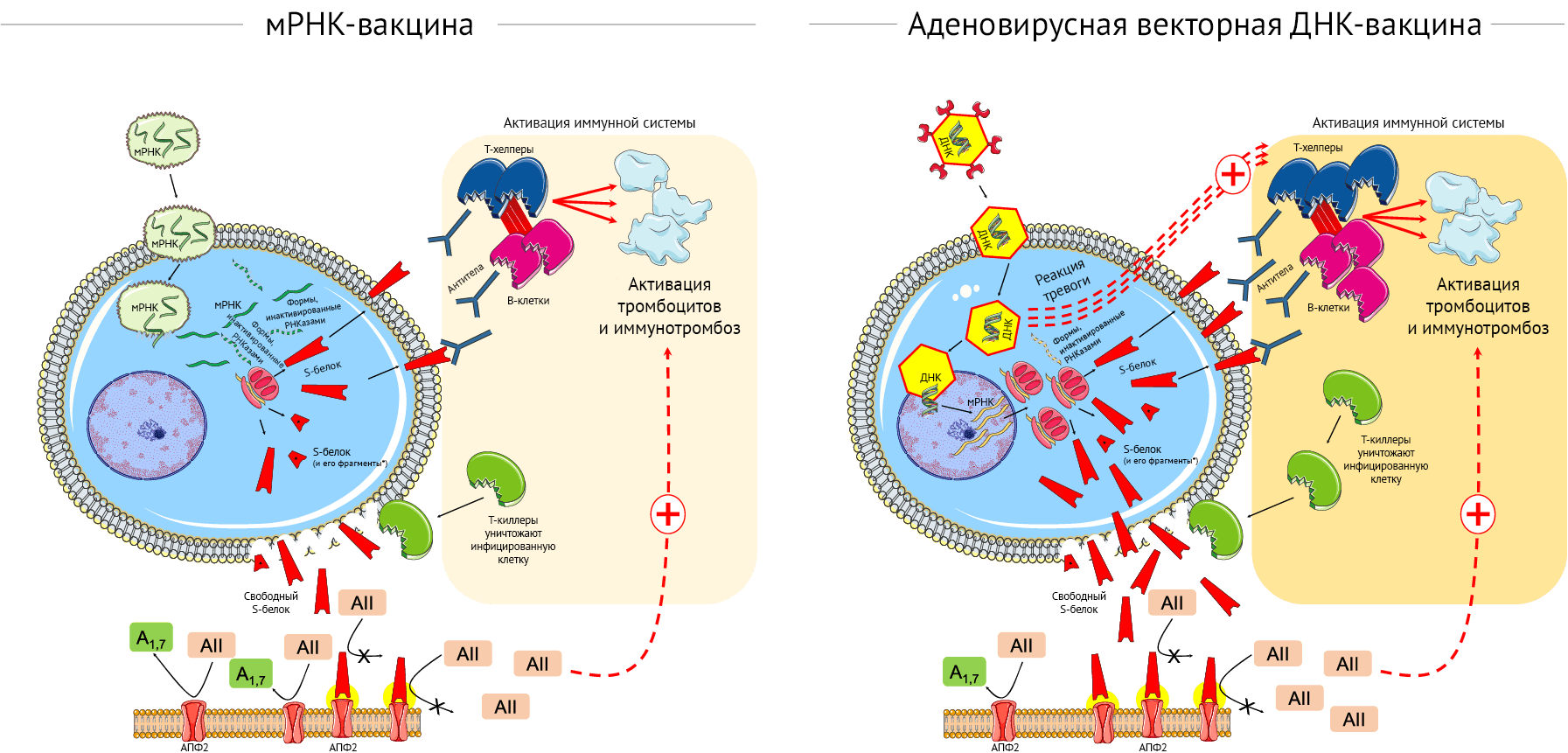
Основные отличия между этими платформами изображены на рис. 1.
Нереплицирующиеся вирусные векторы (аденовирус шимпанзе для ChAdOx1nCoV-19) представляют собой носители для двухцепочечного гена, кодирующего вирусный S-белок (рис. 1, правая панель). ДНК не столь хрупкая, как РНК, и толстая белковая оболочка аденовируса помогает защитить генетический материал, находящийся внутри. Оказавшись внутри инфицированной клетки, вирусный вектор проникает в ядро, где он вырабатывает антиген посредством многочисленных молекул РНК, при этом не копируясь сам. мРНК покидает клеточное ядро, с нее транслируется S-белок, и начинается его сборка. Некоторое варьирующееся количество молекул S-белка в цитоплазме распадается на фрагменты, а другие мигрируют на поверхность клетки [3, 4].
Выступающие молекулы S-белка распознаются иммунной системой, которая запускает иммунную реакцию. Аденовирусный вектор вызывает специфическую иммунную реакцию со стороны хозяина. Тем не менее, использование вектора на основе аденовируса животных может ослаблять предсуществующий иммунитет к вектору, выявляемый при использовании человеческого вирусного вектора [4]. Ранний ответ на аденовирусный вектор со стороны врожденного иммунитета начинается в период от 1–3 часов до 1 дня после вакцинации благодаря действию цитокинов/хемокинов и иммунных клеток и завершается усилением иммунных реакций на S-белок [21].
Более того, вирусные векторные вакцины обладают собственными адъювантными свойствами. После инъекции аденовирусы действуют на клетки врожденного иммунитета (например, дендритные клетки) и макрофаги и стимулируют врожденные иммунные реакции посредством индукции секреции интерферона I типа с участием различных паттерн-распознающих рецепторов. Это приводит к получению Т-клетками дренирующих лимфоузлов в месте инъекции антигенного и воспалительного сигнала (что активирует T-клетки и мобилизует адаптивный иммунитет) [22].
В случае вирусных векторов с ДНК нельзя исключить встраивание вирусного генома в геном хозяина [3].
РНК-вакцины (на основе обычной РНК или самореплицирующейся РНК) приводят к экспрессии кодируемых белков [3, 4]. Их стратегия — использование транскрипционного аппарата хозяина для продукции белков-мишеней путем создания множества копий белка с каждой матрицы мРНК и индукция адаптивного иммунитета путем стимуляции B- и T-клеточного иммунного ответа (рис. 1, левая панель). мРНК может выступать в качестве иммуногена, кодируя вирусный белок, и адъюванта — благодаря внутренним иммуностимулирующим свойствам РНК. При попадании в клетку мРНК более специфично узнается эндосомными и цитозольными внутренними сенсорами, которые образуют ключевую часть врожденного иммунного ответа на вирусы, результатом чего становится активация клеток и выработка интерферона I типа и множества медиаторов воспаления [23, 24]. Примечательно, что липидный носитель из наночастиц и далее защищает мРНК, может прицельно доставлять ее в лимфатическую систему и способствовать трансляции белка в лимфатических узлах. Попадая в лимфоузлы, носитель из липидных наночастиц поглощается дендритными клетками, которые затем выделяют антиген и презентируют его Т-клеткам для активации адаптивного иммунного ответа [23, 24].
Тем не менее, модификация мРНК требуется для повышения ее стабильности [3], a помещение в капсулу из липидных наночастиц улучшает клеточную доставку; локализация трансляции в цитоплазме и невозможность встраивания в геном служат еще одними преимуществами мРНК-вакцин [3, 4]. Другое очевидное следствие состоит в том, что в отличие от вирусных векторов, которые должны проникнуть в ядро клетки, мРНК присутствует только в цитоплазме и подвергается действию активных систем деградации РНК (ферментов РНКаз), служащих первым звеном защиты от РНК-вирусов за счет снижения общего уровня процессов трансляции.
Как и в случае вакцин на основе вирусных векторов, молекулы S-белка и их фрагменты, вырабатываемые инфицированными клетками, накапливаются на их поверхности и быстро распознаются иммунной системой хозяина с последующим синтезом антител. Оба типа вакцин вызывают значительный иммунный ответ на уровне нейтрализующих антител и специфических к вирусу Т-клеток [25, 26]. В частности, способность вакцин на основе мРНК и вирусных векторов вызывать внутриклеточное образование S-белка и врожденные иммунные реакции должна стимулировать дифференцировку CD8+ и CD4+ T-клеток в подтипы эффекторных клеток и клеток памяти с помощью выработки интерферона I типа [24, 27].
Более того, вторая доза этих вакцин связана с усилением воспалительного ответа вследствие кратковременных изменений, претерпеваемых клетками врожденного иммунитета, такими как макрофаги, в ходе явления, известного как «тренированный иммунитет», и/или активации T- и B-клеток памяти, образовавшихся после изначальной инъекции [24, 27]. До конца не ясно, как эти вакцины мобилизуют иммунный ответ и то, сколько длится защита [24].
4. Опыт MERS и SARS-CoV-1
В последние несколько лет вакцины на основе ДНК и мРНК вызвали значительный интерес как потенциальные решения для ряда медицинских вопросов. Эти типы вакцин вызывают гуморальный (нейтрализующие антитела) и клеточный иммунный ответ и помогают избежать возможных рисков для здоровья, связанных с работой с инактивированными или ослабленными патогенами. В целом процесс их разработки происходит быстрее по сравнению с «традиционными» техниками [28].
Данные, касающиеся различий между платформами (см. предыдущую секцию) и их взаимодействия с хозяином доступны, главным образом, из доклинических исследований, выполненных для SARS-CoV-1 и коронавируса ближневосточного респираторного синдрома (MERS-CoV). Подобно SARS-CoV-2, антигенной мишенью вакцин против SARS-CoV-1 и MERS служит крупный поверхностный S-белок. Были разработаны и/или протестированы на эффективность несколько вакцин-кандидатов против MERS и SARS-CoV-1, включая вакцины на основе вирусных векторов, которые экспрессируют S-белок [29–31]. В целом вакцины-кандидаты продемонстрировали способность вызывать иммунный ответ и/или выработку нейтрализующих антител [29–31]. Антитела, связывающиеся с рецептор-связывающим доменом (RBD) S-белка показали способность предотвращать его взаимодействие с АПФ2 и нейтрализовать вирусы [29–31].
Тем не менее, исследования вакцин против SARS-CoV-1 и MERS-CoV на животных также показали, что вакцинация вызывает синтез антител без нейтрализующей активности, которые могут опосредовать усиление вирусной инфекции (после контакта с вирусом дикого типа) или вызывать неблагоприятные иммунные реакции, такие как воспаление, обостренный гепатит и эозинофильное воспаление легких [32–35].
Эти экспериментальные исследования SARS-CoV-1 и MERS-CoV создали некоторые опасения, касающиеся усиления заболевания, индукции синтеза антител, усиливающих вирус, и неблагоприятных иммунных реакций после вакцинации [36].
5. Вакцинация и иммунотромбоз
Недавно возник ряд вопросов, касающихся безопасности вакцин против COVID-19, которые основаны на отдельных сообщениях о тромбоэмболии — в некоторых случаях с летальным исходом — после получения вакцин Vaxzevria и Johnson & Johnson [5–8].
Принимая во внимание все доступные в настоящее время данные, включая рекомендации экспертной группы по сложившейся ситуации, недавно EMA заключило, что нетипичные тромботические события должны быть включены в список побочных эффектов вакцины Vaxzevria (бывшая вакцина против COVID-19 AstraZeneca).
В частности, Комитет по оценке рисков в области фармаконадзора (PRAC) EMA провел углубленный анализ 62 случаев (18 летальных) тромбоза венозного синуса головного мозга (CVST) и 24 случаев тромбоза висцеральных вен, зарегистрированных в базе данных по безопасности лекарственных средств Европейского Союза (EudraVigilance) от 22 марта 2021 года [17]. Однако EMA пришло к выводу, что «указанная комбинация тромбов и низкого уровня тромбоцитов очень редка, а общие преимущества вакцины в предотвращении COVID-19 перевешивают риски побочных эффектов».
В этом контексте в недавнем отчете Датского национального регистра пациентов оценивали частоту впервые выявленных случаев венозной тромбоэмболии среди взрослого населения в целом, зарегистрированных с 1 января 2010 года по 30 ноября 2018 года [37]. Все показатели заболеваемости были рассчитаны путем деления числа случаев венозных тромбоэмболий за период наблюдения на сумму человеко-лет и представлялись в расчете на 1000 человеко-лет [37]. Затем, используя значение частоты случаев венозной тромбоэмболии, авторы оценили ожидаемое число случаев на протяжении одной недели и одного месяца, соответственно, в популяции, по размеру равной той, что получила вакцину против COVID-19 Oxford/AstraZeneca в Европе к 10 марта 2021 года [37]. Это было сделано путем пересчета показателей заболеваемости на недельный (7 дней) и месячный (30,5 дней) уровень на человека и умножения их на пять миллионов (то есть размер, соответствующий приблизительному количеству людей, получивших вакцину против COVID-19 Oxford/AstraZeneca в Европе к 10 марта 2021 года).
Частота заболеваемости была вычислена для популяции в целом и для подгруппы датчан возрастом 18–64 года. Эта возрастная группа служит отражением возрастной категории лиц, которые преимущественно получали вакцину Oxford/AstraZeneca в большинстве европейских стран [37]. Частота венозной тромбоэмболии на 1000 человеко-лет среди датчан возрастом 18–99 лет составляла 1,76 (95 % ДИ: 1,75–1,78) и 0,95 (95 % ДИ: 0,94–0,96) — среди датчан возрастом 18–64 лет [37]. Если ограничивать оценки тромбозом глубоких вен или легочной эмболией, то частота встречаемости на 1000 человеко-лет составляет 1,70 (95 % ДИ: 1,68–1,71) среди датчан возрастом 18–99 лет и 0,91 (95 % ДИ: 0,89–0,92) для лиц 18–64 лет [37].
Как детально описано авторами исследования [37], если основываться на данных по 18–99-летним датчанам, в популяции размером пять миллионов человек такая частота соответствует примерно 169 ожидаемым случаям венозной тромбоэмболии в неделю или 736 ожидаемым случаям в месяц. Аналогично, если брать за основу частоту заболеваемости у 18–64-летних датчан, следует ожидать 91 случай венозной тромбоэмболии в неделю или же 398 — в месяц.
Другими словами, эти результаты отражают концепцию о том, что зарегистрированное количество тромбоэмболических событий среди европейцев, получивших вакцину против COVID-19 Oxford/AstraZeneca, не увеличилось по сравнению с ожидаемой величиной, которая была рассчитана на основе показателей заболеваемости среди всего населения Дании до внедрения программы вакцинации [37].
Однако, как утверждают авторы, данные, полученные в Дании, не могут исключить возможности того, что некоторые случаи венозной тромбоэмболии, о которых сообщалось в связи с использованием вакцины, действительно могли быть вызваны вакциной [37].
Сходным образом, совместное заявление Центра хронических заболеваний (CDC) и FDA содержит рекомендацию приостановить использование этой вакцины из соображений безопасности в связи с сообщениями о шести случаях редких и тяжелых тромбозов у лиц, которым вводили вакцину Johnson & Johnson [6].
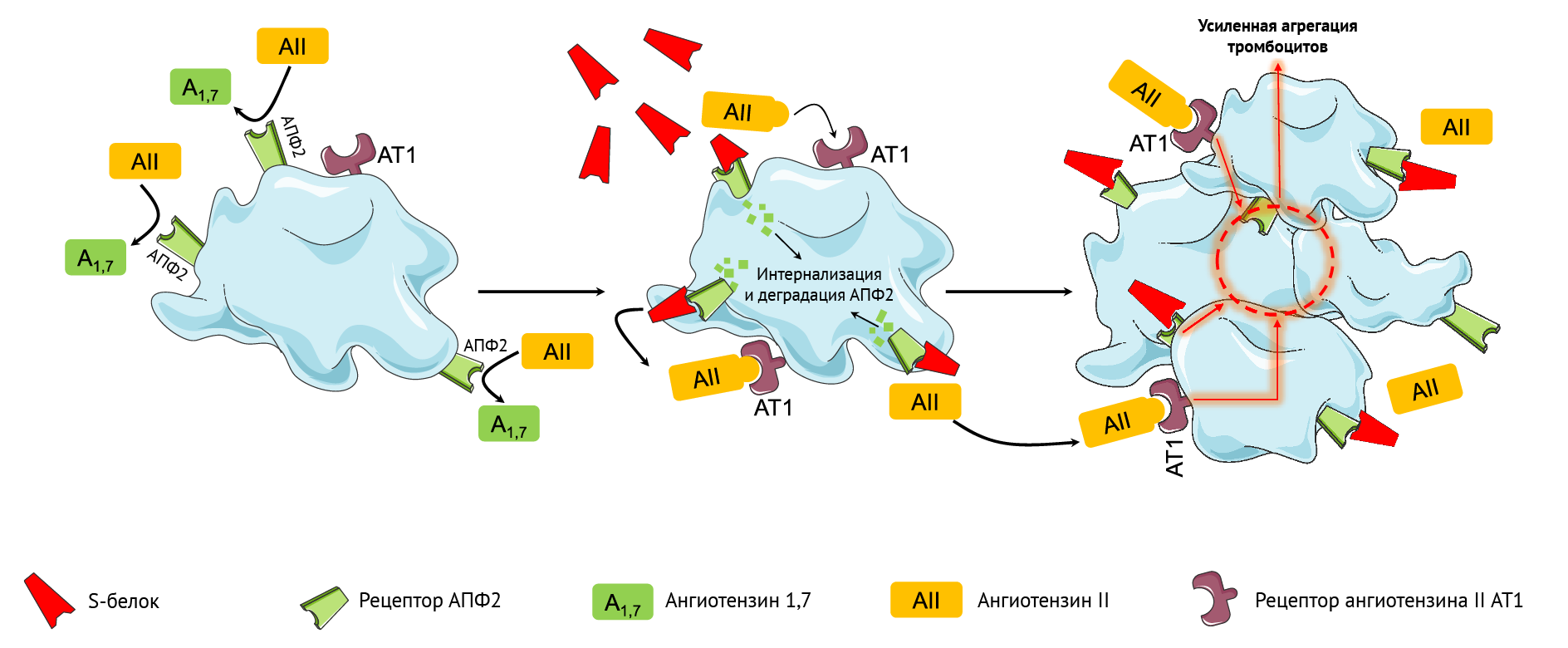
Вероятным объяснением сочетания тромботических событий и низкого содержания тромбоцитов в крови (
Снижение активности рецептора АПФ2 с внешней стороны плазматической мембраны, опосредованное взаимодействием между АПФ2 и S-белком SARS-CoV-2, приводит к ослаблению инактивации ангиотензина II и снижению образования ангиотензина 1–7 [44, 45]. Дисбаланс между гиперактивностью ангиотензина II и дефицитом ангиотензина 1–7 может запускать воспаление, тромбоз и другие побочные реакции (рис. 1) [44, 45]. В этом контексте неясно, благоприятствует ли взаимодействие свободного S-белка и АПФ2 такому дисбалансу и влияет ли на потенциальные побочные эффекты после вакцинации (рис. 1).
Заключение
Вакцинация против SARS-CoV-2 предлагает человечеству возможность выйти из текущей фазы пандемии. Вакцины, которые стимулируют достаточный нейтрализующий иммунный ответ, должны обеспечить защиту против COVID-19 [46]. Однако помимо эффективности любой вакцины против SARS-CoV-2 важным вопросом является ее безопасность. Несмотря на доступность различных платформ, большинство вакцин объединяют следующие общие черты:
В этом контексте вакцины на основе вирусных векторов могут запускать дальнейшее усиление иммунных реакций против S-белка, в которое вовлекается более строгая врожденная иммунная реакция, также опосредованная цитокинами, хемокинами и иммунными клетками [21]. Такая иммунная реакция, по-видимому, уподобляется таковой при активном заболевании COVID-19.
Предыдущие исследования времен инфекций MERS-CoV и SARS-CoV-1 показали, что вакцины, в основе которых лежит полноразмерный S-белок вируса SARS-CoV, могут вызывать сильный иммунный воспалительный ответ на разных уровнях, в том числе включая почки и печень [29, 32–34].
Картина усложняется данными об усиленном иммунном ответе после единичной дозы вакцины на основе мРНК SARS-CoV-2 mRNA у лиц, сероположительных вследствие ранее имевшегося контакта с вирусом [47]. В этом контексте Kramer с соавт. недавно оценили антительный ответ у лиц как с предсуществующим иммунитетом к SARS-CoV-2, так и без него (67 сероотрицательных и 43 сероположительных участника), которые получили первую дозу вакцины на основе мРНК S-белка в 2020 году (вакцины Pfizer или Moderna) [47]. Повторное взятие образцов после первой дозы показало, что у большинства сероотрицательных участников был варьирующий и относительно низкий уровень ответа иммуноглобулина G (IgG) против SARS-CoV-2 спустя от 9 дo 12 дней после вакцинации. Напротив, у тех участников, у которых антитела к SARS-CoV-2 изначально присутствовали еще до первой инъекции вакцины, титр антител быстро возрос в 10–45 раз по сравнению с таковым у вакцинированных, не имевших предсуществующего иммунитета [47]. Более того, титры антител тех вакцинированных лиц, у которых предсуществующего иммунитета не было, увеличились в три раза после введения второй дозы вакцины, а у людей, которые пережили COVID-19, после получения второй дозы вакцины повышения уровня антител не наблюдалось [47]. Примечательно, что авторы расширили свой анализ, вычислив частоту системных реакций, включая усталость, головную боль, озноб, мышечную боль, лихорадку и боль в суставах, после первой дозы вакцины у 148 сероотрицательных и 82 сероположительных участников. У реципиентов вакцины с предсуществующим иммунитетом наблюдались более высокая частота и тяжесть системных реакций, чем у пациентов без иммунитета [47].
Эти данные открывают поле для дебатов о применимости результатов клинических испытаний к реальной жизни [48]. Обычно в клинические испытания эффективности и безопасности вакцин против SARS-CoV-2 [9, 11, 18, 19] включают лиц, изначально не встречавшихся с инфекцией SARS-CoV-2. В самом деле, иммунитет к инфекции SARS-CoV-2 служил конечной точкой этих испытаний. Применяя результаты клинических испытаний к реальной жизни, нельзя исключать возможности, что вакцинация все большего числа людей из различных стран с уже имеющимся иммунитетом к SARS-CoV-2 может запустить неожиданно интенсивные, хоть и редкие, воспалительные и тромботические реакции у иммунизированных и предрасположенных индивидуумов.
Основные механизмы, участвующие в вышеописанных реакциях, требуют дальнейшего изучения. Так, свободные молекулы S-белка, выделяющиеся из разрушенных клеток при действии вакцины, могут взаимодействовать с АПФ2 других клеток, таким образом способствуя его интернализации и деградации [42]. Этот механизм усиливает агрегацию тромбоцитов [43]. Взаимодействие между АПФ2 и свободным S-белком также усиливает дисбаланс между гиперактивностью ангиотензина II и дефицитом ангиотензина 1–7 посредством потери активности рецептора АПФ2; это может вносить вклад в запуск воспаления, тромбоза и прочих побочных эффектов (рис. 1).
В этом контексте подходы белковой инженерии для выявления молекул, связывающихся с вирусными белками проникновения, могут предложить альтернативную терапевтическую стратегию для смягчения потенциальных пагубных эффектов взаимодействия между АПФ и S-белком (рис. 3).
Было сделано предположение, что применение вакцин с матрицами ДНК или мРНК, кодирующими мутантный S-белок с изменениями конформации (от состояния «до слияния» к состоянию «после слияния» после взаимодействия с АПФ2 или изменения в RBD) может ослабить сродство к рецепторам АПФ2 [49, 50].
В заключение можно сказать, что идеальная вакцина-кандидат против SARS-CoV-2 должна обладать высокой иммуногенностью, надежной способностью вызывать эффективный иммунный ответ с помощью нейтрализующих антител, обеспечивать практически полную защиту от тяжелых форм COVID-19 и быть безопасной — то есть не нести значительных побочных эффектов. Учитывая большое количество исследований в этой области, вполне ожидаемо, что новые вакцины, обладающие этими свойствами, будут разработаны в ближайшем будущем.