вакцина на основе пептидных антигенов что это значит
Пресс-центр
Спутник V, ЭпиВакКорона или КовиВак – чем лучше прививаться?
Сначала о преимуществах каждой вакцины. Спутник V: результаты I и II фазы и предварительные результаты III фазы клинических испытаний опубликовали в международных медицинских изданиях, провели клинические испытания в других странах, после которых вакцину одобрили к применению, накоплен большой опыт использования. Вакцина вырабатывает клеточный и гуморальный иммунитет, разрешена к применению у людей старше 60 лет.
Преимущества ЭпиВакКороны: не содержит аденовирусы, иммунитет к которым может повлиять на иммунизацию, в составе только пептиды, а не сам белок вируса, что делает вакцину полностью ареактогенной, возможна повторная ревакцинация после болезни или предыдущей вакцины. Предполагают ревакцинацию каждые 1–3 года.
Преимущества КовиВак: цельновирионная вакцина, созданная на основе полноценного, но убитого вируса, что позволяет ознакомить организм с полным набором белков (антигенов) вируса, так возникает имитация столкновения с инфекцией и обеспечивается более надежная защита и продление действия прививки. Препарат изготовлен по классической, проверенной годами методике. В таблице ниже — сравнительные характеристики вакцин. На полях — памятка для пациентов и персонала.
ПАМЯТКА «ТРИ РОССИЙСКИЕ ВАКЦИНЫ»
Гам-Ковид-Вак
(торговая марка Спутник V)
ЭпиВакКорона
КОВИВАК
Тип вакцины и способ введения
Генно-инженерная векторная с использованием двух штаммов живых аденовирусов человека, лишенных способности размножаться, с удаленным участком, обуславливающим онкогенность одного из них (в Ad 26).
Вводится двукратно, с интервалом в 3 недели.
Генно-инженерная пептидная – на основе искусственных пептидов, копирующих фрагменты коронавируса.
Вводится двукратно внутримышечно с интервалом в 2–3 недели.
Цельновирионная инактивированная – на основе «убитого» целого коронавируса. Это классический тип вакцин, масштабно производимых и используемых еще с прошлого века.
Вводится двукратно внутримышечно с интервалом в 2 недели.
Кем разработана, кто производит
Разработчик: НИЦ эпидемиологии и микробиологии имени Гамалеи МЗ РФ.
Производят: НИЦ имени Гамалеи; BIOCAD (Санкт-Петербург); «Генериум» (Владимирская область); «Биннофарм Групп» (Зеленоград).
Разработана и производится ГНЦ вирусологии и биотехнологии «Вектор» Роспотребнадзора
Разработана и производится ФНЦ исследований и разработки иммунобиологических препаратов имени Чумакова РАН.
Эффективность и побочные проявления
Эффективность составляет 91,4%, против тяжелого течения заболевания – 100%.
Ожидается, что иммунитет формируется на два года (на 9 месяцев – уже доказано).
У привитых может наблюдаться гриппоподобный синдром – повышение температуры (иногда до 38–39 °С), мышечные и суставные боли, боль в месте введения, общая слабость, головная боль. При необходимости рекомендуется принимать жаропонижающие средства. Обычно симптомы проходят в течение 1–2 дней.
Реже отмечаются тошнота, диспепсия, снижение аппетита, иногда – увеличение регионарных лимфоузлов. У некоторых пациентов возможно развитие аллергических реакций, кратковременное повышение уровня печеночных трансаминаз, креатинина и креатинфосфокиназы в сыворотке крови.
Иммунологическая эффективность 100%. Иммунная защита будет действовать один год.
Сильных нежелательных явлений, связанных с действием вакцины, не выявлено, отмечается боль в месте укола и повышение температуры до 38,5 °С.
Иммунологическая эффективность составляет 85% (образование антител в определенные протоколом сроки, однако разработчики не исключают, что иммунный ответ может сформироваться несколько позже).
Сроки действия иммунитета будут объявлены после окончания клинических исследований.
Серьезных нежелательных явлений после вакцинации у добровольцев не выявлено, у 15% участников отмечалась легкая боль в месте укола, а уплотнение – у 1%. Головная боль и легкое повышение температуры были у единичных участников испытаний.
Кому рекомендована, противопоказания, особенности
Применяют у взрослых 18–60 лет, также проводились испытания вакцины на добровольцах 60+.
Противопоказана беременным и кормящим, планируются исследования на детях до 18 лет.
Также запрещено делать прививку при гиперчувствительности к компонентам препарата (гидроокиси алюминия и др.); при тяжелых формах аллергических заболеваний; первичном иммунодефиците, злокачественных заболеваниях крови и новообразованиях, поствакцинальных осложнениях при предыдущем введении вакцины; острых инфекционных и неинфекционных заболеваниях, хронических заболеваниях в стадии обострения.
Прививку можно делать не ранее чем через месяц после выздоровления или ремиссии. При нетяжелых ОРВИ, острых инфекционных заболеваниях ЖКТ вакцинацию проводят после нормализации температуры.
Применяют у взрослых 18–60 лет, также проводились испытания вакцины на добровольцах 60+.
Противопоказана беременным и кормящим, планируются исследования на детях до 18 лет.
Также запрещено делать прививку при гиперчувствительности к компонентам препарата (гидроокиси алюминия и др.); при тяжелых формах аллергических заболеваний; первичном иммунодефиците, злокачественных заболеваниях крови и новообразованиях, поствакцинальных осложнениях при предыдущем введении вакцины; острых инфекционных и неинфекционных заболеваниях, хронических заболеваниях в стадии обострения.
Прививку можно делать не ранее чем через месяц после выздоровления или ремиссии. При нетяжелых ОРВИ, острых инфекционных заболеваниях ЖКТ вакцинацию проводят после нормализации температуры.
Применяют у взрослых 18–60 лет.
Вакцины такого типа применяют у людей с иммуносупрессивными и иммунодефицитными состояниями.
Противопоказана беременным, кормящим и детям, так как исследования на этих группах не проводились. Также не применяют у людей, у которых наблюдались тяжелые поствакцинальные осложнения на любые предыдущие вакцинации, а также людям с тяжелыми аллергиями.
Временно противопоказана: при острых лихорадочных состояниях, острых инфекционных и обострении хронических заболеваний. Прививку делают через 2–4 недели после выздоровления.
Допускается возможность вакцинации при хронических заболеваниях почек, печени, нейроэндокринной системы, тяжелых заболеваниях кроветворения, аутоиммунных, аллергических заболеваниях, бронхиальной астме и др. Состояние пациента и возможность прививки с учетом фактора «польза-риск» оценивает лечащий врач.
Проблема выбора пептидов для «ЭпиВакКороны» и разбор статьи разработчиков вакцины о клинических испытаниях первой и второй фаз
Вакцина «ЭпиВакКорона» уже поступила в гражданский оборот и предлагается населению в поликлиниках. Она позиционируется как более «мягкая», чем «Спутник V» и при этом эффективная. Разберемся, есть ли предпосылки для эффективности у этой вакцины, и что не так с публикацией о ней.
рисунок автора статьи
Автор
Редакторы
В журнале «Инфекция и иммунитет» появилась публикация разработчиков вакцины «ЭпиВакКорона» — ГНЦ «Вектор», — о чем было краткое сообщение в конце моей статьи «ЭпиВакКорона в иллюстрациях», опубликованной в «Троицком варианте». Статью о первых фазах клинических испытаний вакцины «Вектора» в научном мире очень ждали. При полной непрозрачности разработки любая информация, проливающая на неё свет, крайне желательна. Разберем, как устроена вакцина «ЭпиВакКорона», и что стало известно из публикации о ней.
Стоит заметить, что редакция журнала «Инфекция и иммунитет», в которой опубликована работа [1], входит в структуру Роспотребнадзора — ведомства, частью которого является и сам разработчик «ЭпиВакКороны» — ГНЦ «Вектор». Увы, но при таком раскладе независимость оценок данной публикации рецензентами в этом журнале не гарантирована.
В начале февраля ТАСС опубликовал следующее заявление:
Государственный научный центр вирусологии и биотехнологии “Вектор” Роспотребнадзора направил результаты клинических исследований вакцины фазы I–II в зарубежные научные рецензируемые журналы. Их публикация ожидается в ближайшее время. В Роспотребнадзоре подчеркнули, что до выхода международных публикаций обнародование результатов в русскоязычных научных изданиях не представляется “целесообразным” из-за “эксклюзивности и значимости для широкого круга потенциально заинтересованных лиц”.
Наблюдается противоречие между намерением разработчиков вакцины печататься в зарубежных изданиях в начале февраля и реальностью, в которой статья выходит в российском издании, аффилированном с Роспотребнадзором, во второй половине марта. Можно предположить, что рецензенты зарубежных изданий не пропустили статью в печать.
Увы, публикация о вакцине «Вектора» начинает разочаровывать с самого начала. В статье много недоработок и странностей. В предисловии состав оригинальной и необычной вакцины «ЭпиВакКорона», у которой в мире нет аналогов, описан всего одним предложением. Более того, в тексте статьи не приведены аминокислотные последовательности пептидов (фрагментов шиповидного белка), которые входят в состав вакцины и, по замыслу разработчиков, должны стимулировать выработку нейтрализующих вирус антител. Читателям приходится последовательности пептидов искать в других публикациях [2] и в патентах (№№ 2738081, 2743594 и 2743595).
Как устроена вакцина
Прежде чем дальше разбирать публикацию «Вектора» в журнале «Инфекция и иммунитет», хочется рассказать, как устроена вакцина «ЭпиВакКорона». Эта вакцина (согласно публикации [2]) состоит из трёх искусственно синтезированных коротких фрагментов вирусного шиповидного белка — пептидов, которые, по мнению разработчиков «ЭпиВакКороны», должна распознавать иммунная система человека.
Чтобы продолжить рассказ, мне нужно объяснить, что такое антигенный эпитоп. Он представляет собой часть макромолекулы антигена (в нашем случае вируса), которая распознается иммунной системой. Бывает два типа антигенных эпитопов: конформационные и линейные. Первые составлены из участков молекулы, которые не обязательно соседствуют в первичной структуре белка, но соседствуют в пространстве в его третичной или четвертичной структурах. Линейные же эпитопы представлены цепочками аминокислот, которые соседствуют в первичной структуре белка и соответствуют пептидам, то есть фрагментам аминокислотной последовательности белка. Антитела в организме при борьбе с инфекцией могут образовываться и на конформационные, и на линейные эпитопы. Эпитопы, которые узнаются антителами [3], а не Т-лимфоцитами, называются B-клеточными эпитопами. Принципы устройства иммунной системы можно восстановить в памяти, прочтя статью «Иммунитет: борьба с чужими и. своими» [4].
По замыслу разработчиков «ЭпиВакКороны», пептиды, входящие в состав этой вакцины, должны содержать участки шиповидного белка, в которых есть В-клеточные эпитопы, доступные в природном вирусе антителам вакцинированных.
Все пептиды вакцины конъюгированы (соединены) с белком-носителем. В качестве белка-носителя использован продукт так называемого химерного гена. Его аминокислотная последовательность приведена в патентах №№ 2738081, 2743594 и 2743595 и ниже в секции «Химерный белок». Этот ген методами генетической инженерии был составлен из двух генов, происходящих из разных организмов: гена, кодирующего нуклеокапсидный вирусный белок, и гена, кодирующего бактериальный белок, способный связывать сахар мальтозу (maltose binding protein, MBP). Соединенные гены этих двух организмов были экспрессированы в кишечной палочке. Продуктом экспрессии стал химерный белок, который для производства вакцинного препарата сначала проходит несколько стадий очистки, а затем конъюгируется с пептидами.
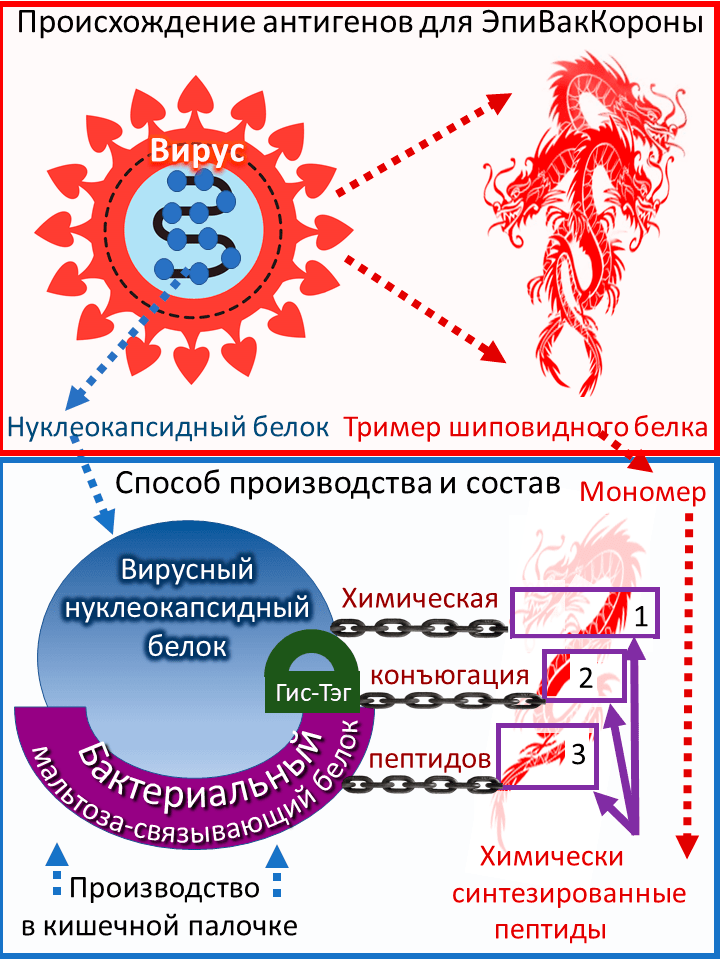
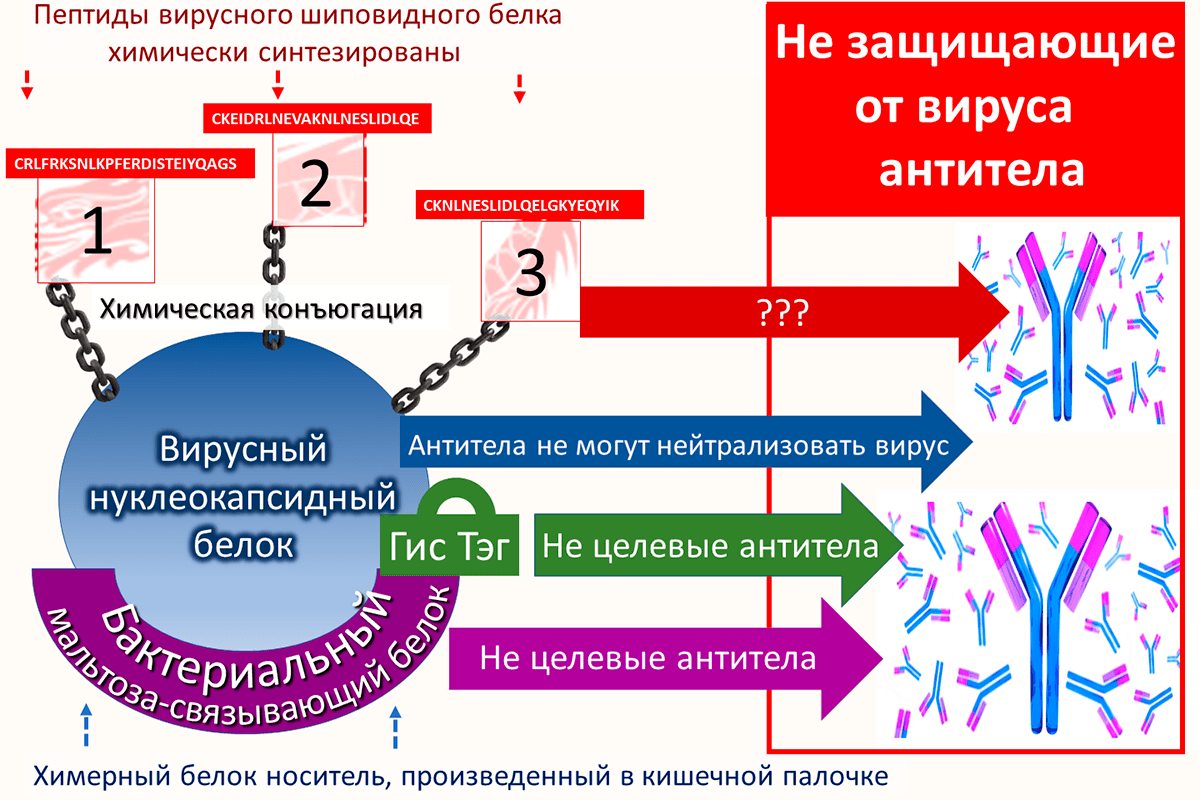
Генетический конструкт для производства белка-носителя вакцины «ЭпиВакКорона» кроме химерного гена включает и короткий генетический фрагмент, кодирующий полигистидиновый пептид (шесть остатков гистидина) и сокращенно называемый гис-тэг; он используется для очистки химерного белка из лизата кишечной палочки. Для этой же цели используется и участок бактериального белка MBP. После очистки к каждой молекуле химерного белка присоединяется в процессе конъюгации только один вариант пептида. В результате получается три типа конъюгированных молекул: химерный белок с присоединенным пептидом номер 1, тот же белок с пептидом номер 2 и, наконец, тот же белок с пептидом номер 3. Все три типа конъюгированных молекул входят в состав вакцины. Рисунок 1 показывает происхождение антигенов вакцины и способ ее производства. Напомню, что антигенами называются чужеродные молекулы в организме.
Рисунок 1. Состав «ЭпиВакКороны», происхождение антигенов и способ ее производства. В образе трехглавого дракона (сверху) представлен тример шиповидного белка коронавируса. Снизу показано химическое соединение пептидов, которые изображены фрагментами дракона, с химерным белком. Последний изображен синим кругом (это вирусный нуклеокапсидный белок) с лиловой дугой снизу (бактериальный белок MBP).
рисунок автора статьи
Химерный белок
В последовательности химерного белка, приведенной ниже, можно выделить часть, соответствующую бактериальному белку MBP (лиловым фоном), гис-тэг (темно-зеленым фоном) и часть, соответствующую вирусному нуклеокапсидному белку (синим фоном) (по патенту №2738081):
MKIEEGKLVIWINGDKGYNGLAEVGKKFEKDTGIKVTVEHPDKLEEKFPQVAATGDGPDIIFWAHDRFGGYAQSGLLAEITPDKAFQDKLYPFTWDAVRYNGKLIAYPIAVEALSLIYNKDLLPNPPKTWEEIPALDKELKAKGKSALMFNLQEPYFTWPLIAADGGYAFKYENGKYDIKDVGVDNAGAKAGLTFLVDLIKNKHMNADTDYSIAEAAFNKGETAMTINGPWAWSNIDTSKVNYGVTVLPTFKGQPSKPFVGVLSAGINAASPNKELAKEFLENYLLTDEGLEAVNKDKPLGAVALKSYEEELAKDPRIAATMENAQKGEIMPNIPQMSAFWYAVRTAVINAASGRQTVDEALKDAQTNSSSNNNNNNNNNNLGIEGRGGSG HHHHHH SGSDNGPQNQRNAPRITFGGPSDSTGSNQNGERSGARSKQRRPQGLPNNTASWFTALTQHGKEDLKFPRGQGVPINTNSSPDDQIGYYRRATRRIRGGDGKMKDLSPRWYFYYLGTGPEAGLPYGANKDGIIWVATEGALNTPKDHIGTRNPANNAAIVLQLPQGTTLPKGFYAEGSRGGSQASSRSSSRSRNSSRNSTPGSSRGTSPARMAGNGGDAALALLLLDRLNQLESKMSGKGQQQQGQTVTKKSAA
Такая сложная конструкция химерного белка объясняется необходимостью его тщательной очистки из лизата кишечной палочки, в которой он производится для вакцинации. Одним из наиболее известных и эффективных способов добиться хорошего синтеза и очистки вирусного или другого нужного исследователям белка в микробах заключается в соединении вирусного белка с мальтозосвязывающим белком (MBP). Это соединение позволяет проводить одностадийную очистку химерного продукта с использованием амилозной смолы.
Пептиды вакцины «ЭпиВакКорона»
Пептиды вакцины «ЭпиВакКорона-H»
Проблема выбора пептидов для вакцины
Я уже кратко писала о проблеме выбора пептидов для такой вакцины в более ранней публикации в газете «ТрВ». Здесь я напишу подробнее, почему пептиды, выбранные «Вектором» для вакцины, не оптимальны.
Как я писала выше, пептиды вакцины «ЭпиВакКорона», по замыслу разработчиков, должны имитировать линейные B-клеточные эпитопы шиповидного белка коронавируса, а соответствующие фрагменты вирусного белка должны быть доступны для взаимодействия с антителами в организме человека. Если фрагменты белка плохо доступны, то антитела, выработанные на эти участки белка, не смогут связаться с вирусом и не смогут способствовать его элиминации. Шиповидный белок коронавируса имеет сложные третичную и четвертичную молекулярные структуры [7]. И в этих структурах много мест, абсолютно не доступных антителам.
Экспериментальным поиском линейных B-клеточных эпитопов шиповидного белка, хорошо доступных для взаимодействия с антителами, занимались сразу несколько лабораторий [8–13]. Идея такого поиска в том, чтобы изучить антитела переболевших COVID-19 людей и найти те, которые способны связываться с пептидами, соответствующими последовательности шиповидного белка. Если такие пептиды найдутся, то, иммунизируя человека этими пептидами в составе вакцины, можно надеяться на получение антител, которые будут связываться с B-клеточными эпитопами шиповидного белка и выполнять протективную функцию.
Исследователи из разных стран независимо друг от друга провели скрининговое картирование почти всех пептидных фрагментов шиповидного белка и выявили пептиды, с которыми связываются антитела хотя бы 20% переболевших COVID-19 людей. Таким образом идентифицировали пептиды, которые соответствуют фрагментам белка, где располагаются B-клеточные эпитопы.
Эксперименты были построены так: на подложку последовательно, по принципу черепичной укладки, иммобилизовали пептиды шиповидного белка. Каждый последующий пептид перекрывался с предыдущим на половину своей длины или больше. Поэтому на подложке были представлены почти все линейные В-клеточные эпитопы шиповидного белка. Таких подложек готовилось много. Потом на каждую подложку наливалась плазма крови выздоровевших после COVID-19 людей. Далее методом иммуноферментного анализа (ИФА) [14] происходила идентификация пептидов, с которыми связались антитела.
После первичного картирования и выявления линейных фрагментов шиповидного белка, которые узнаются антителами, последовала вторая фаза исследования. В этой фазе экспериментально установили, какие пептиды способны помешать реакции нейтрализации вируса сывороткой переболевших. Фазу идентификации этих пептидов можно провести разными способами, например реакцией конкурентного вытеснения. Исследователи обогащают плазму переболевшего COVID-19 человека определенным антителом, которое способно связываться с изучаемым пептидом, а потом исследуют, может ли этот пептид помешать реакции нейтрализации живого вируса [9], [10], [13]. Если да, то это означает, что у данного пептида в составе пептидной вакцины больше шансов спровоцировать образование нейтрализующих антител. Хотя гарантий иммуногенности именно такого пептида в составе вакцины всё равно нет.
При систематическом скрининге пептидов шиповидного белка коронавируса (результаты приведены на рис. 2) обнаружили пептиды, с которыми связываются антитела переболевших COVID-19. Выявленные участки отличались у разных людей, но были найдены универсальные закономерности. Некоторые пептиды соответствовали «слепым» или «полуслепым» зонам иммунитета (на соответствующие участки шиповидного белка крайне редко образуются антитела). Некоторые пептиды, наоборот, соответствовали «острому зрению» иммунитета (к этим участкам образовывались антитела у многих людей, перенесших COVID-19). Хорошо видимые иммунной системой фрагменты белка соответствуют так называемым иммунодоминантным эпитопам. Именно эти участки вирусного белка хорошо доступны для связывания антител в организме инфицированного человека.
рисунок автора статьи
Экспериментально также определили фрагменты шиповидного белка, связывание которых с антителами приводит к нейтрализации вируса [9], [10], [13]. Однако ни один из выявленных в этих работах фрагментов вирусного шиповидного белка не совпал с пептидами, вошедшими в состав «ЭпиВакКороны».
Увы, выбранные «Вектором» для синтеза вакцинных пептидов участки молекулы шиповидного белка, которые должны имитировать линейные B-клеточные эпитопы, на самом деле находятся почти в «слепой зоне» иммунной системы человека. Следует заметить, что на рисунке 2 выделены только участки белка, на которые образуются антитела хотя бы у 20% переболевших COVID-19 людей. Можно назвать эти участки иммунодоминантными.
При этом разработчики сами говорят, что старались избегать таких районов: «Всем известно, что иммунодоминантные районы вызывают на себя иммунный ответ, подвергаются прессингу при развитии, в том числе, и живого вируса, не только вакцины. Под иммунным прессингом происходит мутация, образуются эскейп-мутанты, и мы сейчас имеем мутации по всем иммунодоминатным районам. Таким образом, наш консервативный пептид, который входит в состав вакцины сейчас, — он именно от таких мутаций ускользнул».
Тем не менее в вышеприведенных высказываниях разработчиков есть правильная логика; конечно, участки белка, соответствующие пептидам вакцины, должны быть консервативны в эволюции. Иначе пептидная вакцина станет хуже работать для мутантных вариантов вируса. Однако эти участки белка должны быть все же видны иммунной системе большинства людей и должны располагаться в доступном для антител месте. Существующие экспериментальные данные говорят нам о том, что этого не наблюдается; дополнительные доказательства приведены в таблице 1.
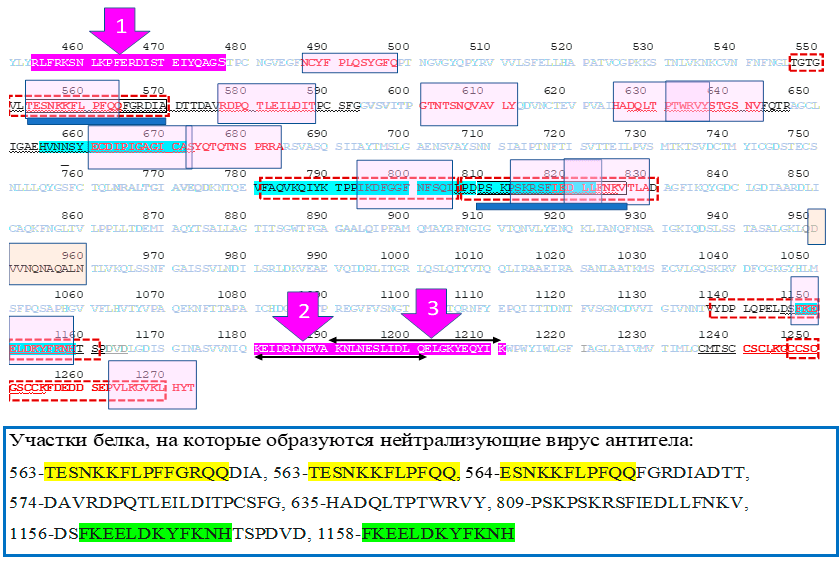
На основании опубликованной работы [8] и сообщения автора публикации [10] профессора Чжиган И (Zhigang Yi) из Университета Фудань (Китай) была создана таблица 1. Она показывает, что антитела на фрагменты шиповидного белка почти c такой же локализацией, как и пептиды «ЭпиВакКороны», формируются не более чем у 9% людей. Видимо, последовательные цепочки аминокислот в соответствующих местах белка недоступны для взаимодействия с антителами, поскольку частично или полностью спрятаны в третичной или четвертичной структуре белковой молекулы.
| Ссылка | Начало | Пептид | Конец | Процент переболевших с антителами к пептиду | Средний сигнал в контрольной группе | Средний сигнал в группе переболевших |
|---|---|---|---|---|---|---|
| Участок рецептор-связывающего мотива в шиповидном белке 454 RLFRKSNLKPFERDISTEIYQAGS 477 | ||||||
| [8] | 451 | YLY RLFRKSNLK | 462 | 5,7% | 42 | 157 |
| 457 | RKSNLKPFERDI | 468 | 1,2% | 56 | 49 | |
| 463 | PFERDISTEIYQ | 474 | 2,2% | 20 | 174 | |
| 469 | STEIYQAGS TPC | 480 | 0,0% | 14 | 22 | |
| [10], личное сообщение | 454 | RLFRKSNLKPFERDISTEIY | 473 | 9% | Значения не определялись | |
| 464 | FERDISTEIYQAGST PCNGV | 483 | 5% | |||
| Участок гепта-повтора 2 1181 KEIDRLNEVAKNLNESLIDLQE 1201 ; 1191 KNLNESLIDLQELGKYEQYIK 1211 | ||||||
| [8] | 1178 | NIQ KEIDRLNEV | 1189 | 7,2% | 8 | 148 |
| 1184 | DRLNEVAKNLNE | 1195 | 1,2% | 6 | 37 | |
| 1190 | AKNLNESLIDLQ | 1201 | 10,5% | 62 | 148 | |
| 1196 | SLIDLQELGKYE | 1207 | 0,0% | 90 | 110 | |
| 1202 | ELGKYEQYIK WP | 1213 | 9,2% | 33 | 144 | |
| [10], личное сообщение | 1176 | VVNIQ KEIDRLNEVAKNLNE | 1195 | 9% | Значения не определялись | |
| 1186 | LNEVAKNLNESLIDLQELGK | 2005 | 1% | |||
| 1196 | SLIDLQELGKYEQYIK WPWY | 1215 | 2% | |||
Пептиды в таблице или в работах, результаты которых суммированы на рисунке 2, в каждом конкретном эксперименте отличаются по длине от пептидов «ЭпиВакКороны». Однако эксперименты с иммобилизованными на подложке пептидами самой разнообразной длины — 12, 18, 20 или даже 50 аминокислот [8–13] — выявляют сходные участки в молекуле белка, которые хорошо видны иммунной системе. Хотя, следует отметить, что 50-меры хуже взаимодействуют с антителами и не выявляют некоторых антител, которые выявляют более короткие пептиды длиной от 12 до 20 аминокислот.
В то же время ни один из экспериментов разработчиков «ЭпиВакКороны» (из описанных в патентах или в публикациях) не демонстрирует того, что у переболевших COVID-19 могут образовываться антитела именно на участки белка, соответствующие пептидам, выбранным для этой вакцины. Казалось бы, такой эксперимент сравнительно легко провести. Но в открытой печати результаты таких экспериментов не описаны. Зато экспериментаторы из лабораторий в других странах в интересующих нас участках белка (соответствующих пептидам «ЭпиВакКороны») хорошо доступных для антител фрагментов не видят [8–13].
Если у людей очень редко образуются антитела, способные взаимодействовать с определенными фрагментами вирусного белка, то это означает, что при иммунизации соответствующими пептидами антитела на эти пептиды не смогут узнать и связать вирус у большинства людей. Нужны ли такие пептиды в вакцине для иммунизации?
Как разработчики «ЭпиВакКороны» искали пептиды и почему этот поиск мог привести к артефактам?
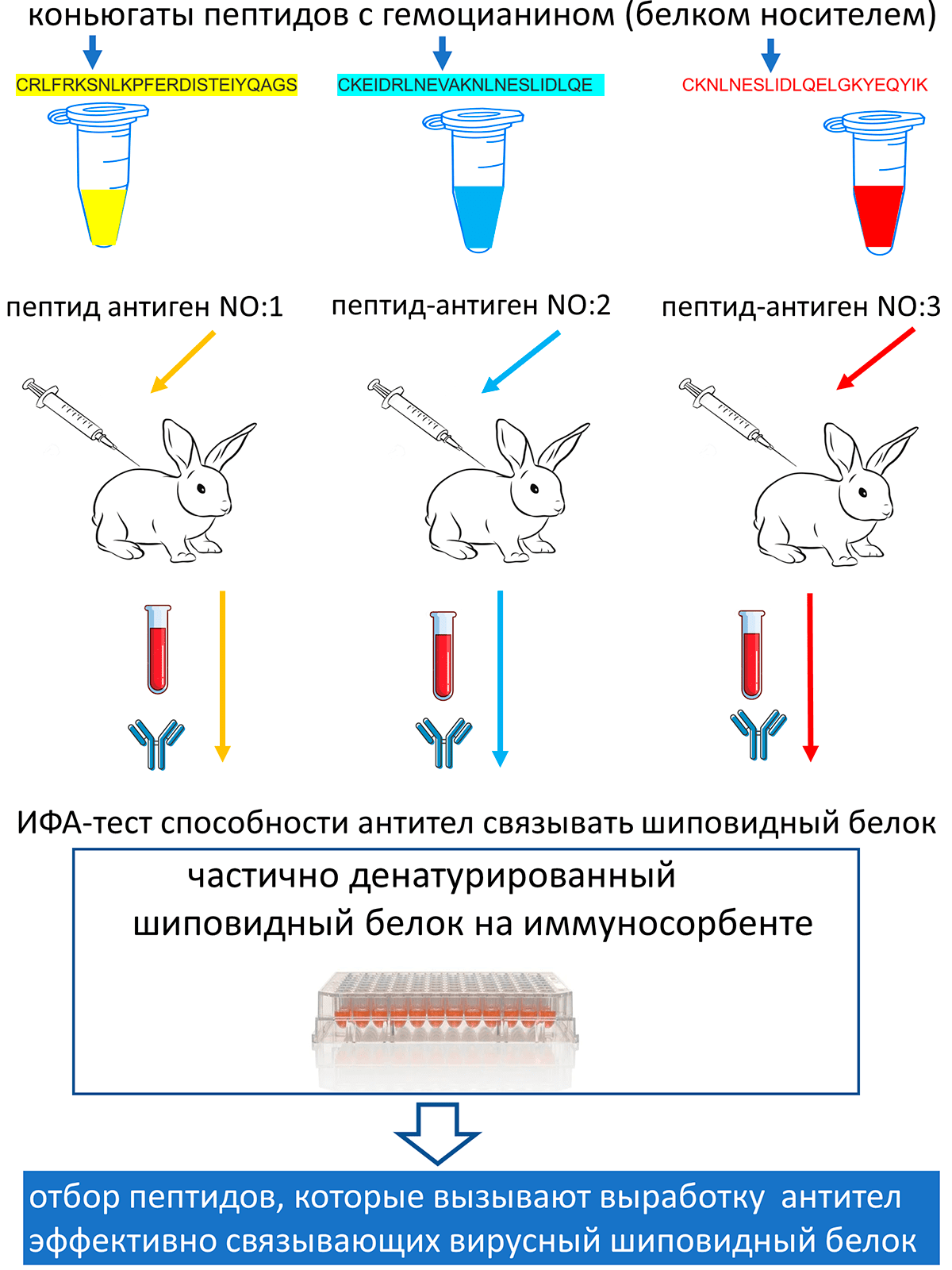
Разработчики «ЭпиВакКороны» иммуногенность пептидов оценивали, вводя разные пептиды в качестве антигенов кроликам (патент РФ на изобретение №2738081). Точнее, кроликов иммунизировали последовательно набором пептидов, соединенных с белком-носителем. Далее у животных собирали кровь и методом иммуноферментного анализа (ИФА) определяли, насколько хорошо антитела, выработанные на каждый отдельный пептид-антиген, связывали вирусный шиповидный белок, который был иммобилизован на иммуносорбенте. Этот подход схематично изображен на рисунке 3.
Самые иммуногенные пептиды, антитела на которые лучше всего связывались с шиповидным белком и давали самый сильный ИФА-сигнал, отбирали для дальнейшей вакцинной разработки. Идея такого отбора в том, что если антитела, выработанные на пептид-антиген, хорошо связывают вирусный шиповидный белок, то этот же пептид в составе вакцины будет вызывать образование антител у человека, которые будут связывать вирусный белок у вириона и, возможно, выполнять протективную противовирусную функцию.
Однако в этом подходе важно, чтобы шиповидный белок в тесте ИФА имел такую же или очень похожую структуру и конформацию, как и нативный белок в вирусе, когда тот находится в человеческом организме. Похоже, что это условие не было соблюдено в экспериментах разработчиков «ЭпиВакКороны». Согласно их протоколу, при посадке шиповидного белка на иммуносорбент для ИФА-теста белок инкубировали, используя рН буфера (9,5–9,7). При таком рН белок может частично денатурировать. Последующая промывка иммобилизованного на иммуносорбенте белка нейтральным буфером может не восстановить его нативную структуру и конформацию. В результате антитела после иммунизации кроликов пептидными антигенами могут связываться с участками денатурированного белка, которые в природе у вируса спрятаны в третичную или четвертичную структуру. Таким образом, этот скрининговый метод может приводить к артефактам и выбору таких пептидов для вакцины, антитела на которые не будут иметь протективной противовирусной функции.
Рисунок 3. Схема отбора пептидов-антигенов для «ЭпиВакКороны»
рисунок автора статьи
Еще одной проблемой такого скрининга является разница между рецепотрами В-клеток человека (B-cell receptor, BCR) и животных. Для того чтобы B-клетка смогла начать вырабатывать антитела на какой-то эпитоп антигена, ей нужно сначала этот эпитоп «узнать» своим BCR-рецептором. В процессе узнавания этот рецептор должен вступить во взаимодействие с эпитопом антигена и образовать комплекс. Так вот, даже у людей BCR различаются между собой. То есть у разных людей эти рецепторы, например, узнают несколько разные участки шиповидного белка коронавируса или пептиды, моделирующие и воспроизводящие эти участки: см. рис. 4. Тем более эти рецепторы различаются у людей и животных. Поэтому метод поиска пептидов для вакцины путем иммунизации кроликов чрезвычайно ненадежен.
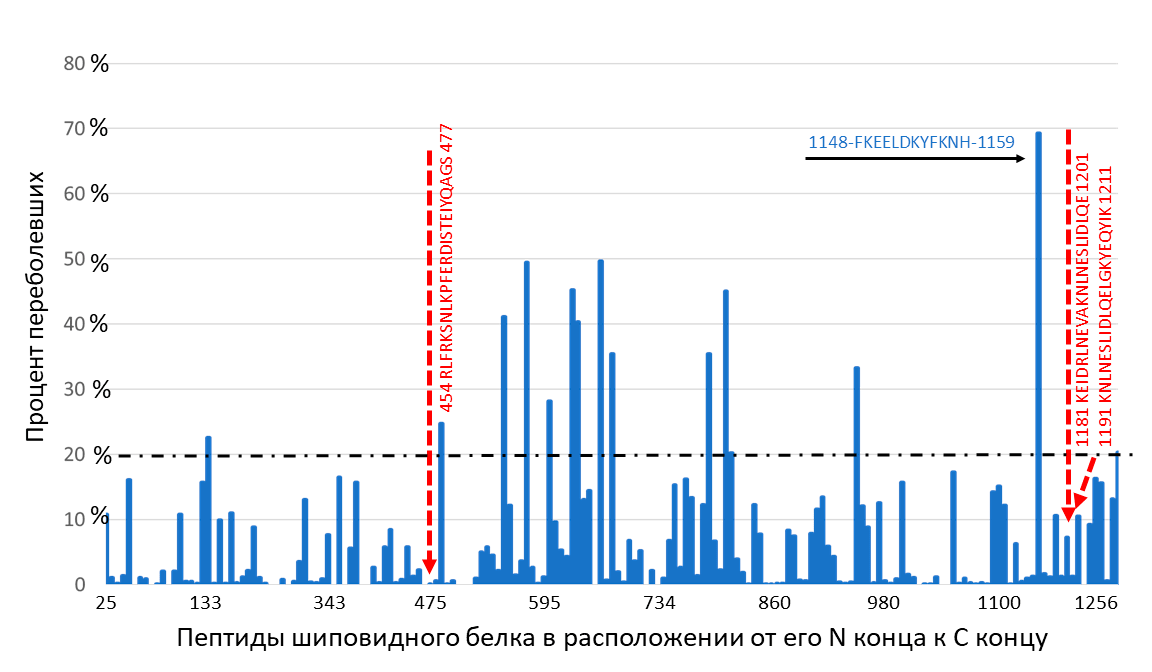
Рисунок 4. Частота образования антител, узнающих короткие пептиды шиповидного белка, у переболевших COVID-19. Показан процент реконвалесцентов (переболевших COVID-19 людей), у которых образовались антитела на каждый отдельный пептид, иммобилизованный на подложке иммуносорбента. Каждый пептид длиной 12 аминокислот на половину длины перекрывает предыдущий. В эксперименте на подложку последовательно, по принципу черепичной укладки, иммобилизованы пептиды шиповидного белка. На графике по оси абсцисс расположены пептиды в направлении от N- к C-концевому участку, по оси ординат — процент людей, у которых есть антитела на этот пептид. 20-процентный порог отмечен горизонтальным пунктиром. Черной стрелкой указан пептид, с которым, согласно публикации [8], реагируют антитела 70% людей, перенесших заболевание. Красными прерывистыми стрелками указаны пептиды, перекрывающиеся с пептидами «ЭпиВакКороны».
рисунок автора статьи
Неудивительно, что пептиды, найденные при скрининге и иммунизации кроликов, не совпадают с пептидами, которые узнаются антителами хотя бы у 20% переболевших COVID-19, согласно исследованиям независимых экспериментаторов [8–13].
Тут еще стоит добавить, что разработчики «ЭпиВакКороны» провели и другие эксперименты, которые тоже, увы, скорее всего, показывает артефактное взаимодействие антител с вирусным шиповидным белком. Антитела животных [2] и людей [1], выработанные при иммунизации пептидами на белковом носителе, проверяли на способность взаимодействовать с вирусом, иммобилизованным на иммуносорбенте [2]. Однако вирус для этого опыта был инактивирован бета-пропиолактоном с последующим нагреванием [2]. Такая инактивация также может приводить к разрушению водородных связей и, соответственно, структуры белка. Поэтому для взаимодействия с антителами могут открыться участки белка, закрытые в природном, нативном, варианте белка в составе вирусной частицы.
Таким образом, из всего вышеперечисленного можно заключить, что способ выбора пептидов на основании вышеописанных экспериментов не свободен от возможности появления серьезных артефактов. На основании факта наличия взаимодействия антител с вирусным шиповидным белком на иммуносорбенте нельзя сделать вывод о том, что антитела на пептиды в вакцине могут провзаимодействовать с коронавирусом и защитить организм от вирусной инфекции.
Формирование антител после вакцинации
Роспотребнадзор сообщает: «Многие тест-системы недостаточно чувствительны, чтобы выявить малый спектр формируемых вакциной антител. Чтобы их обнаружить, нужно использовать специальные ИФА-тесты от центра “Вектор”». Таким образом, разработчики вакцины утверждают, что антитела к шиповидному белку не выявляются у вакцинированных «ЭпиВакКороной» при использовании обычных ИФА-тестов, где на подложку наносится полноразмерный тримерный шиповидный белок, полученный в эукариотических клетках. Это утверждение говорит, что вакцина не вызывает образования антител против главного иммуногена коронавируса.
Итак, для определения уровня антител после вакцинации нужен спецтест. Этот спецтест не описан в открытых документах. Как он устроен — остается загадкой.
В то же время, согласно разработчикам «ЭпиВакКороны»: «вакцинация двумя дозами препарата вызвала у 100% добровольцев выработку антител, специфичных к антигенам, входящим в состав вакцины». Так какие это антитела и антигены?
Согласно описанию состава вакцины, антигенами «ЭпиВакКороны» могут стать не только три пептида шиповидного белка, но и химерный белок, состоящий из двух частей (вирусного нуклеокапсидного и бактериального MBP), и гис-тэг. Последний, как говорилось выше, представляет собой короткий пептид, который введен в состав вакцины для очистки химерного белка из бактериального лизата. На все эти антигены формируются нецелевые антитела, которые, скорее всего, не обладают защитной функцией. Только антитела к шиповидному, но не нуклеокапсидному вирусному белку могут связаться с вирусом, поскольку нуклеокапсидный белок находится внутри вирусной частицы и не экспонирован наружу.
Способность антител против пептидов, вошедших в состав «ЭпиВакКороны», связываться с вирусом и выполнять нейтрализующую или другую защитную противовирусную функцию, вызывает сомнения не только у автора этой статьи. Похожие сомнения высказывают и другие специалисты: «Первая научная статья об ЭпиВакКороне. Часть 1» и «Учёные говорят про “ЭпиВакКорону”». Рисунок 5 иллюстрирует проблему присутствия в вакцине антигенов, антитела к которым по своей природе не могут защищать от инфекции.
Рисунок 5. Антигены вакцины и антитела, которые провоцируют эти антигены у вакцинированных. Показаны все антигены вакцины «ЭпиВакКорона», а именно пептиды шиповидного белка, нуклеокапсидный вирусный белок, бактериальный белок и гис-тэг. Все эти антигены могут провоцировать образование нецелевых антител без протективной противовирусной функции.
рисунок автора статьи
Эксперимент А.А. Чепурнова
Основная интрига, связанная с вакциной «ЭпиВакКорона», заключается в противоречивости утверждений тех, кто тем или иным образом связан с разработкой и испытаниями вакцины. Особенно важен вопрос о нейтрализующих антителах. Если вакцина не вызывает образования нейтрализующих вирус антител, то она вряд ли сможет предупредить COVID-19 у вакцинированных. Отсутствие протективного действия вакцины может привести к заражению и смерти людей, считающих себя защищенными.
Согласно научной работе в журнале «Инфекция и иммунитет» [1], у всех добровольцев-участников клинических исследований 1 и 2 фаз испытаний выработались нейтрализующие вирус антитела. В то же время добровольцы 3 фазы клинических исследований говорят, что даже у тех, у кого выявлялись антитела специальной тест-системой «Вектора», не было обнаружено нейтрализующих антител. Эти данные получил опытный вирусолог, специалист по особо опасным вирусным инфекциям профессор А.А. Чепурнов. Он исследовал в реакции нейтрализации несколько десятков зашифрованных сывороток вакцинированных или переболевших людей. После расшифровки выяснилось, что нейтрализующие антитела выявлены во всех сыворотках переболевших или вакцинированных вакциной «Спутник V» (по 5 сывороток в группе), но полностью отсутствуют, начиная с разведения 1:2, у 19 из 20 человек, привитых вакциной «ЭпиВакКорона». У одного привитого, но заболевшего COVID-19 на 43 день после начала вакцинации (!), нейтрализующие антитела были обнаружены.
Подробно об анализе антител у добровольцев-участников клинических испытаний 3 фазы вакцины «ЭпиВакКорона» можно почитать в ранее опубликованной статье в «ТрВ».
Имеющиеся данные позволяют считать, что необходима официальная комиссионная проверка наличия нейтрализующих антител у людей, привитых этой вакциной. Это недорогое и быстро выполнимое исследование. По его результатам можно принять обоснованное решение о целесообразности использования вакцины в гражданском обороте и о продолжении разработки на данной платформе. Хочу отметить, что ряд крупнейших биотехнологических компаний мира (Sanofi, Merck), свернули свою работу над вакциной, убедившись в неэффективности выбранных ими платформ (ничего зазорного в этом нет).
Т-клеточный иммунитет
В статье [1] полностью отсутствуют данные по Т-клеточному иммунитету, хотя авторы заявляют в СМИ, что «кроме гуморального иммунного ответа, вакцина индуцирует Т-клеточный ответ, в результате чего гибель заражённых клеток не даёт вирусу распространиться дальше и заражать здоровые клетки». Мы часто встречаем заявления разработчиков, что вакцина стимулирует образование так называемых Т-хелперов, способствующих образованию антител у провакцинированных. Так, разработчики вакцины сообщают: «Для оценки Т-клеточного ответа, который может формироваться под влиянием “ЭпиВакКороны”, необходимо учесть ряд особенностей: во-первых, в данном случае должна происходить стимуляция преимущественно Т-хелперных клеток, несущих маркер CD4+, а не CD8+ Т-цитотоксических лимфоцитов. Кроме того, стимуляция в данном случае должна идти по Тh-2-зависимому пути (ведущему к появлению защитных антител), и таким образом, маркером активации Т-лимфоцитов будет являться не гамма-интерферон (определение его уровня ничего не покажет), а интерлейкин-4».
Итак, разработчики вакцины подробно информируют граждан, что они — граждане — не могут сами изучать свой Т-клеточный противовирусный иммунитет доступными коммерческими тестами после вакцинации «ЭпиВакКороной». То есть тест компании «Генериум» не может быть использован для этой цели. Более того, на вопрос добровольцев-участников клинических испытаний «ЭпиВакКороны»: «У какого процента вакцинированных наблюдается CD4+ Т-клеточный ответ по Th2-типу после “ЭпиВакКороны”?» был получен следующий письменный ответ «Вектора»: «Данный вопрос не исследовался».
Проблема ИФА-тестов
Тестирование наличия, титра и характеристик антител у вакцинированных — это очень важная задача научной работы. Увы, эта задача выполнена создателями вакцины, судя по публикации [1], не на высоком уровне.
Первый тест на антитела из статьи в журнале «Инфекция и иммунитет»
Есть крайне неубедительное объяснение разработчиков, почему обычные ИФА-тесты не выявляют антитела к нативному шиповидному белку после иммунизации пептидной вакциной: они считают, что антитела возникают «всего» против трех антигенных детерминант этого белка (в соответствии с тремя используемыми в вакцине пептидами), а этого слишком мало для положительного сигнала. Однако в сыворотках вакцинированных должны появиться три типа антител, которым ничто не должно мешать присоединиться к своим эпитопам, то есть на каждую молекулу антигена-тримера от 1 до 3 молекул антител молекулярного веса 150 кДа (сравнимо с молекулярным весом антигена). Отрицательный тест на антитела к шиповидному белку означает, что такие антитела после вакцинации не образуются. При этом антитела на пептиды, возможно, образуются (не доказано), но они не способны связаться с шиповидным белком коронавируса (доказано).
В статье отсутствует информация, необходимая для воспроизведения экспериментов и понимания результатов. Например, отсутствует описание тест-системы для анализа антител к антигенам вакцины. В статье используется тест-система «Вектор ИФА Корона-АТ», ТУ 21.10.60-092-05664012-2020 (см. в статье в разделе «Материалы и методы» тесты ИФА). Это так называемый спецтест с неизвестными антигенами. Скорее всего, антитела, выявляемые спецтестом, обнаруживают смесь антигенов, имеющихся в вакцине (пептиды, мальтозасвязывающий белок E. coli, гис-тэг, нуклеокапсидный белок коронавируса). Результаты теста показывают, что вакцина вызывает образование антител. Тест, однако, не позволяет понять, могут ли какие-либо из этих антител взаимодействовать с главным иммуногенным антигеном коронавируса — нативным вирусным шиповидным белком.
Тест «Вектора» на антитела к вакцинным антигенам «ЭпиВакКороны», помимо прочего, умудрился показать неплохие результаты у плацебо-группы, вакцинированной физраствором на 0, 14 и 21 дни эксперимента. На 35 и 42 дни антитела к антигенам «ЭпиВакКороны» у группы плацебо детектироваться перестали, и объяснения этого странного феномена в работе нет.
Второй тест на антитела из статьи в журнале «Инфекция и иммунитет»
Второй ИФА-тест основан на использовании инактивированных вирионов SARS-CoV-2. Поскольку оболочка у части вирионов при инактивации и адсорбции на подложку может быть повреждена, этот тест, вероятно, способен выявлять как антитела к шиповидному, так и к нуклеокапсидному белкам коронавируса. Таким образом, в статье не доказано, что вакцина способна вызывать образование антител именно к шиповидному белку.
Более того, ранее разработчики утверждали, что антитела к шиповидному белку не выявляются у вакцинированных «ЭпиВакКороной» при использовании обычных ИФА-тестов, где на подложку наносится полноразмерный тримерный шиповидный белок, полученный в эукариотических клетках. Это говорит о том, что вакцина не вызывает образования антител против главного иммуногена коронавируса.
Но если нет антител к этому белку, нельзя объяснить наличие нейтрализующих антител в ответ на вакцину.
Тест на антитела, способные к нейтрализации вируса
В статье [1] показали нейтрализующие свойства сывороток у вакцинированных. Только этот эксперимент был проведен по достаточно «оригинальной» методике. Классическим методом оценки вирус-нейтрализующих антител в вирусологии принято считать методику реакции нейтрализации с детекцией по цитопатическому действию (метод ЦПД). Метод заключается в прямом подсчете погибших клеток, и именно этот метод используют другие российские разработчики вакцин (Институт им. Гамалеи и Центр им. Чумакова) для оценки вирус-нейтрализующих свойств сывороток вакцинированных. Именно эту методику использовал и проф. А. Чепурнов. Используемая «Вектором» методика нейтрализации отличается от метода ЦПД и основана на детекции нуклеокапсидного белка SARS-CoV-2 в зараженных клетках, то есть является вариантом ИФА. У данной методики потенциально есть важный недостаток — низкая специфичность. Антитела часто дают «неспецифику» (ложноположительный сигнал). Этот недостаток хорошо известен разработчикам тест-систем ИФА, и каждый разработчик тест-системы определяет и указывает не только чувствительность, но и специфичность методики. К сожалению, специфичность методики «Вектора» неизвестна. Кроме того, методика определения нейтрализующих антител по 50%-ному (а не 100%-ному, как в обычном тесте) подавлению вируса может завышать титр нейтрализующих антител в 2–4 раза и принципиально искажать важные результаты.
Использование «альтернативной» методики — это не очень большая проблема, если в эксперименте есть необходимые контроли. В эксперименте от «Вектора» отрицательный контроль — это группа плацебо, но полученные значения в этой группе вызывают недоумение. Методикой «Вектора» в отрицательном контроле плацебо определяются (!) вирус-нейтрализующие антитела. Но их быть не должно, и возникает вопрос — что измеряет данная методика? Подтверждает ли наличие вируснейтрализующих антител в группе плацебо гипотезу о низкой специфичности методики? Кроме того, в эксперименте полностью отсутствует положительный контроль — сыворотки переболевших COVID-19. С чем мы можем сравнить эффективность измеряемой в эксперименте нейтрализации? Какие выводы мы можем сделать по эксперименту без адекватных отрицательных и положительных контролей?
Таким образом, создается впечатление, что утверждение о наличии нейтрализующих антител в сыворотках людей, вакцинированных «ЭпиВакКороной», крайне сомнительно.
Интересная дополнительная критика способов тестирования уровня антител у провакцинированных «ЭпиВакКороной» приведена в статьях «Первая научная статья об ЭпиВакКороне. Часть 2» и «Первая научная статья об ЭпиВакКороне. Часть 3».
«ЭпиВакЭбола» — предшественник «ЭпиВакКороны»
Так как успех создания вакцины «Спутник V» в СМИ освещается довольно широко, то, возможно, многие читатели знают предысторию создания этой вакцины. Аденовирусная платформа первоначально была использована для создания российской вакцины от лихорадки Эбола. Группа разработчиков под руководством Дениса Логунова создала вакцину и опубликовала результаты 1–2 фаз клинических испытаний [16].
Группа создателей вакцины «ЭпиВакКорона» тоже испытывала свою платформу при создании собственной пептидной вакцины от вируса Эбола. Вакцина «ЭпиВакЭбола» была не только зарегистрирована Минздравом, но и получила похвальные отзывы от руководства Минздрава и Роспотребнадзора, была названа уникальной по безопасности. В 2019 году Роспатент назвал патент этой разработки одним из интереснейших патентов 2018 года. Учитывая уникальность разработки пептидной вакцины, имеет смысл познакомиться с патентом и публикациями о вакцине-предшественнике.
Член-корреспондент РАН Сергей Викторович Нетёсов, в прошлом заместитель генерального директора центра «Вектор», в своем интервью о вакцинах против вируса Эбола говорит об «ЭпиВакЭболе», как о завершенной разработке. Он указывает на появление двух работ об испытаниях этой вакцины.
К сожалению, обе работы вместе занимают меньше страницы А4, так как это по сути тезисы конференции, опубликованные в журнале «Инфекция и иммунитет» [17], [18]. В этих коротких тезисах декларируются безопасность и иммуногенность вакцины. Именно декларируются, так как никаких доказательств в тексте не приведено. По мнению профессора Нетёсова, вакцина «ЭпиВакЭбола» готова к полевым испытаниям, то есть к третьему этапу клинических испытаний. Хотя в интервью говорится о том, что с 2016 года можно отследить серию публикаций о создании и испытании пептидной вакцины «ЭпиВакЭбола», но ссылается Сергей Викторович только на эти тезисы «Материалов XI съезда ВНПОЭМП» в Москве 16–17 ноября 2017 года. Никаких серьезных доказательных журнальных публикаций с тех пор не появилось. Хотя в интернете встречаются утверждения о проведении третьего этапа клинических испытаний на 350 добровольцах (первоисточник нам найти не удалось), но никаких результатов испытаний не продемонстрировано.
Единственным источником информации о вакцине становится патент, интересный по двум причинам. Во-первых, он высоко оценен Роспатентом, назван одной из лучших работ 2018 года. А во-вторых, значительная часть текста патента и в русском, и в английском вариантах опубликована в «битой кодировке» и совершенно не поддается прочтению. Вероятно, безразличие к этому тексту было в равной степени и у тех, кто его писал, и у тех, кто его хвалил. В результате и мы тоже не будем тратить время на анализ патента.
Утверждение разработчиков «ЭпиВакКороны» о том, что за их плечами находится успешный опыт создания вакцины «ЭпиВакЭбола» совершенно не подкреплено доказательствами. Нет результатов ни одной из фаз испытаний, нет публикаций, фактически нет патента. Научная полемика по этому вопросу невозможна.
Проблемы и нестыковки в представлении результатов
Вопросов к работе [1] возникает немало: тут и очень странные таблицы данных, и расхождения между значениями в этих таблицах и в описательной части, и главное — непонятные контроли и их отсутствие там, где они критически важны (например, в реакции нейтрализации). Перечислим самое интересное (и самое печальное), а за более подробным анализом этой публикации отсылаем читателя к посту Coronamed.channel в «Фейсбуке».
Отсутствуют положительные контроли
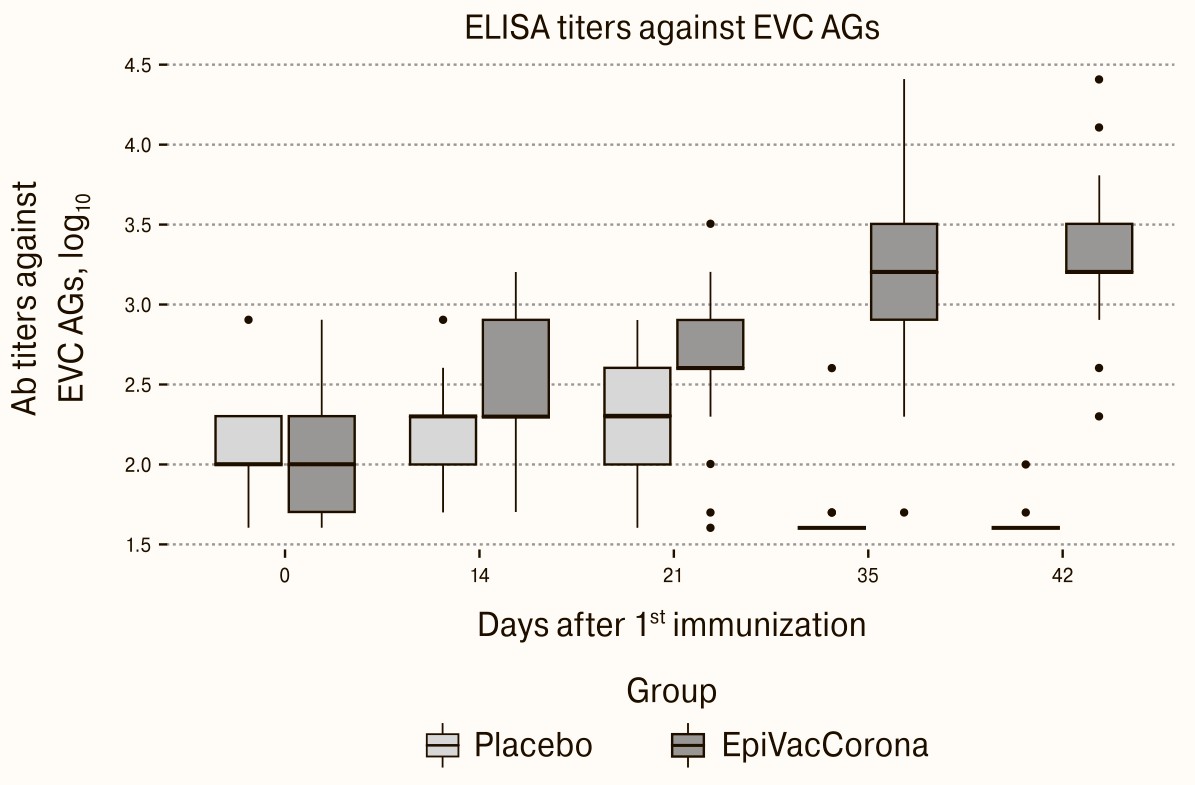
Отсутствует положительный контроль с плазмой реконвалесцентов в эксперименте с титрами антител к антигенам вакцины (рис. 6). На рисунке приведен результат анализа ИФА-тестом антител испытуемых, которых провакцинировали «ЭпиВакКороной» на антигены вакцины.
Рисунок 6. Специфические антитела к антигенам «ЭпиВакКороны» на 0, 14, 21, 35 и 42 дни после вакцинации. По оси ординат результаты ИФА теста в логарифмической шкале.
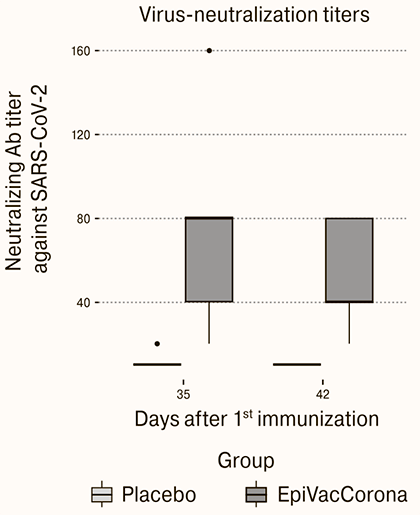
Рисунок 7. Вирус-нейтрализующие антитела (обратные титры) в сыворотках добровольцев-испытуемых на 35 и 42 дни после первой иммунизации
В эксперименте с вирус-нейтрализующими антителами (рис. 7) этот контроль также отсутствует. Показаны результаты анализа обратных титров вирус-нейтрализующих антител в сыворотке испытуемых на 35 и 42 дни после вакцинации.
Обнаружены антитела к антигенам вакцины в контрольной группе испытуемых
Данные, представленные на Fig. 2 из [1] (рис. 6), вызывают много вопросов. На этом рисунке отсутствует положительный контроль, а отрицательный контроль в виде данных для группы плацебо выглядит странно. В этой группе на 0–21 дни после вакцинации обнаруживаются высокие титры антител по тесту «Вектора», а на 35 и 42 сутки они пропадают.
Более того, в таблице «Иммуногенность и исследования вирус-нейтрализующей способности» данные по группе вакцины и группе плацебо представлены полностью не для всех временных отметок. Максимальный титр у кого-то из группы плацебо достиг 1:800, а средний геометрический титр в этой группе к 21 дню вплотную подобрался к 1:200. Такой же минимальный титр специальных антител к вакцинным антигенам «ЭпиВакКороны» указан для группы вакцинированных на последней временной отметке. Если разработчики сообщают о 100%-ной иммунологической эффективности в группе вакцины, означает ли это, что титр 1:200 по тесту «Вектора» в группе плацебо входит в границы эффективности?
Вызывает сомнения статистическая достоверность полученных результатов
На рисунке 6 ошибки титров антител в группе вакцинированных и в группе плацебо перекрываются. В таблице 3 представлены очень большие стандартные отклонения титров антител на 35 и 42 сутки.
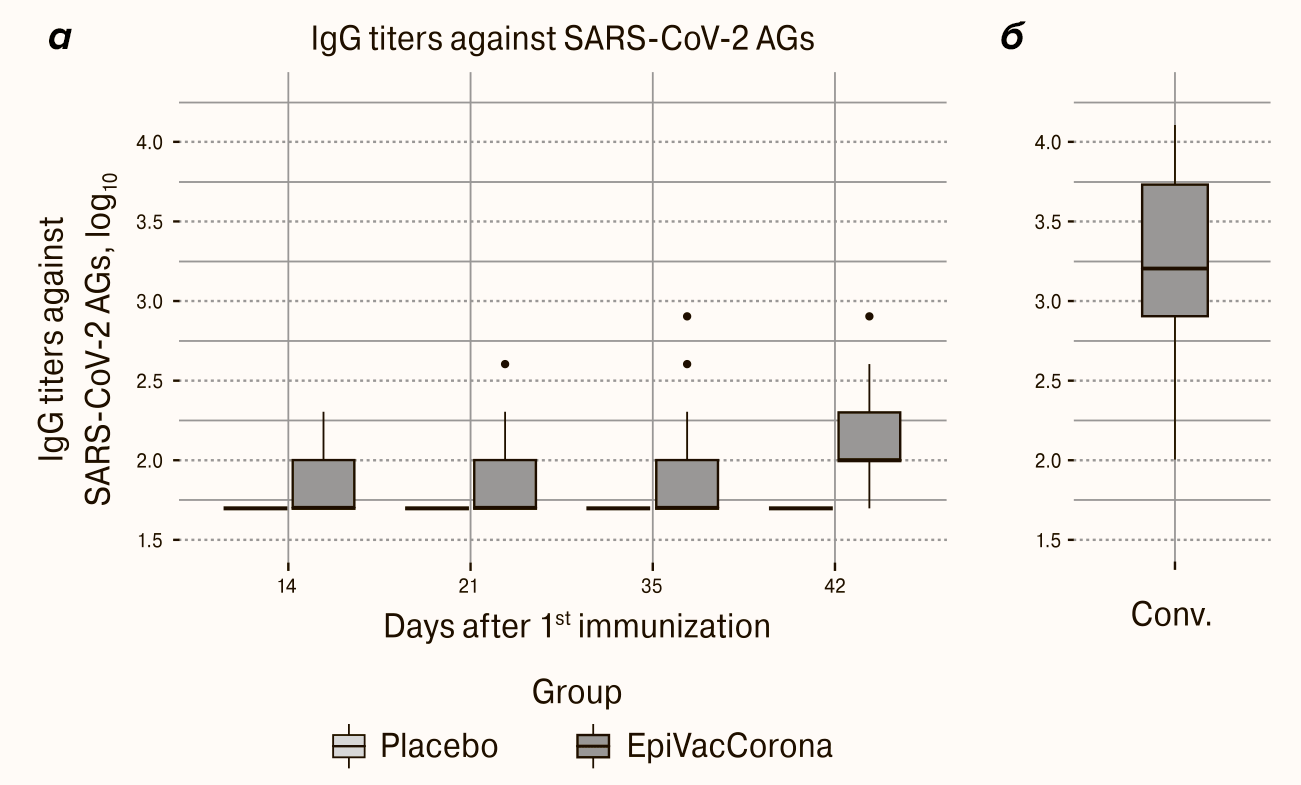
Вакцина продемонстрировала слабую иммуногенность
В эксперименте с титрами антител к антигенам SARS-CoV-2 (рис. 8) средние геометрические титры после вакцины на последней временной отметке более чем в 10 раз ниже титров антител переболевших. На панели а показаны титры антител к антигенам вируса в сыворотках испытуемых, которые определялись в разные сроки после вакцинации. Определение производилось для сывороток, полученных на 14, 21, 35 и 42 дни после вакцинации. На панели б показан титр антител у переболевших COVID-19. Значения титров показано в логарифмической шкале.
Рисунок 8. Специфические антитела к антигенам вируса SARS-CoV-2: а — в сыворотках испытуемых на 14, 21, 35 и 42 дни после иммунизации (логарифмическая шкала); б — в сыворотках реконвалесцентов (переболевших COVID-19) (логарифмическая шкала).
Проблема использования вакцины для пожилых
Заявления «Вектора» о безопасности и иммуногенности вакцины «ЭпиВакКорона» для пожилых, а также людей с хроническими заболеваниями, по-прежнему не подтверждены открытыми научными данными. Участники испытаний — это сравнительно молодые и здоровые люди. В списке участников испытаний людей старшего возраста и людей с хроническими заболеваниями нет.
Тут еще стоит немного отвлечься от анализа статьи и рассказать, на основании каких испытаний вакцина была-таки рекомендована пожилым. Специалисты в разработке вакцин выделяют четыре фазы клинических испытаний вакцин, как и других лекарственных препаратов [19]. Первые две фазы нужны для получения первичных данных о побочных эффектах вакцины и ее иммунологических характеристиках. Кроме того, они помогают подобрать дозировки иммуногенного вакцинного материала при введении в организм, а также режим введения вакцины. В качестве иммунологических характеристик чаще всего оценивают выработку антител, хотя есть и другие параметры, такие как клеточный иммунитет. В первых двух фазах, как правило, участвует от нескольких десятков до нескольких сотен человек.
Исследования фазы III делаются уже на большой группе людей — как правило, много тысяч. Эти исследования обычно спланированы таким образом, чтобы получить надежные статистические результаты о способности вакцины предотвращать инфекцию. То есть сравнивают заболеваемость в группе вакцинированных с группой плацебо. На маленькой выборке людей такие исследования проводить невозможно. Ведь только небольшая часть из них заболеет, а надо получить надежную разницу в числе заболевших в группе вакцинированных и плацебо. При этом разница должна быть статистически значимой. Испытания третьей фазы изучают эпидемиологическую эффективность вакцины.
Испытания четвертой фазы проводятся для изучения того, как долго длится иммунитет и нет ли у вакцины долгосрочных побочных эффектов. В принципе, в России действуют примерно такие же правила изучения новых вакцин. Однако в связи с пандемией Минздрав РФ счел возможным регистрировать и даже разрешать выпускать в гражданский оборот вакцины после первых двух фаз, что, по сути, проблематично. В большинстве других стран вакцину выпускают в оборот и дают временное право использования на основании результатов третьей фазы, а именно клинических испытаний, показавших, что в группе вакцинированных заболеваний статистически значимо меньше, чем в контрольной группе. В пандемию эти общие правила не изменились, хотя процедура получения временного разрешения после третьей фазы клинических испытаний упростилась и ускорилась.
Что же было сделано с испытанием вакцины «ЭпиВакКорона» на пожилых людях? Испытания были проведены на сравнительно маленькой группе людей (меньше 150 человек) без контрольной группы и названы «третьей/четвертой фазой». То есть вакцина, про которую абсолютно неизвестно, способна ли она предотвращать инфекцию у пожилых (впрочем, у молодых тоже), разрешена к применению на пожилых людях. Формально с вакциной всё в порядке, и считается, что испытания третьей фазы состоялись. Роспотребнадзор сообщает: «Завершено пострегистрационное клиническое исследование вакцины с участие 150 добровольцев старше 60 лет. Отчет представлен в Минздрав России. Дальнейшее наблюдение за добровольцами через 3 и 6 месяцев будет осуществляться вне рамок настоящего исследования».
Случаи заражения COVID-19 во время клинических испытаний
В работе описываются два случая лабораторно подтвержденного COVID-19 у участников исследования: один из них в группе вакцины. При этом эти случаи и их влияние на результаты исследования не обсуждаются. Например, после полного курса вакцинации произошло заражение COVID-19 18-летнего участника 1 фазы, протекавшее с высокой температурой и вирусной нагрузкой (положительный ПЦР с Ct 21).
Увы, но далеко не единичные случаи заболевания коронавирусом, в том числе среди тех, у кого выработались антитела на антигены «ЭпиВакКороны», были зафиксированы добровольцами-испытателями, самоорганизовавшимися в сообщество в мессенджере Telegram. По моим сведениям, полученным от личного общения с членами этого сообщества, значительная часть участников исследования потеряла веру в вакцину и привилась «Спутником V». Это грустно, потому как означает, что ответ на вопрос о том, какая у вакцины «ЭпиВакКорона» протективность против COVID-19, мы можем так и не получить.
Вывод в отношении опубликованной работы
Обсуждаемую работу [1] вряд ли можно назвать научной статьей, выполненной на хороших научном и методическом уровнях. С учетом перечисленных замечаний, касающихся контролей, расхождения данных, доверительных интервалов и статистической значимости, статья представляется сырой. Поэтому ее выводы пока не могут быть приняты в качестве подтверждения заявлений разработчиков.
Таким образом, опубликованная статья [1] не помогает ответить на вопросы научного сообщества, касающиеся иммунологической эффективности данной вакцинной разработки. Наоборот, она только порождает новые вопросы. Остается непонятным, есть ли у «ЭпиВакКороны» потенциал защиты от тяжелого заболевания.
Основной вывод: данные разработчиков об образовании нейтрализующих антител в ответ на вакцину «ЭпиВакКорона», а, следовательно, о ее иммуногенности, глубоко сомнительны. Требуется независимая проверка результатов разработчиков.