в желудке налет в виде манной крупы что это такое
Современные представления о грибковой патологии пищеварительного тракта
В гастроэнтерологии, как и в других областях медицины, динамично развиваются методы диагностики и лечения грибковых инфекций на основе изучения физиологии, микробиологии, фармакологии, молекулярной патологии и медицинской генетики. Детально изучаются уже
В гастроэнтерологии, как и в других областях медицины, динамично развиваются методы диагностики и лечения грибковых инфекций на основе изучения физиологии, микробиологии, фармакологии, молекулярной патологии и медицинской генетики. Детально изучаются уже известные варианты болезни и описываются редкие и новые нозологические формы.
Грибы, являясь нормальными комменсалами желудочно-кишечного тракта (ЖКТ), становятся патогенными при определенных условиях. Это касается в основном дрожжеподобных грибов Candida spp., виды и даже штаммы которых различаются по факторам агрессии, способности к адгезии и инвазии [15].
Candida albicans — наиболее частый возбудитель кандидоза ЖКТ. Однако в последние годы большую роль играют Candida non-albicans (C. krusei, C. tropicalis, C. kefyr, C. glabrata, C. parapsilosis); у лиц с иммунодефицитом их пропорция составляет более 50%, при «относительно нормальном» иммунитете — 15%.
Дрожжеподобный гриб Cryptococcus neoformans в патологии ЖКТ как этиологический фактор играет незначительную роль. Он чаще поражает нервную систему и, диссеминируя из первичного очага, вовлекает гастроинтестинальный тракт. Описаны единичные случаи (чаще посмертно) криптококкового эзофагита, стоматита, терминального илеита, колита, холецистита, панкреатита. Как правило, они относились к ВИЧ-серопозитивным больным, а также к пациентам, страдающим гипергаммаглобулинемией Е с рецидивирующими абсцессами печени и перианальной зоны.
Грибы Aspergillus spp. редко вызывают болезнь ЖКТ, только в случаях стойкой нейтропении, кахексии и при других отягощающих состояниях.
Грибы класса Zygomycetes могут привести к развитию интестинального зигомикоза, который, как правило, ассоциирован с амебиазом, голоданием, диабетическим кетоацидозом, почечным гемодиализом. Penicillium spp. и Geotrichum поражают ЖКТ также редко.
ЖКТ покрыт слизистой оболочкой, состоящей из двух компонентов — поверхностного скользкого, слизистого слоя, по которому микроорганизмы легко продвигаются вдоль всего ЖКТ, и более глубокого плотного гликопротеинового слоя с остатками сиаловой кислоты, который формирует физиологический барьер. Адгезия и последующая инвазия грибов через этот плотный слой возможны только благодаря продукции грибами протеолитических «ферментов инвазии»: коагулазы, каталазы, козеиназы, фосфолипазы, а также фибриллярных протеиновых комплексов и эндотоксинов [15].
При физиологическом благополучии между макро- и микроорганизмами существует определенное равновесие, в котором играют роль, с одной стороны, факторы устойчивости организма к микроскопическим грибам, а с другой — факторы патогенности грибов.
Устойчивость организма зависит от принадлежности к группам риска и состояния иммунной системы.
Перечислим факторы риска развития грибковых инфекций ЖКТ.
Важным компонентом защиты от инвазии ЖКТ является иммунная система, ассоциированная с кишечником. Клеточная часть этой системы включает в себя интраэпителиальные лимфоциты, которые препятствуют дисперсии возбудителя через lamina propria и агрегации в пейеровых бляшках. В-лимфоциты кишечника участвуют в продукции секреторных IgA и IgM, которые уменьшают способность грибов к адгезии.
Т-клетки здорового организма продуцируют защитный интерферон, усиливают фагоцитоз, активируют Т-цитотоксические лимфоциты. СД4 и СД8 укрепляют местный иммунитет в ЖКТ. Причем оказалось, что цитотоксичность СД8 играет более существенную роль в предотвращении заболевания, чем предполагали раньше.
В защите важны также макрофагальный и нейтрофильный фагоцитоз, препятствующие диссеминации грибковой, особенно кандидозной инфекции.
У ВИЧ-пациентов и больных с нейтропенией, у которых фагоцитоз резко подавлен, местная инвазия и диссеминация инфекции наступают очень быстро. Известно, что нейтрофилы хотя и не могут полностью защитить слизистую оболочку ЖКТ от «атаки» грибов, но благодаря собственной «киллерной» субстанции через специфический механизм запускают активацию комплемента, который усиливает фагоцитоз. Следует отметить, что фагоцитоз особенно важен при кандидозной инфекции, но «не работает» в тканях против капсулированных криптококков и большинства мицелиальных грибов.
Облигатные микроорганизмы желудка и кишечника (аэробные лактобациллы, анаэробные бифидум-бактерии, нормальная кишечная палочка и др.) также играют защитную роль. Применение антибиотиков убивает, наряду с патогенными, и эти «полезные» бактерии, открывая на слизистой оболочке рецепторы адгезии для грибов [2].
Нельзя не упомянуть также о Helicobacter pylori, который довольно часто обитает в желудке, вызывает гастрит, язвенную болезнь, а иногда оказывает канцерогенное воздействие. В свою очередь, лечение хеликобактериоза антибиотиками приводит к активации грибов Candida и кандидозу желудка [1]. Ассоциации грибов с Helicobacter pylori и другими бактериями в ЖКТ встречаются нередко, что требует продуманного адекватного подхода к тактике лечения.
В желудке могут также присутствовать Saccharomyces cerevisiae и некоторые виды Candida, способные сбраживать и ферментировать до винного спирта сахара, попадающие с пищей в желудок. Этот феномен называется синдромом «пивоваренного завода» [14].
Вирулентность грибов, патогенные факторы, как и полисахариды (маннаны), плазмокоагулаза, эндотоксины, липиды, глюкоконъюгаты, влияют на развитие заболевания. Даже от внутривидовых способностей грибов зависит, разовьются ли в каждом конкретном случае кандиданосительство или болезнь [13]. Например, серотип В Candida albicans считается более вирулентным и наиболее распространенным возбудителем орофарингеального кандидоза у ВИЧ-инфицированных больных, также он поражает генитоуринарную систему и нередко выделяется из зева у гомосексуалистов.
Диагностика
Тщательное изучение анамнеза, выявление факторов риска, хронических заболеваний ЖКТ, патогномоничных клинических симптомов играют большую роль в своевременности установления диагноза.
В последние годы за счет эндоскопических технологий расширились возможности диагностики грибкового эзофагита и гастрита. При эзофагогастродуоденоскопии обращают внимание на гиперемию и изъязвления слизистой, наличие белых налетов и «пленок», сужение просвета пищевода, скопление слизи. Во время этой процедуры в обязательном порядке следует брать материал для микробиологического исследования, так как не всегда этиология этих проявлений грибковая. Причем информативность исследования налетов выше, чем биоптатов (95% по сравнению с 39%).
Особенно перспективны видеоинформационные эндоскопические исследования с цифровой регистрацией и анализом изображения. Четкое разграничение неизмененных и патологических тканей, анализ гистохимических процессов в слизистой оболочке пищеварительного тракта возможны с помощью эндоскопической спектроскопии и флюоресцентной эндоскопии. Видео- и колоноскопия, хромоэндоскопия на фоне «лекарственного» сна по технологии «Диантек» имеют высокое качество исследования, безболезненность манипуляций и отсутствие стресса и страха у пациентов.
Следует, однако, подчеркнуть, что инвазивные манипуляции при воспаленной слизистой ЖКТ небезопасны, могут способствовать грибковой и бактериальной диссеминации, а иногда приводят к травме и перфорации стенки пищевода или желудка. Эндоскопическая ультрасонография с допплеровским картированием, контрастным усилением тканевых и сосудистых структур перспективна, она позволяет детально дифференцировать все слои стенки пищеварительного тракта. Неинвазивные методы — виртуальная эндоскопия, позволяющая получить трехмерное изображение, магнитно-резонансное исследование — имеют большое будущее [3].
Изучение гастродуоденальной моторики с помощью сцинтиграфии и электрогастрографии также важно для диагностики и назначения дополнительных лекарственных средств, так как нарушение двигательной функции желудка, «застой» в ЖКТ создают условия для размножения грибов и бактерий. Колоноскопия дает возможность оценить состояние слизистой кишечника, наличие белого налета, язвенных дефектов и т. д. В перспективе в гастроэнтерологии будут внедряться методы, в основе которых лежат новые научно-практические исследования: иммуноферментный анализ фекальных антигенов, ПЦР и даже генетическое тестирование [3].
Еще одним достаточно информативным методом в гастроэнтерологии является рентгенография пищевода, желудка и кишечника. Она дает возможность выявить дефекты наполнения (депо бария), изъязвления, деформацию, конвергенцию складок, изменения контуров и глубины перистальтики, сужение или расширение пищеводной трубки. С помощью рентгенографии желудка можно оценить его моторику, своевременность эвакуации пищевого комка, что важно для понимания патогенеза заболевания.
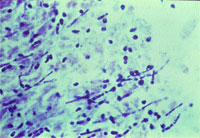 |
| Рисунок 1. Кандидозный эзофагит. Почкующиеся клетки и псевдогифы грибов Candida albicans на эзофагеальной язве |
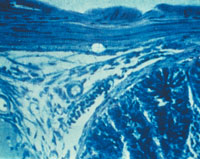 |
| Рисунок 2. Кандидозный энтерит. Утолщенные ворсинки и дефект слизистой тонкой кишки; псевдогифы грибов Candida |
Лабораторное подтверждение грибкового заболевания ЖКТ возможно при микроскопировании и/или культуральном исследовании смывов со слизистых оболочек полости рта и пищевода, содержимого желудка и кишечника, патологических «пленок», налетов и др. Количественная оценка грибов в биосубстратах должна проводиться в сопоставлении с клинической симптоматикой, с учетом наличия фоновых заболеваний, микст-инфекции и т. д. Например, обнаружение на слизистых единичных колоний Candida не является основанием для постановки диагноза «кандидоз» у иммунокомпетентных пациентов.
В кале диагностическую значимость приобретает количество колоний (более 10 5 –10 6 ). По-другому, с более низким диагностическим порогом, интерпретируются результаты посевов у иммуносупрессированных лиц, при нейтропении у больных СПИДом и в отделениях интенсивной терапии. Следует также обращать внимание на способность грибов к вегетации и образованию мицелия, так как это является одним из лабораторных признаков, подтверждающих диагноз кандидоза.
Гистологическое (окраска по Гомори–Гроккоту, ШИК-реакция) и цитологическое (окраска по Романовскому–Гимзе) исследования биоптатов позволяют обнаружить тканевые формы грибов. Многими авторами эти методы рассматриваются как наиболее достоверные. Кроме того, мицелий и псевдомицелий в тканях служат подтверждением наличия инвазивной формы грибковой инфекции ЖКТ (рис. 1, 2).
Кандидоз
Это наиболее распространенная грибковая оппортунистическая висцеральная патология. Агрессивные свойства грибов Candidа проявляются в их способности через стадию адгезии и инвазии поражать слизистые оболочки любых органов, в том числе и ЖКТ. Причем «атаке» подвергается чаще всего многослойный плоский эпителий полости рта и пищевода, реже — однослойный цилиндрический эпителий кишечника. Поэтому, как правило, в верхних отделах ЖКТ происходит инвазия грибов Candidа, а в отделах, расположенных ниже желудка, — колонизация. В то же время в кишечнике даже на стадии адгезии могут наблюдаться клинические симптомы — проявления неинвазивного кандидоза [10].
Язвенные дефекты пищевода, желудка и кишечника поддерживают грибковую колонизацию вплоть до инвазии. Желудочно-кишечный кандидоз нередко приводит к кандидемии.
Классификация кандидоза
I. Орофарингеальный кандидоз.
II. Кандидозный эзофагит.
III. Кандидоз желудка.
V. Кандидозный проктосигмоидит.
VI. Перианальный кандидоз.
VII. Секреторная диарея, ассоциированная с кандидозом.
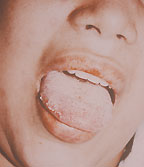 |
| Рисунок 3. Кандидозный глоссит. Типичные белые налеты и эрозии на воспаленной инфильтрированной слизистой |
Среди всех локализаций кандидоза пищеварительного тракта орофарингеальная занимает 1-е место (рис. 3).
О кандидозе полости рта упоминал еще Гиппократ, а впервые описал его хирург Лангенберк в 1839 г.
Кандидозный стоматит у новорожденных — распространенное заболевание. В первые дни после рождения слизистые ребенка устойчивы к грибам.
В дальнейшем недостаточная секреция IgA и постепенное снижение антимикробного иммунитета, переданного от матери, приводят к высокой заболеваемости. Патогномоничный синдром — белые творожистые налеты на слизистой полости рта, так называемая «молочница» [16].
Кандидоз ассоциирован также с ношением протезов. При этом развивается атрофический кандидоз, огромное количество грибов скапливается в щечных складках на фоне красного точечного воспаления слизистой; инвазия, как правило, отсутствует.
Кандидозный эзофагит в стационарах общего профиля встречается у 1,3–2,8% больных, в отделениях трансплантации — до 4%, при диссеминированном карциноматозе — от 2,8 до 6,7%. Это заболевание протекает часто без субъективных жалоб и выявляется случайно при «сплошных» исследованиях населения в 1–7% случаев [5, 17]. Иногда больные отмечают боль и дискомфорт при прохождении твердой и жидкой пищи, дисфагию, гиперсаливацию. По глубине поражения эндоскопически выделяют четыре типа — от легкого отека, гиперемии, единичных белых налетов
С. А. Бурова, доктор медицинских наук, профессор
Национальная академия микологии, ГКБ № 81, Москва
Осложненная форма болезни Крона у подростка (описание клинического случая)
Представлен случай поздней диагностики болезни Крона у подростка с хроническим гастродуоденитом, язвенной болезнью желудка и 12-перстной кишки с деформацией привратника и луковицы 12-перстной кишки. Представлены этапы диагностического поиска и дифференциа
The article represents a case of late diagnostics of Crohn’s disease in a teenager with chronic gastroduodenitis, stomach and duodenal ulcer, with pylorus and duodenal cap deformation. Stages of diagnostic search and differential diagnosis were presented.
На основании анализа заболеваемости детей и подростков педиатрического отделения МОНИКИ структура воспалительных заболеваний кишечника (ВЗК) претерпевает определенные изменения. Так, по данным годового отчета десятилетней давности не было зарегистрировано ни одного случая болезни Крона (БК) среди 200 пациентов с различными заболеваниями желудочно-кишечного тракта (ЖКТ), а язвенный колит (ЯК) диагностирован у трех детей. В 2009–2010 гг. в клинике стали наблюдаться единичные случаи регистрации БК, в 2013 г. заболевание диагностировано у трех детей из 176 больных гастроэнтерологического профиля. Несомненно, что патоморфоз ВЗК и опыт работы с этими больными получили соответствующее статистическое отражение.
Болезнь Крона — хроническое заболевание, характеризующееся сегментарным трансмуральным гранулематозным воспалением, поражающим различные зоны ЖКТ [1]. В Европейском консенсусе по болезни Крона от 2010 г. представлены возможные схемы ведения больных, что не исключает использование соответствующих региональных рекомендаций, в том числе и у детей [2, 3]. Тактика лечебных мероприятий согласно международным и российским стандартам включает использование помимо охранительного режима и диетотерапии (диета № 4 с ограничением или полным исключением молочных продуктов) противовоспалительных препаратов первого ряда — 5-аминосалициловой кислоты (Сульфасалазин, Пентаса, Салофальк, Месакол и пр.), кортикостероидов (преднизолон, гидрокортизон, будесонид).
.jpg)
Препаратами второго ряда являются иммуносупрессоры (азатиоприн, метотрексат, 6-меркаптопурин, циклоспорин А), третьего ряда — биологически активные цитокины (инфликсимаб, адалимумаб).
Следует отметить, что, несмотря на имеющиеся критерии диагностики, определение активности (тяжести), распространенности заболевания и ответа на лечение, отмечаются затруднения при выявлении БК и тактики ведения больного в педиатрической практике.
Представляем клинический случай поздней диагностики БК, обусловленной особенностями течения заболевания, у девушки-подростка с сопутствующими заболеваниями органов пищеварения и тактики лечебных мероприятий.
Пациентка И., 17 лет, поступила в отделение с жалобами на слабость, головные боли, боли в животе, возникающие после еды и в ночное время, неустойчивый стул со склонностью к запорам, однократного эпизода наличия прожилок крови в стуле.
Анамнез жизни: родилась у здоровых родителей, от второй нормально протекавшей беременности и родов. Вес девочки при рождении 3000 г., длина 51 см, на грудном вскармливании до 1,5 мес. На первом году жизни выявлены признаки дисбактериоза кишечника, который характеризовался изменением качественного и количественного состава микрофлоры, чередованием запоров и поносов. Перенесенные заболевания: острые респираторные вирусные инфекции, ветряная оспа. Прививки проведены по плану. Аллергологический анамнез отягощен: на мед отмечалась сыпь на коже. В школьном возрасте у девочки было выявлено отставание в физическом развитии конституционального характера.
Анамнез заболевания: первые указания на интенсивные боли в животе относятся к 2011 г. В августе 2012 г. после острого гнойного бронхита (стационарное лечение) длительно сохранялся субфебрилитет, периодически возникали эпизоды разжиженного стула без патологических примесей. С этого времени у девочки нарастали гастроэнтерологические и астеноневротические жалобы, участились респираторные заболевания, отмечалось снижение веса. Наблюдалась у гастроэнтеролога, проводилась медикаментозная коррекция дисбактериоза кишечника. Одновременно наблюдалась иммунологом, неврологом, гинекологом, получала терапию препаратами прогестерона по поводу дисфункции яичников.
В феврале 2013 г. самочувствие больной ухудшилось, снизился аппетит, участились боли в животе. Девочка направлена в стационар по месту жительства, где была диагностирована язвенная болезнь желудка. При эндоскопическом исследовании выявлены две язвы слизистой оболочки антрального отдела желудка диаметром 4,0 и 7,0 мм. Проведена эрадикационная терапия, при выписке (контрольная эзогастродуоденоскопия (ЭГДС)) — язвенных дефектов не обнаружено. При этом, несмотря на нормализацию эндоскопической картины, жалобы на боли в животе сохранялись.
Повторная госпитализация через 5 месяцев после выписки (август 2013 г.) в связи с усилением болевого синдрома с диагнозом: хронический гастродуоденит, эрозивный бульбит, дуоденогастральный рефлюкс. Сопутствующая патология: деформация желчного пузыря (перегиб), хронический тонзиллит, вазомоторный ринит, инфицирование вирусом Эпштейн–Барра, дисфункция яичников. При обследовании впервые отмечено ускоренное СОЭ до 59 мм/ч, повышение CРБ до 50 мг/л, снижение уровня сывороточного железа до 4,5 мкмоль/л. При ЭГДС — рубцовые изменения луковицы 12-перстной кишки. Была проведена колоноскопия: в пределах осмотра (нисходящий отдел) толстой кишки патологии не выявлено, признаки геморроя. Рентгенограмма органов грудной клетки и магнитно-резонансной томографии головного мозга — без патологии. Консультация онколога — данных за онкологическую патологию нет. Проведенное лечение: диетотерапия, Омез, Де-Нол, Маалокс, Мотилиум, Пробифор, Мексидол, витамины. Пациентка выписана без значимого улучшения состояния. При дальнейшем амбулаторном наблюдении сохранялись резкие боли в животе после каждого приема пищи, продолжалось снижение массы тела (до 39 кг), усилились метеоризм, запор, слабость, головокружение. В октябре 2013 г. больная была направлена в детскую клинику МОНИКИ.
В МОНИКИ находилась с 28.10.2013 г. по 19.12.2013 г. При госпитализации состояние расценено как тяжелое. При осмотре отмечалась выраженная бледность и сухость кожных покровов, периорбитальный цианоз, капиллярит. Вес 39 кг, рост 157 см, физическое развитие ниже среднего, дисгармоничное (рост — 25-й процентиль, вес ≤ 3-го процентиля). Истощение, практически отсутствует подкожно-жировой слой (дефицит массы тела 33%). На верхушке сердца выслушивается функциональный систолический шум. Артериальное давление 95/50 мм рт. ст. Язык густо обложен белым налетом. При пальпации живота отмечается болезненность в эпигастральной и правой подвздошной областях. Стул по типу «овечьего», без патологических примесей. Общий анализ крови: гемоглобин — 106 г/л, тромбоциты — 498 тыс., п/я — 9,5%, анизоцитоз, микроциты, пойкилоцитоз, СОЭ по Вестергрену 100 мм/час. В биохимическом анализе крови СРБ — 23,69 мг/л, уровень белка, билирубина, холестерина, трансаминаз, электролитов, креатинина, железа, альфа-амилазы, прокальцитонина — в пределах нормы. В коагулограмме — фибриноген 4,01 г/л, присутствует слабо выраженный волчаночный антикоагулянт. Электрофорез белков сыворотки крови — общий белок 81 г/л, альбумин — 45,6%, α-1 — 6%, α-2 — 15%, β-1 — 5,4%, β-2 — 7,3%, γ — 20,7%. Иммуноглобулины А, M, G, E, ЦИК 3% и 4%, латекс-тест, HCT-тест, антитела к двуспиральной ДНК, антинуклеарный фактор, антитела к цитоплазме нейтрофилов, антифосфолипидные иммуноглобулины — в норме. LE-клетки не обнаружены. Общий анализ мочи: без патологии. Копрограмма: стул оформленный, коричневый, мышечные волокна с исчерченностью — большое количество, жир нейтральный — единичные капли, слизь — не обнаружена, лейкоциты и эритроциты — единичные в препарате. Исследование кала на скрытую кровь — резко положительная реакция. Исследование кала на дисбактериоз — рост Candida albicans 4 × 10 4 степени. На электрокардиографии (ЭКГ) изменения миокарда желудочков с ЭКГ-признаками гипокалиемии. Ультразвуковое исследование органов брюшной полости: фиксированный перегиб в выходном отделе желчного пузыря, в просвете небольшое количество рыхлого осадка.
Эзофагогастродуоденоскопия: слизистая пищевода розовая, в нижней трети гиперемирована. Кардия смыкается не полностью, пролапс слизистой желудка в пищевод. В просвете желудка большое количество жидкости, на стенках слизь, перистальтика усилена, складки среднего калибра, утолщены за счет отека. Угол желудка подтянут по малой кривизне, проходим. На задней стенке луковицы 12-перстной кишки плоская язва 3 × 7 мм, симптом «манной крупы». Заключение: язва луковицы 12-перстной кишки. Гастроэзофагеальный рефлюкс. Гастродуоденит.
Колоноскопия: слизистая прямой кишки розовая, складки сохранены, сосудистый рисунок прослеживается. Сигмовидная кишка подвижна, слизистая ее гиперемирована, в просвете и на стенках кишки слизь. Перистальтика сохранена. Слизистая нисходящей, поперечно ободочной, восходящей кишки розовая, сосудистый рисунок прослеживается, складчатость сохранена. В просвете купола небольшое количество содержимого. Баугиниева заслонка в виде розетки, сомкнута, пройти через нее не удалось. Заключение: сигмоидит.
Рентгенологическое исследование тонкой кишки с пассажем бариевой взвеси: петли тощей и подвздошной кишки обычно расположены. Рельеф слизистой и просвет их петель не изменены. Через 4 часа от начала исследования контрастировался терминальный отдел подвздошной кишки и его переход в слепую кишку: на протяжении дистальных 12–14 см участок кишки отделен от остальной массы петель, стенки уплотнены, просвет неравномерно сужен с чередованием участков мешковидного расширения, наличием полиповидного рельефа слизистой и депо бариевой взвеси. Заключение: рентгенологическая картина терминального илеита. Долихосигма (рис. 1 (А-Г)).
Гистологическое исследование биоптата желудка: фрагмент слизистой антрального отдела желудка с признаками умеренного выраженного минимальной степени активности хронического воспаления, очаговыми диапедезными кровоизлияниями в собственной пластинке, дисрегенераторной перестройкой покровно-ямочного эпителия. Hp не определяется (рис. 2 (А)).
Гистологическое исследование биоптата толстой кишки: фрагменты слизистой кишки с дисрегенераторной перестройкой крипт, умеренно выраженной лимфоплазмоклеточной воспалительной инфильтрацией с примесью эозинофилов, единичным лимфоидным фолликулом без центра размножения в собственной пластинке, поверхностными диапедезными кровоизлияниями (рис. 2 (Б)).
Диагноз: болезнь Крона тонкой кишки, впервые выявленная, стенотическая форма, тяжелое течение с высокой степенью активности. Хронический гастродуоденит, обострение. Деформация привратника и луковицы 12-перстной кишки. Хроническая трещина заднего прохода. Хронический геморрой. Долихосигма. Дисфункция билиарного тракта на фоне аномалии развития желчного пузыря (перегиб). Панкреатопатия. Аменорея.
Терапия: стол индивидуальный, с исключением молочных продуктов, сырой клетчатки, Пентаса 3000 мг в сутки, омепразол, Энтерол, флуконазол, панкреатин, Мальтофер, витамины В1 и В6, свечи с облепиховым маслом.
Состояние девочки улучшилось через две недели от начала терапии: стала более активной, появился аппетит, уменьшился болевой синдром. ЭГДС в динамике: слизистая пищевода розовая. Кардия смыкается. В просвете желудка мутная жидкость. Перистальтика усилена, слизистая желудка гиперемирована. Складки утолщены за счет отека, расправляются не полностью. Привратник и луковица деформированы. Слизистая 12-перстной кишки отечная, изменения по типу «манной крупы». В анализах крови в динамике: фибриноген 4,34 г/л, СРБ 15,32 мг/л. При выписке жалоб не предъявляла, стул ежедневно без патологических примесей, прибавка в весе 4 кг.
В апреле 2014 г. самочувствие девочки ухудшилось, появилась примесь крови в стуле, боли в животе, метеоризм, снижение веса. Госпитализирована в гастроэнтерологическое отделение МОНИКИ. Проведена коррекция терапии, назначен Буденофальк в дозе 9 мг в сутки, азатиоприн в дозе 2 мг/кг в сутки, Омез, Эрмиталь, флуконазол. На фоне проводимой терапии самочувствие девушки улучшилось.
Таким образом, на ранних этапах диагностики болезни Крона у девушки-подростка в клинической картине заболевания преобладал выраженный болевой синдром, который при четкой положительной эндоскопической динамике язвенного дефекта слизистой оболочки желудка и 12-перстной кишки был недооценен. Наличие болевой и диспепсической симптоматики, значимая потеря веса, маркеры воспаления обуславливали диагностический поиск, направленный на уточнение причины болезни. При этом выполненная колоноскопия без биопсии не позволила изменить клиническое мышление лечащего врача и уточнить заболевание кишечника. Установленные эрозивно-язвенные изменения слизистой оболочки желудка и 12-перстной кишки оказались решающими для подтверждения диагноза язвенной болезни, завершения диагностического поиска, отказа от рентгенологического исследования органов ЖКТ и продолжения назначенного симптоматического лечения.
Имеющиеся у пациентки клинические, эндоскопические, рентгенологические, морфологические изменения желудка и 12-перстной кишки, подвздошной и толстой кишки формировали мнение у педиатра МОНИКИ о едином патологическом процессе — болезни Крона. Определенные сложности были при уточнении характера патологических клинических и морфологических симптомов слизистой оболочки толстой кишки. Однако убедительных данных за БК с поражением нескольких отделов желудочно-кишечного тракта у больной недостаточно.
Ухудшение состояния больной через 3 месяца после выписки из педиатрического отделения МОНИКИ может быть обусловлено несколькими факторами: нарушение диеты в том числе, употребление молочных продуктов, прекращение или нерегулярный прием Пентасы. Возможно, имеет место и естественное течение болезни. Назначение Буденофалька и азатиоприна позволило вновь добиться клинической ремиссии. Собственный опыт ведения детей с ВЗК предусматривает полное исключение продуктов, содержащих молоко, индивидуальный подход к назначению аминосалицилатов, цитостатиков, стероидной терапии и формирование приверженности ребенка и его родителей к лечению [4]. Динамика клинических симптомов заболевания у пациентки в дальнейшем не исключают применения других методов лечения.
Представленное наблюдение демонстрирует сложности ведения больного подростка с БК. Отмечено затруднение ранней диагностики БК у подростка с эрозивно-язвенными поражениями желудка и 12-перстной кишки. Подчеркивается значение рентгенологического обследования и биопсии слизистой оболочки кишечника при выполнении колоноскопии у больного с хронической гастроэнтерологической патологией. Акцентируется значение приверженности к лечению подростка.
Литература
ГБУЗ МО МОНИКИ им. М. Ф. Владимирского, Москва
.jpg)
_575.jpg)