в составе чего можно обнаружить соляную кислоту
Урок №19. Соляная кислота и её соли
Соляная кислота
Физические свойства:
Концентрированная соляная кислота – это бесцветный раствор, сильно дымящий во влажном воздухе, с резким запахом.
Получение соляной кислоты:
Соляная кислота HCl получается при растворении газа хлороводорода воде. Хлороводород можно получить действием концентрированной серной кислоты на поваренную соль.
NaCl + H 2 SO 4 = HCl↑ + NaHSO 4 (хлороводород + гидросульфат натрия)
Химические свойства:
2Al + 6HCl = 2AlCl 3 + 3H 2
3) с оксидами металлов :
MgO + 2HCl = MgCl 2 + H 2 O
4) с основаниями и аммиаком :
HCl + KOH = KCl + H 2 O
3HCl + Al(OH) 3 = AlCl 3 + 3H 2 O
HCl + NH 3 = NH 4 Cl
5) с солями :
CaCO 3 + 2HCl = CaCl 2 + H 2 O + CO 2 ↑
HCl + AgNO 3 = AgCl↓ + HNO 3
2Fe + 3Cl 2 = 2FeCl 3
Mg + 2HCl = MgCl 2 + H 2
CaO + 2HCl = CaCl 2 + H 2 O
Ba(OH) 2 + 2HCl = BaCl 2 + 2H 2 O
Pb(NO 3 ) 2 + 2HCl = PbCl 2 ↓ + 2HNO 3
Большинство хлоридов растворимы в воде (за исключением хлоридов серебра, свинца и одновалентной ртути).
Применение соляной кислоты и ее солей:
1. Соляная кислота входит в состав желудочного сока и способствует перевариванию белковой пищи у человека и животных.
2. Хлороводород и соляная кислота используются для производства лекарств, красителей, растворителей, пластмасс.
3. Применение основных солей соляной кислоты:
Задания для повторения и закрепления
№1. Осуществите превращения по схеме:
HCl → Cl 2 → AlCl 3 → Al(OH) 3 → Al 2 O 3 → AlCl 3 → Cl 2
№2. Расставьте коэффициенты методом электронного баланса в следующей реакции:
HCl + KClO 3 → KCl + H 2 O + Cl 2
Укажите окислитель и восстановитель; процессы окисления и восстановления.
Какое количество алюминия прореагирует с избытком соляной кислоты для получения 5,6 л водорода (н.у.)?
Соляная кислота — одна из самых сильных кислот, чрезвычайно востребованный реактив
Соляная кислота — неорганическое вещество, одноосновная кислота, одна из 
Свойства
Кислота в чистом виде представляет собой жидкость без цвета и запаха. Техническая кислота обычно содержит примеси, которые придают ей слегка желтоватый оттенок. Соляную кислоту часто называют «дымящей», так как она выделяет пары хлороводорода, вступающие в реакцию с влагой воздуха и образующие кислотный туман.
Очень хорошо растворяется в воде. При комнатной температуре максимально возможное по массе содержание хлороводорода —38%. Кислота концентрации большей 24% считается концентрированной.
Хлористоводородная кислота активно вступает в реакции с металлами, оксидами, гидроксидами, образуя соли — хлориды. HCl взаимодействует с солями более слабых кислот; с сильными окислителями и аммиаком.
Для определения соляной кислоты или хлоридов используют реакцию с нитратом серебра AgNO3, в результате которой выпадает белый творожистый осадок.
Техника безопасности

При разливе кислоты ее смывают большим количеством воды или нейтрализуют щелочным растворами. Пострадавших от кислоты следует вынести из опасной зоны, промыть кожу и глаза водой или содовым раствором, вызвать врача.
Перевозить и хранить хим реактив допускается в стеклянной, пластиковой таре, а также в металлической таре, покрытой изнутри резиновым слоем. Тара должна герметично закрываться.
Получение
В промышленных масштабах соляную кислоту получают из газообразного хлороводорода (HCl). Сам хлороводород производится двумя основными способами:
— экзотермической реакцией хлора и водорода — таким образом получают реактив высокой чистоты, например, для пищевой промышленности и фармацевтики;
— из сопутствующих промышленных газов — кислота на основе такого HCl называется абгазной.
Это любопытно
Именно соляной кислоте природа «поручила» процесс расщепления пищи в организме. Концентрация кислоты в желудке составляет всего 0,4%, но этого оказывается достаточно, чтобы за неделю переварить бритвенное лезвие!
Кислота вырабатывается клетками самого желудка, который защищен от этой агрессивной субстанции слизистой оболочкой. Тем не менее, его поверхность обновляется ежедневно, чтобы восстановить поврежденные участки. Кроме участия в процессе переваривания пищи, кислота выполняет еще и защитную функцию, убивая болезнетворные микроорганизмы, попадающие в организм через желудок.
Применение
— В медицине и фармацевтике — для восстановления кислотности желудочного сока при его недостаточности; при анемии для улучшения всасываемости железосодержащих лекарств.
— В пищепроме это пищевая добавка, регулятор кислотности Е507, а также ингредиент сельтерской (содовой) воды. Используется при изготовлении фруктозы, желатина, лимонной кислоты.
— В химической промышленности — основа для получения хлора, соды, 
— Больше всего производимой в мире хлористоводородной кислоты расходуется в металлургии для очистки заготовок от окислов. Для этих целей применяется ингибированная техническая кислота, в состав которой введены специальные ингибиторы (замедлители) реакции, благодаря чему реактив растворяет окислы, но не сам металл. Также соляной кислотой травят металлы; очищают их перед лужением, пайкой, гальванированием.
— Обрабатывают кожу перед дублением.
— В добывающей отрасли востребована для очистки буровых скважин от отложений, для обработки руд и горных пластов.
— В лабораторной практике хлористоводородная кислота используется как популярный реактив для аналитических исследований, для очистки сосудов от трудноудаляемых загрязнений.
— Применяется в каучуковой, целлюлозно-бумажной индустрии, в черной металлургии; для очистки котлов, труб, оборудования от сложных отложений, накипи, ржавчины; для очистки керамических и металлических изделий.
Соляная кислота ГОСТ 3118-77
наименование
Содержание
Физические свойства
Физические свойства соляной кислоты сильно зависят от концентрации растворённого хлороводорода:
| Конц. (вес), кг HCl/кг | Конц. (г/л), кг HCl/м³ | Плотность, кг/л | Молярность M | Водородный показатель (pH) | Вязкость, мПа·с | Удельная теплоемкость, кДж/(кг·К) | Давление пара, Па | Температура кипения, °C | Температура плавления, °C |
| 10 % | 104,80 | 1,048 | 2,87 | −0,4578 | 1,16 | 3,47 | 0,527 | 103 | −18 |
| 20 % | 219,60 | 1,098 | 6,02 | −0,7796 | 1,37 | 2,99 | 27,3 | 108 | −59 |
| 30 % | 344,70 | 1,149 | 9,45 | −0,9754 | 1,70 | 2,60 | 1,410 | 90 | −52 |
| 32 % | 370,88 | 1,159 | 10,17 | −1,0073 | 1,80 | 2,55 | 3,130 | 84 | −43 |
| 34 % | 397,46 | 1,169 | 10,90 | −1,0374 | 1,90 | 2,50 | 6,733 | 71 | −36 |
| 36 % | 424,44 | 1,179 | 11,64 | −1,06595 | 1,99 | 2,46 | 14,100 | 61 | −30 |
| 38 % | 451,82 | 1,189 | 12,39 | −1,0931 | 2,10 | 2,43 | 28,000 | 48 | −26 |
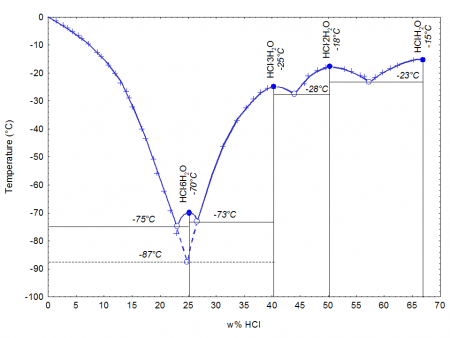
При 20 °C, 1 атм (101 кПа)При затвердевании даёт кристаллогидраты составов HCl·H2O, HCl·2H2O, HCl·3H2O, HCl·6H2O.
Химические свойства
Получение
Соляную кислоту получают растворением газообразного хлороводорода в воде. Хлороводород получают сжиганием водорода в хлоре, полученная таким способом кислота называется синтетической. Также соляную кислоту получают из абгазов — побочных газов, образующихся при различных процессах, например, при хлорировании углеводородов. Хлороводород, содержащийся в этих газах, называется абгазным, а полученная таким образом кислота — абгазной. В последние десятилетия доля абгазной соляной кислоты в объёме производства постепенно увеличивается, вытесняя кислоту, полученную сжиганием водорода в хлоре. Но полученная методом сжигания водорода в хлоре соляная кислота содержит меньше примесей и применяется при необходимости высокой чистоты.
В лабораторных условиях используется разработанный ещё алхимиками способ, заключающийся в действии концентрированной серной кислоты на поваренную соль:
При температуре выше 550 °C и избытке поваренной соли возможно взаимодействие:
Возможно получение путём гидролиза хлоридов магния, алюминия (нагревается гидратированная соль):
Эти реакции могут идти не до конца с образованием основных хлоридов (оксихлоридов) переменного состава, например:
Хлороводород хорошо растворим в воде. Так, при 0 °C 1 объём воды может поглотить 507 объёмов HCl, что соответствует концентрации кислоты 45 %. Однако при комнатной температуре растворимость HCl ниже, поэтому на практике обычно используют 36-процентную соляную кислоту.
Применение
Промышленность
Медицина
Особенности обращения
Высококонцентрированная соляная кислота — едкое вещество, при попадании на кожу вызывает сильные химические ожоги. Особенно опасно попадание в глаза. Для нейтрализации ожогов применяют раствор слабого основания, или соли слабой кислоты, обычно питьевой соды.
При открывании сосудов с концентрированной соляной кислотой пары хлороводорода, притягивая влагу воздуха, образуют туман, раздражающий глаза и дыхательные пути человека.
Реагируя с сильными окислителями (хлорной известью, диоксидом марганца, перманганатом калия) образует токсичный газообразный хлор.
В РФ оборот соляной кислоты концентрации 15 % и более — ограничен.
Соляная Кислота
Химическое название
Химические свойства
Хлороводородная кислота, хлористый водород или хлористоводородная кислота – раствор НСl в воде. Согласно Википедии, вещество относят у группе неорганических сильных одноосновных к-т. Полное название соединения на латинском: Hydrochloricum acid.
Химические свойства Соляной Кислоты. С чем реагирует Соляная Кислота? Вещество вступает во взаимодействие с металлами, которые стоят в ряду электрохимических потенциалов перед водородом (железо, магний, цинк и другие). При этом образуются соли и выделяется газообразный H. С Соляной Кислотой не реагирует свинец, медь, золото, серебро и другие металлы правее водорода. Вещество вступает в реакцию с оксидами металлов, при этом образуя воду и растворимую соль. Гидроксид натрия под действием к-ты образует хлорид натрия и воду. Реакция нейтрализации характерна для данного соединения.
Разбавленная Соляная Кислота реагирует с солями металлов, которые образованы более слабыми к-ами. Например, пропионовая кислота слабее, чем соляная. Вещество не взаимодействует с более сильными кислотами. Карбонат кальция и карбонат натрия будут образовывать после реакции с HCl хлорид, угарный газ и воду.
Для химического соединения характерны реакции с сильными окислителями, с диоксидом марганца, перманганатом калия: 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O. Вещество реагирует с аммиаком, при этом образуется густой белый дым, который состоит из очень мелких кристаллов хлорида аммония. Минерал пиролюзит с Соляной Кислотой также вступает в реакцию, так как содержит диоксид марганца: MnO2+4HCl=Cl2+MnO2+2H2O (реакция окисления).
Существует качественная реакция на хлороводородную кислоту и ее соли. При взаимодействии вещества с нитратом серебра выпадает белый осадок хлорида серебра и образуется азотная к-та. Уравнение реакции взаимодействия метиламина с хлористым водородом выглядит следующим образом: HCl + CH3NH2 = (CH3NH3)Cl.
Вещество реагирует со слабым основанием анилином. После растворения анилина в воде к смеси прибавляют Соляную Кислоту. В результате основание растворяется и образует солянокислый анилин (хлорид фениламмония): (С6Н5NH3)Cl. Реакция взаимодействия карбида алюминия с хлористоводородной к-ой: Al4C3+12HCL=3CH4+4AlCl3. Уравнение реакции карбоната калия с к-той выглядит следующим образом: K2CO3 + 2HCl = 2KCl + H2O + CO2.
Получение соляной кислоты
Чтобы получить синтетическую Соляную Кислоту сжигают водород в хлоре, а затем полученный газообразный хлороводород растворяется в воде. Также распространено производство реактива из абгазов, которые образуются в виде побочных продуктов при хлорировании углеводородов (абгазная Соляная Кислота). При производстве данного химического соединения применяют ГОСТ 3118 77 – на реактивы и ГОСТ 857 95 – для технической синтетической хлористоводородной кислоты.
В лабораторных условиях можно применять давний способ, при котором поваренная соль подвергается действию концентрированной серной к-ты. Также средство можно получить с помощью реакции гидролиза хлорида алюминия или магния. Во время реакции могут образоваться оксихлориды переменного состава. Для определения концентрации вещества применяют стандарт титры, которые выпускаются в запаянных ампулах, чтобы в последствии можно было получить стандартный раствор известной концентрации и использовать его для определения качества другого титранта.
У вещества имеется достаточно широкая область применения:
Данное химическое соединение имеет высокий класс опасности – 2 (по ГОСТу 12Л.005). При работе с кислотой требуется спец. защита кожи и глаз. Достаточно едкое вещество при попадании на кожу или в дыхательные пути вызывает химические ожоги. Для ее нейтрализации применяют растворы щелочи, чаще всего – питьевую соду. Пары хлороводорода образуют с молекулами воды в воздухе едкий туман, который раздражает дыхательные пути и глаза. Если вещество вступает в реакцию с хлорной известью, перманганатом калия и прочими окислителями, то образуется токсичный газ — хлор. На территории РФ ограничен оборот Соляной Кислоты с концентрацией более 15%.
Фармакологическое действие
Повышает кислотность желудочного сока.
Фармакодинамика и фармакокинетика
Что такое кислотность желудочного сока? Это характеристика концентрации Соляной Кислоты в желудке. Кислотность выражается в рН. В норме в составе желудочного сока должна вырабатываться кислота и принимать активное участие в процессах пищеварения. Формула хлороводородной кислоты: HCl. Ее продуцируют париетальные клетки, расположенные в фундальных железах, с участием Н+/К+-АТФазы. Эти клетки выстилают дно и тело желудка. Кислотность желудочного сока сама по себе изменчива и зависит от числа париетальых клеток и интенсивности процессов нейтрализации вещества щелочными компонентами желудочного сока. Концентрация продуцируемой к-ты стабильна и равняется 160 ммоль/л. У здорового человека в норме должно вырабатываться не более 7 и не менее 5 ммоль вещества в час.
При недостаточной или избыточной выработке Соляной Кислоты возникают заболевания пищеварительного тракта, ухудшается способность усваивать некоторые витамины и микроэлементы, например, железо. Средство стимулирует выделение желудочного сока, снижает рН. Активирует пепсиноген, переводит его в активный фермент пепсин. Вещество благоприятно воздействует на кислотный рефлекс желудка, замедляет переход не до конца переваренной пищи в кишечник. Замедляются процессы брожения содержимого пищеварительного тракта, исчезает боль, изжога и отрыжка, лучше усваивается железо.
После приема внутрь средство частично метаболизируется слюной и желудочной слизью, содержимым 12-перстной кишки. Несвязанное вещество проникает в 12-перстную кишку, где полностью нейтрализуется ее щелочным содержимым.
Показания к применению
Вещество входит в состав синтетических моющих средств, концентрата для полоскания ротовой полости ухода за контактными линзами. Разбавленная Соляная Кислота назначается при заболеваниях желудка, сопровождающихся пониженной кислотностью, при гипохромной анемии в сочетании с препаратами железа.
Противопоказания
Лекарство нельзя применять при аллергии на синтетическое вещество, при болезнях пищеварительного тракта, ассоциированных с повышенной кислотностью, при остром гастрите.
Побочные действия
Концентрированная Соляная Кислота при попадании на кожу, в глаза и дыхательные пути может вызывать сильные ожоги. В составе различных лек. препаратов используют разбавленное вещество, при длительном применении больших дозировок может возникнуть ацидоз, ухудшение состояния эмали зубов.
Инструкция по применению (Способ и дозировка)
Хлороводородную кислоту применяют в соответствии с инструкцией.
Внутрь лекарство назначают, предварительно растворив в воде. Обычно используют 10-15 капель препарата на пол стакана жидкости. Лекарство принимают во время еды, 2-4 раза в день. Максимальная разовая дозировка составляет 2 мл (около 40 капель). Суточная доза – 6 мл (120 капель).
Передозировка
Случаи передозировки не описаны. При бесконтрольном приеме вещества внутрь в больших количествах возникают язвы и эрозии в пищеварительном тракте. Следует обратиться за помощью к врачу.
Взаимодействие
Вещество часто используют в комбинации с пепсином и прочими лек. препаратами. Химическое соединение в пищеварительном тракте вступает во взаимодействие с основаниями и некоторыми веществами (см. химические свойства).
Особые указания
При лечении препаратами Соляной Кислоты необходимо четко придерживаться рекомендаций в инструкции.
Кислота соляная – вещь во многих отраслях промышленности просто незаменимая. Металлургия, пищевое производство, гальванопластика, медицина – это и многие другие сферы сегодня трудно представить без использования кислот. К сожалению, далеко не каждый знает, чем является соляная кислота техническая, как она производится и где применяется. Мы постараемся исправить эту ситуацию – рассмотрим данные вопросы и отметим наиболее важные моменты, которые касаются такого важного и незаменимого химического продукта, как кислота соляная.
Уже из названия ясно, что соляная кислота техническая – едкая жидкость, которая обладает явными растворяющими качествами. При попадании состава на кожу образуются серьезные ожоги, поэтому кислота соляная требовательна к условиям хранения, транспортировки и непосредственного взаимодействия с ней. Даже испарения данного вещества способны нанести вред здоровью человека, так как на открытом воздухе кислота соляная начинает выделять пары хлороводорода. Именно поэтому внушительными мерами безопасности во время взаимодействия с подобным химическим составом пренебрегать ни в коем случае нельзя. Тогда же для чего идти на подобный риск? Неужели польза от субстанции под названием соляная кислота техническая превышает степень риска? Ответ однозначно положительный, так как на данный момент только кислота соляная обладает рядом качеств и свойств, которые незаменимы в той или иной сфере.
Рассмотрим основные направления использования кислоты, чтобы иметь представление относительно того, как и где проявляет свои качества данное вещество:
И напоследок необходимо рассмотреть вопрос, как создается соляная кислота техническая. Всего существует две методики, результатом применения первой из которых является синтетическая кислота соляная. В этом случае происходит растворение газообразного хлороводорода в воде, а хлороводород, в свою очередь, получается путем сжигания водорода в хлоре. Вторая методика – соляная кислота техническая создается из побочных газов (агбазов), например, посредством хлорирования углеводородов. Такая кислота соляная называется агбазной. К слову, в последнее время вторая методика стремительно набирает обороты, хотя, еще несколько лет назад агбазы использовались достаточно редко.
Кислота соляная. Характеристики и свойства соляной кислоты.
Соляная кислота, хлористо-водородная кислота, HCl, сильная одноосновная кислота, раствор хлористого водорода в воде. Соляная кислота — бесцветная жидкость с острым запахом хлористого водорода. Техническая кислота имеет желтовато-зелёный цвет из-за примесей хлора и солей железа. Максимальная концентрация соляной кислоты. около 36%; такой раствор имеет плотность 1,18 г/см3, на воздухе он «дымит», т.к. выделяющийся HCl образует с водяным паром мельчайшие капельки.
Соляная кислота была известна алхимикам в конце 16 в., которые получали её нагреванием поваренной соли с глиной или с железным купоросом. Под названием «соляный спирт» её в середине 17 в. описал И. Р. Глаубер, приготовивший соляную кислоту взаимодействием NaCI с H2SO4. Метод Глаубера применяют и в настоящее время.
Соляная кислота — одна из самых сильных кислот. Она растворяет (с выделением Н2 и образованием солей — хлоридов) все металлы, стоящие в ряду напряжений до водорода. Хлориды образуются и при взаимодействии соляной кислоты с окислами и гидроокисями металлов. С сильными окислителями кислота соляная ведёт себя как восстановитель, например: MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O.
Производство соляной кислоты в промышленности включает две стадии: получение HCl и его абсорбцию водой. Основной способ получения HCl — синтез из Cl2 и H2. Большие количества HCl образуются в качестве побочного продукта при хлорировании органических соединений: RH + Cl2= RCI + HCl, где R — органический радикал.
Выпускаемая техническая соляная кислота имеет крепость не менее 31% HCl (синтетическая) и 27,5% HCl (из NaCI). Торговую кислоту называют разбавленной, если она содержит, например, 12,2% HCl; при содержании 24% и больше HCl её называют концентрированной. В лабораторной практике 2н. HCl (7%-ную, плотность 1,035) обычно называют разбавленной соляной кислотой.Кислота соляная
Соляная кислота — важнейший продукт химической промышленности. Она идёт на получение хлоридов различных металлов и синтез хлор-содержащих органических продуктов. Соляная кислота применяют для травления металлов, для очистки различных сосудов, обсадных труб буровых скважин от карбонатов, окислов и др. осадков и загрязнений. В металлургии ею обрабатывают руды, в кожевенной промышленности — кожу перед дублением. Соляная кислота — важный реактив в лабораторной практике. Транспортируют соляную кислоту в стеклянных бутылях или гуммированных (покрытых слоем резины) металлических сосудах.
Газообразный HCl токсичен. Длительная работа в атмосфере HCl вызывает катары дыхательных путей, разрушение зубов, изъязвление слизистой оболочки носа, желудочно-кишечные расстройства. Допустимое содержание HCl в воздухе рабочих помещений не более 0,005 мг/л. Защита: противогаз, очки, резиновые перчатки, обувь, фартук.
Соляная кислота содержится в желудочном соке (около 0,3%); способствует пищеварению и убивает болезнетворные бактерии.
В медицинской практике разведённую соляную кислоту применяют в каплях и микстурах в комбинации с пепсином при заболеваниях, сопровождающихся недостаточной кислотностью желудочного сока (например, гастрите), а также гипохромной анемии (совместно с препаратами железа для улучшения их всасывания).
Физические свойства соляной кислоты
Физические свойства растворов соляной кислоты разных концентраций приведены в таблице:
| Конц. (вес) c : кг HCl/кг | Конц. (г/л) c : кг HCl/м³ | Плотность ρ : кг/л | Молярность M | pH | Вязкость η : мПа·с | Удельная теплоемкость s : кДж/(кг·К) | Давление пара P HCl : Па | Т кипения т.кип. | Т плавления т.пл. |
| 10 % | 104,80 | 1,048 | 2,87 M | −0,5 | 1,16 | 3,47 | 0,527 | 103 °C | −18 °C |
| 20 % | 219,60 | 1,098 | 6,02 M | −0,8 | 1,37 | 2,99 | 27,3 | 108 °C | −59 °C |
| 30 % | 344,70 | 1,149 | 9,45 M | −1,0 | 1,70 | 2,60 | 1,410 | 90 °C | −52 °C |
| 32 % | 370,88 | 1,159 | 10,17 M | −1,0 | 1,80 | 2,55 | 3,130 | 84 °C | −43 °C |
| 34 % | 397,46 | 1,169 | 10,90 M | −1,0 | 1,90 | 2,50 | 6,733 | 71 °C | −36 °C |
| 36 % | 424,44 | 1,179 | 11,64 M | −1,1 | 1,99 | 2,46 | 14,100 | 61 °C | −30 °C |
| 38 % | 451,82 | 1,189 | 12,39 M | −1,1 | 2,10 | 2,43 | 28,000 | 48 °C | −26 °C |
При затвердевании даёт кристаллогидраты составов HCl·H2O, HCl·2H2O, HCl·3H2O, HCl·6H2O.
Химические свойства кислоты соляной
Взаимодействие с металлами, стоящими в электрохимическом ряду металлов до водорода с образованием соли и выделением газообразного водорода:
Взаимодействие с оксидами металлов с образованием растворимой соли и воды:
Взаимодействие с гидроксидами металлов с образованием растворимой соли и воды (реакция нейтрализации):
Взаимодействие с солями металлов, образованных более слабыми кислотами, например угольной:
Взаимодействие с сильными окислителями (перманганат калия, диоксид марганца) с выделением газообразного хлора:
Интересные факты о соляной кислоте:
Данные из энциклопедии
Хлористо-водородная (или соляная) кислота
(техн.). — X. кислотой называется раствор хлористого водорода HCl в воде. Главнейшее количество обращающейся в промышленности X. кислоты получается при фабрикации сульфата (см.) действием серной кислоты на поваренную соль:
2NaCl + H2SO4 = Na2SO4 + 2HCl,
соляная кислота техническаятак что на заводах эти два производства тесно связанными между собой. При начале возникновения сульфатного производства HCl выпускали прямо в атмосферу, но вскоре обнаружилось вредное действие присутствия HCl в воздухе на растительность. Более всего страдают от него деревья и кустарники, причем на первый год опадают их листья, а через некоторое время гибнет и все растение; было определено, что вред от HCl сказывается в расстоянии даже 2 км от завода. Необходимо было отыскать способы, чтобы сделать безвредным выделяющийся из сульфатных печей HCl. Поначалу предполагали достигнуть этого постройкой очень высоких дымовых труб (до 150 м), которые давали бы возможность HCl быстро рассеиваться в атмосфере; но опыт не подтвердил ожиданий, так как HCl в виде густого тумана садился на землю и уничтожал растительность даже на большем пространстве. В Англии Уокер (в 1827 г.) первым сделал попытку удалять HCl, поглощая его водой. На его идею обратили внимание. Лош построил для этой цели подземные каналы, в которые накачивалась вода насосом; затем пробовали устраивать деревянные камеры, орошаемые мелкими струйками воды, или башни, наполненные стеклом, кремнем и проч. Наибольший успех имело предложение Госсэджа, который в 1836 г. патентовал в Англии еще до сих пор применяемые коксовые башни. В первое время при поглощении HCl главнейшей целью являлось желание сделать его безвредным для окружающей местности, и на полученную соляную кислоту смотрели, как на отброс. По мере развития техники соляная кислота мало-помалу приобретает известную ценность на рынке, как материал для получения хлора. Производство ее, являясь источником дохода для сульфатных заводов, становится предметом забот со стороны администрации заводов в том отношении, что вырабатываются способы, имеющие задачей не только поглощать HCl водой, но и получить при этом сравнительно крепкие растворы.
Для наиболее полного поглощения HCl из газов от сульфатных печей самыми благоприятными условиями являются охлаждение газов и возможно лучшее соприкосновение их с водой; самое же устройство поглотительных приборов для HCl на заводах бывает различно и определяется следующими обстоятельствами: желают ли готовить всю кислоту или большей частью крепкой, т.е. которая требуется в продаже, или получать слабую кислоту, какая нужна для собственного употребления, или, наконец, задаются единственной целью избежать выделения HCl в окружающую атмосферу, не заботясь, какой крепости получается соляная кислота, так как ее всю или частью пускают в отброс. Приведенные обстоятельства влияют на выбор устройства сульфатных печей. Когда хотят всю вырабатываемую кислоту сгущать до 20 — 22°Б., нельзя работать иначе, как в муфельных печах, так как тогда получается возможность доводить до указанной концентрации кислоту не только из чаши, но также из печи; для поглощения HCl можно брать глиняные баллоны или ящики (см. ниже). Если предполагают 1/3 всей кислоты расходовать на заводе, доводя ее до 15 — 17°Б. (напр., для получения хлора), то можно готовить сульфат в пламенных печах, нагреваемых коксом (такое количество всей кислоты примерно приходится на печь, а 2/3 выделяются из чаши); наконец, если совсем не хотят утилизировать HCl, выделяющийся из печи, или довольствуются получением слабой X. кислоты 2 — 4°Б. (которая идет, напр., для производства двууглекислой соды), то можно готовить сульфат в пламенных печах на каменном угле, принимая соответственные меры, чтобы поглотительные приборы не засорялись сажей. Во всех этих случаях при работе с пламенными печами ставятся отдельные поглотительные приборы для чаши и печи, причем первые непосредственно сообщаются с атмосферой, а вторые — с вытяжной трубой. При муфельных печах нередко газы из чаши и из муфеля идут в одни и те же поглотительные приборы, но гораздо лучше и здесь разделять их. Дело в том, что газ, выделяющийся из чаши, более богат хлористым водородом, так как в муфеле его выделяется меньше и, кроме того, он разбавляется воздухом при открывании дверей для перемешивания сульфата; затем, температура его ниже, так что сгущать из него HCl легче, чем из муфельного газа. Когда на заводе работает несколько сульфатных печей, то иногда их соединяют в группы по 2 или более с одной системой поглотительных приборов для чаш, а другой для печей: регулируя тогда загрузку печей через определенные промежутки времени, получают более равномерное выделение HCl и таким образом достигают более правильного действия поглотительных приборов.
Для поглощения HCl служат 3 сорта приборов: 1) ящики (каменные резервуары), 2) баллоны и 3) коксовые башни. Какое бы ни было устройство поглотительных приборов, перед поступлением в них газы, обыкновенно, подвергаются охлаждению, проходя по трубам или каналам иногда очень значительной длины. Для охлаждения газов из чаш или муфельных печей устраивают трубопровод из глиняных труб; последние делаются с расширением на одном конце, так что узкий конец одной трубы входит в широкий конец другой; в стык набивается замазка из смеси тонко размолотого шамота с каменноугольным дегтем. Диаметр труб бывает различный. На одном заводе с муфельной печью и суточной производительностью сульфата в 7 тонн брали трубы в 37 см внутреннего диаметра, причем трубопровод для чаши и печи был общий. Для одной чаши (или муфеля после соответственного охлаждения) достаточно 25 — 26 см. Когда трубопровод назначен для 2-х чаш и печей вместе, диаметр трубы доходит до 53 см. Трубы лучше брать не глазурованные и вываривать их в каменноугольном дегте; тогда они становятся более кислотоупорными и менее ломкими. При укладке труб нужно смотреть, чтобы стыки оставлялись доступными со всех сторон на случай течи, а направление движения газов было от широкого конца к узкому. соляная кислота техническаяОхлаждение газов в таком трубопроводе идет медленно из-за малой теплопроводности глины. Например, на одном заводе на расстоянии 28,2 м температура газа с 162° упала до 75,5°, причем на первых 12 м она опустилась до 86,5°; на другом заводе около чаши было 123 — 149°, а через 75 м — 34 — 41°. На английских заводах встречаются трубы из особой каменистой массы; они имеют более тонкие стенки и лучше охлаждают газы; одно время пользовались хорошим успехом стеклянные трубы. Для пламенных печей на больших английских заводах употребляются чугунные трубы. Они, вообще, удобны в тех случаях, когда возможна резкие перемены температуры, чего не могут без повреждения выносить глиняные или стеклянные трубы. Чугунные трубы безопасно можно употреблять только в том случае, когда через них идут значительно нагретые газы; если же довести охлаждение газов до 100 — 120°, в них станет конденсироваться X. кислота, которая будет быстро разъедать чугун; поэтому для дальнейшего охлаждения чугунные трубы соединяются с глиняными. Что касается длины, которая может быть безопасно дана чугунному трубопроводу, то это зависит от того, насколько интенсивно идет работа в сульфатной печи, и насколько нагреты выходящие газы; обыкновенно, она не превышает 20 — 30 м, но иногда встречаются чугунные трубопроводы и в 100 м. Размер чугунных труб обыкновенно такой: 2,7 м длины, 0,6 — 0,75 м диам. при толщине стенок 25 мм. соляная кислота техническаяДля соединения труб их делают с расширением на одном конце; но лучше всего употреблять ровные трубы и соединять их при помощи муфты на замазке. Такое соединение очень удобно на случай чистки трубопровода. Когда в этом является нужда, замазку подогревают, муфту сдвигают в одну сторону и трубу вынимают. Надо заметить, что загрязнение трубопровода бывает очень различно; в одних случаях его нужно чистить каждую неделю, а в других — раз в год. Анализ отложений в трубах показывает, что если не считать сульфата, унесенного газами, они образуются главным образом от действия на чугун серной кислоты, уносимой током газов. Для иллюстрации охлаждения, которое получается в чугунных трубопроводах, могут служить следующие факты. В одном случае, при длине трубопровода 39 м и диам. 0,67 м, температура газов у входа была 360°, а у выхода 138°; в другом случае, при длине 36 м, получалось то же падение температуры с 360° до 138°. Для охлаждения газов из пламенных печей применяют также каналы из камня, имеющие вид желоба, закрытого сверху каменными же плитами (отдельные части поставлены на замазке), или вид круглой трубы, составленной из двух полуцилиндров, высеченных из камня. Каналы делаются надземные, а иногда и подземные; в последнем случае и охлаждение газов идет хуже, и в случае расстройства каналов трудно будет заметить это. Удобнее вести канал так, чтобы он немного поднимался по направлению к поглотительным приборам (в данном случае к коксовым башням) и чтобы образующаяся соляная кислота стекала в канал. Тогда самый канал будет не только служить для охлаждения газов, но также играть роль поглотительных приборов. Собирающаяся в нижнем конце канала кислота довольно крепка, но нечиста. При устройстве приборов для поглощения HCl водой прежде всего стремятся к тому, чтобы поглощение HCl велось непрерывно и методически при расходе наименьшего количества воды; для этой цели газы, наиболее богатые хлористым водородом, приводят в соприкосновение сначала с наиболее крепкими растворами соляной кислоты, а затем со все более и более слабыми, так что газ, уходящий из прибора вон, обрабатывается чистой водой, извлекающей из него последние следы HCl; затем стараются, по возможности, увеличить поверхность соприкосновения газа с поглощающей жидкостью.
На первых же порах, когда разрабатывались способы сгущения HCl, было предложено пропускать газы из сульфатных печей через ряд ящиков, наполненных водой так, чтобы газы шли над поверхностью воды. Так как не только дерево и железо, но даже кирпичи, пропитанные дегтем, разрушаются от действия соляной кислоты, то для приготовления их пришлось брать кислотоупорные каменные породы. Во Франции и Англии встречаются ящики, приготовленные из цельного куска камня; но для более или менее значительных размеров это очень дорого, а кроме того, они склонны давать трещины. Во Франции их делают из вогезского песчаника, высотой около 0,6 м, в основании 1,8×1,8 или 2×2 м и емкостью, следовательно, 2 — 2,4 кб. м. В ящике находится вода (2/3 всего объема), и они расположены террасоуступно, как показано на табл. фиг. 5.
Хлористо-водородная (соляная) кислота.
5. Поглощение хлористого водорода в каменных резервуарах.
Вода по трубкам t», t’, t постоянно течет из верхнего ящика А » сначала в А’, затем в A и по трубке r поступает в приемник В. Ток газов идет в противоположном направлении по трубам Т, Т’, Т» и проч. Обыкновенно ящики делаются из отдельных плит, скрепленных между собой железными обручами или болтами, как видно на фиг. 3.
3. Каменные резервуары для поглощения хлористого водорода.
В первом случае края боковых плит скашиваются до 45°. В плите, которая должна служить дном ящика, делают желобок, закладывают туда каучуковый шнур и, поместив ее на то место, где будет находиться ящик, осторожно вставляют в желобок боковые плиты; в местах соприкосновения их кладется резиновая прокладка, и плиты стягиваются затем железными тяжами, концы которых входят в особой формы чугунные угольники. Крышку укладывают в соответственные фальцы боковых плит на замазке и стягивают с дном. При другой конструкции (фиг. 4) две боковых стенки входят в пазы двух других стенок и стягиваются болтами; для полной герметичности в пазы набивается замазка.
4. Каменные резервуары для поглощения хлористого водорода.
Полученная рама вставляется на замазке в соответствующую выемку в плите, назначенной служить дном ящика. Крышка кладется в фальцы боковых стенок на замазке, а когда она делается из двух половин, при больших ящиках, в ней устраивают лаз. Каждая из приведенных систем устройства ящиков имеет свои достоинства и недостатки. В практику стали входить ящики смешанной системы. Размер плит, идущих для приготовления ящиков, бывает различен. В Англии в Йоркшире добывается плотный песчаник, который в течение долгого времени способен противостоять действию кипящей соляной кислоты, даже не будучи предварительно выварен в каменноугольном дегте (как это, обыкновенно, делается для более пористых каменистых пород). Из него можно готовить тонкие плиты больших размеров. Для дна ящика берется плита в 15 см толщиной, для боков в 10 см, а для крышки 7,5 — 10 см. Во Франции плиты делаются из вольвичской лавы из Клермон-Феррана. В России нет хорошего материала для плит; когда готовят кислоту не на продажу, то иногда берут гранит, как, например, это делается на заводе Ушкова и Ко в Елабуге; в этом случае получают соляную кислоту, немного окрашенную солями железа. Если нет в распоряжении вполне хорошего материала, который был бы кислотоупорен и легко переносил бы изменения температуры, приготовляют плиты из того, что имеется под рукой, и подвергают их вывариванию в каменноугольном дегте. Из дегтя предварительно отгоняются летучие части; однако его не следует делать очень густым, иначе пропитывание плиты будет идти очень трудно; во всяком случае, плиту самое меньшее, держат 8 дней в кипящем дегте. Применение одних только ящиков для поглощения HCl в настоящее время встречается редко, так как для полного поглощения HCl их нужно ставить большое число, что для большого завода и дорого, и требует много места; кроме того, необходимость употреблять большое количество воды делает возможным получать только очень слабую кислоту. В настоящее время каменные резервуары употребляются только в соединении с коксовыми башнями.
Сгущение HCl в глиняных баллонах распространено главным образом в Германии, Франции, Австрии, Бельгии, в Англии же почти не применяется.
На фиг. 1 представлен баллон, наиболее употребительный в Германии; высота его доходит до 1 м и емкость до 175 — 300 л.
1. Баллоны для поглощения хлористого водорода.
В одно широкое горло (около 150 — 200 мм в диам.) входит глиняная труба, по которой притекает газ, а в другое вставлена труба, по которой он уходит; среднее горло (50 мм) служит для наполнения баллона водой; наконец, внизу имеется кран для выпуска кислоты. Ряд баллонов ставится на горизонтальную поверхность, и каждый из них наполняется водой до известного уровня. При пропускании через всю эту систему газа из сульфатной печи главное количество HCl остается в первых же баллонах, и получается кислота летом 18 — 19°Б., а зимой 21 — 22°Б.; в остальных баллонах поглощаются следы HCl и образуется очень слабая кислота. Чтобы не ждать долго, когда и в этих баллонах получится кислота большей крепости (тем более, что тогда часть HCl будет проходить непоглощенной), поступают следующим образом: опоражнивают в приемники кислоту из первых баллонов для продажи, и в них переливают слабую кисл. из остальных баллонов. В последние в ряду опорожнившиеся баллоны наливают свежей воды.
Иногда у баллонов (фиг. 2) крана внизу не бывает, а с боков у них делаются два тубуса, при помощи которых баллоны соединяются между собой, образуя одну непрерывную цепь.
2. Баллоны для поглощения хлористого водорода.
Баллоны ставят тогда один немного выше другого, и пускают воду в верхний баллон; ток же газа идет в обратном направлении; тогда из нижнего баллона будет непрерывно вытекать крепкая кислота. Благодаря такому устройству устраняется довольно мешкотная работа наполнения и опоражнивания баллонов. Наиболее рационально соединять баллоны так, чтобы из верхнего баллона вытекала в рядом стоящий нижний жидкость, более богатая кислотой, которая, именно, как более тяжелая, собирается на дне баллона. Для этой цели служит трубка, идущая до дна баллона и выходящая в один из тубусов (фиг. 2). Баллоны соединяются между собой при помощи стеклянных трубок и резиновых пробок. Чтобы дать достаточную скорость течения кислоте, делают разницу в уровнях между двумя рядом стоящими баллонами в 2 см. Трубы, по которым идет газ из одного баллона к другому, делаются из глины и вставляются в горло баллона на замазке из смеси глины с каменноугольным дегтем. Для приготовления ее берут густой каменноугольный деготь и прибавляют к нему тонко измолотой огнеупорной глины, сколько влезет; затем ее колотят деревянными колотушками, пока не получится пластичная масса, которую формуют в кирпичики; при употреблении ее слабо разогревают и забивают железным инструментом в щели, которые нужно заполнить. Получается плотное кислотоупорное соединение, которое от нагревания со временем делается еще тверже. Иногда трубы не вмазываются в горло баллона, а в месте соединения их устраивается водяной запор; но это неудобно, так как вода насыщается HCl и выделяет его в окружающую атмосферу. Обыкновенно, для поглощения HCl как из чаши, так и из печи, баллоны располагаются в два ряда, так как все соединения баллонов все же недостаточно хороши, чтобы можно было устроить сразу одну тягу через непрерывный ряд их. Чтобы предохранить баллоны от растрескивания вследствие резких изменений в нагреве, газы из чаши или муфеля иногда сначала поступают в небольшую каменную камеру, в которую впрыскивают немного воды; благодаря этому не только получается значительное охлаждение газов, но из них выделяются также следы унесенной серной кислоты. К этой камере уже присоединяют два ряда баллонов. Если такой камеры нет, то серная кислота сгущается в первых баллонах; поэтому рационально уединять их от общей циркуляционной системы жидкости и наполнять и опоражнивать отдельно. Из последних баллонов газ идет в дымовую трубу или, еще лучше, пропускается через коксовую башню. Газ из чаши содержит около 600 г HCl на 1 кб. м. Для обыкновенной чаши на суточную переработку 1000 — 1500 кг поваренной соли требуется 35 — 50 баллонов; такое же примерно количество баллонов требуется и для муфеля, хотя в его газах находится меньше HCl, но зато он более нагрет. Что касается количества воды, которая идет для поглощении HCl, то примерно считают, что на каждые 100 кг разложенной поваренной соли нужно пропустить через поглотительные приборы 140 — 146 литров воды, если хотят вырабатывать исключительно крепкую кислоту; на практике обыкновенно получают и много слабой кислоты; тогда расход воды увеличивается вдвое. Конденсация соляной кислоты при помощи одних только баллонов возможна на небольших заводах, когда, в особенности, хотят получить крепкую и чистую кислоту. На больших заводах удобнее комбинировать их с коксовыми башнями (см. ниже), так как одних баллонов пришлось бы брать громадное количество, что очень дорого по сравнению с тем, сколько стоят коксовые башни. К невыгодам применения баллонов относится то, что они занимают много места и часто трескаются; кроме того, тяга газов через баллоны сильно затруднена и плохо регулируется. Но самым главным недостатком баллонов является малая поверхность соприкосновения газов с жидкостью; к тому же, если случается, что на поверхности жидкости появляется тонкий слой масла из замазки, то тогда в таком баллоне почти совсем не происходит поглощения HCl (такой баллон узнается на ощупь, так как он холоднее других). В России кислотоупорные глиняные баллоны и трубы готовятся, на заводе Вахтера и Ко в Боровичах и Ушкова и Ко в Елабуге. В Германии на заводах Fikentscher в Цвикау и Рормана в Краушвице при производстве баллонов выбирается самый лучший сорт кислотоупорной глины, не содержащей извести; глину подвергают тщательному отмучиванию. Самый обжиг ведется при такой температуре, что масса начинает сплавляться, так что затем не требуется глазуровать их, чтобы сделать непроницаемыми для жидкости. Шаффнер ввел формовку баллонов не на вращающемся столе, как это делается обыкновенно, а в гипсовых составных формах.
Одним из важнейших моментов в деле фабрикации соляной кислоты было введение Госсэджем в 1836 г. коксовых башен; это — высокие и узкие постройки из камня, кирпича и пр., наполненные коксом или другим пористым материалом, который орошается сверху водой; через них пропускается газ из сульфатных печей снизу вверх, навстречу току воды. Главное преимущество таких башен перед другими поглотительными аппаратами состоит в том, что поверхность соприкосновения здесь между водой и газом очень велика; кроме того, проходя через пористый кокс и пр., газ механически освобождается от мелкораздробленных капель кислоты; вследствие всего этого он выходит из башни совершенно прозрачным, тогда как при содержании уже 0,003% HCl в нем заметен туман. Коксовые башни делаются, обыкновенно, четырехугольными, 1 — 6 кв. м в осн. и до 36 м выс. Большие башни делают шести- или 8-угольными. В зависимости от обстоятельств, каждая башня действует самостоятельно или соединяют их в группы; при этом башни или находятся в соединении с вытяжной трубой, или проходящий через них газ прямо выходит наружу. Газ из сульфатной печи сперва проходит, обыкновенно, по длинному трубопроводу, где он предварительно охлаждается. Иногда между башней и сульфатной печью ставят каменные резервуары (от 3 до 6) или глиняные баллоны; при этом, если газ идет из чаши, в первых резервуарах или баллонах оседают пары серной кисл., унесенной током газа; для газа из печи такого выделения серной кислоты не происходит. Так как при одной башне трудно достигнуть полного поглощения HCl, то иногда ставят 2 башни, причем в первой получается крепкая кислота, а во второй, где поглощаются лишь следы HCl, — слабая. При постройке башни особую важность составляет устройство ее фундамента, так как вполне снаряженная башня имеет большой вес, а в то же время, кислота, попадающая в почву, может ослаблять фундамент. Если нельзя найти для башни прочный грунт, то его укрепляют забивкой свай, как при постройке высоких заводских труб; на грунт кладется слой асфальта или смесь песка с каменноугольным дегтем, и затем возводится фундамент. Для постройки его берется кислотоупорный песчаник, обтесанный в виде плит или параллелепипедов, для соединения которых служит замазка из смеси каменноугольного дегтя с песком. На поверхности земли на фундамент опять кладут слой асфальта с некоторым уклоном от башни, чтобы защитить фундамент от кислоты и дождевой воды. На фундамент, на известной высоте над землей ставится деревянная клетка (помост), которая служит для поддержки башенной кладки; а кроме того на ней помещается бак с водой для питания башни. На фундамент (часто еще до установки деревянного помоста) кладется толстая плита (до 30 см), которая будет служить дном башни; в ней предварительно делается углубление или отверстие, куда должна стекать кислота, и на ней устанавливаются 4 других плиты, образующих первое звено стенок, если башня четырехугольная; затем ставится другое звено из 4-х плит, и т. д. до самого верха. Соединение плит между собой производится теми же способами, которые применяются для устройства каменных резервуаров (фиг. 3 и 4). Толщина плит внизу башни доходит до 12,5 — 18 см, а кверху постепенно уменьшается до 10 см; при этом мягкие песчаники берутся более толстые. Для предохранения железных скреплений от действия кислоты они покрываются дегтем. В некоторых случаях (в особенности при получении слабой кислоты) башни строят из кислотоупорного кирпича на глиняно-смоляной замазке, а иногда применяют и обыкновенный кирпич, предварительно выварив его в каменноугольном дегте. Кокс в башне размещается на решетке, которая бывает плоская или в виде свода и устраивается из камня или кислотоупорного кирпича; под решеткой оканчивается труба, приводящая газ. Чаще всего решетку делают следующим образом. На дно башни ставят на ребро, параллельно газовой трубе, 3 плиты высотой около 1 м; у средней, приходящейся как раз против трубы, сделан вырез, так что газ проникает между всеми тремя плитами. На эти плиты кладут горизонтальные плиты в 10 см толщиной и 30 см шириной, оставляя промежутки между ними в 65 см. Если башня очень высока, то, чтобы избежать большого давления на одну решетку, делают их несколько из кирпича, располагая через каждые 10 м. Решетка из кирпича выводится аркой, верх которой выравнивается в плоскость. Если в башне несколько решеток, то в ней устраивают соответственные лазы, чтобы можно было каждую решетку отдельно загружать и разгружать. Кокс, который идет для наполнения башни, должен быть наилучшего качества, крепкий, серебристый. Газовый кокс совсем не годится, так как он мягок и крошится. Укладка кокса требует особой внимательности, чтобы получить в башне правильный ток газа и воды. На решетку сначала кладут более длинные куски так, чтобы они легли поперек промежутков между плитами; на этот слой кладут другой, располагая куски по длине, параллельно промежуткам, затем третий слой — опять перпендикулярно, и т. д.; при этом с каждым слоем размеры кусков все более и более уменьшаются, доходя до 12 — 15 см длиной при толщине в 5 см, однако, с перемежкой больших кусков. Когда таким образом наполнена 1/3 башни, остальное пространство до трубы для выхода газа засыпают отсеянным коксом (при отверстиях решетки в 5 см). В первое время кислота извлекает из кокса немного железа и органических веществ, и кокс немного оседает. Меняют кокс в башне через несколько лет, когда замечают, что тяга уменьшается. Иногда вместо кокса для заполнения внутренности башни берут кислотоупорные кирпичи с дырочками или глиняные цилиндры (стаканы), но это стоит дороже. После наполнения башни коксом закрывают ее одной или двумя плитами, которые образуют потолок. Плиты эти продырявлены во многих местах, и в отверстия (сделанные немного на конус) вставлены чашки с водяным запором, наподобие тех. которые употребляются на Гей-Люссаковой или Гловеровой башне (см. Камерное производство, фиг. 24). Чашки наполняются водой из сегнерова колеса (см. там же, фиг. 23) или качающегося корыта и правильно распределяют воду по поверхности кокса. Вместо таких чашек иногда устраивают нечто вроде лейки и пр. На дне башни имеется кран, из которого вытекает крепкая кислота. На фиг. 6 видно соединение башни, с каменными резервуарами.
6. Разрез нижней части каменной башни для поглощения (в сочетании с каменными резервуарами).
А — фундамент; башни, В — нижняя часть ее; r r — решетки, С — камера, куда входит газ по трубе a’; сгустившаяся в башне кислота вытекает через трубки I’ в резервуар D и затем по трубке b в другой резервуар E; ток газа идет обратно из E по трубе А в D. Кроме описанной системы устройства башен, на небольших и средней величины заводах, в большом ходу керамиковые башни для сгущения газов из чаши и муфеля (фиг. 7 и 8).
7. Глиняная башня для поглощения Hl в сочетании с баллонами.
Они делаются из широких (до 0,9 м) цилиндрических труб из кислотоупорной глины, иногда пропитанных дегтем; трубы соединены на замазке. Довольно значительно распространена система Шаффнера в Ауссиге (для заводов, делающих 12 операций в сутки, при загрузке соли в 400 кг).
8. Разрез глиняной башни.
Здесь отдельно сгущается HCl из чаши и муфеля с той целью, чтобы получить соляную кислоту, наиболее свободную от серной кислоты, так как в газе из муфеля, где температура выше, ее больше, чем в газе из чаши. Газ из чаши по глиняному трубопроводу идет прежде всего в небольшую башенку, наполненную вместо кокса глиняными плошками, которые 3 — 4 раза в день поливаются водой; газ здесь охлаждается и в значительной мере освобождается от серной кислоты; затем он проходит через ряд глиняных баллонов (53 шт.), причем первые баллоны сообщаются между собой длинными трубами, чтобы полнее охладить газ. Из баллонов газ идет в глиняную башню, которая до 2/3 заполнена глиняными плошками и на 1/3 коксом. Орошение башни производится при помощи сегнерова колеса из бака, установленного на верху башни. То же самое устраивается и для газа из муфеля. Из каждой башни газ идет по трубе вниз; здесь обе трубы входят в трехгорлый баллон и затем выходят в вытяжную трубу. Кислота вытекает из башни с уд. в. 1,0597 и течет через ряд баллонов навстречу току газа, выходя из последнего баллона с уд. в. 1,1782. Для наблюдения за ходом производства в разных местах поставлены стеклянные цилиндры, через которые протекает кислота, и делаются определения ее уд. в. ареометром. Кислота из башенок собирается отдельно. Из других систем, применяемых для устройства башен, можно указать еще способ Лунге и Рормана. Для поглощения HCl служит глиняная цилиндрическая башня. Внутри ее находится ряд выступов, на которые кладутся глиняные полки с отверстиями (фиг. 9).
9. Часть башни Рормана в разрезе.
При этом отверстия одной полки приходятся против целых мест другой. Это делается с той целью, чтобы по возможности чаще менять направление газа, проходящего через башню, и таким образом облегчить оседание из него мелких капель соляной кислоты. По этим полкам навстречу току газа течет вода, падая с одной полки на другую; они таким образом заменяют собой кокс. Что касается размеров коксовых башен, то, по Лунге, достаточно одной башни с основанием 1,8 м в квадрате и высотой 15 м для работы двух чаш, рассчитывая на суточную переработку 15 — 20 тонн соли, если предварительно пропускать газы через 2 — 3 резервуара; лучше, однако, доводить высоту до 18 м, если хотят получать кислоты больше и более крепкую. Делать башни в 30 м высотой излишне, и на тех заводах, где такие были, впоследствии предпочитали ставить вместо одной две башни по 15 м. При рациональной системе конденсации можно считать, что HCl из чаши сгущается почти весь (до 1/2 — 1%), и притом в крепкую кисл. Газы из муфеля и пламенной печи для полноты поглощения требуют установки добавочной башни, где получается очень слабая кисл. Так как она имеет очень ограниченное применение, то на больших заводах стараются уменьшить выход ее до minimum’a, увеличивая размеры башни или ставя между печью и башней баллоны или каменные резервуары.
Контроль производства соляной кисл. прежде всего состоит в определении крепости выходящей кислоты. Для этой цели берут несколько раз в день пробы и определяют уд. в. ее ареометром; лучше, если выходящая кисл. будет постоянно протекать через особый стеклянный цилиндр с ареометром (см. выше). Кислота, назначенная для продажи, должна иметь зимой крепость 21 — 22°Б., а летом 19 — 20°Б. Другой пункт, на который обращается внимание, это — количество HCl, остающегося не поглощенным и уходящего вон с дымовым газом. При сырой погоде уже по легкому дымку у трубы, выводящей газ, можно видеть, что некоторая часть HCl прошла через приборы не поглощенной, но для точного определения нужно сделать анализ топочных газов на содержание в них HCl, поглощая HCl из известного объема газа водой или содой, или раствором AgNO3 (см. Газовый анализ). По отчетам английских фабричных инспекторов за 1891—1893 гг. среднее количество несгущенного HCl на разных заводах было 0,185 — 0,213 г в 1 кб. м.
Продажная соляная кислота содержит в виде примесей натрий, кальций, железо, сернистую, серную кисл., хлор, бром, йод, мышьяк, селен, а иногда азотную кисл. и азотистую, если к поваренной соли был примешан бисульфат от получения азотной кислоты.
По Шенеру, чтобы очистить соляную кисл. от серной, берут раствор хлористого магния такой концентрации, который бы кипел около 118 — 120°, и приливают к нему непрерывной струёй соляную кислоту так, чтобы кипение не прекращалось; тогда будет непрерывно отгоняться соляная кислота, не содержащая серной, железа и пр., а хлористый магний будет переходить в серно-кислый. По де Геену, для той же цели берут разбавленную серную кислоту, с темп. кипения градусов на 10 выше темп. кипения соляной кисл., нагревают ее в свинцовых аппаратах при помощи свинцового змеевика и льют струёй соляную кисл. Для удаления мышьяка (по Otto) разбавляют соляную кисл. водой (до уд. в. 1,12), насыщают ее сероводородом, фильтруют и перегоняют. Leather обрабатывает продажную кислоту сернистым барием, который выделяет сразу и серную кисл. и мышьяк. Энгель прибавляет до 0,5% тиосерно-кислого калия, фильтрует и перегоняет. Главная масса всей вырабатываемой соляной кислоты идет для получения хлора и фабрикации белильных солей. В продаже отличают неочищенную соляную кислоту (crudum), и очищенную. Последняя бывает, обыкновенно, уд. в. 1,12 и 1,19. Кислота уд. в. 1,19 дымит на воздухе и потому назыв. дымящей соляной кисл. Следующая таблица показывает связь между уд. в., градусами Бомэ и % составом соляной кисл. (по Лунге и Мархлевскому):