в состав чего входит фосфор
Фосфор (Р) – роль в организме, применение, суточная потребность, источники
Фосфор (Phosphorus, Р) – химический элемент, который играет важную роль макроэлемента в организме человека и берет непосредственное участие в формировании, развитии и поддержании здоровья сердечно-сосудистой системы, головного мозга и опорно-двигательного аппарата.
Основными функциями фосфора также являются – превращение жиров, углеводов, передача нервных импульсов, синергичная работа с кальцием в формировании костного скелета и зубов. Данный элемент входит в состав фосфолипидов, белков, ДНК и АТФ, в связи с чем по праву имеет титул – «элемент жизни».
В чистом виде Р из-за высокой химической активности практически не встречается, тем не менее, он участвует в образовании около 190 минералов, наиболее популярными из которых являются – апатит и фосфорит. По расчётам ученых, масса земной коры на 0,08-0,09% состоит из фосфора.
История – краткая справка
Свое название фосфор получил от двух древнегреческих слов «φῶς» (свет), и «φέρω» (несу), объеденив которые получаем – светоносный.
Впервые о существовании фосфора заявил в 1669 году немецкий алхимик из г. Гамбург – Хеннинг Бранд (Hennig Brandt). Получил же Бранд совершенно случайно – когда пытался добыть золото из человеческой мочи. Конечно, логика у людей тех времен была уникальна – раз моча золотистая, значит в ней может присутствовать золото. В результате многодневного отстаивания, а после длительного выпаривания мочи, вместо жидкости в емкости остались белые воскоподобные частички непонятного вещества, которые могли ярко гореть и мерцать в темноте. Нововыявленное вещество Х.Бранд назвал «чудотворным носителем света» (phosphorus mirabilis).
Далее, Р смогли добыть — немецкий химик Иоганн Кункель (Johannes Kunckel), в 1680 г. англо-ирландский химик и физик Роберт Бойль (англ. Robert Boyle), в 1743 г. немецкий химик Андреас Маргграф (Andreas Marggraf) и другие.
Получить красный фосфор сумел в середине XIX в — А.Шрёттер, что произошло при нагревании белого фосфора без контакта с кислородом.
Общие данные
Расположение в периодической таблице Д.И. Менделеева: в старой версии — III период, III ряд, V группа, в новой версии таблицы – 15 группа, 3 период.
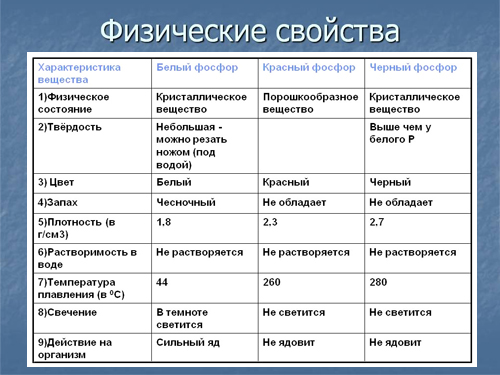
Физико-химические свойства. Фосфор известен во многих модификациях – белый, красный, желтый, черный, металлический и др., которые еще называются аллотропными. Физические и химические свойства напрямую зависят от его формы, особенно его химическая активность.
Белый фосфор – химически активное вещество белого цвета с легкой желтизной или зеленоватостью, схожее на парафин, легко поддается деформации при небольших физических усилиях. Плохо растворим в воде, при контакте с кислородом и светом начинает светиться бледно-зеленым цветом. Небольшое воздействие температуры способно привести к самовозгоранию вещества. Очень ядовит – попадание внутрь всего 0,05-0,15 г вещества может привести к летальному исходу. При контакте с кожей также способен самовоспламеняться, после чего оставляет сильные ожоги.
Красный фосфор – более устойчивая форма элемента к термическому воздействию, которую получают из его белой формы. Окрашен в красные, фиолетовые цвета с металлическим отблеском. Не растворяется в воде, не светится в темноте, способен самопроизвольно загореться при ударе или трении. Ядовитость в тысячи раз меньше по сравнению с белым. Применяется при изготовлении спичечных коробков – входит в состав терочной поверхности.
Биологическая роль фосфора в организме
В организме фосфор присутствует в виде ортофосфорной и пирофосфорной кислот. Этот элемент входит в состав фосфолипидов, АТФ (аденозинтрифосфорная кислота), нуклеиновых кислот (ДНК, РНК), фосфопротеидов, нуклеотидов, различных ферментов и коферментов. В костях человека Р находится в форме гидроксилапатита, в зубной эмали – в виде фторапатита.
В целом, 1% массы тела человека припадает на фосфор в тех или иных формах, из которых около 85% элемента содержится в составе костей из зубов.
Регулирование метаболизма фосфорных соединений производят витамин D и гормоны.
Фосфор выполняет множество важных и полезных функций, среди которых:
Применение фосфора в других сферах человеческой жизни
Суточная потребность
Рекомендуемые суточные дозы фосфора в зависимости от пола и возраста:
| Дети | до 1 года | 100-275 мг |
| От 1 до 3 лет | 460-3000 мг | |
| От 3 до 9 лет | 500-3000 мг | |
| Подростки | от 9 до 18 лет | 1250—4000 мг |
| Взрослые | от 18 до 70 лет | 700-4000 мг |
| Лица преклонного возраста | старше 70 лет | 700-3000 мг |
| Во время беременности | до 3000—3500 мг |
Для максимальной эффективности усваивания организмом фосфора его необходимо одновременно употреблять с кальцием, в соотношении – 1,5 (Р) : 1 (Са).
Суточная доза фосфора повышается при обильных физических нагрузках, занятиях спортом.
Нехватка фосфора — симптомы
Дефицит фосфора в организме (гипофосфатемия) дает о себе знать, когда его количество в сыворотке крови составляет 0,81-0,32 ммоль/л и меньше. Это может вызвать ряд осложнений со здоровьем, среди которых:
Причины нехватки фосфора
Применение фосфора в медицине
Применение Р с лечебной целью целесообразно в следующих случаях:
В качестве препаратов фосфора чаще всего применяют биофосфонаты («Этидронат»), «Кальция глицерофосфат».
Избыток фосфора
Избыток фосфора в организме (гиперфосфатемия) также, как и нехватка может вызвать ряд осложнений со здоровьем, среди которых:
Причины переизбытка фосфора
Источники фосфора
В каких продуктах содержится фосфор больше всего?
Химические источники (Р): «Этидронат», «Кальция глицерофосфат», «Фосален», витаминно-минеральные комплексы «Витрум», пищевые добавки Е338, Е339, Е340, Е341, Е342, Е343.
Взаимодействие фосфора с другими веществами
Избыточное количество в организме алюминия, кальция, магния, железа, эстрогенов, андрогенов и тироксина понижают усвояемость фосфора, а также его полную активность;
Прием Р в сочетании с кальцием (пропорция 1,5 Р к 1 Са) взаимодополняют друг друга, тем самым повышая свою активность.
Повышенное количество витамина D способствует переизбытку фосфора, однако, недостаток D приводит к недостатку Р.
При воздействии кислорода — Р легко окисляется.
Видео
Фосфор (P, Phosphorus)
История фосфора
Фосфор открыл в 1669 году алхимик из Гамбурга Хенниг Бранд, который проводил опыты с выпариванием человеческой мочи, пытаясь получить философский камень. Вещество, образовавшееся после многочисленных манипуляций, оказалось похожим на воск, необыкновенно ярко, с мерцанием, горело. Новому веществу было дано название phosphorus mirabilis (от латинского чудотворный носитель огня). Несколькими годами позже фосфор получил Иоганн Кункель, а также, независимо от двух первых учёных, Р. Бойлем.
Общая характеристика фосфора
Фосфор является элементом XV группы III периода периодической системы химических элементов Д.И. Менделеева, с атомным номером 15 и атомной массой 30,974. Принятое обозначение – Р.
Нахождение в природе
Фосфор содержится в морской воде и земной коре в основном в виде минералов, которых около 190 (самые важные – апатит и фосфорит). Входит в состав всех частей зелёных растений, белков, ДНК.
Физические и химические свойства
фосфор является неметаллом с высокой химической активностью, в свободном виде практически не встречается. Известны четыре модификации фосфора – красный, белый, чёрный и металлический.
Суточная потребность в фосфоре
Для нормального функционирования организм взрослого человека должен получать 1,0-2,0 г фосфора в сутки. Для детей и подростков норма составляет 1,5-2,5 г, для беременных и кормящих женщин возрастает до 3,0-3,8 г (calorizator). Суточная потребность в фосфоре увеличивается во время регулярных спортивных тренировок и при физических нагрузках.
Продукты питания богатые фосфором
Признаки нехватки фосфора
Недостаточное количество фосфора в организме характеризуется усталостью и слабостью, может сопровождаться потерей аппетита и внимания, частыми простудными заболеваниями, тревогой и чувством страха.
Признаки избытка фосфора
Признаками избытка фосфора в организме служат кровотечения и кровоизлияния, развивается анемия, возникает почечнокаменная болезнь.
Полезные свойства фосфора и его влияние на организм
Фосфор обеспечивает нормальные рост костной и зубной тканей организма, поддерживает их в здоровом состоянии, также участвует в синтезе белка, играет важную роль в обмене жиров, белков и углеводов. Без фосфора не могут функционировать мышцы, и не происходит умственная деятельность.
Усвояемость фосфора
При приёме минеральных комплексов стоит помнить о наилучшем балансе фосфора и кальция (3:2), а также о том, что чрезмерное количество магния и железа замедляет процесс усвоения фосфора.
Применение фосфора в жизни
Фосфор широко применяется в промышленности и сельском хозяйстве, прежде всего из-за его горючести. Его используют в производстве топлива, спичек, взрывчатых веществ, фосфорных удобрений и защиты поверхностей металлов от коррозии.
Фосфор
Основное и возбужденное состояние фосфора
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на d-подуровень.
Природные соединения
В промышленности фосфор получают в ходе сплавления фосфата кальция, песка и угля.
Химическая активность фосфора значительно выше, чем у азота. Активность также определяется аллотропной модификацией: наиболее активен белый фосфор, излучающий видимый свет из-за окисления кислородом.
В жидком и газообразном состоянии до 800 °C фосфор состоит из молекул P4. Свыше 800 °C молекулы P4 распадаются до P2.
C неметаллами фосфор часто проявляет себя как восстановитель и окислитель. Легко окисляется кислородом.
Схожим образом происходит взаимодействие фосфора и хлора.
2P + 3Cl2 → 2PCl3 (недостаток хлора)
2P + 5Cl2 → 2PCl5 (избыток хлора)
2P + 3Ca → Ca3P2 (фосфид кальция)
При взаимодействии с водой фосфор вступает в реакцию диспропорционирования (так называются реакции, в которых одно и то же вещество является и окислителем, и восстановителем).
При добавлении фосфора в растворы щелочей также происходит реакция диспропорционирования.
При поджигании спичек происходит реакция между фосфором и бертолетовой солью, которая выступает в качестве окислителя.
Кислотный оксид, пары которого имеют формулу P4O10. Твердый оксид характеризуется белым цветом.
Активно реагирует с водой с образованием фосфорной кислоты. При недостатке воды образует метафосфорную кислоту.
Обладает выраженным водоотнимающим (дегидратационным) свойством: легко извлекает воду из других соединений.
Фосфорные кислоты
Фосфорноватистая кислота способна вытеснять из солей малоактивные металлы, при этом превращаясь в ортофосфорную кислоту.
Ортофосфорная кислота
В твердом виде представляет собой кристаллы белого цвета, хорошо растворимые в воде.
Фосфорную кислоту получают из фосфатов, воздействуя на них серной кислотой. Также известны способы гидролиза пентахлорида фосфора, взаимодействия оксида фосфора V с водой.
Фосфорная кислота может образоваться при окислении фосфора сильной кислотой:
За счет кислотных свойств отлично реагирует с основными оксидами, основаниями. При различных соотношениях кислоты и основания получаются различные соли (фосфаты, гидрофосфаты и дигидрофосфаты).
В реакции с карбонатами образуется нестойкая угольная кислота, которая распадается на воду и углекислый газ.
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из фосфорной кислоты.
При сильном нагревании ортофосфорная кислота теряет воду и переходит в метафосфорную кислоту.
Соли фосфорной кислоты
Соли фосфорной кислоты получаются в ходе реакции ортофосфорной кислоты и оснований.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Фосфор
Фосфор – один из трех главных химических элементов питания растений. По своей важности он занимает второе место после азота. Принадлежит к числу достаточно распространенных элементов. В свободном состоянии в природе не встречается. Является действующим веществом простых и сложных фосфорных удобрений. Применяется под все сельскохозяйственные культуры в виде основного внесения, припосевного внесения и подкормки.
Содержание:
Большую часть новых химических элементов обнаруживали в различных рудах и минералах. Что же касается фосфора, то он был добыт из куда менее «достойного» источника – из мочи. В XII веке арабский ученый Альхильд Бехиль выделил этот элемент в чистом виде, перегоняя мочу, смешанную с несколькими «подручными» реактивами: известью, углем и глиной. В свете такого подбора компонентов для реакции, сложно сказать, рассчитывал ли он на какой-то определенный результат, однако ему повезло: он открыл фосфор. К сожалению, со временем это было предано забвению.
В 1669 году его коллега, алхимик-любитель Хеннинг Бранд, был занят решением важной задачи: он искал философский камень, а если точнее, жидкость, которая бы превращала недрагоценные металлы в золото. Для одного из своих опытов он собрал порядочное количество мочи в солдатской казарме и стал нагревать ее без доступа воздуха. Он заметил, что жидкость испускает странный белый пар, который оседал на стенках посуды и светился в темноте. Хоть Бранд и не получил желаемого, но он вновь совершил забытое открытие. Новый элемент был назван им «фосфор», что означает «светоносец».
В 1680 году независимо от Бранда фосфор был получен и известным ученым Робертом Бойлем. Его опыт тоже оказался не уникальным, и также был основан на нагревании мочи. И лишь в 1774 году Карл Шееле предложил добывать этот элемент из другого органического источника – рогов и костей животных. В настоящее время фосфор получают преимущественно из природных минералов. [7]
Фосфор
Физические и химические свойства
Фосфор (Phosphorus), P – химический элемент главной подгруппы V группы периодической химической системы Менделеева. Атомный номер – 15, атомная масса – 30,97. В настоящее время известно несколько радиоактивных изотопов фосфора, из которых 32 Р применяется в физиолого-биохимических и агрохимических исследованиях.
Фосфор характеризуется в целом как неметалл. Элемент образует несколько аллотропических видоизменений.
Белый фосфор
Красный фосфор
Черный фосфор
Фосфорит
Фосфорит – осадочная порода, источник фосфора.
Содержание в природе
Природные соединения фосфора
По причине легкой окисляемости чистый фосфор в природе не встречается. Соединения фосфора составляют по отношению к весу земного шара только 0,000015 %. В земной коре масса соединений фосфора составляет 0,75 %. [3]
Ортофосфат кальция
Апатит
Фосфор также входит в состав белков растительного и животного происхождения. [4]
Формы фосфора в почве
Запасы фосфора в почве во многом влияют на обеспеченность растений этим элементом. Все формы фосфора в почве и возможные вариации их воздействия отражаются в следующей цепочке:
Валовый → органический → минеральные соединения Р2О5 → потенциально доступный Р2О5 → непосредственно доступный Р2О5
Валовый фосфор
Содержание фосфора в верхних горизонтах почвы, как правило, выше, чем в нижележащих. Данное соотношение не зависит от типа почвы и гранулометрического состава. Обычно это связано с деятельностью человека и биологическими факторами, [1] в частности, с накоплением фосфора в зоне отмирания главной массы корней. Вниз по профилю почвы наблюдается уменьшение содержания фосфора. Большая его часть присутствует в почве в минеральной форме. [5]
Органические фосфаты
Минеральные фосфаты
Органические и минеральные соединения фосфора находятся в состоянии постоянного взаимопревращения. Соотношения данных форм определяется направленностью почвообразования. [1]
Содержание фосфора в различных типах почв
Различные почвы содержат неодинаковое количество фосфора – от 0,1 % Р2О5 в бедных песчаных до 0,20 % в мощных высоко гумусных почвах.
Почвы северной лесостепи
Дерново-подзолистые, глеевато-легкосуглинистые и среднесуглинистые почвы
Дерново-подзолистые легкосуглинистые, развивающиеся на моренном суглинке
Дерново-подзолистые
Дерново-подзолистые песчаные
Дерново-подзолистые почвы
Содержание фосфора в слое 0–20 см, согласно данным: [5]
Почва
Содержание соединений, % к общему содержанию
общее
органических
минеральных
органических
минеральных
Сильно-
оподзоленная
Средне-
оподзоленная
Лесостепная
Мощный чернозем
Каштановая
Серозем
Торфяно-болотные почвы
Симптомы недостатка фосфора, согласно данным: [6]
Культура
Симптомы недостатка
Скручивание краев листовой пластинки;
Образование фиолетовой окраски
Листья темно-зеленые, к стеблю, расположены под острым углом;
Рост наземной массы ослаблен;
При клубнеобразовании на кончиках нижних листьев – узкая темно-коричневая полоса, отмершая ткань заворачивается,
Ботва до уборки темно-зеленая;
Листья темно-зеленые с пурпурным оттенком;
Кочан образуется позднее
Стебли тонкие, слабые, жесткие, волокнистые;
Семядоли у всходов направлены под острым углом к верху;
Нижняя сторона листа – красновато-фиолетовая;
Листья поникшие, с завернутыми под лист долями;
Плоды плохо созревают
Листья мелкие, тусклые, темно-зеленые с голубоватым оттенком;
Края листа чернеют, почернение захватывает концы жилок;
На изломе листа и черешка – почернение;
Отмершие края листьев завернуты вверх;
Содержание сахара низкое;
Признаки недостатка появляются на старых листьях;
Молодые листья рано опадают
Вершины старых листьев вянут и отмирают
Листья мелкие, темно-зеленые с голубоватым оттенком;
Черешок и крупные жилки красноватые; Края листовой пластинки – красновато-лиловые
Плохой рост побегов;
Листья с пурпурным оттенком;
Образование тонких, коротких побегов;
Листья мелкие, тусклые, зеленые;
Листья покрыты пятнышками;
Опадение листьев преждевременное;
Ягоды плохо созревают;
Формируются тонкие, короткие побеги;
Листья редеют, мельчают;
Листья приобретают тускло-зеленую окраску с пурпурным или бронзовым оттенком;
Цветов и плодов мало;
Лесостепные почвы
Мощные черноземы
Обыкновенные черноземы
Выщелоченных черноземы
Темно-каштановые почвы содержат
Роль в растении
Биохимические функции
Окисленные соединения фосфора необходимы всем живым организмам. Ни одна живая клетка не сможет существовать без них.
В растениях фосфор содержится в органических и минеральных соединениях. При этом, содержание минеральных соединений составляет от 5 до 15 %, органических – 85–95 %. Минеральные соединения представлены калиевыми, кальциевыми, аммонийными и магниевыми солями ортофосфорной кислоты. Минеральный фосфор растений – запасное вещество, резерв для синтеза фосфорсодержащих органических соединений. Он увеличивает буферность клеточного сока, поддерживает тургор клетки и другие не менее важные процессы.
Органические соединения – нуклеиновые кислоты, аденозинфосфаты, сахарофосфаты, нуклеопротеиды и фосфатопротеиды, фосфатиды, фитин.
На первом месте по важности для жизнедеятельности растений стоят нуклеиновые кислоты (РНК и ДНК) и аденозинфосфаты (АТФ и АДФ). Данные соединения участвуют во многих процессах жизнедеятельности растительного организма: синтезе белков, энергетическом обмене, передаче наследственных свойств.
Нуклеиновые кислоты
P2O5 в нуклеиновых кислотах содержится около 20 %. Данные кислоты – неотъемлемая часть всех тканей и органов растений любой растительной клетки. В листьях и стеблях нуклеиновые кислоты составляют 0,1–1,0 % сухой массы. [8]
Аденозинфосфаты
Особая роль фосфора в жизни растений заключается в участии в энергетическом обмене растительной клетки. Главная роль в данном процессе принадлежит аденозинфосфатам. В их составе присутствуют остатки фосфорной кислоты, связанные макроэргическими связями. При гидролизе они способны выделять значительное количество энергии.
Они представляют собой своеобразный аккумулятор энергии, поставляя ее по мере необходимости для осуществления всех процессов в клетке.
Различают аденозинмонофосфат (АМФ), аденозиндифосфат (АДФ) и аденозинтрифосфат (АТФ). Последний по запасам энергии значительно превосходит два первых и занимает ведущую роль в энергетическом обмене. Он состоит из аденина (пуринового основания) и сахара (рибозы), а также трех остатков ортофосфорной кислоты. Синтез АТФ осуществляется в растениях в процессе дыхания. [8]
Фосфатиды
Фосфатиды, или фосфолипиды – сложные эфиры глицерина, высокомолекулярных жирных кислот и фосфорной кислоты. Они входят в состав фосфолипидных мембран, регулируют проницаемость клеточных органелл и плазмалеммы для различных веществ.
Цитоплазма всех растительных клеток содержит представителя группы фосфатидов лецитин. Это производное диглицеридфосфорной кислоты, жироподобное вещество, имеющее в составе 1,37 % P2O5. [8]
Сахарофосфаты
Сахарофосфаты, или фосфорные эфиры сахаров, присутствуют во всех тканях растений. Известно более десятка соединений данного типа. Они выполняют важную роль в процессах дыхания и фотосинтеза в растениях. Образование сахарофосфатов носит название фосфорилирование. Содержание сахарофосфатов в растении, в зависимости от возраста и условий питания, варьирует от 0,1 до 1,0 % сухой массы. [8]
Фитин
Фитин – это кальциево-магниевая соль инозитфосфорной кислоты, содержит 27,5 % P2O5. Он занимает первое место по содержанию в растениях среди других фосфорсодержащих соединений. Фитин присутствует в молодых органах и тканях растений, особенно много его в семенах, где он служит запасным веществом и используется проростками в процессе прорастания. [8]
Основные функции фосфора
Большая часть фосфора присутствует в репродуктивных органах и молодых частях растений. Фосфор отвечает за ускорение формирования корневых систем растений. Основное количество фосфора потребляется в первые фазы развития и роста. Фосфорные соединения обладают способностью легко передвигаться из старых тканей в молодые и использоваться повторно (реутилизироваться). [8]