в почках гной что делать
Пиелонефрит: симптомы и лечение
Причины возникновения и развития пиелонефрита
Воспаление почек возникает, когда инфекция нижних отделов мочевыводящих путей распространяется вверх и, двигаясь через уретру, доходит до мочевого пузыря, а оттуда – по мочеточникам в почки.
Главная причина пиелонефрита – инфекция в сочетании с нарушенным оттоком мочи. Любая проблема, которая нарушает нормальный отток мочи, увеличивает риск острого пиелонефрита. Например, мочевыводящие пути необычного размера или формы с большей вероятностью могут привести к острому пиелонефриту.
Также локальное переохлаждение поясничной области может вызвать развитие пиелонефрита, даже в отсутствие анатомических особенностей и при нормальном оттоке мочи.
Симптомы пиелонефрита
Острый пиелонефрит
Хронический пиелонефрит
Пациенты с хронической формой заболевания могут испытывать только легкие симптомы или вовсе не испытывать признаков недуга.
Хронический пиелонефрит чаще встречаются у людей с непроходимостью мочевыводящих путей. Она может быть вызвана инфекциями, пузырно-мочеточниковым рефлюксом или анатомическими аномалиями. Хронический пиелонефрит чаще встречается у детей, чем у взрослых.
Гендерные особенности
Кто в группе риска
Диагностика пиелонефрита
Лечение пиелонефрита
Хотя при правильном лечении симптомы могут пройти уже в течение 2–3 дней, курс антибиотиков необходимо завершить до конца, согласно рекомендации врача (обычно лечение длится от 10 до 14 дней). Если прервать курс терапии досрочно, может выработаться резистентность возбудителя заболевания к антибиотику – это затруднит дальнейшее лечение и увеличит риск хронического пиелонефрита.
Лечение хронического пиелонефрита возможно. Оно проводится по принципам терапии острого пиелонефрита, только требует больше времени и усилий. Лечение предусматривает устранение причины, которая привела к застою мочи, восстановление почечного кровообращения, уничтожение патогенной бактерии при помощи антибиотикотерапии, укрепление общего иммунитета. Даже если удается добиться устойчивой ремиссии, может потребоваться поддерживающая прерывистая антибактериальная терапия. Лечение хронического заболевания – серьезный вызов для медиков и долгий путь для пациента, поэтому так важно своевременно обращаться к врачу при первых симптомах недомогания и не тратить драгоценное время на самолечение.
Без должного лечения острый пиелонефрит переходит в хроническую форму. Если инфекция продолжит распространяться, почки могут быть необратимо повреждены. В редких запущенных случаях инфекция может попасть в кровоток. Последствия этого могут быть крайне серьезные, вплоть до сепсиса и бактериального шока.
Пиелонефрит у беременных
Беременность вызывает множество трансформаций в организме, в том числе и физиологические изменения мочевыводящих путей. Повышенный уровень прогестерона (гормона, поддерживающего нормальное течение беременности) и усиленное давление на мочеточники увеличивают риск пиелонефрита.
Пиелонефрит у беременных может потребовать госпитализации в случае, если это состояние угрожает жизни и матери, и ребенка. Также невылеченные инфекции почек у беременных увеличивают риск преждевременных родов, отслойки плаценты, внутриутробного инфицирования плода и поражения его нервной системы. При правильном и своевременном лечении всех этих последствий можно избежать, роды проходят в срок, прогноз благоприятный и для женщины, и для ребенка.
При беременности крайне важно понимать, первый ли это случай заболевания в анамнезе женщины, или болезнь носила хронический характер, а на фоне беременности произошло обострение. Как показывает статистика, первичное воспаление почек у беременных лечится успешно и без осложнений.
Чтобы предотвратить пиелонефрит у беременных, необходимо сдавать анализ на инфекции при планировании беременности. Также проводят посев мочи в начале второго триместра. Раннее обнаружение ИМП может предотвратить инфекцию почек.
Пиелонефрит у детей
Это распространенное заболевание среди детей, занимающее второе место по частоте случаев после ОРВИ.
Основная группа риска среди детей – дети дошкольного возраста. Девочек, в силу анатомических особенностей, болезнь поражает чаще, чем мальчиков.
Самый распространенный возбудитель детского пиелонефрита – кишечная палочка. Кроме нее, в мазках часто обнаруживают протей (простейших), золотистый стафилококк, энтерококки.
Вовремя замеченный острый пиелонефрит у детей полностью вылечивается в большинстве случаев. После полного восстановления в течение трех лет после болезни требуются регулярное обследование (первые три месяца – раз в 10 дней, дальше – ежемесячно) и наблюдение врача. Спустя три года требуется обследование раз в 3 месяца, чтобы не пропустить важную бессимптомную патологию.
Причины гноя в моче
Наличие гноя в моче может являться симптомом различных серьезных заболеваний, которые требуют незамедлительного лечения. В одном случае хлопья гноя видны пациенту невооруженным взглядом, а в другом — обнаруживаются во время сдачи общего анализа мочи.
Превышение нормальных показателей лейкоцитов (свыше 10 на 1 мкл) называется пиурией, и может встречаться как у мужчин, так и женщин в любом возрасте.
Причины
Существуют и другие причины гноя в моче и помутнения жидкости:
Болезни
Когда в моче появляется гной, человек понимает, что причинами пиурии могут являться различные заболевания печени, почек, мочеточников, мочевого пузыря и мочеиспускательного канала.
Вызывать помутнение мочи могут инфекции, которые передаются половым путем. Например, гонорея или хламидиоз. Также причинами гноя в моче у женщин выступают вульвовагинит, цистит, а у мужчин — простатит.
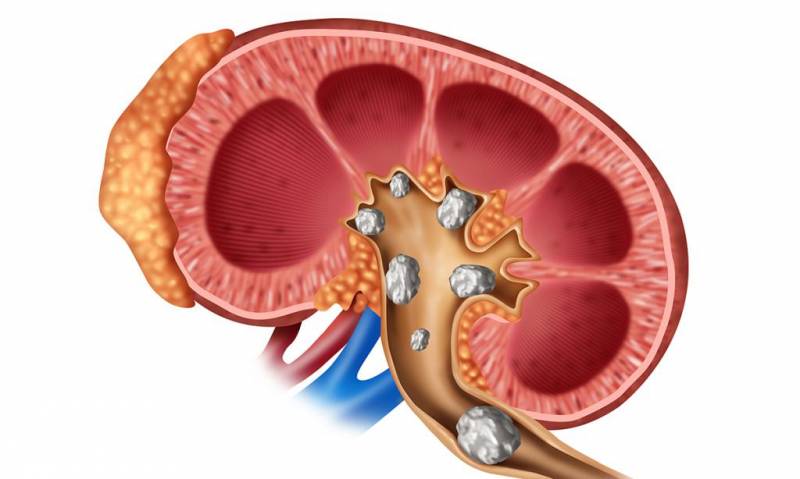
Почечные инфекции, наличие камней в мочевыводящих путях, туберкулез мочевыводящей системы, онкология также приводят к появлению гноя в моче и требуют незамедлительного лечения.
Диагностика
Заподозрить наличие гноя в моче можно при визуальном обследовании жидкости. У здорового человека она прозрачная, а при возникновении заболевания моча приобретает мутный цвет и резкий, неприятный запах. Также пациент отмечает общую слабость, повышение температуры тела, затрудненное мочеиспускание, гематурию, боли в пояснице или в нижней части живота.
Установить, почему гной в моче образовался и какое лечение требуется, можно после проведения диагностики. В клинике урологии им. Р. М. Фронштейна диагностика предполагает взятие пробы мочи, чтобы определить ее концентрацию и содержание. Также для выявления патологии может потребоваться внутривенная пиелография, проведение КТ и МРТ, УЗИ брюшной полости.
Лечение и профилактика
Пиурия не является болезнью, а лишь симптомом какого-либо недуга. По этой причине лечение гноя в моче должно назначаться только врачом-урологом после тщательного обследования.
Обнаружив гной в моче, следует обратиться в клинику урологии им. Р. М. Фронштейна. Высококвалифицированные специалисты возьмут необходимые анализы, установят причину заболевания и назначат наиболее эффективное лечение.
Чтобы избежать появления пиурии, необходимо ежедневно совершать гигиенические процедуры — подмывание с использованием предназначенных для этого средств. Профилактикой появления гноя в моче служат также использование средств защиты во время полового акта, употребление большого количества воды в течение дня и ношение нижнего белья из натуральных материалов.
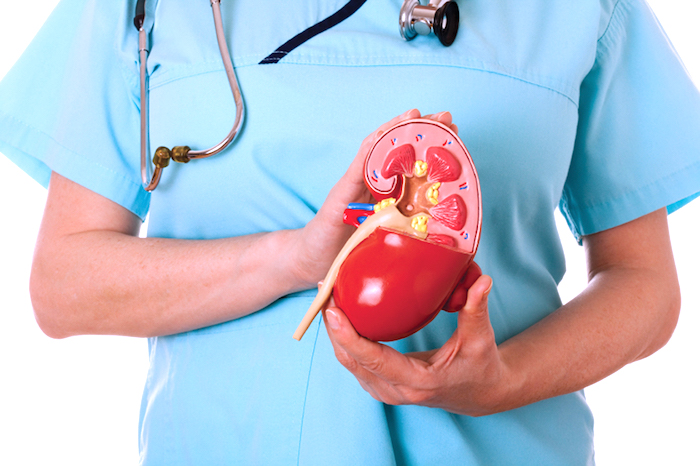
Гнойные воспаления почек: почему возникают и как лечить
Гной в почках — опасное явление, имеющее инфекционную природу. При несвоевременном обращении к урологу такие воспалительные процессы как пионефроз, паранефрит, карбункул, абсцесс приводят к сепсису и летальному исходу.
Причины возникновения гнойного воспаления в почке
Нагноение — следствие некоторых заболеваний почек и органов мочевыделительной системы (пиелонефрит и др.). Одной из причин возникновения воспалительных процессов является инфицирование почек болезнетворными организмами.
После поражения микробами на поверхности органа появляется инфильтрат, наполненный гноем. Если вовремя от него не избавиться, гнойный мешок может вызвать отмирание тканей почки. При его разрыве жидкость изливается в брюшную полость. Последствия в этом случае непредсказуемы.
Другой причиной гнойного воспаления почек может стать механическое повреждение органа (например, ножевые ранения, неверное введение катетера в мочевой пузырь и т.д.). Возникновение инфильтрата может вызвать и нестерильность во время проведения хирургических вмешательств.
Симптоматика
Гнойные заболевания почек могут иметь характерные проявления или проходить практически бессимптомно. Из-за того, что в некоторых случаях воспалительный процесс протекает в скрытой форме, постановка правильного диагноза затрудняется.
Чаще всего симптоматика довольно бурная:
Лабораторные исследования позволяют выявить высокий уровень лейкоцитов в крови, что указывает на воспалительный процесс в организме.
Особенно опасен гной в почках для беременных. Из-за гормональной перестройки организма и увеличения нагрузки на органы здоровье женщины в этот период становится очень уязвимым. На фоне воспалительного процесса у будущей мамы может развиться гестоз и анемия. Гнойная почка может стать причиной прерывания беременности, гипоксии и внутриутробного инфицирования плода, возникновения пороков развития плода, смерти матери и ребенка.
К группе риска относят также больных диабетом. Это заболевание является причиной глубоких нарушений гомеостаза. Из-за этого пациенты, страдающие сахарным диабетом, сталкиваются с гноем в почках в 4 раза чаще, чем люди с неосложненным анамнезом. Более того, после удаления инфильтрата у больных могут развиваться тяжелые осложнения (уросепсис, почечная недостаточность и др.), вызывающие летальный исход.
Методы лечения гноя в почке
Самолечение воспалительных процессов недопустимо. При появлении тревожных симптомов необходимо немедленно обратиться к врачу. Лечение заболевания производится строго в условиях стационара.
Консервативная терапия гнойной почки считается малоэффективной. Прогноз для пациентов условно неблагоприятный, так как длительное лечение воспалительного процесса может привести к серьезным осложнениям (поражению второй почки, уросепсису, прорыву гноя и т.д.). По этой причине наиболее эффективным методом признано хирургическое вмешательство. Гнойный очаг удаляется с последующим дренажом брюшной полости. В тех случаях, когда некротическое поражение слишком велико, врач может принять решение удалить больную почку.
После проведения операции пациентам показана интенсивная антибактериальная терапия, способствующая выведению токсинов из организма.
Если вы почувствовали недомогание, не стоит откладывать поход к врачу, так как малейшее промедление может стоить вам жизни. Врачи клиники урологии имени Р. М. Фронштейна Первого Московского Государственного Медицинского Университета имени И.М. Сеченова (Государственный центр урологии) окажут вам квалифицированную помощь и помогут сохранить здоровье.
Абсцесс почки. Причины, симптомы, диагностика и лечение абсцесса почки
1. Общие сведения
Термином «абсцесс» обозначается аварийная для организма ситуация, когда иммунитет не успевает справиться с гнойным воспалением, и этот процесс, словно пожар, защитная система пытается хотя бы локализовать в ограниченном пространстве. Частицы распадающейся и отмирающей ткани (как говорят в медицине, «расплавляющейся») образуют тот или иной объем гноя, который инкапсулируется в замкнутой полости и, таким образом, изолируется от окружающих тканей грануляционной оболочкой. Абсцессы чрезвычайно многообразны по месту возникновения, характеру, размеру и т.п., но практически всегда сопровождаются припухлостью, болезненностью, повышением температуры, а также теми или иными нарушениями работоспособности пораженного органа, системы или ткани.
Учитывая сказанное, нетрудно догадаться, что диагноз «абсцесс почки» является тревожным и тяжелым во всех случаях. Речь идет об инфекционно-воспалительном расплавлении паренхиматозной (основной, функционально специализированной) ткани нашего естественного фильтра, т.е. о локальном гнойном нарыве в одной или, реже, в обеих почках.
В одних источниках абсцесс почки определяется как «редкая» или «очень редкая» патология в общем объеме регистрируемой уро- и нефропатологии. В других же подчеркивается, что такое осложнение является одним из наиболее распространенных и закономерных следствий гнойного пиелонефрита (инфекционное воспаление почечных фильтрующих канальцев). Известно также, что почечные абсцессы при определенных условиях легко трансформируются в жизнеугрожающие состояния и результируют летально. Однако медико-статистические данные в этом отношении недостаточны и носят преимущественно оценочный характер.
2. Причины
Непосредственной причиной образования абсцесса (любого, не только почечного) становится жизнедеятельность гноеродных микроорганизмов. Как правило, это стафило- или стрептококки, однако к настоящему времени выявлено множество случаев атипичных гнойных воспалений, вызванных самыми разными, в т.ч. условно-патогенными культурами.
Этиопатогенез (механизм развития) абсцесса почки также может быть различным. Нередко пусковым фактором становится мочекаменная болезнь или хирургическое вмешательство по данному поводу. Иногда инфекционный возбудитель заносится с током крови или лимфы из других очагов, в т.ч. весьма удаленных от почек (например, из носоглотки). К образованию абсцесса может привести слияние мелких гнойничковых очагов при пиелонефрите. Наконец, причиной абсцедирования может стать метастатическое распространение онкопроцесса – как правило, именно в этих случаях абсцессы носят множественный и двусторонний характер.
3. Симптомы и диагностика
Клиническая картина почечного абсцесса зависит от ряда факторов (общее состояние больного, функциональный статус почек, конкретная локализация гнойного очага в почке, наличие фоновой и сопутствующей патологии, препятствий в мочевыводящем тракте и др.) и потому в разных случаях может значительно варьировать. Обычно почечный абсцесс приходится дифференцировать с пиелонефритом как таковым: у пациентов повышается температура (иногда до фебрильных значений), отмечается лихорадка, озноб, тахикардия, выраженное или тяжелое общее недомогание, рвота, болевой синдром. Нередко наблюдается гной в моче, признаки печеночной и почечной недостаточности с соответствующей интоксикацией.
Диагностика, таким образом, может представлять значительные трудности в силу неспецифичности симптоматики. Первичный диагноз удается поставить верно лишь в 35-40% случаев.
Наиболее информативными методами диагностики являются осмотр, пальпация, исследование рефлексов и значимых признаков (например, симптом Пастернацкого), лабораторные анализы крови и мочи, а также инструментальные методы – прежде всего, контрастная рентгенография (обзорная и экскреторная урография), УЗИ и КТ.
4. Лечение
Развитие ситуации в случае почечного абсцесса является малопредсказуемым; прогноз, как и прочие аспекты, зависит от сочетания конкретных условий и факторов. Так, в одних случаях спонтанный разрыв гнойной капсулы приводит к излиянию содержимого в почечную лоханку и заканчивается, по сути, без патологических последствий, в других – тот же разрыв результирует перитонитом, сепсисом и быстрым летальным исходом.
В целом, абсцесс почки создает однозначные и абсолютные показания для хирургического вмешательства, причем неотложного или, в зависимости от ситуации, экстренного. Методика определяется зачастую уже в операционной, по мере прояснения состояния мочевыводящей системы.
Альтернативным подходом служит чрескожная пункционная эвакуация содержимого абсцесса с последующей установкой дренажа, антисептическим промыванием и мощной антибиотической терапией. Однако, при всех преимуществах этой малоинвазивной техники, на ее подготовку и осуществление зачастую просто не остается времени.
Консервативная терапия неэффективна; более того, такой подход является смертельным риском: есть статистические данные о том, что при неправильной диагностике и/или попытке справиться с почечным абсцессом выжидательно-медикаментозными методами летальность достигает 75%.
Поэтому чрезвычайно важной профилактической мерой является терапевтический контроль и мониторинг в случае хронического пиелонефрита, своевременное лечение обострений, санация всех очагов хронической инфекции в организме, а в случае ухудшения состояния – немедленное обращение за специализированной помощью. При своевременной адекватной операции прогноз благоприятен.
Инфекция мочевых путей в пожилом возрасте (старше 65 лет) и ее коррекция в амбулаторной практике
Инфекция мочевыводящих путей (ИМП) — инфекционно-воспалительный процесс в мочевыводящих путях (мочеточники, мочевой пузырь, уретра) без вовлечения в патологический процесс паренхимы почек.
Инфекции мочевой системы широко распространены в пожилом возрасте. Этому способствует ряд факторов: изменение нормальных анатомо-физиологических особенностей органов малого таза (пролапс тазовых органов), несостоятельность эпителия мочевыводящих путей, уменьшение образования слизи, ослабление местного иммунитета, нарушения микроциркуляции, увеличение загрязнения в области уретры в результате недержания мочи, недержания кала, старческого слабоумия (несоблюдение правил личной гигиены).
Частота встречаемости ИМП у пожилых людей значительно выше, чем у молодых. По крайней мере, 20% женщин и 10% мужчин старше 65 лет имеют мочевую инфекцию. В сравнении с молодыми людьми, среди которых наличие мочевой инфекции в 30 раз чаще встречается у женщин, у пожилых людей соотношение встречаемости заболевания женщина/мужчина снижается до уровня 2:1.
Наиболее частым возбудителем мочевых инфекций является кишечная палочка, реже встречаются другие грамотрицательные микроорганизмы, а также стафилококки и энтерококки. В ряде случаев ИМП обусловлены хламидиями, уреаплазмой, а также грибковой флорой.
Примерно у 20% больных наблюдаются микробные ассоциации, частое сочетание — кишечная палочка и энтерококк. В течение болезни может наблюдаться смена возбудителя инфекционного процесса, в результате появляются полирезистентные формы микроорганизмов. Это особенно опасно при бесконтрольном и бессистемном применении антибактериальных препаратов. Следует отметить, что собственная мочевая флора, присутствующая и в норме в мочевыводящих путях, при поступлении в стационар очень быстро (за двое-трое суток) замещается на внутрибольничные резистентные штаммы. Поэтому инфекции, развивающиеся в стационаре, оказываются куда более тяжелыми, чем развивающиеся в домашних условиях.
Помимо «обычной» бактериальной флоры, ИМП нередко вызываются протопластами и L-формами бактерий.
Уропатогенными свойствами обладают микробы с наличием на клеточной мембране р-фимбрий, способствующих лучшей адгезии микроорганизма на эпителии мочевыводящего тракта с последующим восхождением по нему. Некоторые микробы обладают гемолизирующими свойствами, снижающими эффективность иммунной защиты, а также способностью расщеплять мочевину, вызывая ощелачивание мочи и риск формирования конкрементов.
Для возникновения ИМП необходимы предрасполагающие факторы со стороны макроорганизма и наличие микробного агента.
Клинические проявления ИМП варьируют от тяжелого воспалительного до бессимптомного течения. Наиболее часто пациенты жалуются на болезненность и чувство жжения в уретре, учащенное, болезненное мочеиспускание (в начале акта мочеиспускания), иррадиацию боли в промежность, выделения из уретры (слизисто-гнойные или кровянистые). При лабораторном исследовании наблюдаются: изменения в общем анализе крови (ускорение СОЭ, воспалительный бактериальный сдвиг в лейкоцитарной формуле), в общем анализе мочи (слизь, умеренное количество белка, лейкоциты), в биохимическом анализе крови отмечается повышение титра С-реактивного протеина, имеется наклонность к гиперкоагуляции крови. У части больных обнаруживаются нарушения функциональных показателей клубочкового и канальцевого аппарата. При цистоскопии находят изменения на слизистой мочевого пузыря. Кардинальным признаком инфекции мочевой системы считается бактериурия свыше 105 микробных тел в 1 мл мочи, собранной из средней части струи при свободном утреннем мочеиспускании, или любая степень бактериурии в моче, полученной при надлобковой пункции.
При острых ИМП и обострениях хронических главным принципом лечения является незамедлительность антимикробной терапии во избежание повреждающего действия микробного воспаления на почки. Поэтому стартовый препарат выбирается, как правило, эмпирически, на основе знаний этиологической характеристики вероятных возбудителей и их потенциальной чувствительности к данному препарату, а также исходя из опыта предшествовавшего лечения, клинической симптоматики, возраста больного, доступности лекарственных средств, с учетом возможных побочных действий. При отсутствии клинического эффекта через 3 дня эмпирической терапии проводится ее коррекция со сменой антибиотика, учитывая данные посева мочи. При легком течении ИМП обычно используются пероральные формы антимикробных препаратов. При тяжелом течении рекомендуется «ступенчатая» терапия, которая предусматривает использование в течение первых 3–5 дней парентеральных препаратов с последующей их сменой по мере купирования воспалительного процесса на пероральные препараты. Среднетяжелые и тяжелые формы ИМП рекомендуется лечить в условиях стационара.
Пенициллины
Для эмпирической терапии ИМП в настоящее время рекомендуется применение «защищенных» пенициллинов на основе амоксициллина с клавулановой кислотой (Амоксициллин, Аугментин, Амоксиклав), поскольку к ним сохраняется высокая чувствительность Escherichia сoli мочи (96–97%). У больных с незначительным снижением скорости клубочковой фильтрации (СКФ) дозы «защищенных» пенициллинов могут не подвергаться корректировке. При снижении СКФ менее 50 мл/мин (по формуле Кокрофта) дозы этих препаратов должны быть уменьшены на 25–75%. Препараты вводятся в 2–3 приема, пероральные формы могут применяться во время еды с целью предупреждения побочных действий в виде расстройств желудочно-кишечного тракта (тошнота, рвота, диарея), которые встречаются в 0,2–1,5% случаев. Как и при любой антибактериальной терапии, возможны аллергические реакции, чаще в виде кожной сыпи.
Режим дозирования:
Амоксициллин — внутрь, по 500 мг 3 раза в сутки; максимальная суточная доза — 6 г. При снижении СКФ до 10–30 мл/мин (у пациентов с хронической болезнью почек) препарат вводят в суточной дозе 1 г, затем — по 0,5 г каждые 12 ч; при СКФ менее 10 мл/мин — 1 г, затем по 0,5 г каждые 24 ч. У больных в состоянии анурии суточная доза не должна превышать 2 г. Больным, находящимся на гемодиализе, назначают дополнительно 2 г препарата: 0,5 г во время сеанса гемодиализа и 0,5 г после его окончания.
Аугментин — внутрь, по 500 мг 3 раза в сутки. При нарушении функции почек проводят коррекцию режима дозирования в зависимости от СКФ.?При СКФ больше 30 мл/мин коррекция дозы не требуется, при СКФ 10–30 мл/мин — 25 мг/кг 2 раза в сутки, при СКФ менее 10 мл/мин — 20 мг/кг 1 раз в сутки.
При проведении гемодиализа Аугментин применяют из расчета 25 мг/кг 1 раз/сут и дополнительно 12,5 мг/кг в конце диализа, затем 25 мг/кг/сут, поскольку суточная концентрация амоксициллина и клавулановой кислоты снижается.
Нельзя назначать Аугментин более 14 дней без оценки целесообразности продолжения терапии.
Амоксиклав — внутрь, по 375 или 625 мг (в зависимости от тяжести инфекции) 3 раза в сутки.
Максимальная суточная доза — 6 г. При почечной недостаточности необходимо уменьшение дозы или увеличение интервала между приемами (при СКФ 10–30 мл/мин интервал между приемами — 12 ч, менее 10 мл/мин — 24 ч).
Цефалоспорины
Основным механизмом действия цефалоспоринов, как и пенициллинов, является нарушение синтеза клеточной стенки бактерий за счет угнетения активности фермента транспептидазы. По данным АРМИДа, цефалоспорины III–IV поколения обладают высокой активностью в отношении E. coli. Резистентность последней не превышала 3,9%, причем не было выявлено резистентных штаммов к цефтазидиму и цефтибутену (III поколение), а к цефепиму (IV поколение) она составляла всего 0,9%. Цефтазидим, цефтибутен и цефепим были наиболее активными цефалоспоринами в отношении Klebsiella pneumoniae и Proteus spp. Наиболее активными в отношении Enterobacter spp. обладает цефепим. Резистентность к нему бактерий в 2–3 раза ниже, чем к другам цефалоспоринам. В отношении Pseudomonas aeruginosa наиболее активными цефалоспоринами были цефтазидим и цефепим.
Из пероральных препаратов наиболее высокая активность отмечалась у цефтибутена, превосходящая некоторые парентеральные цефалоспорины в отношении ряда грамотрицательных возбудителей.
Однако следует учитывать, что цефалоспорины, в отличие от амоксициллина/клавуланата, не действуют на энтерококки, которые являются возбудителями внебольничных форм ИМП.
Цефтазидим — внутрь, по 1–2 г каждые 8 ч или по 2 г каждые 12 ч; в тяжелых случаях — 6 г/сут. При нетяжелых инфекциях и ИМП — 0,5–1 г 2 раза в сутки. На фоне дисфункции почек (в зависимости от тяжести поражения) — 1 г через 12 или 24 ч либо 0,5 г каждые 24–48 ч.
Цефтибутен — внутрь, разовая доза для взрослых составляет 200–400 мг каждые 8 часов. Взрослым пациентам с почечной недостаточностью требуется коррекция дозы: при CКФ 49–30 мл/мин 200 мг в сутки или 400 мг через 48 ч; 29–5 мл/мин — 100 мг/сут или 400 мг через 96 ч. Пациентам, находящимся на гемодиализе (2–3 процедуры в неделю), назначают 400 мг или 9 мг/кг в конце каждого диализа.
Цефепим — внутрь, при нормальной функции почек — 0,5–1 г (при тяжелых инфекциях до 2 г) 2–3 раза в день. Курс лечения 7–10 дней и более. При нарушении функции почек дозу корректируют в зависимости от клиренса креатинина. Пациентам, находящимся на диализе, после каждого сеанса необходимо вводить повторную дозу, равную исходной.
При лечении пожилых пациентов цефалоспоринами необходимо контролировать функцию почек, вычисляя скорость клубочковой фильтрации, для предупреждения осложнений со стороны ЦНС (энцефалопатия, полинейропатия).
Макролиды
Для клинической практики максимальный интерес представляет активность макролидов в отношении грамположительных кокков и внутриклеточных возбудителей (кампилобактерий, микоплазм, легионелл, хламидий). Группа макролидов считается наименее токсичными антибиотиками.
Механизм антибактериального действия макролидов связан с нарушением синтеза белка рибосомами микробной клетки, в результате чего формируется выраженный бактериостатический эффект. В высоких концентрациях макролиды способны оказывать и бактерицидное действие в отношении бета-гамолитического стрептококка группы А, пневмококка, возбудителей коклюша и дифтерии. Макролиды обладают умеренной противовоспалительной и иммуномодулирующей активностью.
Рокситромицин, кларитромицин, азитромицин, джозамицин оказывают выраженный бактериостатический (при больших концентрациях и бактерицидный) эффект на Streptococcus spp., Staphylococcus spp., Bacillus anthracis, Corynebacterium diphtheriae, Haemophilus influenza, Shigella spp. Bordetella pertussis, Legionella spp., Chlamydia trachomatis, Mycoplasma spp., Ureaplasma urealyticum, Treponema pallidum, Borrelia burgdorferi.
Рокситромицин — внутрь, 300 мг/сут в 1–2 приема. Длительность курса зависит от показаний к применению, тяжести инфекционного процесса и активности возбудителя (от 5–12 дней). При нарушении функции печени и почек может потребоваться снижение дозы. При тяжелой печеночной недостаточности — 150 мг 1 раз в сутки.
Кларитромицин — внутрь. Режим дозирования и продолжительность курса лечения определяются индивидуально с учетом показаний, тяжести течения инфекции, чувствительности возбудителя. По 250–500 мг 2 раза в сутки; курс лечения — 6–14 дней. У больных с почечной недостаточностью (при СКФ менее 30 мл/мин или концентрации сывороточного креатинина более 3,3 мг/100 мл) дозу следует снижать в 2 раза. Максимальная длительность лечения у пациентов этой группы — не более 14 дней.
Азитромицин — внутрь (за 1 ч до или через 2 ч после еды), принимают 1 раз в сутки 1 г однократно.
Сульфаниламиды
Сульфаниламидные препараты — группа химиотерапевтических средств широкого противомикробного спектра действия. Сульфаниламидные препараты — производные амида сульфаниловой кислоты. В основе механизма антибактериального действия сульфаниламидных препаратов лежит блокада синтеза фолиевой кислоты в бактериях с последующим нарушением образования нуклеотидов, подавлением жизнедеятельности и размножения микроорганизмов.
Бисептол (Ко-тримоксазол) — комбинированный противомикробный препарат широкого спектра действия, в состав которого входят: сульфаниламид — сульфаметоксазол и производное диаминопиримидина — триметоприм.
Блокируя разные этапы биосинтеза фолиевой кислоты в микробной клетке, оба компонента препарата — триметоприм и сульфаметоксазол — не просто потенцируют бактериостатические эффекты друг друга, а приводят к появлению бактерицидного действия Бисептола.
Бисептол активен в отношении многих грамположительных и грамотрицательных микроорганизмов, являющихся основными этиологическими агентами при инфекциях мочевой системы: Staphylococcus spp., Streptococcus spp., Listeria monocytogenes, Neisseria gonorrhoeae, E. coli, Shigella spp., Salmonella spp., Yersinia spp., Klebsiella spp., а также против простейших Toxoplasma gondii, Pneumocystis carinii.
Применение рекомендуемых доз и продолжительность курса терапии Ко-тримоксазола (Бисептола) редко сопровождается серьезными осложнениями. Все же, в связи с биотрансформацией сульфаметоксазола в печени и последующей элиминацией через почки, возможно образование в ренальных канальцах кристаллов его ацетилированных метаболитов, которые нарушают функционирование тубулярных отделов нефрона и, в тяжелых случаях, могут привести к развитию интерстициального нефрита. Обильное щелочное питье предупреждает данные осложнения. При терапии Бисептолом должно обязательно контролироваться количество потребляемой жидкости. У пациентов с нарушениями функции почек, при которых клиренс эндогенного креатинина снижается до 30 мл/мин и ниже, должна использоваться половина возрастной нормы.
При тяжелом течении инфекций — по 480 мг 3 раза в сутки, при хронических инфекциях поддерживающая доза — 480 мг 2 раза в сутки. Минимальная длительность лечения — 4 дня; после исчезновения симптомов терапию продолжают в течение 2 дней. При хронических инфекциях курс лечения более длительный. Для профилактики рецидивов хронических ИМП — 480 мг 1 раз в сутки на ночь. Продолжительность лечения — 3–12 мес. При почечной недостаточности доза зависит от величины СКФ: при СКФ свыше 25 мл/мин — стандартная доза; при 15–25 мл/мин — стандартная доза в течение 3 дней, затем половину стандартной дозы. При СКФ менее 15 мл/мин назначают половину стандартной дозы только на фоне гемодиализа.
Нитрофураны
В течение многих лет препаратами выбора при микробно-воспалительных заболеваниях почек в амбулаторных условиях являются нитрофурановые препараты. Они эффективны в отношении грамположительных и грамотрицательных микробов. По данным АРМИДа, нитрофурантоин обладает высокой активностью в отношении E. coli (резистентность — 2,1%). Медленное развитие резистентности к нитрофуранам микробной флоры, малая токсичность сделали их незаменимыми для инфекции мочевой системы. Вследствие низких концентраций в паренхиме почек, нитрофурантоин используется только при остром цистите или вторичном пиелонефрите на фоне аномалий развития мочевой системы для предупреждения реинфицирования. Нитрофураны являются ингибиторами биосинтеза нуклеиновых кислот, акцепторами кислорода.
Нитрофурантоин (Фурадонин) ингибирует синтез ДНК и РНК, протеинов, препятствует нормальному образованию цитомембран, тормозит анаэробный метаболизм.
Фуразидин (Фурагин) обладает бактериостатическим действием, блокирует ферментные системы микроорганизмов.
В Институте органического синтеза АН Латвии на основе калиевой соли фуразидина в сочетании с магния карбонатом в соотношении 1:1 была разработана оптимизированная лекарственная форма Фурагина для перорального применения под торговым названием «Фурамаг». Магния карбонат препятствует превращению калиевой соли фуразидина в кислой среде желудка в фуразидин и обеспечивают в тонкой кишке более полное всасывание препарата в виде хорошо растворимой калиевой соли. Резистентность микроорганизмов к Фурамагу развивается крайне медленно, а бактериостатический эффект в 2 раза выше, чем у растворимого Фурагина. Фурамаг, в отличие от других антимикробных средств, не угнетает, а наоборот, стимулирует иммунную систему организма за счет активации системы комплемента и фагоцитарной активности лейкоцитов. Фурамаг обладает широким спектром действия, активен по отношению к грамотрицательной и грамположительной флоре, воздействует на стафилококки, Enterobacter aerogenes, Citrobacter spp., Proteus mirabilis, а наибольшую активность проявляет против E. coli. В отличие от других нитрофуранов, Фурамаг малотоксичен, даже аллергические реакции в виде кожной сыпи отмечаются крайне редко. Препарат рекомендуется принимать после еды, запивая большим количеством жидкости. При длительном использовании Фурамага желательно назначать витамины группы В. Назначается препарат в следующих дозах: для лиц пожилого возраста (старше 65 лет) по 0,05 г 3 раза в день курсом от 7 до 14 дней.
Учитывая изменение нормальных анатомо-физиологических особенностей органов малого таза, несостоятельность эпителия мочевыводящих путей, уменьшение образования слизи, ослабление местного иммунитета, увеличение загрязнения в области уретры, антибактериальную терапию у пожилых людей необходимо назначать, консультируясь с врачом-гинекологом или урологом.
При выборе оптимального антибактериального средства у больных пожилого возраста в первую очередь следует учитывать следующие факторы:
Длительность антимикробной терапии
Длительность антимикробной терапии инфекций мочевой системы должна быть оптимальной, до полного подавления активности возбудителя. Многочисленными исследованиями доказано, что длительность антимикробной терапии у лиц старше 65 лет с ИМП не должна быть меньше 7 дней. Оптимальная продолжительность начального курса лечения ИМП, если не исключен пиелонефрит, составляет 10–14 дней. Наличие аномалий развития органов мочевой системы, пузырно-мочеточниковый рефлюкс, уретроцеле и др. определяют более длительные сроки непрерывной антибактериальной терапии (до 4 недель и более). Короткий курс лечения показан пациентам, имеющим локальную симптоматику ИМП.
Эффективность антибактериальной терапии
Признаками эффективности антибактериальной терапии у пожилых пациентов с ИМП в активной фазе являются следующие:
При отсутствии клинического улучшения в течение 48 часов от начала лечения рекомендуется:
Антибактериальную терапию необходимо проводить в комбинации с препаратами, усиливающими местный иммунитет (Полиоксидоний, Виферон). Отличительной особенностью этих препаратов служит способность их воздействовать на иммунную систему в зависимости от ее состояния у конкретного пациента, т.?е. повышение исходно сниженных или понижение исходно повышенных показателей, что делает возможным назначение препарата без предварительного иммунологического исследования. Применение Полиоксидония в комплексной терапии позволяет повысить эффективность и сократить продолжительность лечения, значительно уменьшить использование антибиотиков, глюкокортикостероидов, удлинить срок ремиссии. Использовать Виферон и Полиоксидоний рекомендуется в виде суппозиторий.
Во время лечения необходимо проводить следующие исследования:
Фитотерапия при инфекциях мочевых путей
Пролит
Пролит — это комплекс из лекарственных трав, обладающих высокой биологической активностью по отношению к мочевыводящей системе человека.
Лекарственные травы, входящие в состав Пролита:
Пролит рекомендован в качестве БАД к пище — как источник органических кислот, дубильных веществ, калия. Способствует улучшению функционального состояния мочевыводящей системы и положительно влияет на состояние обмена веществ у людей, страдающих мочекаменной болезнью.
Препарат Пролит имеет две формы выпуска. Пролит пилюли № 100 удобен для подбора меньшей дозировки препарата, рекомендован на начальных этапах терапии МКБ, для профилактики, при назначении пожилым пациентам. Пролит Супер капсулы № 60 — это улучшенная формула препарата, в составе которой использованы более концентрированные экстракты лекарственных трав.
Бруснивер
Применяют при лечении острых и хронических заболеваний мочеполовой области и кишечника.
Бруснивер комбинированное средство растительного происхождения, обладающее антимикробной активностью.
В состав растительного сбора входят: брусники листья, зверобоя трава, череды трехраздельной трава, шиповника плоды.
Способ применения и дозы:
Внутрь или местно, в виде свежеприготовленного отвара или настоя. Отвар: один брикет (8 г) заливают 500 мл кипящей воды, настаивают в течение 1 ч и кипятят под крышкой на слабом огне в течение 15 мин, охлаждают при комнатной температуре в течение 45 мин. Настой: один брикет заливают в термосе 500 мл кипящей воды и настаивают не менее 2 ч. Полученное этими способами водное извлечение процеживают и применяют в теплом неразбавленном (внутрь, микроклизмы) или разбавленном в 2 раза (орошения, спринцевания, ванночки, примочки) виде. Внутрь назначают в дозах 1/4–1/3 стакана 3–4 раза в сутки. Наружно применяют в теплом виде. При этом для орошений, спринцеваний, ванночек отвар или настой разбавляют в 2–4 раза, для микроклизм используют по 25–50 мл неразбавленного теплого отвара (настоя).
ЦистоТранзит
ЦистоТранзит концентрат напитка — для очищения и улучшения функционального состояния почек и мочевыводящих путей.
ЦистоТранзит содержит биологически активные вещества, которые:
Растительные компоненты БАД «ЦистоТранзит», очищая почки, улучшают их состояние, что способствует более эффективной работе почек.
В состав Цистотранзита входят: трава хвоща полевого, трава золотарника канадского, трава горца птичьего, цветки ромашки, плоды клюквы.
Богатые кремнием соединения хвоща в организме образуют защитные коллоиды, препятствующие кристаллизации минеральных компонентов и затрудняющие образование мочевых камней.
Трава золотарника канадского (золотая розга) способствует растворению камней в почках и мочевом пузыре.
Благодаря растворимым соединениям кремниевой кислоты трава горца птичьего (спорыша) препятствует образованию мочевых камней. Спорыш способствует отхождению конкрементов из почек и мочевого пузыря.
Действие ромашки обусловлено комплексом веществ, содержащихся в цветочных корзинках. Полифенольное соединение ромашки, а также кумарины оказывают умеренное спазмолитическое действие.
Клюква сохраняет питательные и витаминные свойства благодаря содержанию в ягодах бензойной кислоты, обладающей противомикробными свойствами. Пектиновые вещества клюквы легко образуют нерастворимые соединения — хелаты — с тяжелыми и радиоактивными металлами, способствуя их детоксикации и выведению из организма.
Способ применения и дозы:
1 чайную ложку (5 мл) концентрата напитка растворить в 1 стакане (250 мл) воды, принимать взрослым 4 стакана в день. Допускается дневную дозу концентрата напитка — 4 чайные ложки (20 мл) — растворить в 1 литре воды и принимать в течение дня. Продолжительность приема — 20 дней. Рекомендуется повторять прием 4 раза в год (каждый сезон).
В. В. Смирнов, доктор медицинских наук, профессор
И. С. Мавричева, кандидат медицинских наук
А. Е. Гаврилова