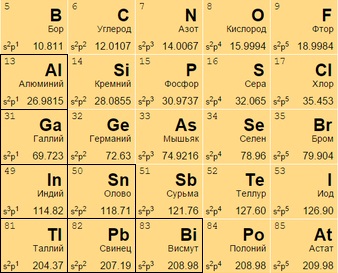
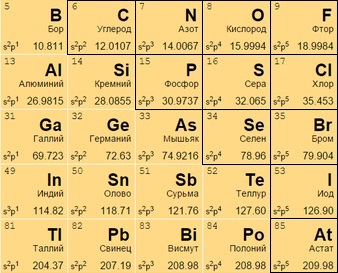
в элементы в таблице менделеева что это
Крупная, многогранная и неоднозначная группировка химических элементов порождает немало вопросов на тему того, как пользоваться таблицей Менделеева. Между тем, это самый полный и завершенный вариант сортировки атомов всех веществ этой планеты.
Область применения данной классификации – не только химия или иные точные и естественные науки. Полезна она будет и простому обывателю для тренировки памяти или приспособлению к большим и сложным формулировкам и документам. С должным усердием и прилежанием в изучении таблицы, она станет легко понимаемым справочным материалом.
Периодическая таблица Менделеева
До Дмитрия Ивановича собрать элементы в один список пытались многие умы Европы. С начала XIX века они предприняли множество попыток сопоставления веществ.
В 1869 г. свой первый план представляет и Менделеев, через 2 года – завершает доработку и издает последний вариант таблицы.
Основная идея группировки – периодичность. Расположив элементы в порядке увеличения атомной массы, он заметил, что время от времени их свойства повторяются.
Ко 2-й половине XIX века миру было известно намного меньше веществ, чем сегодня, так что химик оставил пустые места в своей таблице, предполагая открытие новых элементов, и даже сумел заранее определить свойства открытых впоследствии галлия Ga 31 и германия Ge 32.
С каждым последующим номером элемента возрастает его атомная масса, заряд ядра, уровень электронов (количество элементов и их связей), показатели активности повторяются в зависимости от периода.
Формулировка периодического закона химических элементов
Русский ученый составлял наброски таблицы около 20 лет, пытаясь подобрать верную закономерность в их размещении. Отметив концепцию цикличности, он превратил её в периодический закон, изложив свое понимание правила:
«Свойства элементов, как и формируемых ими простых и сложных веществ, предполагают периодическую зависимость от их атомного веса».
Как читать таблицу Дмитрия Ивановича Менделеева
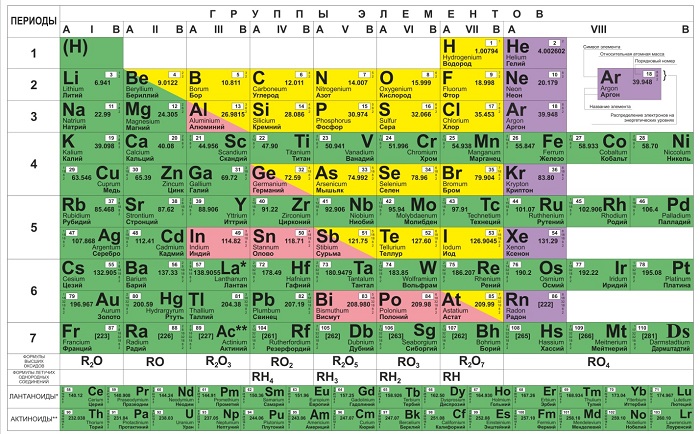
Ячейки химической базы данных разбиты в группы последовательностей по горизонтали и вертикали. Элементы имеют краткое обозначение из 1-3 букв (для формул и вычислений).
Группы
Представлены в виде столбцов таблицы. В системе старого образца их 8.
В настоящий же момент выделено 18.
Распределяют элементы в группы по однотипности: по строению атома они подобны друг другу. Также у представителей одного столбца схожая формула высшего оксида.
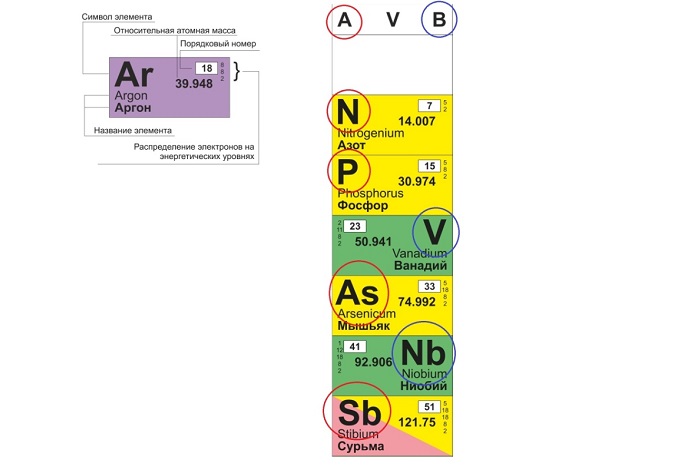
Традиционные типы столбцов делятся на подкатегории: А (с яркими признаками группы) и В (переходные металлы). Принадлежность зависит от положения символа (слева для A или справа для B):
Периоды
Горизонтальные цепочки в таблице, в которых элементы расположены по росту порядкового номера. В линии слева направо увеличиваются заряды ядра атомов.
1-й период содержит лишь гелий He 2 и водород H 1 ;
2 и 3 содержат по 8 компонентов;
4-й и 5-й содержат 18 единиц каждый;
6-й период вмещает 32 элемента;
7-й хранит 31 единицу и продолжает дополняться.
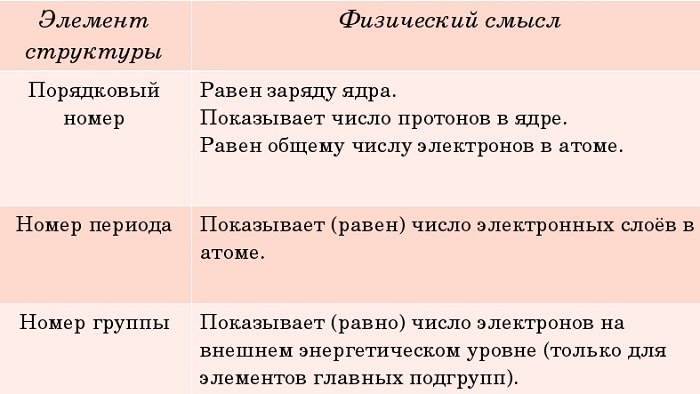
Физический смысл порядкового номера
Порядковый номер химического элемента также показывает, сколько в составе ядра атома протонов и сколько электронов вращается вокруг него.
Свойства таблицы Менделеева
Химические элементы оцениваются по множеству параметров. Один из основных – окислительно-восстановительные свойства.
С убыванием в периоде и возрастанием в группе (стремление к левому нижнему углу) проявляются металлические характеристики, обратное направление в правый верхний угол увеличивает окислительные неметаллические качества.
Элементы таблицы Менделеева
Также есть класс «металлоподобных» полупроводников с неопределенным статусом. Отдельно располагаются благородные газы, не подверженные реакциям.
Часть элементов с номером более 100 открыта сравнительно недавно, их принадлежность к каким-либо группам только предположительна.
Щелочные и щелочноземельные элементы
Щелочные металлы имеют серебристый отблеск, хорошо разламываются и режутся. Из всех размещенных в таблице металлов активнее других вступают в реакцию с молекулами других веществ, отдавая единственный свободный электрон. При контакте с водой создают гидроксиды – щелочи:
Щелочноземельные металлы более твердые и тугоплавкие, с бледно-серым оттенком. В их список входят:
Большая часть из них способна создавать щелочь, но не так легко расстается с двумя незанятыми электронами. Другие металлы они замещают, но перед щелочными бессильны и вытесняются ими из молекул.
Лантаноиды и актиноиды
Прежде получили название редкоземельных металлов из-за малого количества месторождений и трудностей в выводе чистого металла из соединений. Им соответствует 3 (III B) группа, хотя это иногда оспаривается.
В рамках семейства лантаноиды («скрытые») имеют схожую форму атома и внешние признаки, но различаются свойствами. Поодиночке почти не встречаются.
Актиноиды, помимо общих черт, радиоактивны. В природе, кроме, урана U 92, почти не встречаются, создаются искусственно.
Для удобства обе группы элементов выведены в 2 строки под общей таблицей.
Галогены и благородные газы
17 (VII A) группа состоит из галогенов:
В противоположность щелочам, эти неметаллы – самые сильные окислители, активно принимающие 8-й электрон к имеющимся семи для заполнения внешней оболочки.
Самый реактивный – фтор F 9 (способен разрушать молекулы воды):
С ростом периода свойства элементов слабеют.
Все галогены токсичны, опасны для жизни, поражают дыхательные пути.
В последней, VIII A или 18 группе, находятся инертные газы:
Их внешний уровень электронов равен 8 (полностью заполнен), отчего они не способны вступать в реакцию с другими атомами. Крайне редко создают непрочные молекулы, распадающиеся при нагревании.
Переходные металлы
Представлены всеми подгруппами в традиционной системе или занимают с 3 по 12 столбцы в современных таблицах. Большинство обладает металлическим блеском, по цвету и состоянию различаются (большинство – твердые, но есть исключения, например, жидкая ртуть).
Могут отдавать разное количество электронов с нескольких оболочек для создания вещества (например, титан Ti 22 и железо Fe 26 способны отдавать от 2 до 4, медь Cu 29 – от 1 до 2, цинк Zn 30 – только 2, золото Au 79 и серебро Ag 47 практически не вступают в реакцию).
Металлоиды
Располагаются на стыке посреди легких металлов и неметаллов, в диагонали с 13 по 17 группах. В своем большинстве – полупроводники (хуже металлов проводят электрический ток).
Часть из них – металлы внешне, неметаллы по активности, часть – наоборот. Бор B 5, к примеру, является неметаллом с полупроводниковыми качествами.
Постпереходные металлы
Они же «легкие». От переходных аналогов отличаются меньшей твердостью и весом. Имеют иные температуры плавления и кипения. Для соединений отдают электроны только с внешней оболочки. Превосходят полуметаллы по восстановительности. Легкий металл выглядит как вещество с матовым оттенком вместо блеска.
Размещаются после переходных металлов под полупроводниками (в 13-17 столбцах или IIIA – VIIA). Алюминий Al 13 носит неопределенный статус (иногда причисляется к металлоидам).
Неметаллы
Располагаются в правом верхнем углу между полуметаллами и инертными газами (начала 13-17 групп). Имеют больше электронов на внешней оболочке, стремятся присоединить к себе еще больше (в противоположность металлам), чтобы набрать полный уровень электронов.
в виде газа (кислород O 8, азот N 7);
жидкости (бром Br 35);
в твердом (углерод C 6, кремний Si 14) состоянии.
Интересное положение занимает водород H 1. Его причисляют то к 1, то к 17 группе: он, будучи неметаллом, может проявлять и окислительные, и восстановительные свойства.
Заключение
При детальном рассмотрении таблица Менделеева уже не кажется столь огромной. Главные моменты в пользовании – отследить группу и период элемента, после чего будет несложно определить его свойства и показатели.
Различные картинки в 8 или 18 столбцов не будут поводом для замешательства: семейства и категории выделяются разными цветами (полуметаллы – двухцветные). Ученики найдут решение задач, а любители головоломок получат новый способ тренировки мышления. Ячейка с нужными обозначениями найдется без особых препятствий.
ТАБЛИЦА МЕНДЕЛЕЕВА

Чтобы посмотреть все свойства конкретного химического элемента нужно перейти по ссылке нажав на символ элемента в таблице.
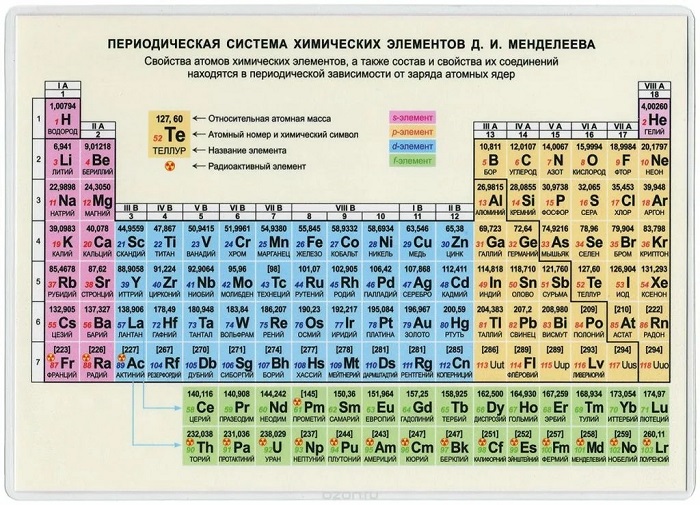
Периодическая система химических элементов Д.И. Менделеева
Расшифровка периодической системы химических элементов Д.И. Менделеева:
Число элементов в периоде – максимальная емкость соответствующего энергетического уровня:
18 элементов (5s 2 4d 10 5p 6 )
8 элементов (2s 2 2p 6 )
32 элемента (6s 2 4f 14 5d 10 6p 6 )
8 элементов (3s 2 3p 6 )
32 элемента (6s 2 4f 14 5d 10 6p 6 )
18 элементов (4s 2 3d 10 4p 6 )
Построение периодов – в начале: два s-элемента, в конце: шесть р- элементов. В четвертом и пятом периодах между ними помещается по десять d-элементов, а в шестом и седьмом к ним добавляются четырнадцать f-элементов (формы электронных орбиталей).
В периоде – свойства химических элементов различаются между собой, т.к. электронные конфигурации валентных электронов их атомов различны.
В подгруппе – свойства элементов сходны между собой, т.к. электронные конфигурации валентных электронов их атомов сходны.
Причина периодичности свойств химических элементов заключается в периодической повторяемости сходных электронных конфигураций внешних энергетических уровней.
Формы электронных орбиталей (электронные семейства)
Классификация химических элементов по электронным конфигурациям их атомов (электронные орбитали)
внешний (n) s-подуровень
внешний (n) р-подуровень
предвнешний (n–1 ) d-подуровень
(n-2)f 1–14 (n-1)d 1–10 ns 1–2
третий снаружи (n–2) f-подуровень
Графическое изображение орбиталей
 |  |  |  |
Свойства элементов таблицы Менделеева
Металлы – элементы главных подгрупп с числом валентных электронов от 1 до 3 (подгруппы IA, IIA, IIIА, кроме элемента бора), а также германий, олово, свинец, сурьма, висмут и полоний.
Неметаллы – бор и элементы главных подгрупп с числом валентных электронов от 4 до 7 (подгруппы IVA, VA, VIA, VIIA) кроме германия, олова, свинца, сурьмы, висмута и полония.
Переходные элементы – элементы побочных подгрупп (IB-VIIB); в виде простых веществ ведут себя как металлы.
Галогены – элементы подгруппы VII(a) таблицы Менделеева, реагируют со всеми простыми веществами, кроме некот. неметаллов, являются энергичными окислителями, к ним относят F, Cl, Br, I, At, Ts.
Лантанойды – 15 элементов III группы 6-го периода, металлы с атомными номерами 57–71. Все они имеют стабильные изотопы, кроме прометия.
Актинойды – 15 радиоактивных элементов III группы 7-го периода с атомными номерами 89–103.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
В периодах с увеличением порядкового номера элемента прослеживается следующая закономерность:
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения: RH4, RH3, RH2, RH. Соединения RH4 имеют нейтральный характер; RH3 – слабоосновной; RH2 – слабокислый; RH – сильнокислый характер.
История открытия периодического закона Менделеевым Д.И.
Самый важный вклад в систематизацию химических элементов внёс русский выдающийся химик Дмитрий Иванович Менделеев, автор труда «Основы химии», который в марте 1869 года представил Русскому химическому обществу (РХО) периодический закон химических элементов, изложенный в нескольких основных положениях.
В 1871 году Менделеев в итоговой статье «Периодическая законность химических элементов» дал формулировку Периодического закона: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомного веса». Тогда же Менделеев придал своей периодической таблице классический вид (короткая таблица, смотрите ниже).
В современном изложении периодический закон химических элементов звучит так: «Свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).»
Периодическая таблица элементов Менделеева длинная форма
Длинная форма таблицы Менделеева (или длиннопериодная форма) состоит из 18 групп с лева на право от щелочных металов до благородных газов. считается официальной версией с 1989 года.
Таблица Менделеева для печати в хорошем качестве скачать
Вы можете скачать таблицу Менделеева на выбор короткую или длинную форму в цветном и черно-белом цвете, для этого откройте по ссылке ниже изображение и сохраните его себе на компьютер.
____________
Источник информации:
1. Большой химический справочник / А.И.Волков, — М.: 2005.
2. Большая энциклопедия химических элементов. Периодическая таблица Менделеева / И.А.Леенсон. — Москва : 2014.
Периодический закон Д. И. Менделеева и периодическая система химических элементов
Периодический Закон Д.И. Менделеева
Периодический закон Д.И. Менделеева и периодическая система химических элементов имеет большое значение в развитии химии. Окунемся в 1871 год, когда профессор химии Д.И. Менделеев, методом многочисленных проб и ошибок, пришел к выводу, что
«… свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Периодичность изменения свойств элементов возникает вследствие периодического повторения электронной конфигурации внешнего электронного слоя с увеличением заряда ядра.
Современная формулировка периодического закона
звучит следующим образом
«свойства химических элементов (т.е. свойства и форма образуемых ими соединений) находятся в периодической зависимости от заряда ядра атомов химических элементов».
Преподавая химию, Менделеев понимал, что запоминание индивидуальных свойств каждого элемента, вызывает у студентов трудности. Он стал искать пути создания системного метода, чтобы облегчить запоминание свойств элементов. В результате появилась естественная таблица, позже она стала называться периодической.
Наша современная таблица очень похожа на менделеевскую. Рассмотрим ее подробнее.
Таблица Менделеева
Периодическая таблица Менделеева состоит из 8 групп и 7 периодов. Рассмотрим подробнее что такое период и что такое группа в периодической таблице Менделеева.
Группы в таблице Менделеева
Вертикальные столбцы таблицы называют группами.
Элементы, внутри каждой группы, обладают сходными химическими и физическими свойствами. Это объясняется тем, что элементы одной группы имеют сходные электронные конфигурации внешнего слоя, число электронов на котором равно номеру группы. При этом группа разделяется на главные и побочные подгруппы.
В Главные подгруппы входят элементы, у которых валентные электроны располагаются на внешних ns- и np- подуровнях.
В Побочные подгруппы входят элементы, у которых валентные электроны располагаются на внешнем ns- подуровне и внутреннем (n — 1) d- подуровне (или (n — 2) f- подуровне).
Все элементы в периодической таблице, в зависимости от того, на каком подуровне (s-, p-, d- или f-) находятся валентные электроны классифицируются на:
Высшая и низшая степени окисления элементов
Высшая валентность элемента и высшая степень окисления (за исключением O, F, элементов подгруппы меди и восьмой группы) равна номеру группы, в которой он находится.
Низшая степень окисления элемента равна
Номер группы — 8
Для элементов главных и побочных подгрупп одинаковыми являются формулы высших оксидов (и их гидратов).
В главных подгруппах состав водородных соединений являются одинаковыми, для элементов, находящихся в этой группе.
Твердые гидриды образуют элементы главных подгрупп I — III групп, а IV — VII групп образуют а газообразные водородные соединения. Водородные соединения типа ЭН4 – нейтральнее соединения, ЭН3 – основания, Н2Э и НЭ — кислоты.
Периоды в таблице Менделеева
Горизонтальные ряды таблицы называют периодами. Элементы в периодах отличаются между собой. Общим является то, что последние электроны находятся на одном энергетическом уровне (главное квантовое число n — одинаково).
Как определить металл или неметалл?
Если посмотреть на периодическую таблицу Менделеева и провести воображаемую черту, начинающуюся у бора и заканчивающуюся между полонием и астатом, то все металлы будут находиться слева от черты, а неметаллы главных подгрупп – справа.
Элементы, непосредственно прилегающие к этой линии будут обладать свойствами как металлов, так и неметаллов. Их называют металлоидами или полуметаллами. Это бор, кремний, германий, мышьяк, сурьма, теллур и полоний.
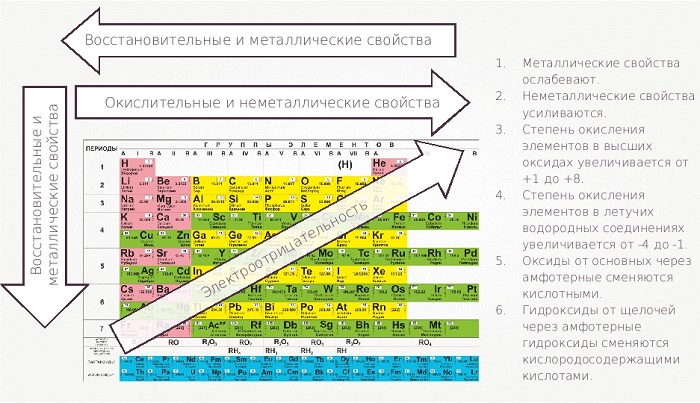
Как изменяются свойства элементов в Периодической таблице?
Правило октета
Правило октета утверждает, что все элементы стремятся приобрести или потерять электрон, чтобы иметь восьмиэлектронную конфигурацию ближайшего благородного газа. Т.к. внешние s- и p-орбитали благородных газов полностью заполнены, то они являются самыми стабильными элементами.
Согласно правилу октета, при движении по периодической таблице слева направо для отрыва электрона требуется больше энергии. Поэтому элементы с левой стороны таблицы стремятся потерять электрон, а с правой стороны – его приобрести.
Изменение энергии ионизации
Энергия ионизации – это количество энергии, необходимое для отрыва электрона от атома.
Изменение сродства к электрону
Сродство к электрону – изменение энергии при приобретении дополнительного электрона атомом вещества в газообразном состоянии.
Изменение электроотрицательности
Электроотрицательность — мера того, насколько сильно атом стремится притягивать к себе электроны связанного с ним другого атома.
Электроотрицательность увеличивается при движении в периодической таблице слева направо и снизу вверх. При этом надо помнить, что благородные газы не имеют электроотрицательности. Таким образом, самый электроотрицательный элемент – фтор.
Итак, в периодической зависимости находятся такие свойства атома, которые связанны с его электронной конфигурацией: атомный радиус, энергия ионизации, электроотрицательность.
Изменение металлических и неметаллических свойств атомов
Неметалличность атома увеличивается при движении в периодической таблице слева направо и снизу вверх.
Изменение основных и кислотных свойств оксидов и гидроксидов
О сновные свойства оксидов уменьшаются, а кислотные свойства увеличиваются при движении слева направо и снизу вверх. При этом кислотные свойства оксидов тем сильнее, чем больше степень окисления образующего его элемента
По периоду слева направо основные свойства гидроксидов ослабевают.
По главным подгруппам сверху вниз сила оснований увеличивается. При этом, если металл может образовать несколько гидроксидов, то с увеличением степени окисления металла, основные свойства гидроксидов ослабевают.
По периоду слева направо увеличивается сила кислородосодержащих кислот. При движении сверху вниз в пределах одной группы сила кислородосодержащих кислот уменьшается. При этом сила кислоты увеличивается с увеличением степени окисления образующего кислоту элемента.
По периоду слева направо увеличивается сила бескислородных кислот. При движении сверху вниз в пределах одной группы сила бескислородных кислот увеличивается.
На рисунке ниже схематично показано изменение свойств атомов химических элементов в периодах и группах периодической таблицы Менделеева
Задания и примеры по строению таблицы Менделеева, положению атомов химического элемента в ней и закономерностям изменения свойств атомов элементов в периодах и группах периодической таблицы Менделеева представлены с разделе Задачи к разделу Периодический закон Д.И. Менделеева и периодическая система химических элементов