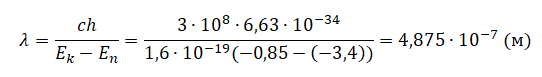в чем заключаются противоречия между постулатами бора и законами
В чем заключаются противоречия между постулатами бора и законами
§ 34. квантовые постулаты бора
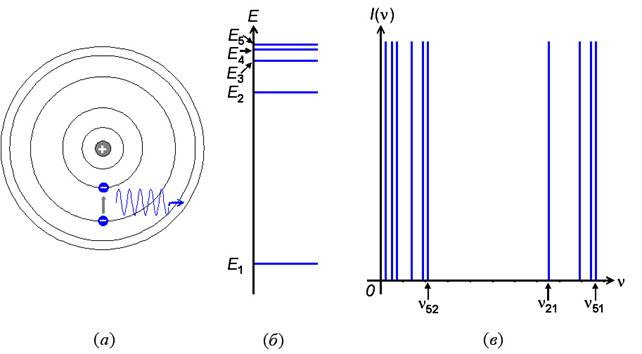
Электроны в атоме могут находиться только на разрешённых орбитах, двигаясь по которым они не излучают энергию.
Электроны, обращающиеся вокруг ядра в планетарной модели атома, движутся с ускорением. Согласно законам электродинамики (уравнениям Максвелла) заряды, движущиеся с ускорением, излучают электромагнитные волны, в результате чего их механическая энергия должна уменьшаться. Расчёты показывают, что вращающийся вокруг ядра электрон должен, теряя энергию, приблизиться к ядру и, наконец, упасть на него уже через миллионную долю секунды. В действительности атомы весьма стабильны и, не излучая энергию, могут существовать неограниченно долго. Таким образом, планетарная модель атома противоречит законам классической физики.
В 1913 г. датский физик Н. Бор предложил несколько ограничить классическую физику, когда её применяют к явлениям, происходящим внутри атома. Чтобы сделать устойчивой планетарную модель атома Бор ввёл два допущения (постулата), которые впоследствии были названы постулатами Бора (рис. 34а):
Оба постулата Бора противоречат законам классической физики. Постулат 1 утверждает, что энергия стационарных состояний атома не может иметь любые значения, что противоречит классической механике. Противоречит этот постулат и классической электродинамике, так как согласно ему электрон, обладая центростремительным ускорением при вращении вокруг ядра, не излучает электромагнитных волн. Постулат 2 тоже противоречит классической электродинамике, так как согласно уравнениям Максвелла частота излучения электрона зависит от характеристик его движения, а не только от изменения энергии атома.
Вопросы для повторения:
· Какие состояния атома называют стационарными и возбуждёнными?
· Сформулируйте постулаты Бора?
· Почему постулаты Бора противоречат законам классической физики?
· Как с помощью постулатов Бора объяснить линейчатые спектры атомов?
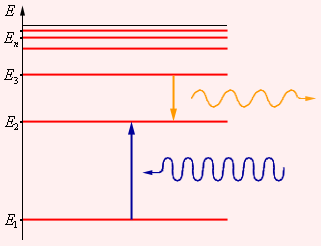
Рис. 34. (а) – схематическое изображение разрешённых орбит электрона, соответствующих стационарным состояниям атома, и кванта излучения при переходе с одной такой орбиты на другую; (б) – схематическое изображение нескольких стационарных состояний атома, характеризуемых его энергией; (в) – спектр излучения атома, стационарные состояния которого показаны на (б).
Модель Бора: описание теории, противоречия модели
Долгое время строение атома было дискуссионной темой среди физиков, пока не появилась созданная датским ученым Нильсом Бором модель. Он не был первым, кто попытался описать движение субатомных частиц, но именно его наработки позволили создать непротиворечивую теорию с возможностью прогнозирования местонахождения элементарный частицы в тот или иной момент времени.
Жизненный путь
Нильс Бор родился 7 октября 1885 года в Копенгагене и умер там же 18 ноября 1962 года. Он считается одним из величайших физиков и неудивительно: именно ему удалось построить непротиворечивую модель водородоподобных атомов. По легенде он увидел во сне, как вокруг некоего светящегося разреженного центра вращалось что-то вроде планет. Затем эта система резко уменьшилась до микроскопических размеров.

С тех пор Бор упорно искал способ воплотить сон в формулах и таблицах. Тщательно изучая современную литературу по физике, экспериментируя в лаборатории и размышляя, он смог достичь своей цели. Обнародовать результаты ему не помешала даже врожденная застенчивость: он стеснялся выступать перед большой аудиторией, начинал путаться, и слушатели ничего не понимали из объяснений ученого.
Предшественники
До Бора ученые пытались создать модель атома, основанную на постулатах классической физики. Наиболее успешная попытка принадлежала Эрнесту Резерфорду. В результате многочисленных опытов он пришел к выводу о существовании массивного атомного ядра, вокруг которого двигаются по орбитам электроны. Поскольку графически такая модель была похожа на строение Солнечной системы, за ней укрепилось название планетарной.
Но в ней имелся существенный недостаток: атом, отвечающий резерфордовским уравнениям, оказывался нестабильным. Рано или поздно электроны, двигавшиеся с ускорением по орбитам вокруг ядра, должны были упасть на ядро, а их энергия тратилась бы на электромагнитное излучение. Для Бора модель Резерфорда стала отправным пунктом в построении собственной теории.
Первый постулат Бора
Главным новшеством Бора стал отказ от использования классической ньютоновской физики в построении теории атома. Изучив полученные в лаборатории данные, он пришел к выводу, что в мире элементарных частиц не работает такой важный закон электродинамики, как равноускоренное движение без волнового излучения.
Итогом его размышлений стал закон, который звучит так: атомная система стабильна, только если она находится в одном из возможных стационарных (квантовых) состояниях, каждому из которых соответствует определенная энергия. Смысл этого закона, иначе называемого постулатом квантовых состояний, состоит в признании отсутствия электромагнитного излучения, когда атом находится в таком состоянии. Также следствием первого постулата является признание наличия в атоме энергетических уровней.
Правило частот
Однако было очевидно, что атом не может все время находиться в одном и том же квантовом состоянии, поскольку стабильность отрицает любое взаимодействие, а значит, не было бы ни Вселенной, ни движения в ней. Кажущееся противоречие разрешил второй постулат модели строения атома Бора, известный как правило частот. Атом способен перейти из одного квантового состояния в другое с соответствующим изменением энергии, излучая или поглощая при этом квант, энергия которого равна разности энергий стационарных состояний.
Второй постулат тоже противоречит классической электродинамике. Согласно теории Максвелла, характер движения электрона не может воздействовать на частоту его излучения.
Спектр атома
Квантовая модель Бора стала возможной благодаря тщательному изучению спектра атома. Долгое время ученых смущало, что вместо ожидаемой непрерывной цветовой области, получаемой при изучении спектров небесных светил, спектрограмма атома была прерывистой. Линии яркого цвета не переходили друг в друга, а разделялись внушительными темными участками.
Теория перехода электрона из одного квантового состояния в другое объясняла эту странность. Когда электрон переходил с одного энергетического уровня на другой, где от него требовалась меньшая энергия, он испускал квант, что отражалось на спектрограмме. Теория Бора сразу же продемонстрировала способность к прогнозированию дальнейших изменений в спектрах простых атомов вроде водорода.
Недостатки
Теория Бора не до конца порывала с классической физикой. Она по-прежнему сохраняла идею орбитального движения электронов в электромагнитном поле ядра. Идея о квантовании при переходе из одного стационарного состояния в другое удачно дополняла планетарную модель, но все же не разрешала всех противоречий.
Хотя в свете модели Бора электрон не мог перейти в движение по спирали и упасть на ядро, непрерывно излучая энергию, оставалось непонятным, почему он не мог последовательно подниматься на более высокие энергетические уровни. В этом случае все электроны рано или поздно оказались бы в наинизшем энергетическом состоянии, что привело бы разрушению атома. Другой проблемой стали аномалии в атомных спектрах, которые теория не объясняла. Еще в 1896 году Питер Зееман провел любопытный эксперимент. Он поместил атомный газ в магнитное поле и снял спектрограмму. Оказалось, что некоторые спектральные линии расщепились на несколько. Такой эффект в теории Бора объяснения не получал.
Построение модели атома водорода по Бору
Несмотря на все недостатки своей теории, Нильс Бор смог построить соответствующую действительности модель атома водорода. При этом он использовал правило частот и законы классической механики. Расчеты Бора по определению возможных радиусов орбит электрона и вычислению энергии квантовых состояний оказались достаточно точными и подтвердились экспериментально. Частоты излучений и поглощений электромагнитных волн соответствовали расположению темных промежутков на спектрограммах.
Таким образом, на примере атома водорода было доказано, что каждый атом представляет собой квантовую систему с дискретными энергетическими уровнями. Кроме того, ученый смог найти способ совместить классическую физику и свои постулаты с помощью принципа соответствия. Он гласит, что квантовая механика включает в себя законы ньютоновской физики. При определенных условиях (например, если квантовое число было достаточно большим), квантовая и классическая механика сближаются. Это доказывалось тем, что при увеличении квантового числа протяженность темных промежутков на спектре уменьшалась вплоть до полного исчезновения, как это и ожидалось в свете ньютоновских представлений.
Значение
Введение принципа соответствия стало важным промежуточным этапом на пути к признанию существования особой квантовой механики. Модель атома Бора стала для многих отправной точкой в конструировании более точных теорий движения субатомных частиц. Нильс Бор не смог подобрать точной физической интерпретации правилу квантования, но он и не мог этого сделать, поскольку лишь с течением времени были обнаружены волновые свойства элементарных частиц. Луи де Бройль, дополнив теорию Бора новыми открытиями, доказал, что каждая орбита, по которой движется электрон, представляет собой волну, распространяющуюся от ядра. С этой точки зрения стационарным состоянием атома стали считать такое, что образуется в случае, когда волна, сделав полный оборот вокруг ядра, повторялась.
§ 43. Противоречия планетарной модели атома. Постулаты Бора
Противоречия планетарной модели атома
1. Модель строения атома, предложенная Резерфордом, оказывается в противоречии с основными законами классической физики. Она не могла объяснить устойчивость атомов.
В действительности же атомы достаточно устойчивы и не излучают энергию в невозбуждённом состоянии.
Постулаты Бора
2. Выход из создавшегося положения был найден Бором. В 1913 г. он предложил идею, основанную на квантовых представлениях, которая позволила понять и объяснить стабильность атома. В виде постулатов Бор сформулировал положения новой теории, которые налагали определённые ограничения на классические представления о движении микрочастиц и электромагнитном излучении.
Нильс Хенрик Давид Бор (1885—1962) — датский физик-теоретик, один из основоположников современной физики, член Датского королевского общества, член многих академий и научных обществ мира, иностранный член Академии наук СССР. Внёс значительный вклад в развитие теории атомного ядра и ядерных реакций, процессов взаимодействия элементарных частиц со средой, которая явилась первой квантовой моделью атома; создал теорию во- дородоподобного атома; сформулировал важный для понимания квантовой механики принцип дополнительности, фундаментальное для ядерной физики представление о характере протекания ядерных реакций (модель составного ядра); один из создателей капельной модели ядра; совместно с Дж. Уилером развил теорию деления ядер.
Постулаты Бора гласят:
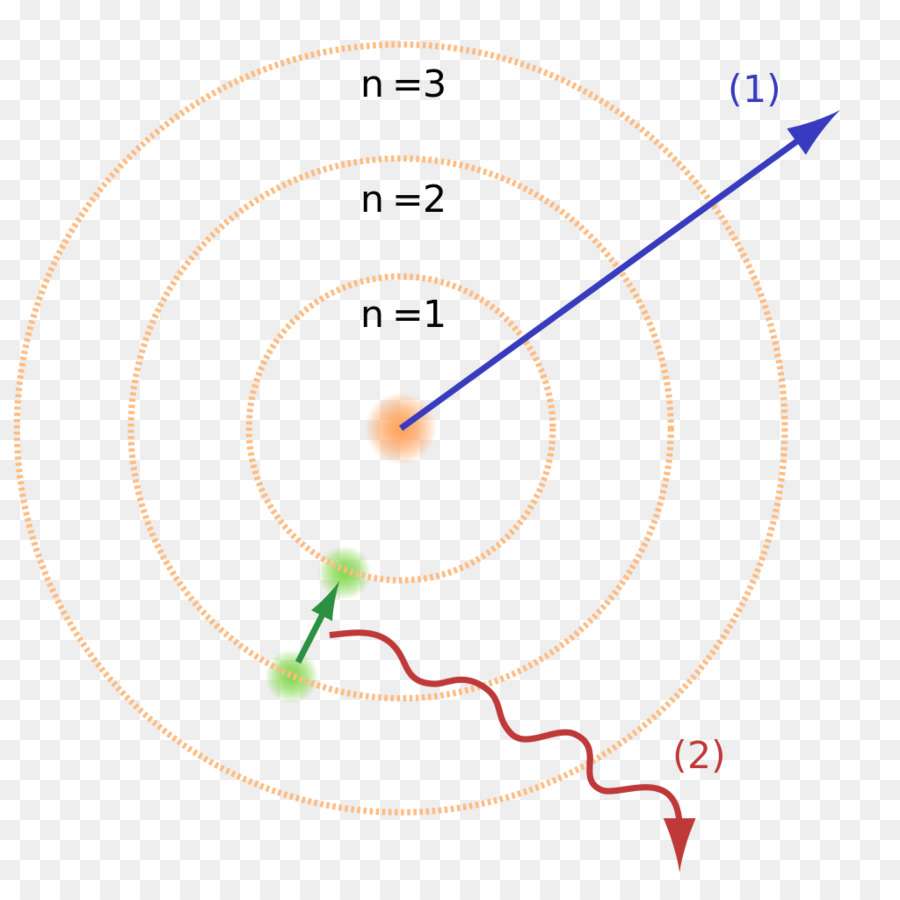
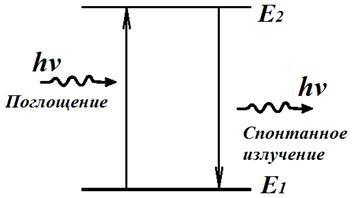
1. Атом может находиться в особых стационарных состояниях, каждому из которых соответствует определённая энергия Еn. В стационарном состоянии атом не излучает.
2. Излучение света происходит при переходе атома из стационарного состояния с большей энергией Еm в стационарное состояние с меньшей энергией Еn.
Энергия излучённого фотона равна разности энергий атома в стационарных состояниях:
В результате перехода электрона с орбиты m на орбиту n (рис. 142, а) происходит излучение кванта энергии hν. При поглощении энергии атом переходит из стационарного состояния с меньшей энергией Еn в стационарное состояние с большей энергией Еm (рис. 142, б). Энергия поглощённого фотона также равна разности энергий атома в стационарных состояниях:
Квантовые постулаты Бора
В свое время планетарная модель атома была предложена Резерфордом. Фактически, это была неудачная попытка перенести классические представления о движении тел в область явлений атомных масштабов. Планетарная модель оказалась несостоятельной, так как атом неустойчив по причине ускорения, с которым электроны якобы движутся по орбите. В таких условиях электроны должны достаточно быстро растрачивать свою энергию на электромагнитное излучение и падать на ядро.
На смену планетарной теории пришли постулаты Бора. В 1913 году выдающийся датский физик Нильс Бор на основе своих наблюдений и фактов, полученных опытным путем, установил, что большая часть представлений о строении атома не соответствовала действительности. Он же стал основоположником новой теории о строении атома.
Рассмотрим два постулата Бора подробнее.
Первый постулат Бора
В соответствии с классической механикой энергия электрона, движущегося по орбите вокруг ядра, может быть любой. В этом плане первый постулат Бора находится в явном противоречии и с планетарной моделью атома, и с классической механикой.
Второй постулат Бора
Энергия кванта при этом определяется как разность энергий двух квантовых состояний:
где h – постоянная Планка.
Постулаты Бора
теория по физике 🧲 квантовая физика
Планетарная модель атома, предложенная Резерфордом, – это попытка применения классических представлений о движении тел к явлениям атомных масштабов. Она оказалась несостоятельной. Классический атом неустойчив. Электроны, движущиеся по орбите с ускорением, должны неизбежно упасть на
Следующий шаг в развитии представлений об устройстве атома в 1913 году сделал выдающийся датский физик Н. Бор. Проанализировав всю совокупность опытных фактов, Бор пришел к выводу, что при описании поведения атомных систем следует отказаться от многих представлений классической физики. Он сформулировал постулаты, которым должна удовлетворять новая теория о строении атомов.
Квантовые постулаты Бора – предположения (утверждения), сделанные Н. Бором для того, чтобы модель строения атома Резерфорда соответствовала реальному поведению атомов водорода.
Первый постулат Бора
Первый постулат Бора также носит название постулата стационарных состояний:
Атомная система может находиться только в стационарных, или квантовых, состояниях, каждому из которых соответствует определенная энергия En. В стационарном состоянии атом не излучает электромагнитные волны.
Этот постулат находится в явном противоречии с классической механикой, согласно которой энергия движущегося электрона может быть любой. Он находится в противоречии и с электродинамикой, так как допускает возможность ускоренного движения электронов без излучения электромагнитных волн.
Согласно первому постулату Бора, атом характеризуется системой энергетических уровней, каждый из которых соответствует определенному стационарному состоянию (см. рисунок ниже). Механическая энергия электрона, движущегося по замкнутой траектории вокруг положительно заряженного
Внимание! В квантовой физике энергию принято измерять не в Джоулях, а в электрон-вольтах, обозначаемых «эВ». 1 эВ равен энергии, приобретаемой электроном при прохождении разницы потенциалов 1 В. 1 эВ = 1,6∙10 –19 Дж.
Отсюда можно выразить частоту излучения:
Частоту найдем по формуле:
Следовательно, длина волны равна:
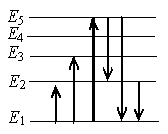
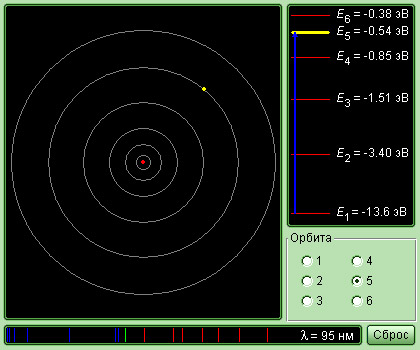
а) с уровня 1 на уровень 5
б) с уровня 5 на уровень 2
в) с уровня 5 на уровень 1
г) с уровня 2 на уровень 1
Алгоритм решения
Решение
Излучение света происходит при переходе атома из стационарного состояния с большей энергией Ek в стационарное состояние с меньшей энергией En. Энергия излученного фотона равна разности энергий стационарных состояний.
Причем чем на более высоком уровне находится электрон, тем с более высокой энергией фотон он испускает при переходе на 1 уровень. Поэтому на рисунке нам подходит переход с уровня 5 на уровень 1.
pазбирался: Алиса Никитина | обсудить разбор | оценить
В сосуде находится разреженный атомарный водород. Атом водорода в основном состоянии (Е1 = – 13,6 эВ) поглощает фотон частотой 3,7⋅10 15 Гц. С какой скоростью υ движется вдали от ядра электрон, вылетевший из атома в результате ионизации? Энергией теплового движения атомов водорода пренебречь.