в чем заключается отличие конъюгированных и субъединичных вакцин ответ
Виды вакцин
Страх перед прививками во многом вызван устаревшими представлениями о вакцинах. Конечно, общие принципы их действия остались неизменными со времен Эдварда Дженнера, который в 1796 году первым применил вакцинацию от оспы. Вот только медицина с тех пор шагнула очень далеко вперед.
Так называемые «живые» вакцины, в которых используется ослабленный вирус, применяются и в наши дни. Но это лишь одна из разновидностей средств, призванных предупредить опасные болезни. И с каждым годом – в частности, благодаря достижениям генной инженерии – арсенал врачей-иммунологов пополняется все новыми видами и даже типами вакцин.
Живые вакцины
Требуют специальных условий хранения, зато обеспечивают стойкий иммунитет к болезни после одной, как правило, вакцинации. По большей части их вводят парентерально, то есть с помощью инъекций; исключение – вакцина от полиомиелита. При всех преимуществах живых вакцин, их использование связано с некоторым риском. Всегда остается шанс, что штамм вируса окажется достаточно вирулентным и станет причиной заболевания, от которого вакцинация должна была защитить. Поэтому живые вакцины не применяют на людях с иммунодефицитом (например, носителях ВИЧ, онкологических больных).
Инактивированные вакцины
Анатоксины
Конъюгированные вакцины
Некоторые бактерии имеют антигены, которые плохо распознаются незрелой иммунной системой младенцев. В частности, это бактерии, вызывающие такие опасные заболевания, как менингиты или пневмонию. Конъюгированные вакцины призваны обойти эту проблему. В них используется микроорганизмы, хорошо распознаваемые иммунной системой ребенка и содержащие антигены, схожие с антигенами возбудителя, к примеру, менингита.
Субъединичные вакцины
Эффективны и безопасны – в них используются лишь фрагменты антигена патогенного микроорганизма, достаточные для того, чтобы обеспечить адекватный иммунный ответ организма. Могут содержать частицы самого микроба (вакцины против Streptococcus pneumoniae и против менингококка типа А). Другой вариант – рекомбинантные субъединичные вакцины, создаваемые с использованием генно-инженерной технологии. Например, вакцину от гепатита B получают путем введения части генетического материала вируса в клетки пекарских дрожжей.
Рекомбинантные векторные вакцины
ВАКЦИНОПРОФИЛАКТИКА
ВАКЦИНАЦИЯ – ЗАЛОГ ЗДОРОВОГО БУДУЩЕГО
Ежегодно в мире от инфекционных заболеваний погибают около 12 миллионов детей. Третья часть из них (4 миллиона) умирают от болезней, которые можно было предотвратить с помощью прививки. В XIX веке диагноз «корь», «дифтерия», «бешенство», «столбняк», считались смертным приговором. Начиная с XX века, благодаря достижениям в области микробиологии, вирусологии и фармакологии заболеваемость этими инфекциями сведена практически к нулю. Целью иммунизации является формирование специфического иммунитета к инфекционному заболеванию посредством искусственного создания инфекционного процесса, который в большинстве случаев протекает бессимптомно или в легкой форме (у непривитого человека течение этих болезней несет тяжелейший характер, иногда с летальным исходом).
МЕХАНИЗМ ДЕЙСТВИЯ ВАКЦИНЫ
В ответ на вакцинацию в организме возникает цепочка иммунологических реакций, подразделяющихся на три периода. Первый период (латентный, или «лаг-фаза») продолжается с момента введения вакцины до появления первых антител в крови. Длительность первого, латентного, периода варьирует от нескольких дней до 2 недель и зависит от вида вакцины, способа ее введения и особенностей иммунной системы организма. Второй период характеризуется повышением концентрации специфических антител в крови. После введения некоторых вакцин специфические антитела появляются очень быстро, содержание их в крови стремительно повышается, что позволяет использовать эти вакцинные препараты для экстренной профилактики при контакте с больными корью, полиомиелитом, эпидемическим паротитом и другими инфекциями. Второй период продолжается от 4 дней до 4 недель. Третий период наступает после достижения максимального уровня специфических антител, когда их количество начинает уменьшаться — вначале быстро, затем медленно. Такое уменьшение происходит в течение нескольких лет. При повторной встрече с антигеном (при ревакцинации или инфицировании привитого ребенка) «лаг-фаза» отсутствует, так как активируются В-клетки памяти и специфический иммунный ответ возникает быстрее и отличается большей интенсивностью.
ПОМНИТЕ, ПРИВИВКИ СПАСАЮТ ВАШЕ ЗДОРОВЬЕ И ЖИЗНЬ!
2. Все вакцины обладают определенной степенью реактогенности, которая лимитирована нормативной документацией на препараты.
3. В соответствии с Законом Российской Федерации “О лекарственных средствах”, утвержденным 22 июня 1998 г, производство лекарственных средств, к которым относятся и иммунобиологические препараты, осуществляется предприятиями-производителями лекарственных средств, имеющими лицензию на их производство”.
4. В России на 16 предприятиях производится 50 видов вакцин против 28 инфекционных заболеваний. Практически все вакцины соответствуют по основным показателям безопасности и эффективности требованиям.
Вакцинацию можно проводить следующими способами:
— накожно (скарификационная вакцинация) оптимальна при иммунизации живыми вакцинами против особо опасных инфекций (чумы, туляремии и др.). Вакцины наносят на наружную поверхность плеча, а затем сухим оспопрививочным пером делают насечки через каплю.;
ОДНОВРЕМЕННОЕ ВВЕДЕНИЕ НЕСКОЛЬКИХ ВАКЦИН
Виды вакцин
Открытие метода вакцинации дало старт новой эре борьбы с болезнями.
В состав прививочного материала входят убитые или сильно ослабленные микроорганизмы либо их компоненты (части). Они служат своеобразным муляжом, обучающим иммунную систему давать правильный ответ инфекционным атакам. Вещества, входящие в состав вакцины (прививки), не способны вызвать полноценное заболевание, но могут дать возможность иммунитету запомнить характерные признаки микробов и при встрече с настоящим возбудителем быстро его определить и уничтожить.
Производство вакцин получило массовые масштабы в начале ХХ века, после того как фармацевты научились обезвреживать токсины бактерий. Процесс ослабления потенциальных возбудителей инфекций получил название аттенуации.
Сегодня медицина располагает более, чем 100 видами вакцин от десятков инфекций.
Препараты для иммунизации по основным характеристикам делятся на три основных класса.
В последние годы появился еще один вид вакцин — молекулярные. Материалом для них становятся рекомбинантные белки или их фрагменты, синтезированные в лабораториях путем применения методов генной инженерии (рекомбининтная вакцина против вирусного гепатита В).
Схемы изготовления некоторых видов вакцин
Живые бактериальные
Схема подходит для вакцины БЦЖ, БЦЖ-М.
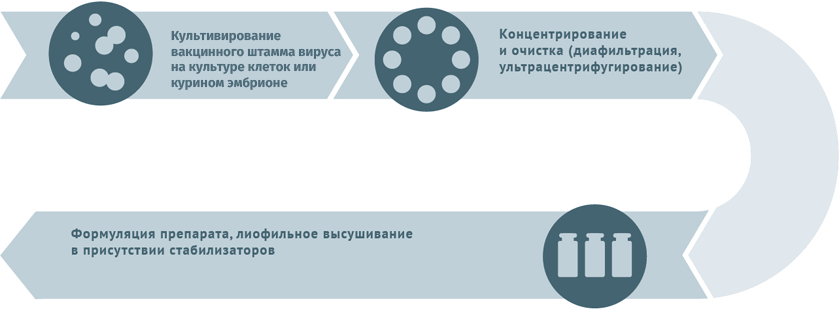
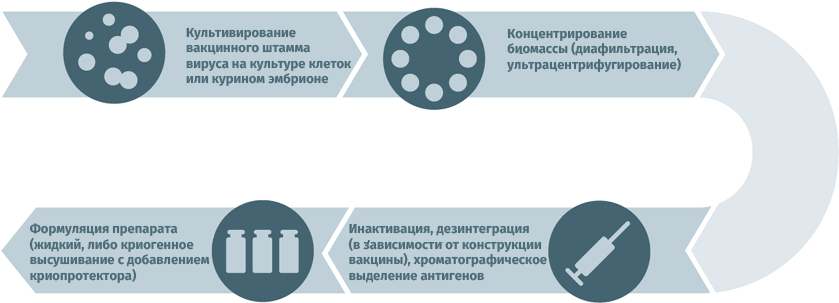
Живые противовирусные
Схема подходит для производства вакцин от гриппа, ротавируса, герпеса I и II степеней, краснухи, ветряной оспы.
Субстратами для выращивания вирусных штаммов при производстве вакцин могут становиться:
Первичный сырьевой материал очищают от клеточного дебриса в центрифугах и с помощью сложных фильтров.
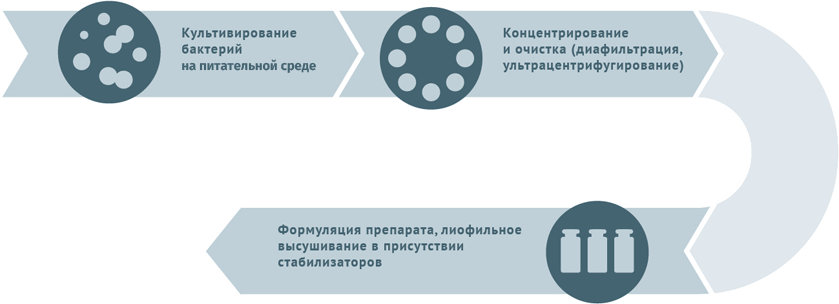
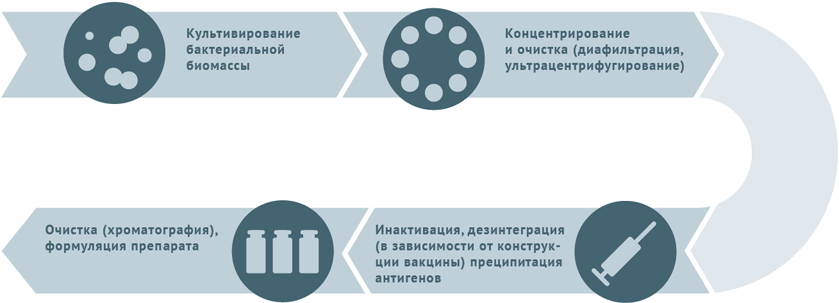
Инактивированные антибактериальные вакцины
Инактивированные противовирусные вакцины
Схема подходит для производства прививочного материала против гепатита А, желтой лихорадки, бешенства, гриппа, полиомиелита, клещевого и японского энцефалитов.
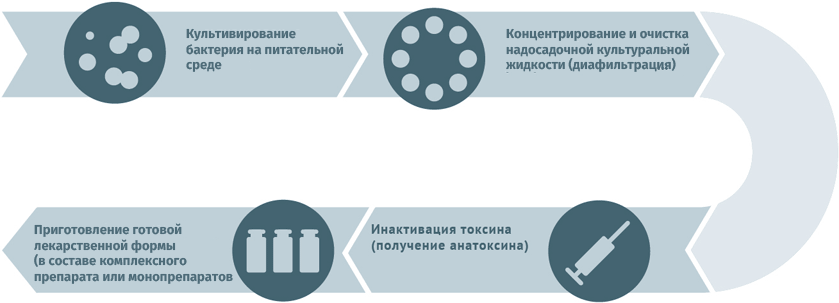
Анатоксины
Для дезактивации вредного воздействия токсинов используют методы:
Схема подходит для производства вакцин против столбняка и дифтерии.
По данным Всемирной Организации Здравоохранения (ВОЗ), на долю инфекционных заболеваний приходится 25 % от общего количества смертей на планете ежегодно. То есть инфекции до сих пор остаются в списке главных причин, обрывающих жизнь человека.
Одним из факторов, способствующих распространению инфекционных и вирусных заболеваний, являются миграция потоков населения и туризм. Перемещение человеческих масс по планете влияет на уровень здоровья нации даже в таких высокоразвитых странах, как США, ОАЭ и государства Евросоюза.
По материалам: «Наука и жизнь» № 3, 2006, «Вакцины: от Дженнера и Пастера до наших дней», академик РАМН В. В. Зверев, директор НИИ вакцин и сывороток им. И. И. Мечникова РАМН.
Задать вопрос специалисту
Вопрос экспертам вакцинопрофилактики
Вопросы и ответы
Я много лет вакцинируюсь от гриппа вакциной французского производителя. В этом году терапевт предложила мне сделать прививку российской вакциной. Я ничего не знаю об отечественных вакцинах, какая из них качественная?
Отвечает Полибин Роман Владимирович
Российские препараты, которыми проводится вакцинацию в рамках ОМС, эффективны и безопасны. Для массовой иммунизации населения Минздравом используются вакцины Совигрипп (НПО «Микроген»), Ультрикс (ООО ФОРТ), УльтриксКвадри (ООО «ФОРТ» иФлю-М (СПбНИИВС ФМБА России). Препараты доказали высокий профиль безопасности и эффективности в ходе полного объема обязательных доклинических и клинических исследований, проведенных в соответствии с требованиями, предъявляемыми регуляторными органами РФ и Европы, а также длительного опыта успешного применения в России и динамики снижения заболеваемости. Подробнее о вакцинах можно узнать на официальных сайтах разработчиков.
Вакцина «Менюгейт» зарегистрирована в России? С какого возраста разрешена к применению?
Отвечает Харит Сусанна Михайловна
Да, зарегистрирована, вакцина – от менингококка С, сейчас также есть вакцина конъюгированная, но уже против 4 типов менингококков – А, С, Y, W135 – Менактра. Прививки проводят с 9 мес.жизни.
Муж транспортировал вакцину РотаТек в другой город.Покупая ее в аптеке мужу посоветовали купить охлаждающий контейнер,и перед поездкой его заморозить в морозильной камере,потом привязать вакцину и так ее транспортировать. Время в пути заняло 5 часов. Можно ли вводить такую вакцину ребенку? Мне кажется,что если привязать вакцину к замороженному контейнеру, то вакцина замерзнет!
Отвечает Харит Сусанна Михайловна
Моему сыну сейчас 7 месяцев.
В 3 месяца у него случился отек Квинке на молочную смесь Малютка.
Прививку от гепатита сделали в роддоме, вторую в два месяца и третью вчера в семь месяцев. Реакция нормальная, даже без температуры.
Но вот на прививку АКДС нам устно дали медотвод.
Я за прививки!! И хочу сделать прививку АКДС. Но хочу сделать ИНФАНРИКС ГЕКСА. Живем в Крыму. В крыму ее нигде нет. Посоветуйте как поступить в такой ситуации. Может есть зарубежный аналог? Бесплатную делать категорически не хочу. Хочу качественную очищеную, что бы как монжно меньше риска.
Отвечает Полибин Роман Владимирович
В Инфанрикс Гекса содержится компонент против гепатита В. Ребенок полностью привит против гепатита. Поэтому в качестве зарубежного аналога АКДС можно сделать вакцину Пентаксим. Кроме того, следует сказать, что отек Квинке на молочную смесь не является противопоказанием к вакцине АКДС.
Подскажите, пожалуйста, на ком и как тестируют вакцины?
Отвечает Полибин Роман Владимирович
Как и все лекарственные препараты вакцины проходят доклинические исследования (в лаборатории, на животных), а затем клинические на добровольцах (на взрослых, а далее на подростках, детях с разрешения и согласия их родителей). Прежде чем разрешить применение в национальном календаре прививок исследования проводят на большом числе добровольцев, например вакцина против ротавирусной инфекции испытывалась почти на 70 000 в разных странах мира.
Почему на сайте не представлен состав вакцин? Почему до сих пор проводится ежегодная реакция Манту (зачастую не информативна), а не делается анализ по крови, например, квантифероновый тест? Как можно утверждать реакции иммунитета на введенную вакцину, если еще ни кому не известно в принципе, что такое иммунитет и как он работает, особенно если рассматривать каждого отдельно взятого человека?
Отвечает Полибин Роман Владимирович
Состав вакцин изложен в инструкциях к препаратам.
Реакция Манту. По Приказу № 109 «О совершенствовании противотуберкулезных мероприятий в Российской Федерациии» и Санитарным правилам СП 3.1.2.3114-13 «Профилактика туберкулеза», несмотря на наличие новых тестов, детям необходимо ежегодно делать реакцию Манту, но так как этот тест может давать ложноположительные результаты, то при подозрении на тубинфицирование и активную туберкулезную инфекцию проводят Диаскин-тест. Диаскин-тест является высоко чувствительным (эффективным) для выявления активной туберкулезной инфекции (когда идет размножение микобактерий). Однако полностью перейти на Диаскин-тест и не делать реакцию Манту фтизиатры не рекомендуют, так как, он не «улавливает» раннее инфицирование, а это важно, особенно для детей, поскольку профилактика развития локальных форм туберкулеза эффективна именно в раннем периоде инфицирования. Кроме того, инфицирование микобактерией туберкулеза необходимо определять для решения вопроса о ревакцинации БЦЖ. К сожалению, нет ни одного теста, который бы со 100% точностью ответил на вопрос, есть инфицирование микобактерией или заболевание. Квантифероновый тест также выявляет только активные формы туберкулеза. Поэтому при подозрении на инфицирование или заболевание (положительная реакция Манту, контакт с больным, наличие жалоб и пр.) используются комплексные методы (диаскин-тест, квантифероновый тест, рентгенография и др.).
Ребёнку 1 год и 8 месяцев, все прививки ставились в соответствии с календарем прививок. В том числе 3 пентаксима и ревакцинация в полтора года тоже пентаксим. В 20 месяцев надо ставить от полиомиелита. Очень всегда переживаю и отношусь тщательно к выбору нужных прививок, вот и сейчас перерыла весь интернет, но так и не могу решить. Мы ставили всегда инъекцию (в пентаксиме). А теперь говорят капли. Но капли-живая вакцина, я боюсь различных побочек и считаю, что лучше перестраховаться. Но вот читала, что капли от полиомиелита вырабатывают больше антител, в том числе и в желудке, то есть более эффективные, чем инъекция. Я запуталась. Поясните, инъекция менее эффективна (имовакс-полио, например)? Отчего ведутся такие разговоры? У каплей боюсь хоть и минимальный, но риск осложнения в виде болезни.
Отвечает Полибин Роман Владимирович
В настоящее время Национальный календарь прививок России предполагает комбинированную схему вакцинации против полиомиелита, т.е. только 2 первых введения инактивированной вакциной и остальные – оральной полиовакциной. Это связано с тем, чтобы полностью исключить риск развития вакциноассоциированного полиомиелита, который возможен только на первое и в минимальном проценте случаев на второе введение. Соответственно, при наличии 2-х и более прививок от полиомиелита инактивированной вакциной, осложнения на живую полиовакцину исключены. Действительно, считалось и признается некоторыми специалистами, что оральная вакцина имеет преимущества, так как формирует местный иммунитет на слизистых кишечника в отличие от ИПВ. Однако сейчас стало известно, что инактивированная вакцина в меньшей степени, но также формирует местный иммунитет. Кроме того, 5 введений вакцины против полиомиелита как оральной живой, так и инактивированной вне зависимости от уровня местного иммунитета на слизистых оболочках кишечника, полностью защищают ребенка от паралитических форм полиомиелита. В связи с вышесказанным вашему ребенку необходимо сделать пятую прививку ОПВ или ИПВ.
Следует также сказать, что на сегодняшний день идет реализация глобального плана Всемирной организации здравоохранения по ликвидации полиомиелита в мире, которая предполагает полный переход всех стран к 2019 году на инактивированную вакцину.
Вакцины: обзор и классификация
Основное назначение вакцин – создание активного поствакцинального иммунитета, который по своему характеру и конечному эффекту соответствует постинфекционному иммунитету, иногда отличаясь от него лишь по уровню напряженности (интенсивности).
Вакцинальный процесс при введении живых вакцин напоминает инфекционный, но отличается доброкачественностью течения. Также при введении живых вакцин происходят размножение и генерализация аттенуированного (ослабленного) штамма в организме вакцинированного животного или птицы и вовлечение в процесс иммунной системы. Иммунная реакция на вакцинные штаммы вируса или их антигены может носить выраженный гуморальный, клеточный или клеточно-гуморальный характер.
В зависимости от биологической модели, на которой накапливали вирус, вакцины подразделяют на 5 групп.
Тканевые вакцины.
Из мозговой ткани овец, зараженных пастеровским штаммом «фикс» вируса бешенства, готовят вакцину против бешенства для ветеринарных целей. Свободные от миелина антирабические вакцины производят из тканей головного мозга новорожденных мышей.
Лапинизированные вакцины.
Препараты из тканей крольчат, зараженных, например, адаптированным к ним вакцинным штаммом вируса ящура или классической чумы свиней.
Авианизированные вакцины. Препараты, при производстве которых используют эмбрионы птиц или живых цыплят.
Культуральные вакцины.
Это вакцины против ящура, бешенства, болезни Ауески, классической чумы свиней, ньюкаслской болезни, ИЛТ и других. Готовят их с накоплением вакцинного штамма на культурах клеток.
Дивергентные вакцины.
Они же – вакцины из гетерологичных вирусов, образованные при помощи «подхода Дженера». Данный подход заключается в использовании в качестве вакцинного штамма вирусов, как правило, не патогенных, а значит, не нуждающихся в аттенуации, выделенных от животных или птиц другого вида.
Так, вирус герпеса индеек защищает кур от болезни Марека; вирус кори человека в состоянии защитить щенков от чумы плотоядных; вирус оспы голубей создает иммунитет против оспы кур; вакцина против натуральной оспы человека создана на основе непатогенного для человека вируса оспы коров; вирус фиброматоза предохраняет кроликов от миксоматоза (вакцина из гетерологичных штаммов вирусов).
В зависимости от типов возбудителей и их количества различают вакцины 21 вида.
1. Моновалентные вакцины. Содержат антиген микроорганизма одного вида.
2. Поливалентные (би-, трехвалентные и более) вакцины. Изготавливаются из нескольких типов микроорганизмов одного вида. Например, трехвалентную противоящурную формолвакцину получают из культурального вируса ящура серотипов О-А-С.
3. Ассоциированные вакцины. Содержат антигены возбудителей разных видов или антигены возбудителя одного и того же вида, но в различных вариантах (скажем, корпускулярный и молекулярный антигены).
Пример – вакцина «Бивак» против инфекционного ринотрахеита и парагриппа-3 крупного рогатого скота.
4. Смешанные вакцины. Являются разновидностью ассоциированных вакцин и представляют собой смесь вирусных и микробных антигенов.
Пример – вакцина против чумы плотоядных, ботулизма и вирусного энтерита.
5. Комбинированные вакцины.
Представляют собой препараты, состоящие из вирусного (или микробного) антигенного компонента и синтетических веществ (полиакриловой кислоты и др.) – стимуляторов иммунного ответа.
6. Живые вакцины.
Производятся из аттенуированных (искусственно ослабленных), селекционированных или слабовирулентных естественных (природно-ослабленных) штаммов вирусов.
Живые аттенуированные вакцины. Чаще всего они изготавливаются из гомологичных аттенуированных штаммов (т. е. из утративших вирулентность патогенных штаммов, сохранивших иммуногенную активность) путем многочисленных пассажей вирусов на биологических системах (эмбрионах птиц или культурах клеток, на животных или птицах) и/или путем воздействия на вирусы в процессе их культивирования в лабораторных условиях под воздействием физических или химических факторов.
Л. Пастер аттенуировал вирусы серийными пассажами на нетрадиционном хозяине. В частности, посредством интрацеребральных пассажей уличного вируса бешенства на кроликах он получил вакцинный штамм, известный под названием вирус «фикс». Пассированием на кроликах были созданы вакцинные штаммы вирусов чумы КРС и классической чумы свиней. Путем серийных пассажей на мышах получены вакцинные штаммы вируса гриппа и ящура; путем пассажей на эмбрионах кур – вакцинные штаммы вируса болезни Ауески, чумы плотоядных и гепатита утят.
На культуре клеток по близкому принципу созданы вакцинные штаммы чумы КРС, ИРТ, вирусной диареи КРС и ящура.
Природно-ослабленные вирусы – это вирусы, циркулирующие в различных популяциях животных, не вызывая у них патологии. При этом данные вирусы способны индуцировать выработку высокого уровня иммунитета. После «доработки» в лабораторных условиях эти вирусы используются как вакцинные.
Гибриды, полученные из «актуальных» эпизоотических штаммов вирусов и безвредных для животных и птиц штаммов, характеризуются авирулентностью.
Живые неаттенуированные вакцины. Такие вакцины могут содержать и «дикий» (полевой) вирус, но применяют их нехарактерным для внедрения вируса путем. В результате репликация вируса в месте его введения ограничивается, и развивается бессимптомная инфекция, заканчивающаяся выработкой иммунитета. В США, например, для профилактики у солдат аденовирусной инфекции используют вирус «дикого» типа, заключенный в таблетки с покрытием. Когда такая таблетка достигает кишечника, вирус освобождается, но желудочно-кишечный тракт не является его естественной средой обитания, и аденовирус данного типа заболевания не вызывает. Макрофаги и специализированные антигенпрезентующие клетки передают информацию о попавшем в кишечник возбудителе аденовирусной инфекции Т- и В-лимфоцитам, в результате чего обеспечиваются иммунный ответ и последующая устойчивость к инфекции.
Любой вакцинный штамм должен быть хорошо изучен, классифицирован, клонирован и паспортизирован. Плюс он не должен вызывать специфического инфекционного процесса или существенных осложнений после введения 5–10-кратных иммунизирующих доз.
Для штаммов вирусов, подготовленных в качестве вакцинных, обязательны:
Перед выпуском с биофабрики живые вакцины проверяют как минимум:
Выпускаются живые вакцины в лиофилизированной форме (в ампулах, флаконах, в виде таблеток).
Живые вакцины применяются:
7. Инактивированные цельновирионные (корпускулярные) вакцины. Содержат полный набор антигенов. Готовят их из накопленного на биологической модели производственного вирулентного штамма вируса, инактивированного с помощью химических или физических факторов. Инактивация чаще всего проводится химическим способом: формалином (формальдегидом в конечной концентрации 0,05–0,2 %), теотропином (А-24), димерэтиленимином, мертиолатом натрия, карболовой кислотой и др.). К физическим способам относят радиоактивное излучение, ультрафиолет, температуру.
К инактивированному вирусу (антигену) добавляют адъювант, обычно в дозе 1:1, и после проверки по ряду параметров вакцина готова к применению. Адъюванты – это соединения, которые при введении в организм активируют пролиферацию Т- и В-лимфоцитов, повышают способность организма реагировать на любой иммуноген. В результате адсорбции на адъюванте происходит укрупнение антигена, и он лучше захватывается и активнее представляется фагоцитирующими клетками. В месте введения адъюванты вызывают депонирование антигена, затем медленное и длительное его высвобождение в организм. Адъювантными свойствами обладают масла, прямые и обратные масляные эмульсии, полиэлектролиты, гидроокись алюминия, липосомы, клетки бактерий, полимеры и наномолекулярные эмульсии.
Наномолекулярные эмульсии (наноструктурные адъюванты, микроэмульсии) выполняют функции адресной доставки компонентов вакцины к клеткам иммунной системы и иммуностимуляции различных механизмов иммунного ответа. Состоят наноэмульсии из двух жидких фаз – или масляных капель в воде, или водных капель в масле. Размер капель, как правило, колеблется от 50 до 600 нм.
Наноэмульсионные вакцины вызывают мощный местный иммунитет при инфекциях, вызванных возбудителем, проникающим через слизистые, а также иммунитет клеточный. Большое преимущество таких вакцин состоит в том, что они могут применяться интраназально. По некоторым параметрам нановакцины более эффективны, чем вакцины с традиционными адъювантами. Наноразмерность придает веществу особые химические, физические, физико-химические и биологоческие свойства, которые могут значительно отличаться от свойств этого же вещества в исходной форме.
Одним из интересных направлений использования наноэмульсий является разработка на их основе усовершенствованных вакцинных препаратов. Во ВНИВИП – филиале ФНЦ ВНИТИП РАН старшими научными сотрудниками А. С. Дубовым и Г. Н. Самусевой разработаны и успешно апробированы в лабораторных условиях наноэмульсионные вакцины против ньюкаслской болезни и инфекционного бронхита кур.
Образцы вакцин № 1 (инактивированная эмульгированная вакцина против ИБК) и № 2 (наноэмульсионная вакцина против ИБК) после успешной проверки на стерильность, стабильность эмульсии, вязкость, полноту инактивации и безвредность протестировали на цыплятах на антигенную-иммуногенную активность с оценкой результатов по титрам поствакцинальных антител в ИФА. Установлено, что вакцина № 2 индуцирует более высокий уровень иммунного ответа, чем стандартная вакцина № 1. В настоящее время проводятся комплексные исследования по дальнейшему изучению и усовершенствованию препарата.
Комплексный масляный адъювант содержит в качестве основы высокоочищенное минеральное масло (Маркол 52 или Дракеол 6ВР, Байоль Ф и др.) в комбинации с эмульгатором и поверхностно-активным веществом (Монтанид 103 или Арлацел А).
Полный адъювант Фрейнда, в состав которого входят смесь минеральных масел, эмульгатор и убитые микобактерии, введенный животному, вызывает образование болезненных гранулем. В настоящее время из-за своей высокой реактогенности (т. е. развития сильных поствакцинальных осложнений) адъювант Фрейнда при производстве вакцин не применяется.
Инактивированные вакцины перед выпуском с биофабрики проверяют:
Инактивированные вакцины бывают и жидкими, и сухими (сухая вакцина против бешенства – медицинская). Вводят их внутримышечно или подкожно.
8. Химические вакцины. Данные вакцины не содержат в своем составе генома вируса, поэтому они безопасны. Термин «химическая вакцина» не вполне корректен, поскольку такие вакцины не являются химическими веществами в чистом виде, а представляют собой группы антигенов, эндотоксинов и т. д. Ранее к химическим вакцинам относили субъединичные вакцины и сплит-вакцины, но только потому, что их наработка проводилась с использованием многих физико-химических методов и реактивов.
9. Субъединичные (компонентные) вакцины. Содержат в своем составе отдельные антигенные компоненты вирусов, в том числе наборы протективных вирионных белков (антигенов) или отдельный поверхностный протективный белок, выделенные из разрушенных вирионов или их клеточных мембран. Такие компоненты необходимы для выработки защитного иммунного ответа. Выделение данных иммуногенных компонентов происходит с использованием физико-химических методов.
Данные вакцины, подобно вакцинам инактивированным, не содержат живых компонентов патогена. Реактогенность у субъединичных вакцин меньше, чем у цельновирионных. Они безопасны, но слабо активизируют некоторые звенья клеточно-опосредованного иммунного ответа и не гарантируют формирования хорошей иммунологической памяти на данные антигены. Иммуногенность повышают посредством применения адъювантов (сорбирования на гидроксиде алюминия).
10. Сплит-вакцины (расщепленные вакцины). Во многих субъединичных вакцинах отсутствуют внутренние антигены вируса, поэтому иммуногенная эффективность у субъединичных вакцин несколько ниже, чем у сплит-вакцин (на 10–15 %). Теоретически сплит-вакцины имеют некоторый «запас» профилактической эффективности по сравнению с субъединичными вакцинами.
Готовят сплит-вакцины из продуктов химического расщепления вирионов, включая в состав все антигены, освобожденные от генома и липидов, поэтому пирогенность сплит-вакцин снижается. Благодаря высокой очистке в сплит-вакцине меньше токсичных субстанций, отсутствуют вирусные липиды и белки куриного эмбриона. Небольшие размеры вводимых антигенных комплексов обуславливают быстрое выведение их из организма и краткое антигенное раздражение иммунной системы. Поэтому в состав сплит-вакцин включают адъюванты, в качестве которых используются минеральные адсорбенты (гидрат окиси алюминия, фосфат кальция) и минеральные масла.
В качестве вакцин используются сами модифицированные микроорганизмы или протективный антиген, образующийся при их культивировании в условиях in vitro. В первом случае иммунный ответ направлен не только против продуктов встроенного гена, но и на носитель вектора.
11. Генно-инженерные (рекомбинантные) вакцины. Их изготавливают с помощью генетической рекомбинации. Целевой ген, полученный методом химического синтеза или путем выделения (клонирования), с помощью ферментов сшивается с другим геном, который используется в качестве вектора для встраивания гибридного гена в клетку. Вектором могут служить плазмиды, бактериофаги, вирусы человека и животных. Экспрессируемый ген встраивается в геном бактериальной или животной клетки, которая начинает синтезировать не свойственное ей ранее вещество, кодируемое экспрессируемым геном. В качестве продуцентов протективного антигена используют микроорганизмы E. coli, B. subtilis, псевдомонады, дрожжи, вирусы. Штаммы некоторых продуцентов способны переключать на подобный синтез чужеродного вещества до 50 % своих синтетических возможностей (эти штаммы называются суперпродуцентами).
Иногда к генно-инженерным вакцинам добавляется адъювант. Например, к вакцинам против гепатита В (типичная векторная вакцина), сифилиса, холеры, бруцеллеза, гриппа, бешенства. Антирабическая вакцина – классическая векторная вакцина, антигены которой образуются in vivo, получена на основе вируса осповакцины. Применяется в профилактике бешенства у диких животных с помощью приманки, содержащей эту вакцину.
12. Синтетические вакцины. Содержат искусственно синтезированные короткие пептиды, имитирующие небольшие участки протективных антигенов вируса, способные вызвать специфический иммунный ответ организма. Это возможно при полной расшифровке структуры протективных антигенных детерминант (последовательности аминокислот). Такие вакцины получают с помощью автоматических синтезаторов. У синтетических вакцин слабая антигенная активность, и для усиления иммуногенности они нуждаются в соединении с белком-носителем или синтетическим биополимером (мурамилпептидом, сополимерами D-глутамина и др.).
Как индукторы иммунитета у животных синтетические пептиды впервые опробовали при ящуре. Белок VP-1 вируса ящура – антиген, вызывающий в организме животных выработку вируснейтрализующих антител. Был синтезирован пептид, содержащий аминокислотные последовательности VP-1, который объединили с гемоцианином и адъювантом Фрейнда. Морские свинки, свиньи и КРС, вакцинированные данным препаратом, были устойчивы к заражению вирулентным штаммом вируса ящура даже при низком поствакцинальном титре антител. Положительные результаты получены при применении синтетических вакцин против гриппа, гепатита В, полиомиелита и других болезней.
13. Анатоксины. Представляют собой полученные из бактериальных экзотоксинов препараты, полностью лишенные токсических свойств, но сохранившие антигенные и иммуногенные свойства. При приготовлении анатоксинов культуры бактерий – возбудителей токсинемических инфекций, продуцирующих экзотоксины, выращивают в жидких питательных средах (в реакторах большой емкости) для накопления токсина, а затем фильтруют через бактериальные фильтры для удаления микробных тел. К фильтрату добавляют 0,3–0,4 % формалина и помещают смесь в термостат при температуре 37–40 °С на 3–4 недели до полного исчезновения токсических свойств. Полученный анатоксин проверяют на стерильность, безвредность и иммуногенность.
14. Конъюгированные вакцины. Представляют собой комплекс бактериальных полисахаридов и токсинов. При таком сочетании усиливается иммуногенность полисахаридных антигенов. С положительным результатом апробированы конъюгированные вакцины в виде сочетания антигена Haemophilus influenzae и дифтерийного анатоксина.
15. Синтетические пептидные вакцины. Метод химического синтеза позволяет получить синтетический пептид – аналог главной антигенной детерминанты протективного антигена (белка) патогенных микроорганизмов. Такой синтетический пептид используется для производства вакцин.
У данных вакцин высокая степень стандартности, слабая реактогенность, и они безопасны. С помощью таких вакцин можно избежать развития аутоиммунных процессов при иммунизации, а при использовании доминантных пептидов – получить вакцины против возбудителей с высокой степенью изменчивости.
Однако у синтетических пептидных вакцин есть и недостаток – слабая иммуногенность вследствие малого размера синтетических пептидов. Усиливают иммуногенность таких пептидов за счет связывания их с высокомолекулярными носителями (полиэлектролитами, полисахаридами, анатоксинами). В качестве высокомолекулярных носителей и адъювантов используются микросферы и липосомы, внутрь которых или к поверхности их мембран прикрепляются антигены. Микросферы – это защитные полимеры, подвергающиеся в организме гидролизу. Липосомы – пузырьки с двуслойной мембраной, состоящей из фосфолипидов. Размеры липосом варьируются от 0,01 до 150 мкм. Это способствует снижению токсичности антигенов и более продолжительной их циркуляции в организме. По мере распада микросфер и липосом антиген дозированно, от нескольких дней до нескольких месяцев, выделяется в организм, и происходит последовательная и постепенная иммунизация особи. Подобные вакцины имеются против гепатита А и гриппа.
16. ДНК-вакцины. Принцип иммунизации с их использованием состоит в том, что в организм вводят не вирусный антиген, а ДНК, кодирующую синтез этого антигена (белка), т. е. сама ДНК используется как вакцина. И ранее было известно, что ДНК и РНК многих вирусов, инфицируя клетки, могут осуществлять полный цикл репликации.
Для иммунизации используют рекомбинантную ДНК как таковую или гибридную плазмиду, содержащую ген протективного антигена. При разных способах введения гибридная плазмида может проникать в клетки, экспрессировать нужный белок и при этом долго сохраняться в организме, что завершается формированием полноценного иммунного ответа. ДНК-вакцины индуцируют выработку антител (гуморальный иммунитет) и специфический цитотоксичный ответ (клеточный иммунитет), что ранее было достижимо только с помощью живых вакцин.
17. Антиидиотипические антитела (вакцины). Многие фрагменты активных центров антигенов имеют пространственное сходство с антиидиотипическими антителами против них, поэтому данные антитела можно использовать как вакцинный антиген, что сразу исключает патогенные и вирулентные свойства возбудителя.
Вакцины из антиидиотипических антител не реактогенны, безвредны и иммунны. Возможно образование Т-, В-эффекторов, Т-, В-клеток иммунологической памяти, обусловливающих защиту против данного антигена.
Антиидиотипические антитела были получены для индукции иммунного ответа к вирусам гриппа и диареи КРС.
18. Вакцины, содержащие продукты генов гистосовместимости. Пептиды приобретают выраженную иммуногенную активность после взаимодействия с антигенами генов гистосовместимости классов I или II. Приняв это как аксиому, исследователи разработали ГКГ-рестриктивные вакцины для лечения людей с гепатитом В, цитомегаловирусной и папилломавирусной инфекцией и с онкологическими заболеваниями (меланома, рак простаты).
Данные вакцины представляют собой комплекс антигенов гистосовместимости класса I с антигенами вируса гепатита В или возбудителя цитомегаловирусной инфекции.
19. Мукозальные вакцины. Разработаны как средства, препятствующие колонизации возбудителями инфекционных заболеваний поверхности слизистых оболочек. В таких вакцинах основу составляет белок адгезин, находящийся на концах пилей, с помощью которых бактерии прикрепляются к поверхности слизистой. Введение такого адгезина сопровождается образованием антител, препятствующих колонизации бактерий и развитию инфекционного процесса.
20. Растительные вакцины. Создаются на основе трансгенных растений. Генная инженерия позволяет внедрить нужные гены почти во все сельскохозяйственные культуры. Экспрессия протективного антигена в растение вызывает в нем стабильные генетические трансформации.
Такие трансгенные пероральные вакцины приводят к формированию системного гуморального и клеточного иммунитета, а также к развитию местного иммунитета кишечника.
Пример – вакцина в виде картофеля, в который экспрессирован антиген энтеротоксигенной кишечной палочки.
21. Рибосомальные (субклеточные) вакцины. Производятся из имеющихся в каждой клетке бактериальных рибосом соответствующего возбудителя. Рибосомы – это органеллы, продуцирующие белок по матрице и-РНК. Выделенные в чистом виде рибосомы с матрицей и представляют собой вакцину.
Примеры – бронхиальная и дизентерийная вакцины (ИРС-19, Бронхомунал, Рибомунил), а также вакцины против сальмонеллеза, эшерихий, стрептококков, гемофилл, франциселл, бруцелл, лептоспир и др.
Авторы:
В. А. Бакулин, профессор, заведующий отделом вирусологии и опухолевых болезней птиц, Всероссийский научно-исследовательский ветеринарный институт птицеводства – филиал Федерального научного центра «Всероссийский научно-исследовательский и технологический институт птицеводства» Российской академии наук (ВНИВИП – филиал ФНЦ ВНИТИП РАН), Санкт-Петербург
А. С. Дубовой, старший научный сотрудник отдела вирусологии и опухолевых болезней птиц, ВНИВИП – филиал ФНЦ ВНИТИП РАН, Санкт-Петербург
Г. Н. Самусева, старший научный сотрудник отдела вирусологии и опухолевых болезней птиц, ВНИВИП – филиал ФНЦ ВНИТИП РАН, Санкт-Петербург