в чем заключается генетический риск генно терапевтических процедур
В чем заключается генетический риск генно терапевтических процедур
Генотерапия для лечения болезни человека имеет как уже продемонстрированные, так и теоретические риски трех общих типов.
Неблагоприятный ответ на вектор или комбинацию вектор/болезнь в генной терапии
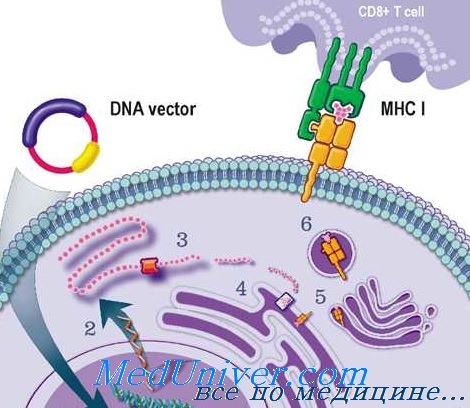
Главная озабоченность — то, что пациент может неблагоприятно отреагировать на вектор или передаваемый ген. Такие проблемы в основном предполагают на основе животных моделей и предварительных исследований у человека. По крайней мере один пациент погиб из-за неблагоприятного иммунного ответа на введенный аденовирусный вектор.
Дополнительные соображения в этом случае — иммунный ответ у больного проявился вследствие катаболической реакции. Поскольку его генетическое заболевание — дефект цикла мочевины, способность переносить катаболизм белка была резко снижена.
Общий вывод из этого примера состоит в том, что при выборе подходящего вектора необходимо учитывать патофизиологические характеристики специфического заболевания; пациент, устойчивый к катаболизму, вероятно, смог бы перенести иммунную реакцию на введение аденовируса.
Инсерционный мутагенез, приводящий к злокачественным новообразованиям в генной терапии
Вторая причина для беспокойства — инсерционный мутагенез, т.е. вероятность того, что переданный ген, внедряясь в ДНК пациента, активизирует протоонкогены или нарушает гены — супрессоры опухолевого роста, возможно, вызывая злокачественное новообразование.
Текущее поколение вирусных векторов с меньшей вероятностью вызывает экспрессию онкогенов, так как они изменены для минимизации способности их промоторов активизировать экспрессию смежных генов хозяина. Инактивация генов-супрессоров, вероятно, будет встречаться редко, поэтому риск такого события оценивают как приемлемый при болезнях без другой терапевтической альтернативы.
Неожиданный механизм онкогенеза при генотерапии был обнаружен случайно при выявлении лимфопроли-феративных заболеваний у некоторых пациентов после генотерапии Х-сцепленного комбинированного иммунодефицита, обсуждаемого далее. Оказалось, что у этих больных перенос гена содействовал развитию злокачественного заболевания.
Следовательно, необходимо максимально предусматривать биологическое влияние передаваемого гена, когда он экспрессируется в необычном хромосомном положении за пределами своего нормального биологического контекста.
Инсерционная инактивация важного гена в генной терапии
Третий фактор риска — инактивация гена, существенного для жизнеспособности клетки — в основном не будет иметь значимого эффекта, поскольку ожидают, что такие летальные мутации будут редкими и повредят лишь единичные клетки.
Хотя векторы в основном включаются в транскрибируемые гены, а ретровирусы преимущественно в их 5′-конец, шанс, что один и тот же ген будет нарушен более чем в нескольких клетках, чрезвычайно низок, так как отдельные типы клеток экспрессируют около 10 000 генов.
Единственное исключение из этого правила относится к половым клеткам; инсерция в важный ген в половой клетке может вызвать патогенную доминантную мутацию у потомства пациента. Тем не менее, вероятно, такие события будут редкими, а риск приемлемым, поэтому на этом основании трудно оправдать отказ от тщательно спланированной и проверенной попытки генотерапии у пациентов, для которых нет других способов лечения.
Кроме того, проблема модификации половых клеток при лечении болезни не ограничивается генотерапией. Например, широко используемая при лечении злокачественных болезней химиотерапия мутагенна, но этот риск принимают из-за терапевтических преимуществ.
Этические проблемы генной терапии
Как и любое новое лечение, предложения по пересадке генов следует подвергать строгому изучению полномочными органами и этическими комитетами больниц. Тем не менее фактически все правительственные и религиозные учреждения, изучавшие предложения по применению генотерапии у человека для лечения генетической патологии, согласны, что эта терапевтическая возможность должна быть использована. Соматическая генотерапия, в отличие от передачи генов в половые клетки, поднимает всего несколько этических вопросов, не учитываемых при введении других новых видов лечения (например, новых противораковых препаратов).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
В чем заключается генетический риск генно терапевтических процедур
Препарат Zolgensma был разработан швейцарской фармацевтической компанией Novartis. Он применяется одноразово и стоит 2 млн долларов. Врачи считают, что лекарство может дать начало массовому применению генной терапии: только за первые три месяца 2019 года было зарегистрировано 372 новых клинических испытания генно-терапевтических препаратов.
Для многих наследственных заболеваний нет эффективного лечения, существующие препараты помогают облегчить жизнь пациентов. Причиной таких заболеваний являются изменения генетического материала – мутации. В результате мутаций с гена синтезируется либо изменённый белок, который не может правильно выполнять свою функцию, либо белок не синтезируется вовсе. Для полного излечения пациентов необходимо исправить в их клетках мутации. Задачу немного упрощает тот факт, что для многих наследственных заболеваний неработающий белок оказывается критически важен только в одном месте организма. Поэтому достаточно исправить ген только в этом органе или ткани.
Генно-терапевтический подход к лечению наследственных заболеваний разрабатывается уже 40 лет. Основная технология генной терапии основана на замещении гена с мутацией правильно функционирующей копией этого гена. Но есть еще две стратегии: выключение неправильно работающего гена и введение нового гена, который поможет организму победить заболевание.
Надо подчеркнуть принципиальное отличие генной терапии от редактирования генома, которое сейчас тоже активно разрабатывается для лечения наследственных заболеваний. Генная терапия доставляет ген в клетки, чтобы компенсировать дефектный ген. Но при этом не происходит удаление дефектной ДНК из клеток. При редактировании генома происходит удаление или изменение дефектной ДНК в клетках пациента.
В зависимости от цели генная терапия бывает соматической и фетальной. В первом случае вирус с геном вводят в клетки тела, во втором – в эмбрион на ранней стадии развития. В результате фетальной генной терапии генетический материал попадает во все клетки и может быть передан детям.
В ходе клинических испытаний препарат Zolgensma показал хорошие результаты у пациентов со спинальной мышечной атрофией: из 21 пациентов 19 смогли начать двигать головой и самостоятельно сидеть.
Препараты генной терапии могут стать эффективным средством лечения многих наследственных заболеваний, для которых не существовало лечения до этого. Так, в ближайшее время ожидает одобрения международного регулятора еще один новый генно-терапевтический препарат для лечения талассемии и серповидноклеточной анемии. Оба этих заболевания связаны с мутациями, результатом которых является синтез неправильно работающего гемоглобина – белка, переносящего кислород в крови.
Прежде всего, препараты генной терапии разрабатываются для заболеваний, причиной которых является одна в мутация в одном гене. Таких болезней 10 000. В связи с большими затратами на разработку генно-терапевтических препаратов, они очень дорогие. Но постепенно отработка технологии позволит значительно снизить стоимость таких лекарств и сделать их доступными большинству пациентов.
В чем заключается генетический риск генно терапевтических процедур
До использования методов ДНК-диагностики генетический риск при менделирующих заболеваниях определяется путем вероятностных расчетов, основанных на закономерностях сегрегации патологического фенотипа при том или ином типе наследования. Точность расчета генетического риска зависит от информативности родословной и возможности установления генотипов консультируемых родителей. Если генотипы родителей (тип брака) известны или могут быть предположены с высокой вероятностью, оценка риска манифестации патологического фенотипа у потомков сравнительно проста [Козлова СИ. и др., 1996].
В необходимых случаях делается поправка на неполную пенетрантность мутантного гена, коэффициент инбридинга и некоторые другие факторы, влияющие на проявление фенотипа. Значительно сложнее расчет генетического риска при неизвестных генотипах родителей. Обычно это имеет место при наличии единичных случаев заболевания в семье, особенно если изучаемый синдром является генетически гетерогенным: в такой ситуации оценка сегрегации признаков в родословной неосуществима, и расчет генетического риска приходится проводить для различных возможных типов наследования.
В этих случаях используются специальные математические формулы, основанные на теории вероятности. Данные формулы при расчете общего риска принимают во внимание априорные факторы (менделевские закономерности предполагаемого типа наследования и сравнительную частоту возможных генетических вариантов болезни), а также фактическое наличие у консультируемого лица больных или здоровых родственников (что определяет апостериорную вероятность рассматриваемой гипотезы). При неизвестном типе брака рождение каждого последующего ребенка (здорового или больного) существенно дополняет имеющуюся генетическую информацию и видоизменяет величину апостериорной вероятности.
При мультифакториальных заболеваниях с полигенно-детерминируемой наследственной предрасположенностью суммарный генетический риск зависит от большого числа факторов и определяется с помощью специальных таблиц эмпирического риска.
Медицинские интернет-конференции
Языки
Медико-этические аспекты генотерапии
Ворфоломеев С.А., Юпатов В.Д., Ялиева Л.К., Фахрудинова Э.Р.
Резюме
В этой статье освещены основные морально-этические и этико-правовые вопросы генной инженерии и, в частности, генотерапии. Данная тема является более чем актуальной, в связи со стремительным развитием молекулярной генетики и расшифровкой структуры ДНК. Здесь мы пытаемся ответить на вопрос: имеет ли место вмешательство человека в естественные механизмы существования живых организмов.
Ключевые слова
Статья
Ворфоломеев С., Юпатов В., Ялиева Л., Фахрудинова Э.Р.
Министерство здравоохранения Российской Федерации
ФГБОУ ВО Саратовский ГМУ им. В.И. Разумовского Минздрава России
Кафедра философии, гуманитарных наук и психологии
Медико-этические аспекты генотерапии
Стремительное развитие молекулярной генетики, расшифровка структуры ДНК, появление методов генной инженерии и генной терапии вполне ожидаемо столкнули человечество с рядом морально-этических и этико-правовых вопросов, связанных с прямым вмешательством человека в механизмы существования живых организмов.
Большее количество этих вопросов еще далеко от разрешения. Некоторые из них нашли свои ответы в международных и отечественных этико-правовых документах. Свое мнение относительно этих проблем выразили и представители ряда религиозных конфессий. Многие вопросы являются предметом длительных дискуссий и на сегодняшний день:
Может ли человек стать творцом направленной биоэволюции?
Может ли «цепочка из нескольких нуклеотидов» стать показателем личностных качеств индивидуума?
Применима ли генетическая модификация путем избирательной селекции определенных генов к человеку и человеческому роду в целом? И возможно ли таким образом подготовить основу для создания «сверхчеловека»?
Имеет ли место государственное и общественное регулирование процесса научных исследований?
Также встает вопрос и о доступности методов генной инженерии для отдельных слоев населения.[4]
Генная терапия представляет собой новый метод лечения генетически обусловленных заболеваний, основанный на замене «больного» гена (ответственного за заболевание) геном «здоровым». Целью генной терапии является внесение изменений в генетический аппарат клеток человека в целях лечения конкретных заболеваний.
В частности, открыты новейшие технологии, позволяющие участвовать в направленном мутагенезе, а в 2013 г. разработаны высокоизбирательные методы активирования и ингибирования генов с помощью системы CRISPR/Cas9, которые дают возможность исправлять неправильные последовательности генов и таким образом лечить наследственные заболевания человека.
CRISPR/Cas9 — это уникальная технология изменения геномов, в основе которой лежит собственная иммунная защита бактерий. Эта система основывается на особых участках бактериальной ДНК. Вирус, проникая в клетку бактерии, тут же обнаруживается с помощью специальных Cas-белков, связанных с CRISPR РНК. Если фрагмент вируса «записан» в бактериальной CRISPR РНК, Cas-белки разрезают вирусную ДНК и уничтожают ее, защищая клетку от инфекции.[9]
Для исправления «дефектного» гена, необходим очень точный «молекулярный скальпель», который отыщет мутантную последовательность нуклеотидов и вырежет ее из ДНК. Этим «скальпелем» и является Cas9. Используя гид РНК, последовательность нуклеотидов которого комплиментарна искомому месту, производят разрез в нужном месте генома. Узнавание «мишени» осуществляется на участке ДНК длиной в 20–30 нуклеотидов. Участки ДНК этой длины встречаются в геноме человека не более одного раза, поэтому использование этой технологии позволяет с наибольшей точностью произвести замену дефекта. Клетка не погибнет от внесения разрыва в молекулу ДНК, т.к. в работу включатся системы репарации, достроив вторую цепь ДНК, на основе первой.
Открытие этого метода дало основание ученым утверждать, что в ближайшем будущем для любого генетика не составит труда вырезать, удалять и встраивать новые гены в матрицу ДНК, исцеляя генетические заболевания, изменяя человеческие качества и их потенции (лидерство, способность к познанию, творческий потенциал и т.д.)
По мнению И.В. Силуяновой, решение проблем, связанных с вмешательством в генетический аппарат живых существ, способствовало формированию внутри биоэтики двух подходов, которые условно можно назвать «либеральным» и «консервативным».[1]
Главным аргументом «либералов» в этой полемике является рассмотрение данного метода как потенциально универсального подхода к лечению широкого спектра заболеваний. В первую очередь с помощью CRISPR/Cas9 мы сможем лечить «простые», моногенные генетические заболевания: гемофилию, муковисцидоз, лейкемию; вирусные (в том числе ВИЧ-инфекции и герпесвирусных инфекций); аллергии и иммунологические заболевания (в том числе аутоиммунные), онкологические, сердечно-сосудистые заболевания и даже ревматизм, а также наследственных расстройств — таких, как синдром Дауна, серповидно-клеточная анемия и β-талассемия.
Консерваторы, в свою очередь, озабочены тем, что генетик может взять на себя роль своеобразного «бога» и попытается вмешаться в действия законов природы.
Во-вторых, учитывая концепцию евгеники (гены имеют решающее значение в процессе формирования человека), существуют опасения по поводу существования одобренных правительствами программ «улучшения расы» и использования медицинских технологий в немедицинских целях.[3] Другими словами, основными критериями генотерапии являются уважение личности человека, его автономии и соблюдение принципа невмешательства в его частную жизнь.
В-третьих, технология нуждается в совершенствовании, она недостаточно точная. В 2015 году китайские ученые предприняли попытку исправить геном человеческого эмбриона. В результате эксперимента в 5–10% эмбрионов мутация, ответственная за возникновение β-талассемии у взрослых людей, действительно была исправлена, однако во всех клетках пролеченных эмбрионов возникло большое количество непредвиденных мутаций.[10]
Именно поэтому по-прежнему сохраняется значительная напряженность в отношении эффективности генной терапии, возможности развития негативных последствий. Различные «этические комитеты» безустанно поднимают эту проблему, пытаясь найти «идеальные» условия, при которых это возможно реализовать. В основном на первое место выдвигаются такие параметры, как:
1) Доказательство того, что ген, принесенный в клетку-мишень будет достаточное время функционировать, не теряю свою эффективность.
2) Нужна абсолютная гарантия того, что этот ген не повлечёт за собой неблагоприятные последствия.
Несмотря на кажущуюся простоту, указанные условия не могут быть достаточно конкретизированы, чтобы стать универсальным правилом. Для каждого случая применения этой технологии придется определять, какие сроки сохранения эффективности гена будут считаться достаточными, каков может быть потенциальный риск для пациента, и как он будет соотноситься с предполагаемым положительным лечебным эффектом.[6]
Д. Нейсбит также отмечает, что использование генетической информации страховыми компаниями приводит к отказу от оказания медицинской помощи в ряде случаев. Основанием здесь служит генетическая предрасположенность к некоторым заболеваниям, которая присутствует у человека с рождения.[2]
Поэтому на сегодняшний день существует множество морально-этических норм и требований к генетическим технологиям и методам, которые закреплены в ряде международных этико-правовых документов, а также в законодательстве РФ.
Главным документом в этой области является «Конвенция о биомедицине и правах человека» 2005 года, в которой отражены основные принципы регулирования генетических исследований, генной инженерии и терапии. Так, статья 13 «Конвенции» гласит: «Вмешательство в геном человека, направленное на его модификацию, может быть осуществлено только в профилактических, терапевтических или диагностических целях и только при условии, что подобное вмешательство не направлено на изменение генома наследников данного человека».
Существует большое количество иных международных документов, относящихся к этой сфере: «Всеобщая декларация о геноме человека и правах человека» (ЮНЕСКО, 1997), «Всеобщая декларация о биоэтике и правах человека» (ЮНЕСКО, 2005), «Декларация о клонировании человека» (ООН, 2005) и другие.
В нашей стране основные аспекты этико-правового регулирования генной инженерии и генной терапии отражены в Федеральном законе «О государственном регулировании в области генно-инженерной деятельности» от 05.07.1996 N 86-ФЗ (действующая редакция, 2016). В нем говорится, что одним из основных направлений в области государственного регулирования генно-инженерной деятельности является улучшение условий жизни человека и охрана его здоровья, а также определяется ответственность за нанесенный человеку и окружающей среде вред.
Резюмируя все вышесказанное, можно сделать вывод, что технология CRISPR/Cas9 может быть весьма перспективной в лечении многих заболеваний. Но нельзя забывать, что сами методы диагностики этих заболеваний еще не совершенны. Так многие заболевания кодируются не одним геном, а сотнями и тысячами генов, и идентификация этих генов также требует высокой точности, чего сегодня еще не смогли добиться.
Диагностика многих генетических заболеваний затруднена вследствие того, что гены, отвечающие за возникновение этих заболеваний, являются рецессивными и фенотипически не проявляются. Поэтому, на данный момент, на первое место нам необходимо поставить разработку методов диагностики, а уже потом внедрять методы генотерапии.[8]
Не стоит забывать и о правовом регулировании данной сферы деятельности. Вмешательство в геном человека, прежде всего, должно быть безопасным как для него, так и для окружающей среды. Важную роль в вопросах правового регулирования должны играть как государство, так и международные научные сообщества. Направленность генетических исследований, методы генной инженерии и терапии должны сопоставляться с морально-этическими принципами и нормами современных биотехнологий.
Литература
3. Жарова М.Н. Этические проблемы современных генетических технологий// RELGA №11 [209] 01.08.2010.
4. Шумская Е.И. Социально-этические и правовые проблемы в медицинской генетике// Личность в меняющемся мире: здоровье, адаптация, развитие. №3 (10), 2015.
5. Моров А.В. Природно-генетическая основа лидерства и биоэтика III тысячелетия.// Современные проблемы науки и образования №1-2, 2015.
6. Салмина А.Б., Шнайдер Н.А. Этические вопросы новых медицинских технологий.// Сибирское медицинское обозрение. №3, том 40, 2006.
7. Мамедова Н.Д., Нуржанова А.Б., Табачкова О.А., Живайкина А.А. Постчеловек: иллюзия или реальность? // Бюллетень медицинских интернет-конференций. – 2013. – Т. 3. – № 2. – С. 399.
Медицина и генная инженерия: достижения и проблемы (на пересечении биологии, медицины и биоэтики)
Генная инженерия представляет собой новое направление в сфере молекулярной биологии, которое получило широкое распространение во многих сферах медицины и биологии относительно недавно.
Генная инженерия позволяет целенаправленно, по заранее намеченной программе, экспериментально модифицировать геном с использованием генетической информации из разных гетерологических систем: вирусов, бактерий, насекомых, животных и человека. Применяя методы генной инженерии, ученые способны модифицировать структуру генов, а также создавать гибридные гены.
Следует отметить огромный вклад генной инженерии в улучшение сферы медицинского обслуживания. Так, благодаря генной инженерии стало возможным создание новых диагностических препаратов, вакцин и препаратов для заместительной терапии, а также лечение наследственных заболеваний. Применение генной терапии в лечении такой патологии как первичные иммунодефициты является единственным терапевтическим методом, обеспечивающим полное излечение, что значительно улучшает качество жизни пациентов и снижает риск летального исхода. В последнее время рассматриваются новые варианты применения генной инженерии в трансплантологии и редактировании генома эмбрионов. Возможность применения этой инновационной технологии порождает множество биоэтических вопросов. Считаю, что анализ предполагаемых последствий применения генной инженерии для общества должен создавать рамки возможного вмешательства в геном организмов.
Среди многих достижений генной инженерии, получивших применение в медицине, наиболее значимое — получение человеческого инсулина в промышленных масштабах. Генные инженеры в качестве первой практической задачи решили клонировать ген инсулина. Клонированные гены человеческого инсулина были введены с плазмидой в бактериальную клетку, где начался синтез гормона, который природные микробные штаммы никогда не синтезировали.
Использование генно-инженерного инсулина не вызывало каких-либо патологических реакций в организме, в том числе и иммунопатологических, которые часто наблюдались у пациентов, использующих в терапии диабета инсулин животного происхождения. Масштабное использование генно-инженерного инсулина значительно снизило летальность от диабета, в особенности у пациентов детского возраста, так как именно у этой категории населения преимущественно развивается инсулинозависимый диабет 1 типа. Следующими разрабатываемыми генно-инженерными препаратами были интерфероны и интерлейкины, используемые в терапии вирусных и онкологических заболеваний.
Около 200 новых диагностических препаратов уже введены в медицинскую практику, и более 100 генно-инженерных лекарственных веществ находятся на стадии клинических исследований. Среди них лекарства, используемые в терапии артрозов, сердечно-сосудистых заболеваний, онкологических заболеваний.
Сферы использования генной инженерии в медицине значительно расширяются. Так актуальной является возможность применения генной инженерии в диагностике и терапии наследственных заболеваний.
В настоящее время известно более 4000 наследственных заболеваний, для большинства из которых не найдено эффективных способов лечения. Генные инженеры разрабатывают диагностические препараты, позволяющие обнаруживать генетические аномалии в период беременности, что дает возможность предотвратить рождение ребенка с генетической аномалией [4].
Генная терапия наследственных заболеваний заключается в замене мутантных генов на гены «дикого типа», в которых отсутствуют мутации.
Так в 1989 году в Национальных Институтах Здоровья США впервые была предпринята попытка применить в клинической практике генную терапию для лечения пациентов с диагнозом тяжелая комбинированная иммунная недостаточность (ТКИН). Наиболее обнадеживающие результаты ожидают в тех случаях, когда заболевание обусловлено дефектом одного гена. В этом случае полагают, что удастся вводить нормальный ген в соматические клетки прицельно в то место на хромосоме, где находится дефектный ген. При гомологичной рекомбинации введенный ген заместит дефектный. Такой однократной процедуры в ряде случаев будет достаточно, чтобы излечить болезнь. Однако на практике очень трудно проконтролировать судьбу введенной в клетки ДНК, и на одно правильное встраивание в геном приходится более 1000 случайных. Разрабатывается и другой подход, когда введенный ген не заменяет дефектный, а компенсирует его функцию, встраиваясь в хромосому в другом месте.
Инновационной технологией в редактировании генома является технология CRISPR. По причине легкости редактирования генома с использованием технологии CRISPR существует значительный интерес к перспективам редактирования генома эмбриона человека.
Основной метод применения технологии CRISPR — доставка редактирующих агентов в клетки эмбриона, созданного путем оплодотворения in vitro. В последствии может оказаться более целесообразным и этически приемлемым редактировать гаметогенные клетки-предшественники у будущих родителей. Преимущество зародышевой коррекции аллелей генов, соответствующих патологическим состояниям, заключается в том, что они навсегда исчезнут из генома.
Еще одной сферой использования генной инженерии в медицине является CAR-T-терапия. На сегодняшний день одним из наиболее перспективных направлений в терапии онкологических заболеваний является адоптивная клеточная иммунотерапия. При проведении такой терапии выделяют, активируют и размножают аутологичные T-лимфоциты, а затем вводят их обратно пациенту, что приводит к частичной регрессии или эрадикации опухоли. Введение Т-клеток, модифицированных химерными антигенными рецепторами (CAR-T-клеток), является одним из наиболее активно развивающихся направлений иммуноонкологии [6]. CAR-T-клетки представляют собой генетически модифицированные собственные Т-клетки пациентов, которые содержат химерный антигенный рецептор. Этот рецептор содержит в себе часть антитела, специфического к антигену опухоли и часть, рецептора Т-клеток. С использованием CAR-T-терапии получены обнадеживающие результаты при гематологических опухолевых заболеваниях. Так, клинические испытания CAR-T-клеток, направленных против В-лимфоцитарного антигена CD19, показали их эффективность при лечении резистентных к химиотерапии опухолей В-клеточного происхождения.
Биоэтические проблемы
С точки зрения биоэтики возникает ряд вопросов о допустимости применения генной инженерии по отношению к человеку. Помимо биоэтических проблем существует ряд дополнительных вопросов как в непосредственно самой процедуре генетической модификации клеток организма человека, так и в отдаленных последствиях этой процедуры для отдельного человека и для человеческой популяции в целом.
Примером проблемы при использовании генной инженерии в редактировании генома эмбриона является риск того, что попытка исправить генетический код не родившегося ребенка может принести больше вреда, чем пользы. Современная технология редактирования генома не обладает достаточной эффективностью и специфичностью, чтобы полностью гарантировать безопасность. Мутации, возникающие в нецелевых локусах хромосом вследствие введения редактирующих конструкций, могут влиять на организм ребенка и передаваться из поколения в поколение, а их эффекты не всегда могут быть доброкачественными, предсказуемыми или обратимыми.
Использование генной терапии в лечении наследственных заболеваний также сопровождается рядом проблем, так при лечении некоторых заболеваний отдаленным последствием такой терапии является развитие онкологических заболеваний.
Обратной стороной CAR-T-терапии является высокий риск возникновения системных и опасных для жизни побочных эффектов, в первую очередь, гиперцитокинемии (цитокиновый шторм, цитокиновый каскад, синдром выброса цитокинов и синдром лизиса опухоли). Эти осложнения могут спровоцировать развитие синдрома полиорганной недостаточности и, как следствие, привести к летальному исходу. Еще одна существенная проблема применения CAR-T-терапии – неспецифическая цитотоксичность, особенно актуальная в случае терапии солидных опухолей, к которым крайне сложно подобрать специфичные антигены. Неспецифическая цитотоксичность обусловлена развитием интенсивной и быстрой кросс-реакции введенных Т-клеток на здоровые клетки, что часто приводит к летальному исходу.
Ценностные суждения из области биоэтики можно подразделить на два типа, как это делает М. Хяурю в своей работе «Категорические возражения генной инженерии − критика». Суждения первого типа касаются вероятных последствий тех или иных биотехнологических процедур, их можно назвать прагматическими (или консеквенционалистскими). Суждения второго типа высказываются вне зависимости от возможных последствий предмета суждений, их называют деонтологическими (или категорическими).
Примером этических суждений о конкретных последствиях может служить то, что граница между лечением и улучшением в области медицинской генетики не является очевидной, и улучшающая генная инженерия сама по себе может быть благом, но угрозу представляет социальное неравенство относительно распределения выгод генной инженерии так как это может привести к созданию серьезной и необратимой несправедливости. Любые генно-инженерные процедуры будут доступны в первую очередь для развитых стран, в то время как страны третьего мира будут лишены возможности использования генно-инженерных технологий.
Отдельные генетические последовательности, пригодные для улучшающей генной инженерии людей, в будущем могут быть запатентованы. Рынок улучшающей генной инженерии представляется перспективным: все люди будут заинтересованы в улучшении параметров своего потомства, но, иметь доступ к таким процедурам в первую очередь будут жители развитых стран.
Использование генной инженерии приведет не только к усугублению неравенства между жителями отдельных стран, но и к расслоению общества внутри этих стран. Генетически привилегированные люди могут стать не стареющими, здоровыми супер гениями безупречной физической красоты, отличающимися блестящим остроумием и обезоруживающим, умаляющим чувство собственного достоинства юмором, излучающими тепло, эмпатический шарм и ослабленную непоколебимость. Непривилегированные останутся сегодняшними людьми, возможно, не имеющими чувства самоуважения и страдающими от случайных приступов зависти. Мобильность между низшими и высшими классами может исчезнуть, и ребенок, рожденный в бедной семье, не имеющий генетического усовершенствования, не сможет успешно соперничать с супер детьми богатых родителей. Даже если не случится дискриминация или эксплуатация низшего класса, все еще будет что-то разрушительное в перспективе общества с такими крайними формами неравенства.
Примерами категорических суждений являются изменение уникальности и ценности личности человека, подвергшегося воздействию генной инженерии, а также дискриминация по отношению к еще не родившемуся ребенку, в случае проведения генно-инженерных процедур на зародышевой линии.
В случае участия в создании «дизайнерских детей», ученый принимает (в соответствии с собственными предпочтениями и/или общественными стереотипами) необратимые решения, задающие основания и границы органических черт будущего индивида, а вместе с тем и черт будущей личности. Из этого следует, что генетически запрограммированные личности уже более не смогут рассматривать себя как безусловных творцов своей собственной истории жизни. Это может повлечь за собой множество самых неожиданных последствий, включая расщепление идентичности, изменение механизмов, формирующих самосознание, самопонимание, самооценку, а значит и существенный сдвиг морально-нравственных норм, ценностей и идеалов. Необходимо отдавать себе отчет в том, что реализация возможностей генетической инженерии приводит к угрозе трансформации не только человеческой телесности (которая является результатом биологической эволюции, насчитывающей миллионы лет), но и собственно человеческой культуры, ее эмоционального строя, черт личности, особенности индивидуального сознания, духовного мира, способов переживания бытия, а также характера самоидентификации личности..
Присвоив себе роль творцов, человечество начинает переделывать природу, исходя исключительно из своей выгоды и не считаясь с балансом, тем самым нарушая всю структуру природных механизмов. Новаторские методы породили дилеммы, несущие в себе вызов моральным ценностям. Здесь важно обратить внимание на то чрезвычайно негативное обстоятельство, что достижения генетики и биомедицины, делая геном человека объектом постороннего вмешательства, катализируют не только возрастание значимости человеческой жизни, но и её падение. Как это ни парадоксально, но девальвация ценности жизни проявляет себя особенно ярко в технологиях, обеспечивающих воспроизводство человеческой жизни. Создание «запасных» зигот и их последующее уничтожение — условие процедуры искусственного оплодотворения. Негативные результаты пренатальной диагностики — повод для искусственного прерывания жизни. Существует реальный риск овеществления эмбриона, а значит, и выросшего из него человека. Человек здесь выступает как творец, проявляя тем самым свою универсальность. Впервые в истории живое становится объектом проектирования и конструирования; тем самым нивелируется различие между живым и неживым как объектами познания и преобразования. Безусловно, такого рода практическая деятельность должна быть ограничена определенными рамками и запретами. Однако до какой степени подобные исследования совместимы с природой и свободой человека? До какого предела следует разрешать экспериментальную интервенцию в человеческий организм, чтобы не нанести непоправимый ущерб человеческому достоинству, уникальности и неповторимости каждого индивида? [19].
В воспроизводстве наиболее важными вопросами являются интересы ребенка, который не может дать свое предварительное согласие или свободно вступать в любую форму договора. Ведь эмбрион является будущей личностью, которая не давала разрешения на проведение опытов.
Также следует отметить, что способность отбирать гены детей и создавать так называемых «дизайнерских детей» будет изменять родителей, которые будут рассматривать своих детей как обычный продукт. Тогда люди начнут оценивать потомство в соответствии со стандартами контроля качества, и это отрицательно повлияет на этический идеал безоговорочного принятия детей, не важно, каковы их способности и индивидуальные черты.
Еще одним вопросом является то, что сегодня никто не может даже приблизительно оценить те последствия, которые повлечет за собой размножение живой материи, созданной искусственно.
Также хочется осветить биоэтические вопросы генетического тестирования. Наиболее глубокие проблемы, относящиеся к прогнозированию, лежат в сфере здравоохранения, где проводится генетическое тестирование. Генные технологии имеют отношение к правам человека и в судебных случаях — например, при установлении отцовства или материнства и при идентификации подозреваемых преступников. Права человека нарушаются и тогда, когда насильственное или даже добровольное тестирование методами генной технологии может представлять угрозу частной жизни индивида, если информация помещается в общедоступную базу данных. Нарушение прав человека в данном случае состоит в том, что подозреваемым становится любой, кто отказывается подвергнуться ДНК-тестированию.
Двигаться вперед или остановиться? Предлагаем поразмышлять….
Автор — Валерия Пугачева
Лещинская, И. Б. Генетическая инженерия / И. Б. Лещинская // Соросовский образовательный журнал. – 1996. – № 1. – С. 32-394.
Мохов, А. А. Использование технологии геномного редактирования: достижения и перспективы / А. А. Мохов, А. А. Чапленко, А. Н. Яворский // Биомедицина. – 2019. – Т. 15, № 2. – С. 34-42.
Молекулярные подходы к безопасной и контролируемой Т-клеточной терапии / Р. С. Калинин [и др.] // Acta Naturae. – 2018. – Т. 10, № 2. – С. 17-25.
Буйнякова, И. С. «Дизайнерские младенцы» социально-этические проблемы биотехнологического проектирования будущих детей / И. С. Буйнякова // Научные ведомости. – 2017. – Т. 40, № 9. – С. 130-139.
Воронцова, З. И. Философские и социокультурные проблемы биогенных технологий / З. И. Воронцова // Новые технологии. – 2009. – № 4. – С. 13-19.
Найдыш, В. М. Философские проблемы антропогенетики генной инженерии (статья вторая) / В. М. Найдыш, Е. Н. Гнатик // Вестник РУДН. – 2009. – № 3. – С. 31-38.
Воронцов, С. А. Морально-этические проблемы развития биотехнологии / С. А. Воронцов // Вестник молодежной науки. – 2017. – Т. 5, № 12. – С. 22-27.
International Union of Immunological Societies: 2017 Primary Immunodeficiency Diseases Committee Report on Inborn Errors of Immunity / C. Picard [et al.] // J. Clin. Immunol. – 2018. – Vol. 38, N 1. – P. 96-128.
Первичные иммунодефициты: принципы терапии и организации медицинской помощи / Н. Chapel [et al] // Frontiers in Immunology. – 2014. – Т. 5, № 12. – С. 1-15.