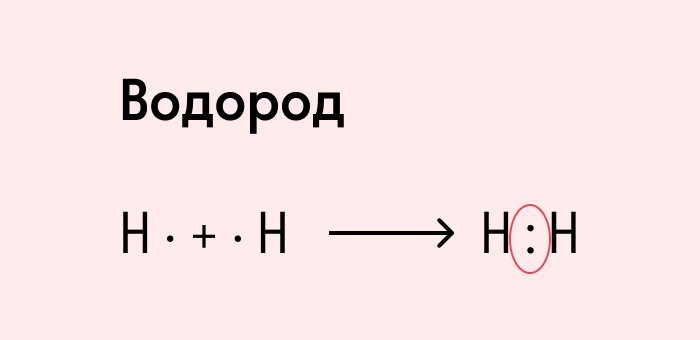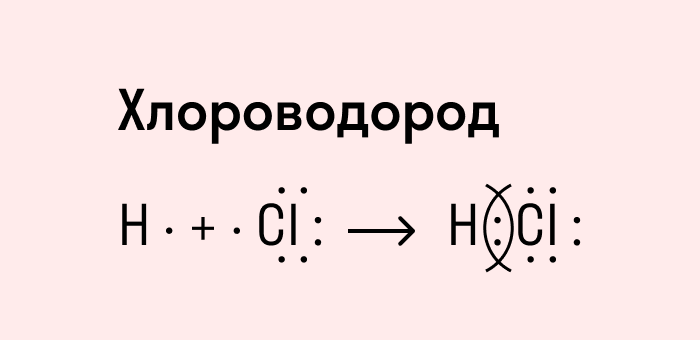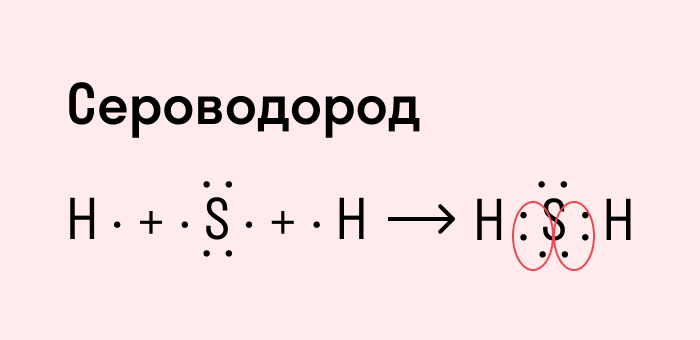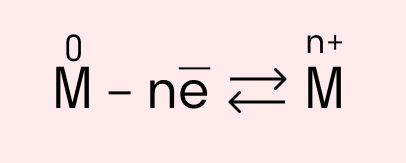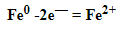в чем сущность металлического ионного и ковалентного типов связи
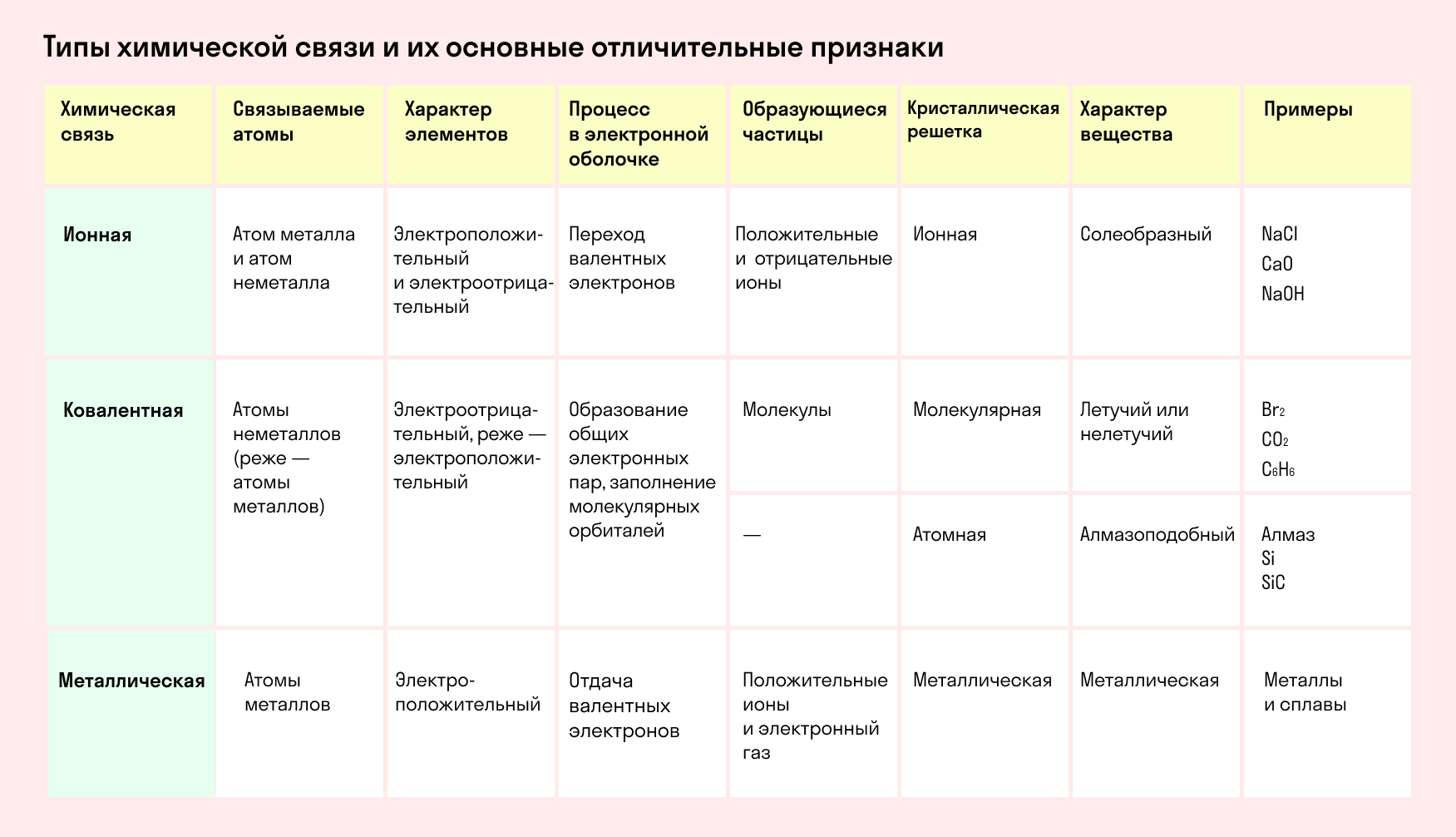
Типы связей: ионная, ковалентная, металлическая, вандервальсовская. Зависимость материалов от типа связей.



1) ионная
Ионная связь – частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому, становящемуся анионом. Основой для выделения этой связи в отдельный тип служит то обстоятельство, что соединения с такой связью можно описывать в электростатическом приближении, считая ионную связь обусловленной притяжением положительных и отрицательных ионов. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщености. Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака (координационное число иона). Ионные пары могут существовать в газообразном состоянии в виде полярных молекул.
Распространенные строительные материалы этого типа – гипс и ангидрит – имеют невысокую прочность и твердость, они неводостойки
2)ковалентная
Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору).
Такие материалы отличаются очень высокой механической прочностью и твердостью, они весьма тугоплавки.
3)металлическая
Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.
Вещества, обладающие металлической связью, часто сочетают прочность с пластичностью, так как при смещении атомов друг относительно друга не происходит разрыв связей.
4)вандервальсовская
Наиболее универсальный вид межмолекулярной связи, обусловлен дисперсионными силами (индуцированный диполь – индуцированный диполь), индукционным взаимодействием (постоянный диполь – индуцированный диполь) и ориентационным взаимодействием (постоянный диполь – постоянный диполь).
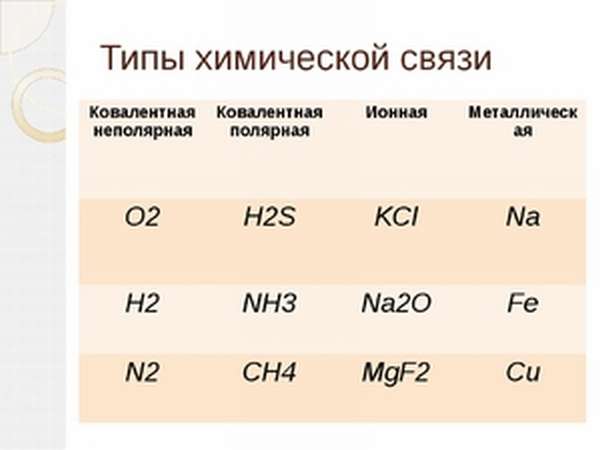
Типы химических связей: ионная, ковалентная, металлическая
Природа химической связи состоит в действии электростатических сил, которые являются силами взаимодействия между электрическими зарядами. Такие заряды имеют электроны и ядра атомов.
Электроны, расположенные на внешних электронных уровнях (валентные электроны) находясь дальше всех от ядра, слабее всего с ним взаимодействуют, а значит способны отрываться от ядра. Именно они отвечают за связывание атомов друг с другом.
Типы взаимодействия в химии
Типы химической связи можно представить в виде следующей таблицы:
| внутримолекулярные | межмолекулярные |
| ионное | водородное |
| металлическое | вандерваальсовое |
| ковалентное | ион-дипольное |
| диполь-дипольное |
Характеристика ионной связи
Наименьшими показателями электроотрицательности обладают типичные металлы, а наибольшими — типичные неметаллы. Ионы, таким образом, образуются при взаимодействии между типичными металлами и типичными неметаллами.
Атомы металла становятся положительно заряженными ионами (катионами), отдавая электроны внешних электронных уровней, а неметаллы принимают электроны, превращаясь таким образом в отрицательно заряженные ионы (анионы).
Атомы переходят в более устойчивое энергетическое состояние, завершая свои электронные конфигурации.
Ионная связь ненаправленная и не насыщаемая, так как электростатическое взаимодействие происходит во все стороны, соответственно ион может притягивать ионы противоположного знака во всех направлениях.
Расположение ионов таково, что вокруг каждого находится определённое число противоположно заряженных ионов. Понятие «молекула» для ионных соединений смысла не имеет.
Примеры образования
Na0 — 1 е = Na + (катион)
Cl0 + 1 е = Cl (анион)
В хлориде натрия вокруг катионов натрия расположено шесть анионов хлора, а вокруг каждого иона хлора шесть ионов натрия.
При образовании взаимодействия между атомами в сульфиде бария происходят следующие процессы:
Химическая связь
Статья находится на проверке у методистов Skysmart.
Если вы заметили ошибку, сообщите об этом в онлайн-чат (в правом нижнем углу экрана).
Химическая связь и строение вещества
Все системы стремятся к равновесию и к уменьшению свободной энергии — так гласит один из постулатов химической термодинамики. Атомы, взаимодействующие в молекуле вещества, тоже подчиняются этому закону. Они стремятся образовать устойчивую конфигурацию — 8-электронную или 2-электронную внешнюю оболочку. Этот процесс взаимодействия называется химической связью, благодаря ему получаются молекулы и молекулярные соединения.
| Химическая связь — это взаимодействие между атомами в молекуле вещества, в ходе которого два электрона (по одному от каждого атома) образуют общую электронную пару либо электрон переходит от одного атома к другому. |
Как понятно из определения химической связи, при взаимодействии двух атомов один из них может притянуть к себе внешние электроны другого. Эта способность называется электроотрицательностью (ЭО). Атом с более высокой электроотрицательностью (ЭО) при образовании химической связи с другим атомом может вызвать смещение к себе общей электронной пары.
Механизм образования химической связи
Существует два механизма взаимодействия атомов:
обменный — предполагает выделение по одному внешнему электрону от каждого атома и соединение их в общую пару;
донорно-акцепторный — происходит, когда один атом (донор) выделяет два электрона, а второй атом (акцептор) принимает их на свою свободную орбиталь.
Независимо от механизма химическая связь между атомами сопровождается выделением энергии. Чем выше ЭО атомов, т. е. их способность притягивать электроны, тем сильнее и этот энергетический всплеск.
| Энергией связи называют ту энергию, которая выделяется при взаимодействии атомов. Она определяет прочность химической связи и по величине равна усилию, необходимому для ее разрыва. |
Также на прочность влияют следующие показатели:
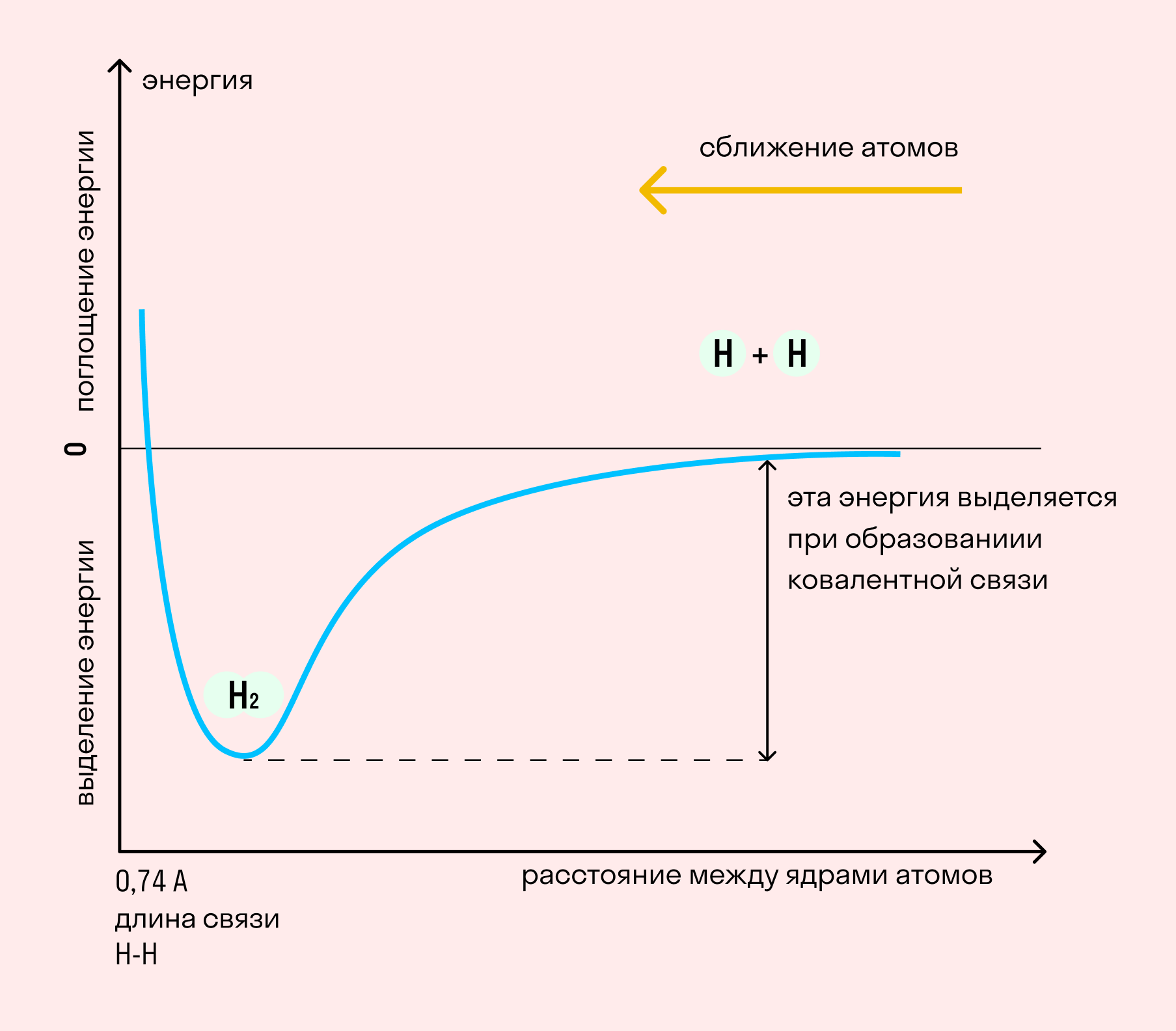
Длина связи — расстояние между ядрами атомов. С уменьшением этого расстояния растет энергия связи и увеличивается ее прочность.
Кратность связи — количество электронных пар, появившихся при взаимодействии атомов. Чем больше это число, тем выше энергия и, соответственно, прочность связи.
На примере химической связи в молекуле водорода посмотрим, как меняется энергия системы при сокращении расстояния между ядрами атомов. По мере сближения ядер электронные орбитали этих атомов начинают перекрывать друг друга, в итоге появляется общая молекулярная орбиталь. Неспаренные электроны через области перекрывания смещаются от одного атома в сторону другого, возникают общие электронные пары. Все это сопровождается нарастающим выделением энергии. Сближение происходит до тех пор, пока силу притяжения не компенсирует сила отталкивания одноименных зарядов.
Основные типы химических связей
Различают четыре вида связей в химии: ковалентную, ионную, металлическую и водородную. Но в чистом виде они встречаются редко, обычно имеет место наложение нескольких типов химических связей. Например, в молекуле фосфата аммония (NH4)3PO4присутствует одновременно ионная связь между ионами и ковалентная связь внутри ионов.
Также отметим, что при образовании кристалла от типа связи между частицами зависит, какой будет кристаллическая решетка. Если это ковалентная связь — образуется атомная решетка, если водородная — молекулярная решетка, а если ионная или металлическая — соответственно, будет ионная или металлическая решетка. Таком образом, влияя на тип кристаллической решетки, химическая связь определяет и физические свойства вещества: твердость, летучесть, температуру плавления и т. д.
Основные характеристики химической связи:
насыщенность — ограничение по количеству образуемых связей из-за конечного числа неспаренных электронов;
полярность — неравномерная электронная плотность между атомами и смещение общей пары электронов к одному из них;
направленность — ориентация связи в пространстве, расположение орбиталей атомов под определенным углом друг к другу.
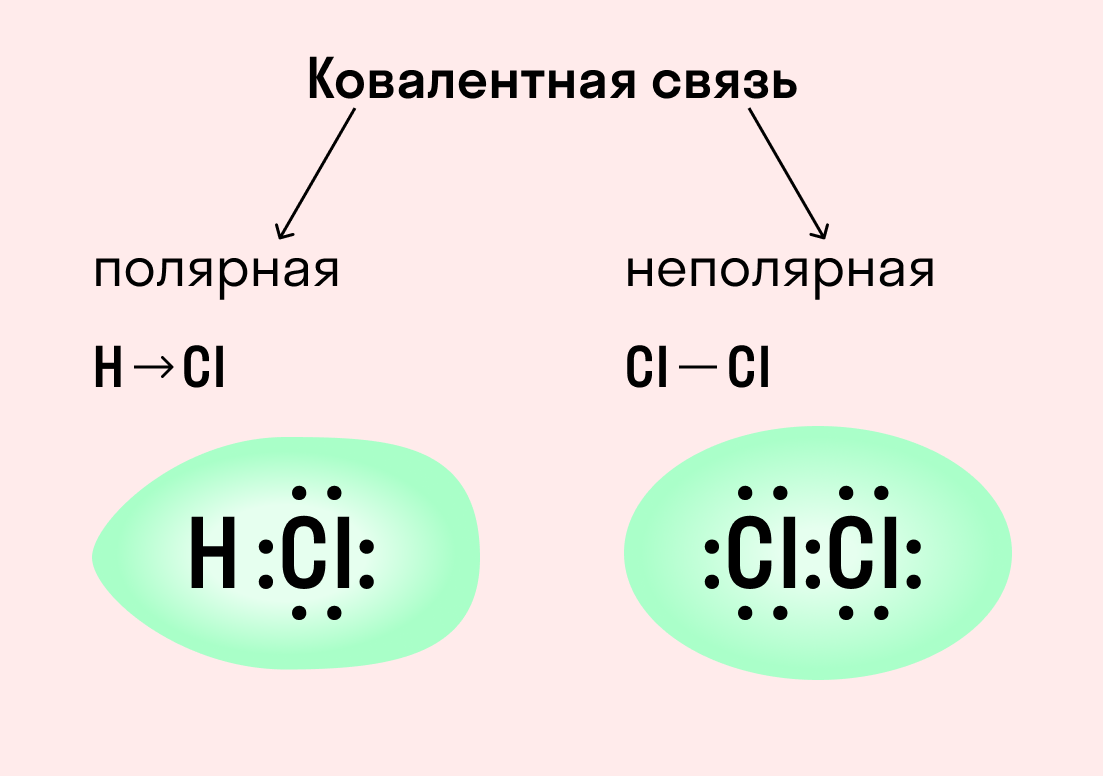
Ковалентная связь
Как уже говорилось выше, этот тип связи имеет два механизма образования: обменный и донорно-акцепторный. При обменном механизме объединяются в пару свободные электроны двух атомов, а при донорно-акцепторном — пара электронов одного из атомов смещается к другому на его свободную орбиталь.
| Ковалентная связь — это процесс взаимодействия между атомами с одинаковыми или близкими радиусами, при котором возникает общая электронная пара. Если эта пара принадлежит в равной мере обоим взаимодействующим атомам — это неполярная связь, а если она смещается к одному из них — это полярная связь. |
Как вы помните, сила притяжения электронов определяется электроотрицательностью атома. Если у двух атомов она одинакова, между ними будет неполярная связь, а если один из атомов имеет большую ЭО — к нему сместится общая электронная пара и получится полярная химическая связь.
Ковалентная неполярная связь образуется в молекулах простых веществ, неметаллов с одинаковой ЭО: Cl2, O2, N2, F2 и других.
Посмотрим на схему образования этой химической связи. У атомов водорода есть по одному внешнему электрону, которые и образуют общую пару.
Ковалентная полярная связь характерна для неметаллов с разным уровнем ЭО: HCl, NH3,HBr, H2O, H2S и других.
Посмотрим схему такой связи в молекуле хлороводорода. У водорода имеется один свободный электрон, а у хлора — семь. Таким образом, всего есть два неспаренных электрона, которые соединяются в общую пару. Поскольку в данном случае ЭО выше у хлора, эта пара смещается к нему.
Другой пример — молекула сероводорода H2S. В данном случае мы видим, что каждый атом водорода имеет по одной химической связи, в то время как атом серы — две. Количество связей определяет валентность атома в конкретном соединении, поэтому валентность серы в сероводороде — II.
Число связей, которые могут быть у атома в молекуле вещества, называется валентностью.
Характеристики ковалентной связи:
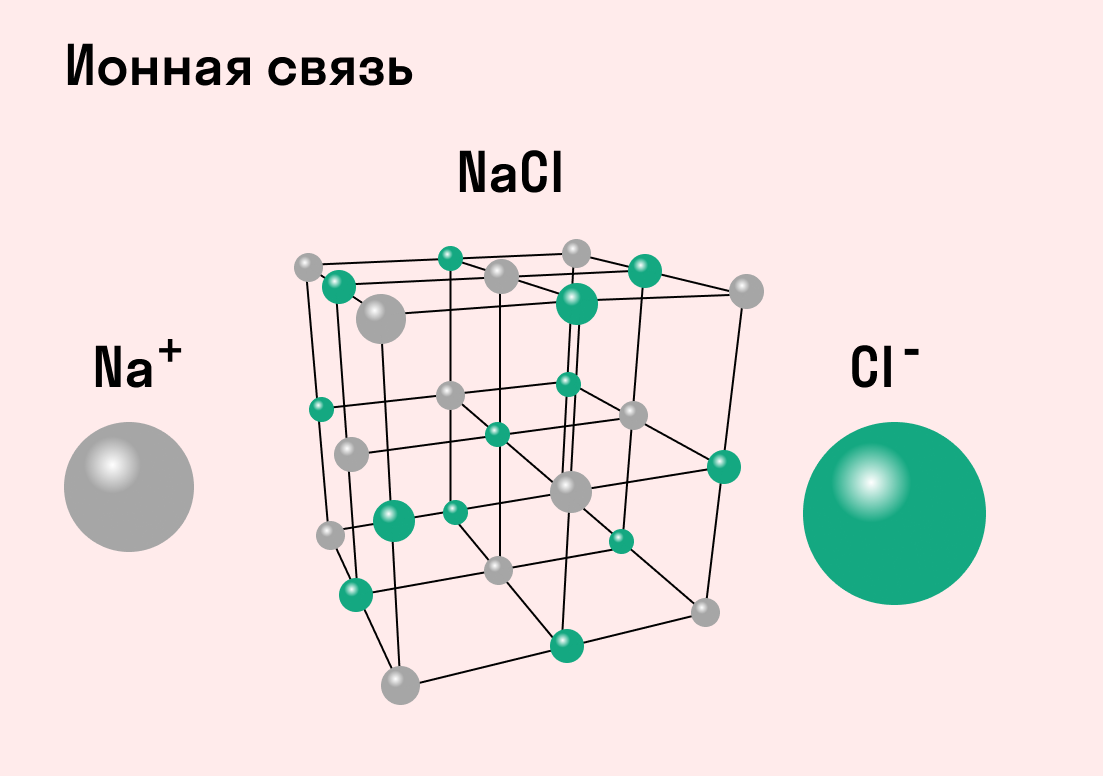
Ионная связь
Как понятно из названия, данный тип связи основан на взаимном притяжении ионов с противоположными зарядами. Он возможен между веществами с большой разницей ЭО — металлом и неметаллом. Механизм таков: один из атомов отдает свои электроны другому атому и заряжается положительно. Второй атом принимает электроны на свободную орбиталь и получает отрицательный заряд. В результате этого процесса образуются ионы.
| Ионная связь — это такое взаимодействие между атомами в молекуле вещества, итогом которого становится образование и взаимное притяжение ионов. |
Разноименно заряженные ионы стремятся друг к другу за счет кулоновского притяжения, которое одинаково направлено во все стороны. Благодаря этому притяжению образуются ионные кристаллы, в решетке которых заряды ионов чередуются. У каждого иона есть определенное количество ближайших соседей — оно называется координационным числом.
Обычно ионная связь появляется между атомами металла и неметалла в таких соединениях, как NaF, CaCl2, BaO, NaCl, MgF2, RbI и других. Ниже схема ионной связи в молекуле хлорида натрия.
Характеристики ионной связи:
не имеет направленности.
Ковалентная и ионная связь в целом похожи, и одну из них можно рассматривать, как крайнее выражение другой. Но все же между ними есть существенная разница. Сравним эти виды химических связей в таблице.
Характеризуется появлением электронных пар, принадлежащих обоим атомам.
Характеризуется появлением и взаимным притяжением ионов.
Общая пара электронов испытывает притяжение со стороны обоих ядер атомов.
Ионы с противоположными зарядами подвержены кулоновскому притяжению.
Имеет направленность и насыщенность.
Ненасыщенна и не имеет направленности.
Количество связей, образуемых атомом, называется валентностью.
Количество ближайших соседей атома называется координационным числом.
Образуется между неметаллами с одинаковой или не сильно отличающейся ЭО.
Образуется между металлами и неметаллами — веществами со значимо разной ЭО.
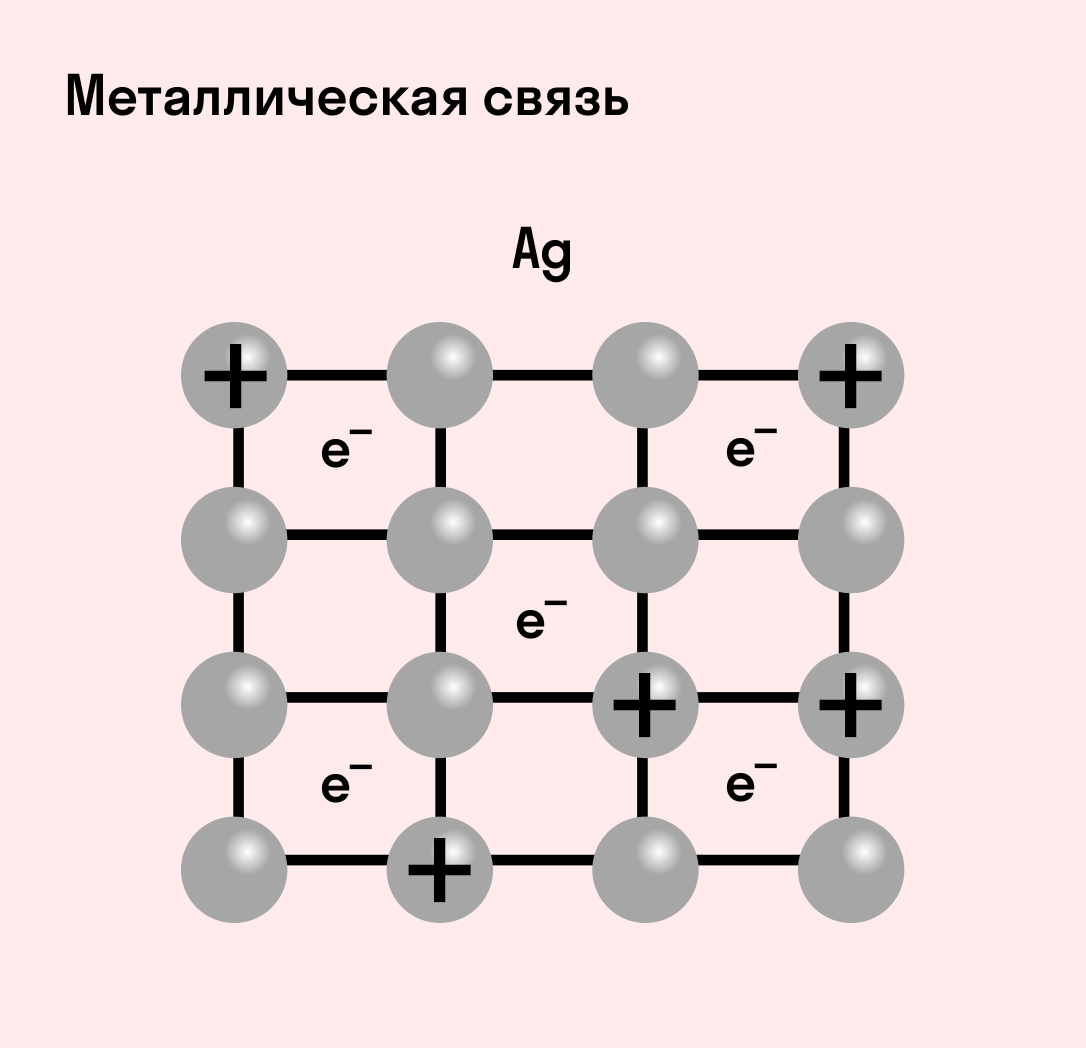
Металлическая связь
Отличительная особенность металлов в том, что их атомы имеют достаточно большие радиусы и легко отдают свои внешние электроны, превращаясь в положительно заряженные ионы (катионы). В итоге получается кристаллическая решетка, в узлах которой находятся ионы, а вокруг беспорядочно перемещаются электроны проводимости, образуя «электронное облако» или «электронный газ».
Свободные электроны мигрируют от одного иона к другому, временно соединяясь с ними и снова отрываясь в свободное плавание. Этот механизм по своей природе имеет сходство с ковалентной связью, но взаимодействие происходит не между отдельными атомами, а в веществе.
| Металлическая связь — это взаимодействие положительных ионов металлов и отрицательно заряженных электронов, которые являются частью «электронного облака», рассеянного по всему объему вещества. |
Наличие такого «электронного облака», которое может прийти в направленное движение, обусловливает электропроводность металлов. Другие их качества — пластичность и ковкость, объясняются тем, что ионы в кристаллической решетке легко смещаются. Поэтому металл при ударном воздействии способен растягиваться, но не разрушаться.
Характеристики металлической связи:
Металлическая связь присуща как простым веществам — таким как Na, Ba, Ag, Cu, так и сложным сплавам — например, AlCr2, CuAl11Fe4, Ca2Cu и другим.
Схема металлической связи:
M — металл,
n — число свободных внешних электронов.
К примеру, у железа в чистом виде на внешнем уровне есть два электрона, поэтому его схема металлической связи выглядит так:
Обобщим все полученные знания. Таблица ниже описывает кратко химические связи и строение вещества.
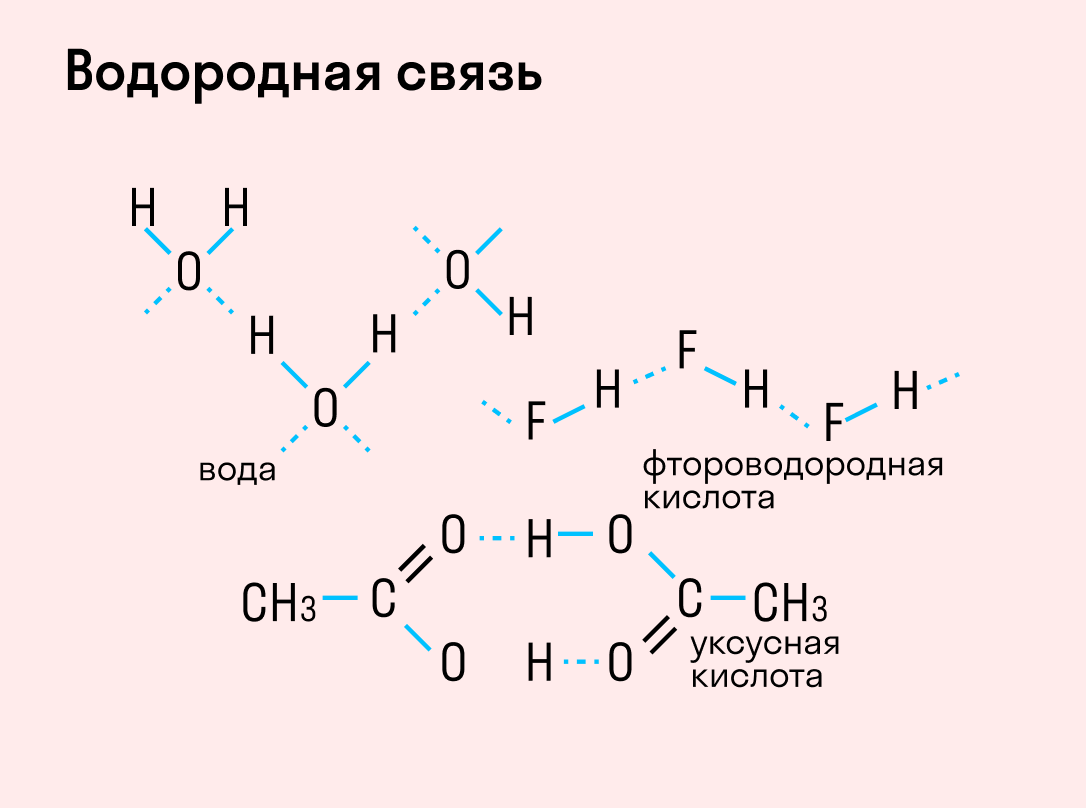
Водородная связь
Данный тип связи в химии стоит отдельно, поскольку он может быть как внутри молекулы, так и между молекулами. Как правило, у неорганических веществ эта связь происходит между молекулами.
| Водородная связь образуется между молекулами, содержащими водород. Точнее, между атомами водорода в этих молекулах и атомами с большей ЭО в других молекулах вещества. |
Объясним подробнее механизм этого вида химической связи. Есть молекулы А и В, содержащие водород. При этом в молекуле А есть электроотрицательные атомы, а в молекуле В водород имеет ковалентную полярную связь с другими электроотрицательными атомами. В этом случае между атомом водорода в молекуле В и электроотрицательным атомом в молекуле А образуется водородная связь.
Такое взаимодействие носит донорно-акцепторный характер. Донором электронов в данном случае выступают электроотрицательные элементы, а акцептором — водород.
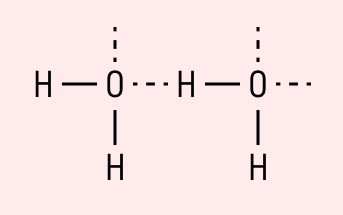
Графически водородная связь обозначается тремя точками. Ниже приведена схема такого взаимодействия на примере молекул воды.
Характеристики водородной связи:
Кратко о химических связях
Итак, самое главное. Химической связью называют взаимодействие атомов, причиной которого является стремление системы приобрести устойчивое состояние. Во время взаимодействия свободные внешние электроны атомов объединяются в пары либо внешний электрон одного атома переходит к другому.
Образование химической связи сопровождается выделением энергии. Эта энергия растет с увеличением количества образованных электронных пар и с сокращением расстояния между ядрами атомов.
Основные виды химических связей: ковалентная (полярная и неполярная), ионная, металлическая и водородная. В отличие от всех остальных водородная ближе к молекулярным связям, поскольку может быть как внутри молекулы, так и между разными молекулами.
Как определить тип химической связи:
Ковалентная полярная связь образуется в молекулах неметаллов между атомами со сходной ЭО.
Ковалентная неполярная связь имеет место между атомами с разной ЭО.
Ионная связь ведет к образованию и взаимному притяжению ионов. Она происходит между атомами металла и неметалла.
Металлическая связь бывает только между атомами металлов. Это взаимодействие положительных ионов в кристаллической решетке и свободных отрицательных электронов. Масса рассеянных по всему объему свободных электронов представляет собой «электронное облако».
Водородная связь появляется при условии, что есть атом с высокой ЭО и атом водорода, связанный с другой электроотрицательной частицей ковалентной связью.
Химическая связь и строение молекулы: типом химической связи определяется кристаллическая решетка вещества: ионная, металлическая, атомная или молекулярная.
Определить тип химической связи в 8 классе поможет таблица.
Разница между ионными ковалентными и металлическими связями
Содержание:
В этой статье рассматриваются,
1. Каковы Ионные Облигации?
— определение, формирование, свойства
2. Что такое ковалентные облигации?
— определение, формирование, свойства
3. Что такое металлические облигации?
— определение, формирование, свойства
4. В чем разница между ионными ковалентными и металлическими облигациями?
Каковы Ионные Облигации
Некоторые атомы имеют тенденцию жертвовать или получать электроны, чтобы стать более стабильными, полностью занимая их крайнюю орбиту. Атомы с очень небольшим количеством электронов в их внешней оболочке имеют тенденцию отдавать электроны и становиться положительно заряженными ионами, в то время как атомы с большим количеством электронов на их внешней орбите имеют тенденцию принимать электроны и превращаться в положительно заряженные ионы. Когда эти ионы сближаются, силы притяжения возникают из-за противоположных зарядов ионов. Эти силы называются ионными связями. Эти стабильные связи также называются электростатические связи, Твердые тела, связанные ионными связями, имеют кристаллическую структуру и низкую электропроводность, что связано с отсутствием свободно движущихся электронов. Связи обычно возникают между металлом и неметаллом, которые имеют большую разницу в электроотрицательности. Примеры ионно-связанных материалов включают LiF, NaCl, BeO, CaF2 и т.п.
Что такое ковалентные облигации
Ковалентные связи образуются, когда два атома делят свои валентные электроны. Два атома имеют небольшую разницу в электроотрицательности. Ковалентные связи возникают между одинаковыми атомами или атомами разных типов. Например, фтору нужен один электрон, чтобы завершить его внешнюю оболочку, таким образом, один электрон делится другим атомом фтора, образуя ковалентную связь, в результате чего F2 молекулы. Ковалентно связанные материалы встречаются во всех трех штатах; т.е. твердое вещество, жидкость и газ. Примеры ковалентно связанных материалов включают газообразный водород, газообразный азот, молекулы воды, алмаз, диоксид кремния и т. Д.
Что такое металлические облигации
В металлической решетке валентные электроны слабо связаны ядрами атомов металла. Таким образом, валентные электроны требуют очень низкой энергии, чтобы освободиться от ядер. Как только эти электроны отсоединяются, атомы металла становятся положительно заряженными ионами. Эти положительно заряженные ионы окружены большим количеством отрицательно заряженных, свободно движущихся электронов, называемых электронным облаком. Электростатические силы образуются из-за притяжения между электронным облаком и ионами. Эти силы называются металлическими связями. В металлических связях почти каждый атом в решетке металла разделяет электроны; поэтому нет способа определить, какой атом разделяет какой электрон. По этой причине электроны в металлических связях называют делокализованными электронами. Благодаря свободно движущимся электронам металлы известны хорошими проводниками электричества. Примеры металлов с металлическими связями включают железо, медь, золото, серебро, никель и т. Д.
Разница между ионными ковалентными и металлическими связями
Определение
Ионная связь: Ионные связи представляют собой электростатические силы, возникающие между отрицательными и положительными ионами.
Бонд Энерджи
Ионные Связи: Энергия связи выше, чем металлические связи.
Ковалентные связи:Энергия связи выше, чем металлические связи.
Металлические облигации: Энергия связи ниже, чем у других первичных облигаций.
формирование
Ионные Связи: Ионные связи образуются, когда один атом предоставляет электроны другому атому.
Ковалентные связи: Ковалентные связи образуются, когда два атома делят свои валентные электроны.
Металлические облигации: Металлические связи образуются, когда переменное число атомов разделяет переменное число электронов в металлической решетке.
проводимость
Ионные Связи: Ионные связи имеют низкую проводимость.
Ковалентные связи: Ковалентные связи имеют очень низкую проводимость.
Металлические облигации: Металлические связи обладают очень высокой электрической и теплопроводностью.
Точки плавления и кипения
Ионные Связи: Ионные связи имеют более высокие температуры плавления и кипения.
Ковалентные связи: Ковалентные связи имеют более низкие температуры плавления и кипения.
Металлические облигации: Металлические связи имеют высокие температуры плавления и кипения.
Физическое состояние
Ионные Связи: Ионные связи существуют только в твердом состоянии.
Ковалентные связи: Ковалентные связи существуют в форме твердых веществ, жидкостей и газов.
Металлические облигации: Металлические связи существуют только в форме твердого тела.
Природа Бонд
Ионные Связи: Связь ненаправленная.
Ковалентные связи: Связь направленная.
Металлические облигации:Связь ненаправленная.
твердость
Ионные Связи: Ионные связи являются твердыми из-за кристаллической структуры.
Ковалентные связи: Ковалентные связи не очень прочны, за исключением алмаза, кремния и углерода.
Металлические облигации: Металлические связи не очень твердые.
тягучесть
Ионные Связи: Материалы с ионными связями не являются податливыми.
Ковалентные связи:Материалы с ковалентными связями не являются податливыми.
Металлические облигации:Материалы с металлическими связями податливы.
тягучесть
Ионные Связи: Материалы с ионными связями не являются пластичными.
Ковалентные связи: Материалы с ковалентными связями не являются пластичными.
Металлические облигации: Материалы с металлическими связями являются пластичными.
Примеры
Ионные Связи: Примеры включают LiF, NaCl, BeO, CaF2 и т.п.
Ковалентные связи: Примеры включают газообразный водород, газообразный азот, молекулы воды, алмаз, диоксид кремния и т. Д.
Металлические облигации: Примеры включают железо, золото, никель, медь, серебро, свинец и т. Д.