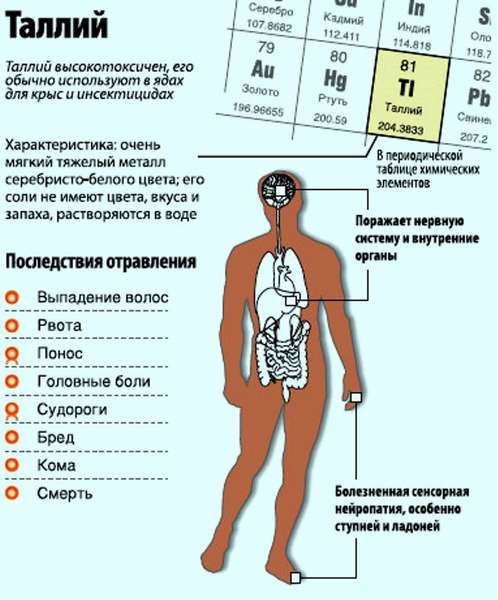
в чем содержится талий
Опасный металл таллий. Применение
Таллий (Tl) и его соединения очень ядовиты — смертельно 
Опасность представляет попадание металла или его производных на кожу, она начинает быстро разрушаться. Еще более опасно вдыхание паров, поэтому при работе с этим реактивом нужно пользоваться надежными и качественными средствами защиты.
В обычной ситуации человек практически никогда не сталкивается с соединениями таллия, но такая возможность существует на некоторых производствах, в лабораториях и в сельском хозяйстве. Элемент входит в состав многих пестицидов и средств борьбы с вредителями сельскохозяйственных культур.
 |  |
| Полнолицевая маска «ЗМ» серии 6900 | Костюм «Л-1» с хранением |
Все работники, контактирующие с таллием или его соединениями, обязательно проходят предварительный инструктаж по правилам безопасности и методам оказания первой помощи.
Для того, чтобы получить тяжелое отравление, требующее неотложного врачебного вмешательства, достаточно 1 грамма металла. Вдыхание паров может привести к смерти даже при своевременно оказанной помощи.
Острое отравление приводит к сильной боли в желудке, тошноте, рвоте, диарее, судорогам, сильной слабости, тахикардии. Через 6 часов после отравления человек начинает терять координацию движений, речь становится несвязной, парализуются глаза (пострадавший смотрит в одну точку), наблюдается спутанность сознания, потом потеря сознания и кома.
При регулярном воздействии небольших доз симптомы не выражены, человек чувствует лишь постоянное недомогание. Поэтому работники, имеющие дело с соединениями Tl, должны регулярно проходить медосмотр.
Первая помощь при отравлении таллием
Чтобы облегчить состояние пострадавшего и дать ему возможность дождаться врачебной помощи, следует:
• вывести пострадавшего на свежий воздух или в хорошо проветриваемое помещение;
• вызвать скорую помощь;
• дать выпить много теплой воды и вызвать рвоту, чтобы промыть желудок;
• дать выпить сорбенты для впитывания и удаления токсина, например, активированный уголь или Смекту.
Применение
• Чистый металл востребован в производстве стеклообразных полупроводников.
• Монокристаллы галогенидов таллия прозрачны для ИК-излучения; применяются в приборах инфракрасной оптики (линзы, призмы, кюветы, перископы, микроскопы, ИК-спектрометры и т.п.).
• Из галогенидов изготавливаются световоды для лазеров, в том числе для хирургических лазеров.
• Монокристаллы хлорида таллия или его сплава с бромидом востребованы в детекторах высокоэнергетических частиц. Сплавы Tl с цезием используются в детекторах, устанавливаемых в телескопах, химических лазерах.
• Оксид входит в состав сверхпроводящей высокотемпературной керамики. Сверхпроводники, содержащие таллий, отличаются стабильностью и стойкостью к магнитным полям. Пленки из таких материалов применяются в интегральных схемах.
• Входит в состав некоторых сплавов со свинцом, отличающихся высокой стойкостью к коррозии и кислотам. Tl добавляют в подшипниковые свинцовые сплавы.
• Соли элемента используются для выплавки оптических стекол с высоким коэффициентом преломления и дисперсией; для изготовления цветных стекол.
• Соли Tl применяются в косметологии (в лампах для солярия), в медицине (лечение стригущего лишая).
• Радиоактивные изотопы применяются как источник бета-излучения в контролерах толщины полотна бумаги или ткани, в дефектоскопах.
• Соединения с таллием используются в качестве тяжелых жидкостей для разделения минералов по плотности.
• Сульфат таллия — пестицид, применяемый в сельском хозяйстве.
Отравление таллием
Таллий является редко встречающимся металлом на Земле. Но случаи отравления им не так уж и редки. Отравление таллием протекает тяжело, зачастую приводит к летальному исходу. Сравнить по токсичности можно со свинцом и мышьяком, опасен, как и кристаллический фенол. Более токсичен, чем ртуть, находящаяся перед таллием в таблице Менделеева. Следует познакомиться поближе с этим опасным металлом.
Каковы же его свойства и характеристики?
У вещества порошковая консистенция, бело-серебристой расцветки. Применяется обширно, особенно находясь в составе противоядий от грызунов. Для проведения радиологического обследования сердца используются соли таллия, а также сульфат таллия, как и в роли катализатора для фейерверков и в изготовлении оптических линз.
Этот химический элемент располагается в третьей группе таблицы Менделеева и имеет голубой оттенок. Бывает он одно- и трёхвалентным, более токсичным ядом считается одновалентный элемент. В природе он присутствует мало и не концентрированно, потому добывают его при обработке и добыче солей тяжёлых металлов (например, из свинца). В жирной и водной среде соединения таллия практически не растворяются.
Существует таллий в следующих состояниях:
Также этот элемент встречается в человеческом организме, роль его полноценно еще не изучена. Ученые предполагают, что в организм он попадает вместе с растительной пищей. Содержится он также в:
Оксид таллия, как и прочие его соединения, распределяется по организму равномерно. Меньше всего его в кишечнике, волосяном покрове и зубах, в большом объеме отмечается в жировых тканях, чуть больше в мышцах и жирах. Гидроксид таллия или в другой форме в организме должен быть в пределах 0,1 мг, норма повышается до 0,5 мг при большой мышечной массе.
Какова токсикогенетика этого вида отравления?
Острое отравление таллием может произойти из-за намеренного и случайного попадания в организм больших порций солей металла. Парами и пылью металлов можно получить повреждения дыхательной системы, поражение происходит и при контактах с кожным покровом.
Ядам легко впитываться в кровь, и большая часть оседает в сердечных мышцах, почках, слюнных железах и печени. Сравнительно малой являются отложения в мозге и жировых тканях. Выводится элемент в основном через желудок. Около месяца составляет срок полувыведения яда.
Как же происходит интоксикация?
Отравление солями таллия опасно тем, что он способен не только нарушать структуру клеток, но также и накапливаться в ней. Он способен изменять свойства молекул, так как способен взаимодействовать с различными энедогенными лигандами. Также он может образовывать связи с низкомолекулярными соединениями. Накапливаясь в клетках кожи, вещество поражает их.
Оксид таллия, находясь в организме, выбирает мишенью транспортные системы биомембран, работу ферментов, а также структурные белки. Повреждения происходит также и лизосом, эндоплазматического ретикулума. Механизмы работы биологически активных веществ нарушаются.
Каковы же симптомы?
Отравление таллием происходит при употреблении веществ с содержащимся таллием в количестве более 1 грамма. Летальный исход наступает при приёме дозы в 600 мг. Есть разница во временных рамках проявления симптоматики отравлений, как хронических, так и острых, но можно отследить и общие схожие проявления.
В течение первых 3-4 часов могут проявиться первые симптомы:
В течение следующих 7 суток поражается нервная система, проявляется это в следующих симптомах:
Гидроксид таллия и прочие соли также со временем вызывают нарушения в работе всех систем организма.
Если отравление в хронической стадии, то симптоматика весьма расплывчата, проявиться может на последних стадиях. В основном присутствуют нарушения функционирования желудочно-кишечного тракта. Такое состояние характеризуется следующей симптоматикой:
Как диагностировать?
Чтобы получить информацию о наличии таллия в организме, нет смысла использовать рентген, так как он в данном случае незаметен, используется для диагностирования рентгенограмма. При попадании в организм этого вещества в значительных дозах, его концентрация варьируется в пределах 300-2000 мкг/л, а экскреция за сутки превосходит 10-20 мкг. Оксид таллия в организме также можно заметить при помощи электроэнцефалограммы, заметные небольшие изменения, также в периферических нервах замедляется нервная проводимость.
Варианты лечения
В желудке и кишечнике таллий впитывать помогает прусский голубой, который в кристаллической решетке заменяет таллий калием, благодаря чему он не всасывается в кровь. Употребить нужно 250 мг/кг однократно. Для очищения желудка применяют цитрат магния или маннитол (в качестве слабительных препаратов).
Последствия отравления и профилактические меры
Оксид таллия в организме сверх нормы может привести к тяжелым последствиям, а также нарушить нормальное функционирование организма. Необходимо избегать прямых контактов с веществами, которые содержат в своем составе гидроксид таллия или другие его производные.
Интоксикация имеет не разовые последствия, а более серьезные, ведь таллий очень токсичен. Развиться может бесплодие, число врожденных пороков, импотенция, гормональные нарушения и нарушения психики, хроническими заболеваниями дыхательной системы и желудочно-кишечного тракта. Летальный исход возможен от инфаркта или же инсульта.
Если подвести итоги, то отравление таллием, как высокотоксичным элементом, очень опасно. Отравиться можно не только в производственных условиях, но и в бытовых. Все системы в организме разрушаются под его воздействием, особенно страдает нервная и мышечная системы.
Лечение необходимо начинать сразу же. В первую очередь необходимо ввести прусскую синь, эффективный антидот. Также следует всегда осуществлять профилактические меры и осторожность, особенно на производстве.
Видео
Насколько тяжелым может быть отравление таллием? Ответ на этот вопрос вы найдете, посмотрев видеосюжет.
Это вещество – самый популярный химический элемент в художественной литературе. Именно таллием убивают друг друга персонажи детективов Агаты Кристи. Его, как и мышьяк, окрестили «ядом наследников».
Однако вещество востребовано металлургами, врачами, учеными.
Что представляет собой
Таллий – это элемент периодической системы №81 с примечательными свойствами:
Главная характеристика таллия – токсичное вещество номер один на планете.
Есть и радиоактивные изотопы. Для их полураспада хватает пяти минут, созданы лабораторно.
Международное обозначение – Thallium (Tl).
Как был обнаружен
История открытия металла связана с именами двух ученых, обнаруживших его одновременно (1861-1862 годы):
Металл назван благодаря зеленой окраске линий спектра и пламени. По этому параметру опознается среди других элементов.
Древнегреческий термин θαλλος означает «зеленая веточка».
Как представлен в природе
Месторождений таллия на планете не существует: элемент рассеян по толще других пород либо образует собственные минералы.
Его находят в разных локациях:
Таллиевые минералы (семь наименований) – редкость.
Тонна земной коры содержит 0,7 г таллия.
Технология получения
Таллий как металл извлекают из пыли, выносимой доменными газами на металлургических комбинатах. Главные компоненты – железо и известняк. Плюс толика никеля, цинка, кадмия, индия. А также астата, теллура, свинца, других элементов.

Процесс производства многоступенчат:
Далее применяют электролиз:
Металл получают плавкой в печи, заполненной водородом, при 360-410°С.
Физико-химические характеристики
Таллий – не совсем типичный металл. Кристаллическая структура меняется в зависимости от температуры. Модификаций три, « рубиконом » служат температуры 234°C и 25°C.
При минус 270,7°C металл становится сверхпроводником.
Кубик таллия с ребром 1 см весит 11,85 грамма.
| Свойства атома | |
|---|---|
| Название, символ, номер | Та́ллий / Thallium (Tl), 81 |
| Атомная масса (молярная масса) | [204,382; 204,385] а. е. м. (г/моль) |
| Электронная конфигурация | [Xe] 4f14 5d10 6s2 6p1 |
| Радиус атома | 171 пм |
| Химические свойства | |
| Ковалентный радиус | 148 пм |
| Радиус иона | (+3e) 95 (+1e) 147 пм |
| Электроотрицательность | 1,62 (шкала Полинга) |
| Электродный потенциал | Tl←Tl+ −0,338 В Tl←Tl3+ 0,71 В |
| Степени окисления | 3, 1 |
| Энергия ионизации (первый электрон) | 588,9 (6,10) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 11,849 г/см³ |
| Температура плавления | 577 K (304 °C, 579 °F) |
| Температура кипения | 1746 K (1473 °C, 2683 °F) |
| Уд. теплота плавления | 4,31 кДж/моль |
| Уд. теплота испарения | 162,4 кДж/моль |
| Молярная теплоёмкость | 26,3 Дж/(K·моль) |
| Молярный объём | 17,2 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | a=3,456 c=5,525 |
| Отношение c/a | 1,599 |
| Температура Дебая | 96,00 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 38,9 Вт/(м·К) |
| Номер CAS | 7440-28-0 |
Где используется
Металл нашел применение у промышленников, ученых, врачей:
Хранят таллий под слоем кипяченой воды, парафина либо в герметично закрываемой емкости.
Таллий в истории отравлений
Историей зафиксировано два громких криминальных инцидента с таллием в «главной роли».
Таллиевое безумие в Австралии
Внимание к себе привлекла жительница Сиднея Ивонна Флетчер. Эта мать двоих детей обрела репутацию «черной вдовы»: оба ее мужа умерли с одинаковыми симптомами. Вину и средство убийства (таллий из крысиного яда) доказали.
«Мститель» из Таганрога
Место и время действия – авиазавод в Таганроге (Ростовская область, Россия), 2017-2018 годы.
Инженер Шульга, «обидевшись», травил сослуживцев – 34 человека. Он добавлял к закупаемой бутилированной воде – 19-литровые емкости – изготовленное лично вещество.
Все остались живы, но пострадали.
Влияние на человека
Таллий, его соединения отнесены к первому классу опасности. То есть абсолютно токсичны.
По стандартам РФ, кубометр воды не должен содержать больше 0,0001 мг таллия. Кубометр воздуха на специализированных предприятиях – 0,01 мг.
В организм человека металл попадает с пищей, воздухом или через кожу.
Явный признак отравления – выпадение волос. Другие симптомы:
Таллий
(молярная масса)
Tl←Tl 3+ 0,71 В
(первый электрон)
Таллий — элемент 13-й группы периодической таблицы химических элементов (по устаревшей классификации — элемент главной подгруппы III группы), шестого периода, атомный номер 81. Обозначается символом Tl (лат. Thallium ). Относится к группе тяжёлых металлов. Простое вещество таллий — мягкий, чрезвычайно токсичный металл серебристо-белого цвета с серовато-голубоватым оттенком.
Содержание
История
Таллий был открыт спектральным методом в 1861 году английским учёным Уильямом Круксом в шламах свинцовых камер сернокислотного завода вблизи города Аббероде, расположенным в горном массиве Гарц.
Металлический таллий был независимо получен Уильямом Круксом и французским химиком Клодом-Огюстом Лами в 1862 году.
Происхождение названия
Название элемент получил по характерным зелёным линиям своего спектра и зелёной окраске пламени. От др.-греч. θαλλός — молодая, зелёная ветвь.
Нахождение в природе
Среднее содержание таллия (по массе):
Изотопы
Природный таллий состоит из двух стабильных изотопов: 205 Tl (изотопная распространённость 70,48 % по числу атомов) и 203 Tl (29,52 %). В ничтожных количествах в природе встречаются также радиоактивные изотопы таллия, являющиеся промежуточными членами рядов распада:
Все остальные известные изотопы таллия с массовыми числами от 176 до 217 получены искусственно.
Получение
Технически чистый таллий очищают от других элементов, содержащихся в колошниковой пыли (Ni, Zn, Cd, In, Ge, Pb, As, Se, Te), растворением в тёплой разбавленной кислоте с последующим осаждением нерастворимого сульфата свинца и добавлением HCl для осаждения хлорида таллия (TlCl). Дальнейшая очистка достигается электролизом сульфата таллия в разбавленной серной кислоте с использованием проволоки из платины с последующим плавлением выделившегося таллия в атмосфере водорода при 350—400 °C.
Свойства
Таллий — блестящий серебристый мягкий металл с голубоватым оттенком. На воздухе быстро тускнеет, покрываясь чёрной плёнкой оксида таллия Tl2O. В воде в присутствии кислорода растворяется с образованием TlOH, в отсутствие кислорода не реагирует, поэтому таллий хранят под слоем прокипячённой дистиллированной воды (или парафина, а также покрывают лаком).
Физические свойства
Сечение захвата тепловых нейтронов атомом — 3,4 ± 0,5 барн. Конфигурация внешних электронов — 6s 2 6p. Энергии ионизации (в эВ): Tl 0 →Tl + →Tl 2+ →Tl 3+ →Tl 4+ соответственно равны 6,1080; 20,4284; 29,8; 50,0.
При температуре 2,39 K таллий переходит в сверхпроводящее состояние.
Спектр таллия в видимом диапазоне имеет яркую линию с длиной волны 525,046 нм (зелёный), благодаря которой этот элемент и получил своё название.
Твёрдость по Моосу 1,3, по Бриннелю 20 МПа.
Химические свойства
Реагирует с неметаллами: с галогенами и кислородом при комнатной температуре, с серой, селеном, теллуром, фосфором — при нагревании. С мышьяком сплавляется без образования соединения. С водородом, азотом, углеродом, кремнием, бором, а также с аммиаком и сухим углекислым газом не реагирует.
Легко растворяется в азотной кислоте, хуже — в серной. Соляная кислота на таллий действует слабо из-за пассивации плёнкой монохлорида таллия.
Не реагирует со щелочами, с этанолом в присутствии растворённого кислорода образует этилат таллия.
В соединениях проявляет степени окисления +1 и +3. Наиболее устойчивы соли Tl(I), которые напоминают соли калия, серебра и свинца. Под действием бромной воды, перманганата калия, бромата калия, дисульфата калия Tl(I) окисляется до Tl(III), соли которого термически малоустойчивы, легко гидролизуются и восстанавливаются. В растворах Tl(III) восстанавливается до Tl(I) под действием диоксида серы, сероводорода, тиосульфата натрия и ряда металлов, включая цинк, железо и медь. Известны соединения, в которых таллий присутствует сразу в двух степенях окисления, например гексахлороталлат(III) таллия(I) Tl3[TlCl6].
Применение
Биологическая роль и физиологическое воздействие
Таллий не играет значительной биологической роли (среди тяжёлых металлов). Как сам таллий, так и его соединения высокотоксичны и канцерогенны в больших концентрациях (в особенности растворимые в воде — хлорид, нитрат, ацетат и т. д.). Соединения таллия относят к категории кумулятивных ядов — накапливающиеся патологические симптомы при хроническом отравлении.
В больших дозах соединения таллия поражают периферическую нервную систему, желудочно-кишечный тракт и почки.
Ионы одновалентного таллия Tl + замещают ионы калия в биохимических процессах из-за сходства их химических свойств. Таллий концентрируется в волосах, костях, почках и мышцах.
Характерный симптом отравления соединениями таллия — частичное выпадение волос, при значительной дозе — тотальная алопеция. При высокой дозе — алопеция нехарактерна, так как человек погибает от отравления до наступления потери волос.
При отравлении таллием или его соединениями в качестве антидота используется берлинская лазурь.
Первая помощь при отравлении таллием — промывание желудка раствором 0,3 % тиосульфата натрия (Na2S2O3) с взболтанным порошком активированного угля.
Криминальные отравления соединениями таллия описаны в ряде остросюжетных произведений детективной литературы и кинофильмов.
Известные случаи отравления таллием
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| 8 | Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | Ubs |
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu,
Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2,
W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au