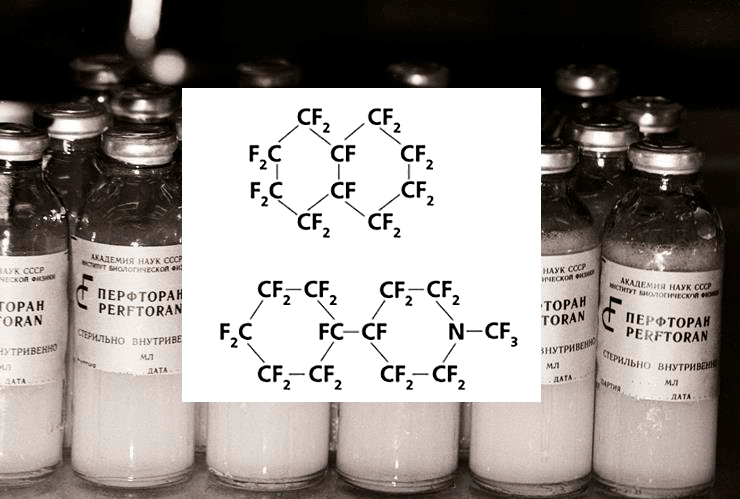в чем содержится резус фактор
В чем содержится резус фактор
Rh, Rh type, Rh typing, Rh-factor, rhesus factor.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Резус-фактор – это белок, находящийся на поверхности эритроцитов у некоторых людей. Кровь тех, у кого он есть, называют резус-положительной, у кого нет – резус-отрицательной. Наличие или отсутствие этого белка является индивидуальной особенностью, а не патологией. Положительный резус-фактор встречается у 85 % людей, соответственно, отрицательный – у 15 %.
Особое значение резус-фактор имеет во время беременности. Если у матери положительный резус, то ее кровь будет в любом случае совместима с кровью ребенка, если отрицательный – возможны варианты: в том случае, когда у отца ребенка тоже отрицательный резус-фактор, кровь матери будет совместима с кровью плода, потому что и ребенок унаследует отрицательный резус, когда же у отца положительный резус-фактор, а у матери отрицательный, с вероятностью в 50 % может возникнуть несовместимость крови матери и ребенка – резус-конфликт, который грозит осложнениями.
Происходит это следующим образом: когда кровь плода попадает в кровоток матери, на его положительный резус в ее организме начинают вырабатываться антитела, так как белки на молекулах эритроцитов воспринимаются организмом матери как нечто чужеродное. Это не опасно для женщины, однако антитела через плаценту проникают в кровоток плода, что грозит ему негативными последствиями: антитела «приклеиваются» к эритроцитам плода и могут вызывать их слипание. Этот процесс называется гемолизом. Гемолиз во время беременности может привести к нарушениям развития плода и в некоторых случаях к выкидышу, а после рождения – к так называемой гемолитической желтухе новорождённых, при которой в крови младенца разрушается значительное количество эритроцитов. При этом кожа новорождённого желтеет, так как продукты распада эритроцитов окрашены именно в желтый цвет. Чаще всего поражается головной мозг, может развиться водянка. В тяжелых случаях младенцу требуется переливание крови.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Если у женщины резус-отрицательная кровь и положительный результат на антирезусные антитела, необходимо определение группы крови и резус-фактора отца ребенка. Если у отца отрицательный резус-фактор, дальнейшего обследования не требуется, если положительный – проводится дальнейшее наблюдение за динамикой уровня антирезусных антител в крови матери. При его повышении следует принять своевременное решение о терапии.
Кто назначает исследование?
Акушер-гинеколог, врач-терапевт, врач общей практики, гематолог, трансфузиолог, хирург.
«Кровавая» работа врачей, ученых и природы
«Кровавая» работа врачей, ученых и природы
Только сейчас, спустя 100 с лишним лет после открытия групп крови, начали появляться ответы на вопросы: «Зачем человечеству необходимы разные группы крови?» и «Как можно избежать ВСЕХ осложнений при ее переливании?»
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Никто из нас не застрахован от непредвиденных обстоятельств, когда судьбу может решить каждая минута. Например, в результате серьезной травмы, тяжелых родов или операций человек может потерять слишком много крови. Еще в античные времена люди поняли, что такие кровопотери можно компенсировать вливанием крови других людей, однако долгое время такие процедуры были безуспешны, зачастую ухудшали состояние и так тяжелого больного, а иногда даже приводили к смерти. Лишь с начала XX века переливания крови были поставлены на поток. Это произошло благодаря тому, что австрийский ученый Карл Ландштейнер понял, что кровь разных людей отличается по набору неких молекулярных меток, и чтобы переливания были успешны, эти молекулы у донора и реципиента должны быть совместимы. Что же это за метки и какие у них свойства? Почему кровь людей разная? Ведь неспроста же природа исхитрилась, создавая все это разнообразие. Каково современное состояние трансфузиологии, учения о переливании крови, и как человечество пришло к тому, что мы имеем сейчас в этой области? Давайте же разберемся в иммунологической гематологии и постараемся ответить на все эти вопросы.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019.
Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступила компания BioVitrum.
У каждой клетки крови есть своеобразный молекулярный «паспорт» — набор меток (антигенов), показывающий, что собой представляет клетка и, главное, где она прописана. По тому, какие антигены содержатся на эритроцитах человека, определяют его группу крови. Каждый день, каждую минуту иммунная система проверяет все эти «паспорта»-антигены, и, если хоть у одной клетки набор некоторых, клинически важных, антигенов будет не совпадать с соответствующим набором у остальных клеток, принимаются соответствующие меры. Весь этот процесс очень сложен и регулируется десятками генов. Именно из-за наличия этой многоуровневой защиты долгое время переливания крови были настолько рискованными, что на них даже налагался запрет. Современные достижения учения о переливаниях крови построены буквально на костях сотен жертв медицины прошлого. Давайте же начнем свой рассказ с того, что проследим историю развития учения о переливаниях крови.
Становление трансфузиологии
Маленькие успехи и большие неудачи
Люди с древнейших времен понимали, насколько важна кровь. Древние философы называли ее «вместилищем жизни», а древнегреческий врач Гиппократ, «отец медицины», считал, что кровь даже влияет на характер. Такого же мнения были и жители Древнего Рима, которые, в надежде стать сильными и смелыми, выпивали кровь умирающих гладиаторов.
Античные, а затем и средневековые лекари пытались давать кровь своим пациентам внутрь или в качестве мази. Нам, «стоящим на плечах великанов», понятно, что это, разумеется, не помогало, а если и помогало, то исключительно из-за пресловутого эффекта плацебо, но тогда медицина еще не была настолько развита, чтобы врачи это осознавали.
Самый абсурдный в этом плане случай произошел в конце XV века, когда напоить кровью пытались смертельно больного Папу Римского Иннокентия VIII. Когда Папа впал в кому, трем десятилетним мальчишкам пообещали дать по монетке в обмен на их кровь. Ребята, конечно же, согласились. После того, как им вскрыли вены, их кровь стали вливать понтифику через рот (рис. 1). Как и следовало ожидать, эта процедура не увенчалась успехом и привела к гибели всех трех мальчиков, а также самого Папы [1].
Рисунок 1. Гравюра, изображающая «переливание крови» Папе Иннокентию VIII подпись
Проблему этого подхода люди поняли лишь в 1628 году, когда англичанин Уильям Гарвей описал замкнутую систему кровообращения. Открытие Гарвея было встречено огромной критикой ученых, придерживающихся консервативных взглядов, согласно которым кровь образуется в печени из пищи и движется по венам, слепо заканчивающимся в органах. Тем не менее открытие кровообращения Гарвеем ученые со временем все же признали [2], [3].
Поняв, что выпитая пациентом кровь не дает ровным счетом ничего, медики начали обдумывать, как бы ввести чужую кровь прямо в вены нуждающегося в ней человека. Первые эксперименты проводили на животных. Так, в 1657 году была проведена первая в истории внутривенная инъекция, когда известный английский медик, математик, физик, архитектор (на этом поприще он знаменит тем, что после пожара 1666 года перестроил весь центр Лондона) и просто хороший человек Кристофер Рен ввел алкоголь в кровоток собаки, и она, как и ожидал исследователь, опьянела [4].
Спустя десятки лет тщетных и иногда даже неоправданно жестоких опытов над животными (тогда верили, что наука, как и красота, требует жертв), в 1666 году, когда Рен уже переквалифицировался в архитекторы, его соотечественник Ричард Ловер сделал первое успешное переливание крови от животного к животному. После того как маленькой собачке выпустили кровь, почти доведя ее до смерти, Ловер вскрыл артерию у большого мастифа и перелил от него часть крови той самой собачке. В результате обе собаки выжили. Этот опыт мгновенно стал «популярен», и именно с этого момента принято отсчитывать кровопролитную, во всех смыслах этого слова, историю трансфузиологии [5].
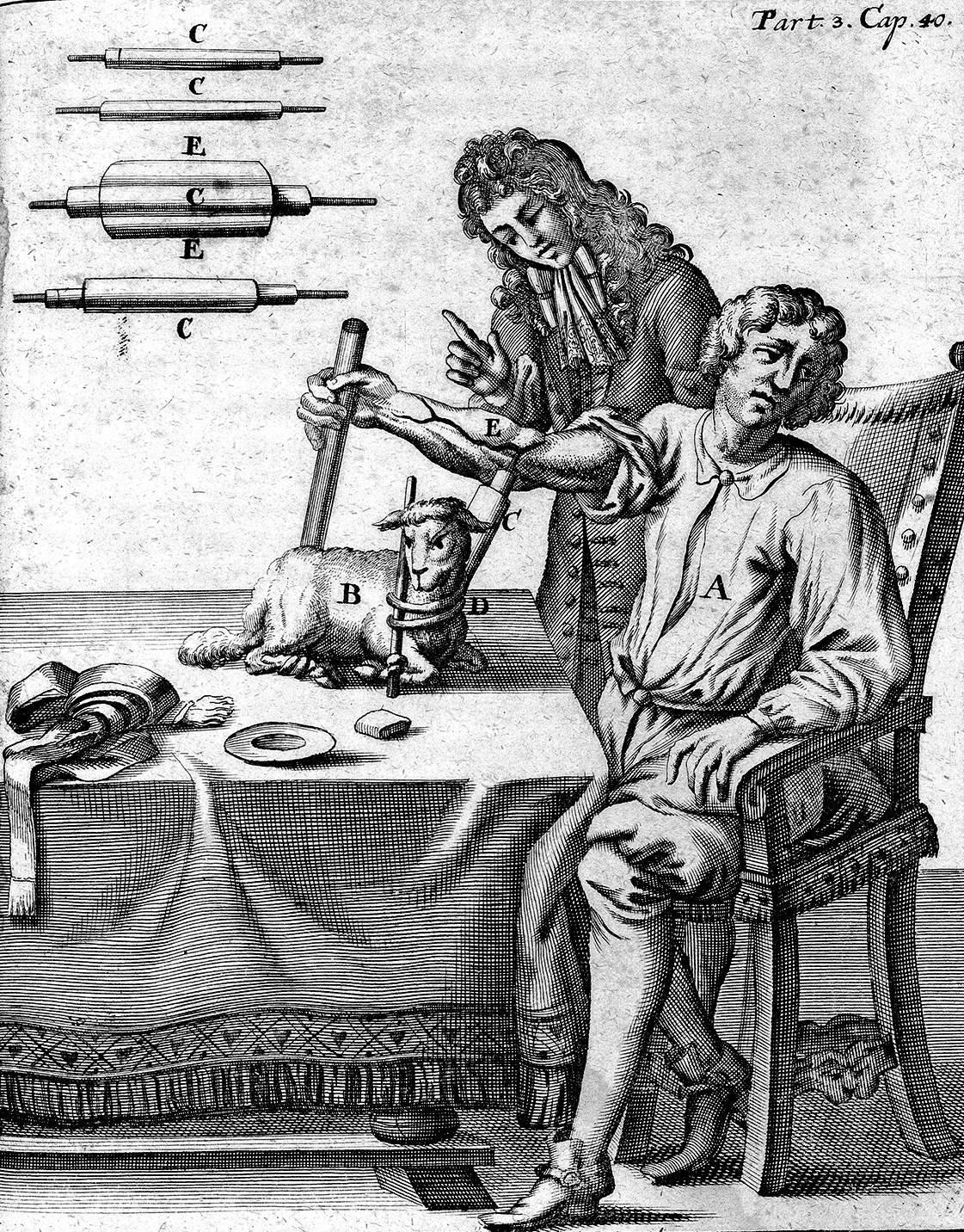
Через год, летом 1667 года случилось первое успешное переливание крови от животного к человеку. Этим счастливчиком оказался 15-летний французский мальчик, который выпустил себе много крови из-за желания поправить свое здоровье. Ничем хорошим это, естественно, не кончилось: мальчик не только не излечился от прежних недугов, но и заработал новые из-за серьезной кровопотери (вот до чего может довести самолечение!). Когда доктор Жан-Батист Дени ознакомился с этим случаем, он вспомнил о недавних популярных опытах Ловера на собаках и решил зайти еще дальше — перелить кровь от овцы к человеку (переливания крови от животных к людям (рис. 2) теперь называют ксенотрансфузиями (xen (лат.) — «чужой»). Удивительно, но мальчик выжил. Удачно закончился и второй эксперимент доктора, когда тот переливал кровь строителю. Вероятнее всего, оба пациента выжили из-за того, что крови Дени перелил им не так много, чтобы это вызвало отторжение. Сейчас есть данные, что в принципе в очень небольших количествах кровь от некоторых животных (например свиней) переливать человеку можно. Однако это нерентабельно, так как в современных клиниках имеется достаточно человеческой донорской крови. Третья трансфузия прошла уже не так гладко, как хотелось бы. Не посчастливилось шведскому барону Густаву Бонде, которому медик сделал целых два переливания: почти сразу после второй трансфузии барон скончался. Трагический исход был и у четвертого случая. Тогда чудаковатый парижанин Антуан Моруа, который нагишом бродил по улицам и выкрикивал всякие неприличные вещи, был принужден Дени к прохождению переливания в целях поправить психику. После вливания крови теленка Моруа скончался (по одной из версий, он умер совсем не из-за неудачной трансфузии, а из-за того, что при загадочных обстоятельствах отравился мышьяком), а горе-врача обвинили в убийстве. После долгих тяжб врач чудом был оправдан (тем не менее он решил оставить врачебную практику), но было решено, что во Франции больше никогда не будут проводить переливания крови без одобрения вышестоящих органов. После еще нескольких неудачных процедур трансфузии и вовсе запретили [6], [7].
Рисунок 2. Переливание крови от ягненка к человеку. Гравюра 1705 года.
Носитель характера и молодости
Выбор овец и телят в ходе тех опытов был отнюдь не случайным, и не был связан с удобством и доступностью крови скота. В качестве «доноров» крови в XVII веке использовали самых разных животных, при этом выбор «донора» в каждом случае осуществляли по довольно экстравагантным критериям. Считалось, что получение чужой крови меняет душу и наделяет реципиента теми чертами, которые донор проявлял в своей жизни. Поэтому врачи, проводившие такие эксперименты, стремились найти баланс между личностями донора и реципиента, чтобы создать человека с равномерными качествами. Так, если у пациента был бурный нрав, идеальным донором был кроткий ягненок. А если пациент наоборот был слишком застенчив, избиралась кровь более общительных существ, например, собак.
Рисунок 3. Здание, в котором размещался институт в первые годы своего существования, — бывший особняк купца Игумнова на Якиманке, ныне — резиденция французского посла в Москве (слева). Справа — основатель института Александр Богданов (Малиновский).
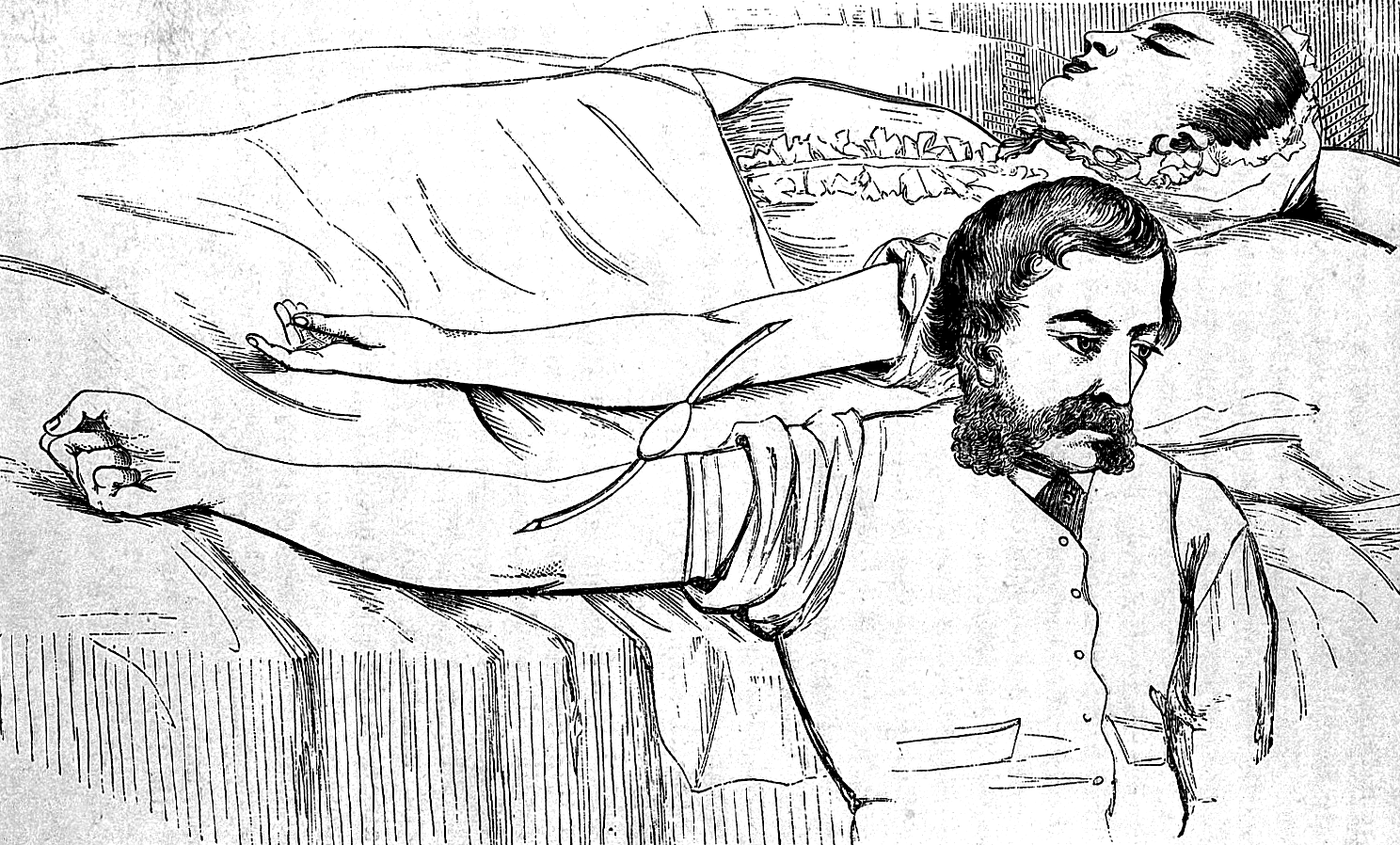
После оглушительного провала с чудаковатым парижанином, на защиту которого встал весь тогдашний научный мир, исследования возобновились лишь спустя более чем 100 лет. В 1795 году американский врач Филипп Синг Фисик провел первое в истории переливание крови от человека к человеку, но ото всех скрыл это, боясь ареста (рис. 4).
Рисунок 4. Рисунок из британского медицинского труда 1873 года, показывающий процедуру переливания крови
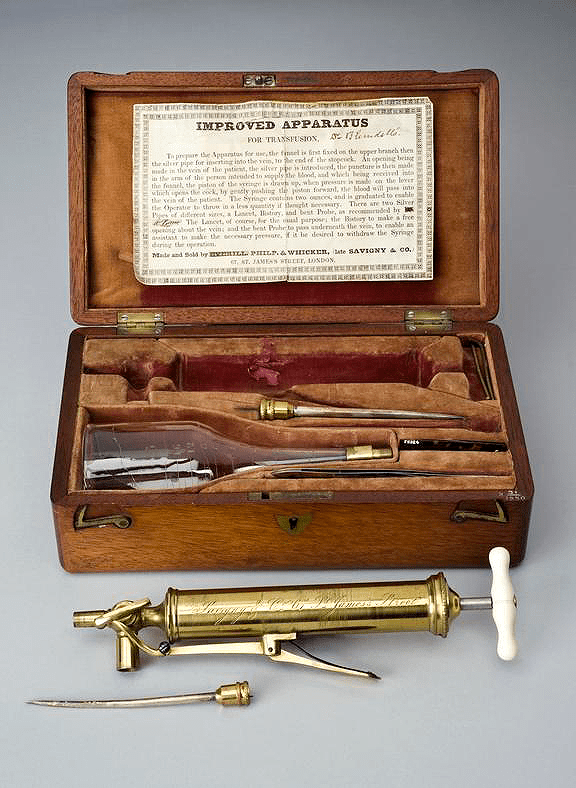
Рисунок 5. Прибор Бланделла для переливания крови
А еще через несколько лет, в 1818 году, лондонский акушер Джеймс Бланделл впервые придал огласке переливание крови между двумя людьми, которое он провел, спасая рожениц от послеродовых кровотечений. Кроме того, Бланделл изобрел удобные инструменты для переливания крови (рис. 5) [10].
Последующие годы процедура много раз повторялась и совершенствовалась, но так и не получила должного распространения — она оставалась слишком рискованной. Если на кону не стояла жизнь больного, медики не спешили браться за переливание. Некоторым оно спасало жизнь, у других же во время процедуры или сразу после резко повышалась температура, появлялась желтуха и начиналась тяжелая лихорадка. С чем это было связано, объяснить никто не мог. Объяснение этих загадочных реакций людей на трансфузии появилось совершенно неожиданно.
Карл Ландштейнер: революционер в трансфузиологии
Многие годы спустя, в 1900 году, работая на кафедре патологической анатомии Венского университета, австрийский ученый Карл Ландштейнер (рис. 6) внезапно столкнулся с любопытным феноменом. Он заметил, что сыворотка крови (плазма, лишенная фибриногена — главного фактора свертывания) одних людей при добавлении эритроцитов других, часто (но не всегда), вызывала их слипание.
Карл Ландштейнер знаменит не только своими исследованиями крови. Кроме этого, он, в частности, открыл вирус полиомиелита, вакцина от которого сегодня даже входит в «Национальный календарь профилактических прививок». Подробнее о биографии знаменитого ученого можно прочитать в статье «Тема песни для Цоя: Карл Ландштейнер» на «Биомолекуле» [56].
Рисунок 6. Карл Ландштейнер, первооткрыватель групп крови и вируса полиомиелита, в своей лаборатории
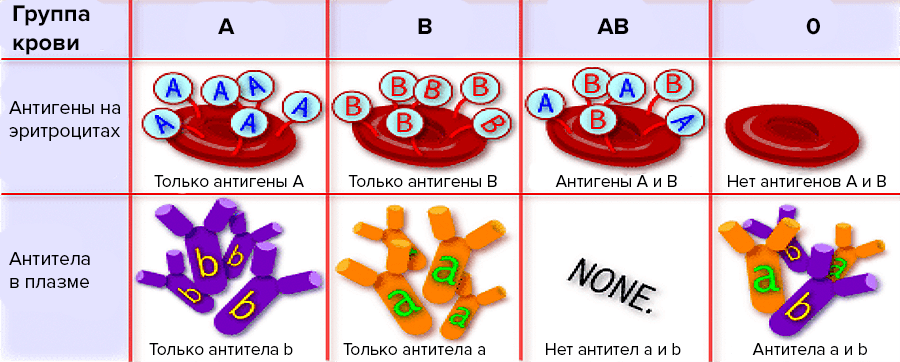
Ученый заинтересовался и решил провести более широкую серию опытов. Взяв кровь у себя и пяти своих коллег, он отделил сыворотку от эритроцитов и взялся смешивать полученные образцы. Проанализировав их реакции между собой и применив познания в комбинаторике, Ландштейнер заключил, что в сыворотке могут находиться антитела двух видов (α и β), которые он назвал агглютининами. При смешении крови и сыворотки разных людей антитела связываются с распознаваемыми антигенами на поверхности эритроцитов, склеивая красные клетки друг с другом. Эти антигены ученый назвал агглютиногенами и выделил тоже два их вида — A и B. В норме реакции слипания эритроцитов (агглютинации, лат. agglutinatio — приклеивание) в крови не происходит. Вливание же человеку крови несовместимой группы ведет к тому, что агглютинины распознают «чужие» антигены на эритроцитах и начинают избавляться от этих клеток, склеивая, а затем и разрушая их. Это ведет к так называемому посттрансфузионному шоку, который проявляется в виде гемолитической анемии, почечной недостаточности и может даже привести к смерти. Просуммировав все это, ученый сформулировал главное правило трансфузиологии: «В организме антиген группы крови и антитела к нему никогда не сосуществуют, причем в плазме всегда находятся антитела к отсутствующим на эритроцитах антигенам» (рис. 7) [11].
Рисунок 7. Главное правило трансфузиологии: антитела в плазме и соответствующие им антигены на эритроцитах никогда не встречаются вместе в организме. Так, например, у людей группы крови A на эритроцитах есть только антигены A, а в плазме — только антитела β.
Антитела против себя
При аутоиммунной гемолитической анемии (AIHA) у человека возникают те же самые симптомы, что и при неудачных трансфузиях: гемолиз, желтуха из-за повышения в организме уровня билирубина (продукта распада гемоглобина), почечная недостаточность, гипертония и обмороки. Впервые с этой болезнью (которую тогда назвали индуцированной кровью желтухой) столкнулись в 1871 году, но далеко не сразу поняли, в чем дело. Об аутоиммунном характере этой желтухи первым заговорил Карл Ландштейнер, а в 1938 году предположение подтвердили.
Причины AIHA изучены не полностью. Предположительно, она возникает, когда в эритроциты встраиваются инфекционные антигены, неудачно пытаясь замаскироваться под человеческие, либо же когда человеческий антиген почему-то изменил свою структуру. Причинами этого могут быть онкологические заболевания, влияние некоторых лекарств (например пенициллина) или ядов, инфекций (например ВИЧ) или других аутоиммунных заболеваний (так, хорошо изучена связь AIHA и системной красной волчанки [57]).
Лечение AIHA разработано уже в наши дни и зависит от причины. Оно может включать применение кортикостероидов, внутривенных иммуноглобулинов, иммуносупрессантов, удаление селезенки (производящей антитела), также требуется отказ от гемотрансфузий, отмена некоторых препаратов и прочее [12].
Ландштейнер в 1900 году открыл первые три группы крови — A, В и С. Группу С потом переименуют в 0, так как она связана с отсутствием антигенов на эритроцитах. Через два года коллеги Ландштейнера Альфред де Кастелло и Адриано Стурли описали четвертую группу крови как «не имеющую типа» — AB (потом оказалось, что у людей с этой группой крови на эритроцитах есть как антиген A, так и антиген B). Эту групповую систему, первую из всех открытых, стали впоследствии называть AB0 — по названиям соответствующих антигенов. В странах СНГ принято эти группы крови нумеровать римскими цифрами — так, 0 группа крови у нас называется I, A — II, B — III и AB — IV [13].
За свои открытия Ландштейнер получил в 1930 году Нобелевскую премию. Открытие Ландштейнера было настолько тепло воспринято, что все запреты из прошлых веков сразу сняли, выведя трансфузии «на поток» — подбор донора по их совместимости позволил значительно снизить число осложнений при переливании. Открытие Ландштейнера имеет настолько большое значение для медицины, что день рождения ученого, 14 июня, даже решено было отмечать как Всемирный день донора.
. в этот день мы выражаем благодарность людям, которые добровольно и безвозмездно сдают кровь, необходимую для спасения человеческих жизней, и повышаем осведомленность о необходимости регулярного донорства крови для того, чтобы обеспечить всем лицам и сообществам своевременный доступ к приемлемым по стоимости поставкам безопасной крови и продуктов крови гарантированного качества, что является неотъемлемой частью всеобщего охвата услугами здравоохранения и одним из ключевых компонентов эффективных систем здравоохранения.
ВОЗ о Всемирном дне донора крови [14]
Карл Ландштейнер не остановил на этом изучение крови. В течение следующих пятидесяти лет он плотно исследовал молекулярный состав крови, открыв в ходе этих опытов множество других систем групп крови. Эти системы не так часто сегодня используются в практике и поэтому малоизвестны для широкой аудитории. Всего их существует более 30, и в дальнейшем мы остановимся на них подробнее. Ученый планировал ввести результаты своих исследований в криминалистику в целях использования различных антигенов крови в качестве «молекулярных отпечатков пальцев».
Даже после открытия групповой системы AB0 довольно часто случались необъяснимые реакции на переливания крови. Так, в 1939 году американский врач-гематолог русского происхождения Филипп Левин и его коллега Руфус Стетсон столкнулись с довольно интересной пациенткой. Мало того, что у нее наблюдалась необъяснимая реакция на переливание крови той же группы, выражающаяся в агглютинации эритроцитов, так еще и у ее новорожденного ребенка были симптомы, которые приписывались так называемому неонатальному эритробластозу, — его клетки крови агглютинировали и распадались, а цвет его кожи был болезненно желтым. Взяв у этой пациентки кровь на анализ, доктора выяснили, что ее кровь несовместима с кровью примерно 80% людей той же группы. Тогда этот случай (как и еще несколько подобных) перешел в ранг «загадок медицины» [15].
Разгадка же произошла всего через год, когда в 1940 году уже знакомый нам Карл Ландштейнер и его коллега доктор Александр Винер в ходе исследований «молекулярных отпечатков пальцев» выявили сыворотку, которая вызывает агглютинацию при сливании примерно с 85% различных эритроцитов человека. Эта сыворотка была получена путем иммунизации кроликов с эритроцитами макаки резуса. Антиген, вызвавший иммунизацию, назвали резус-фактором, чтобы показать, что во время опытов использовали кровь макаки резус. Вскоре подробно описали подобную систему и у человека, которая, как показали исследования 1942 года, хоть немного и отличается от обезьяньей, но все же сильно не нее похожа, и ее тоже стали называть резус-фактором [16].
На пути к совершенству
Знания по трансфузиологии в начале XX века все накапливались, однако имелось ограничение — хранение крови «на черный день» было невозможным из-за того, что она имеет свойство сворачиваться. Если пациенту срочно требовалась кровь, то возникала необходимость немедленно искать подходящего донора. Все изменилось в 1915 году, когда в госпитале Маунт Синай в Нью-Йорке Ричард Левисон впервые использовал антикоагулянт цитрат натрия (вещество, препятствующее свертыванию), чтобы законсервировать донорскую кровь и использовать ее в будущем [17]. Так произошел переход от прямого переливания крови от одного человека к другому (при помощи трубки) к непрямому. Несмотря на всю значимость этого изобретения, цитрат стали активно использовать только через 10 лет, когда повсеместно начали открываться так называемые банки крови, где и хранили разную донорскую кровь. В ходе Первой мировой войны Великобритания использовала мобильные станции переливания крови для лечения тяжелораненых солдат. Впервые в истории люди поняли, насколько трансфузии важны. В дальнейшем в состав антикоагулянта для переливаний, помимо цитрата натрия, стали входить лимонная кислота, глюкоза и фосфат натрия. Это позволило увеличить срок хранения крови до 42 суток [18].
Трансфузиология сыграла огромную роль и во время Второй мировой войны. Именно тогда система банков крови во всех странах-союзниках заработала централизованно и на всю катушку, массово начали применять непрямое переливание крови (рис. 8), изобрели хорошие аппараты для прямого и непрямого переливания крови (рис. 9), а кровь стали обеззараживать сульфаниламидом (сегодня кровь людей, страдающих рядом заболеваний, вовсе не допускают к переливаниям, но тогда, в условиях острого ее дефицита, на это закрывали глаза). Одна только Великобритания снабдила союзные войска почти 50 000 литрами крови [19]!
Рисунок 8. Непрямое переливание крови в Красной армии во время Великой Отечественной войны
Рисунок 9. Шприц для прямого переливания крови от одного человека к другому времен Второй мировой войны
После окончания войны, когда начала набирать силы «новая биология», на основе иммунологии, генетики и биохимии постепенно вырабатывались современные положения в трансфузиологии. Так, интенсивные исследования позволили к 1957 году точно определить молекулярное строение молекулы-агглютиногена, а в 1959 году — ее биосинтез. Сам процесс переливания крови тоже претерпел множество изменений. Появилось гораздо больше разнообразных «проверок» крови на пригодность, включая диагностику инфекций (в частности, ВИЧ) и других антигенов, которые могут вызывать нежелательные реакции.
Но наука на этом не останавливается, и сейчас проводят (и будут проводить) множество исследований, которые позволят минимизировать все риски, связанные с переливаниями крови. Результаты некоторых из этих исследований будут освещены дальше, в главе о современной трансфузиологии. А пока что давайте рассмотрим само понятие «группа крови».
Группы крови по Ландштейнеру
Термин «группы крови» обозначает системы антигенов эритроцитов, которые определяются генами с разным количеством возможных их вариантов (причем строго определенным — потому-то кровь и разбивают по группам). Например, в системе AB0 есть всего два возможных типа антигенов — A и B, комбинации которых и определяют группу крови по этой системе. Всего же в мембране эритроцитов человека содержится более 300 разных антигенов, которые относятся к 36 различным системам групп крови, и несовпадение примерно по четверти из них может привести к осложнениям при переливаниях! Правда, в медицине наибольшее значение имеют только две системы, реакции несовместимости крови по которым более серьезны и могут случиться с большей вероятностью — это AB0 и резус-фактор. Однако же реакции, связанные с несовместимостью крови по другим системам иногда все же случаются, например, при повторных переливаниях, после беременностей и т. д.
Надо сказать, что в клетках крови содержится в несколько раз меньше некоторых антигенов групп крови (в том числе, антигенов системы AB0), чем, например, в слюне или кишечнике (по факту, эти молекулы есть почти во всех клетках и жидкостях организма), и поэтому в англоязычной литературе их уже называют не антигенами групп крови, а антигенами гистогрупп (от названия науки о тканях — гистологии). В связи с этим определение групп крови необходимо также в трансплантологии, так как реакции несовместимости групп крови могут возникать и при пересадке твердых органов.
Группы крови — это не чисто человеческая история. Эритроциты животных имеют на своей поверхности антигены с аналогичными свойствами. У обезьян найдены антигены АВ0 и резус (обратите внимание, резус-антигены даже названы в честь обезьяны, у которой их обнаружили), что говорит о том, что эти системы имеют древнюю историю. Кровь других животных иногда (но не всегда — именно поэтому не каждый опыт до 1900 года кончался плачевно) агглютинирует с кровью человека, но в целом структура антигенов группы крови у животных далеко не всегда похожа на структуру таковых у людей. Так, у собак основной является система DEA, насчитывающая несколько групп крови (притом антигены двух из них — DEA 4 и DEA 6 — присутствуют у 98% всех собак), а всего групповых систем у них 13. Наиболее тяжелая реакция случается при переливании крови более редкой группы DEA 1.1 (этот антиген есть примерно у 40% всех собак); собаки с такой группой крови — универсальные реципиенты [20]. Однако есть одно разительное отличие крови собак от крови людей. На этих животных не распространяется главное правило трансфузиологии — не всегда в их организме с рождения присутствуют антитела, реагирующие на отсутствующие антигены. Однако же иногда собаки (как и люди) могут вырабатывать антитела на отсутствующие у них антигены.
Есть несколько предположений касательно происхождения системы AB0 (рис. 10). Согласно первой, варианты гена AB0 возникли независимо сами по себе в Европе, Азии и Южной Америке соответственно, и постепенно распространились. Но мы знаем, что на каждом материке наблюдаются изолированные популяции с этими же группами крови. Так, у народов, проживающих в Сибири (а это отдаленная местность), высока частота встречаемости первой группы (0). Так что это предположение, скорее всего, в корне не верно. Согласно другой гипотезе, появление групп крови A и B произошло в результате мутаций генотипа первой группы крови. Эту гипотезу доказывает то, что более древние и изолированные народы имеют бóльшую частоту ее встречаемости, чем менее древние. Есть и третья гипотеза, согласно которой раньше всего возникла группа крови AB (IV), а мутации в генах со временем привели к возникновению групп крови A, B и, наконец, 0. В пользу этой теории говорят два факта. Во-первых, мутации потери функции происходят чаще, чем мутации ее приобретения. Во-вторых, согласно недавним исследованиям ископаемых останков древних людей, мутации, приведшие к появлению группы крови 0 (I), произошли за историю человечества как минимум три раза и каждый раз настойчиво закреплялись эволюцией. Поэтому-то, в том числе, I группа, несмотря на рецессивность, встречается очень часто [13].
Рисунок 10. Две теории эволюции групп крови человека. Согласно первой (слева), все группы крови произошли от первой, согласно второй (справа) — от четвертой.
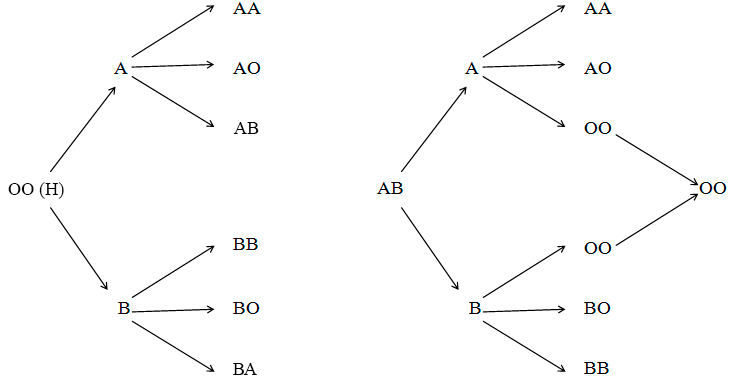
У человека существует 23 пары хромосом (одна половина от отца, другая от матери). Две хромосомы в каждой паре похожи друг на друга — одни и те же позиции (локусы) в них занимают гены, отвечающие за одни и те же признаки. Такая же история и с геном AB0 — в определенном локусе на девятой хромосоме находится один из трех его вариантов (аллелей), определяющих группу крови, — А, В или 0. Так как хромосом пара, группу крови определяет именно сочетание двух аллелей — отцовской и материнской. Варианты A и B отвечают за синтез соответствующих антигенов, а вот ген 0 — нефункционирующий вариант. Аллели A и B доминантные (если они встречаются вместе, а это происходит в случае четвертой группы крови, то на эритроцитах находятся как антигены A, так и антигены B; генетики называют такой случай кодоминированием), а ген 0 — рецессивный. То есть наследование групп крови не отступает от законов Менделя. Таким образом, у людей 0 (I) группы крови может быть только генотип 00, у людей A (II) группы — генотипы A0 и AA, у людей B (III) — B0 и BB, а у людей AB (IV) группы — только AB. Своим детям человек может передать любой из двух имеющихся у него вариантов гена АВ0. На основе этого можно, например, определить, какая группа крови может быть у того или иного человека, или же попытаться разоблачить неверную жену, решая задачки по наследованию групп крови (рис. 11), [21].
Ген АВ0 кодирует фермент гликозилтрансферазу, который проводит модификацию мембранного белка H. Аллели А и В дают чуть различающиеся варианты фермента, первый из которых преобразует белок H в антиген А, а второй — в антиген В. А вот в варианте 0 гена АВ0 появляется делеция гуанина-258 вблизи N-конца будущего белка, что приводит к сдвигу рамки считывания и синтезу нефункционального продукта. Этот фермент уже не может модифицировать белок H, поэтому ни антиген А, ни антиген В не появляются у людей с группой крови 0. Подробности найдете в следующей главе. — Ред.
Рисунок 11. Наследование групп крови системы AB0. В процентах выражена вероятность рождения ребенка с той или иной группой крови у данной пары родителей.
Как же определяют группу крови в лабораторных условиях? В основе этого метода лежат опыты Ландштейнера, но только вместо сывороток используют очищенные моноклональные антитела-агглютинины анти-А и анти-B, которые синтезируют в лабораториях биотехнологическими методами и затем разводят в изотоническом солевом растворе. Смешивая растворы тех или иных антител с эритроцитами пациента, можно определить, есть ли на них распознаваемые агглютининами антитела, и из этого понять, какая группа крови у пациента. Аналогичными методами определяют и наличие антигенов других групп крови, например, резус-фактор [21].
Моноклональные антитела, которые можно выработать против практически любого природного антигена, широко используются как в молекулярной биологии и биохимии, так и в медицине. О производстве и использовании моноклональных антител на «Биомолекуле» есть отдельная статья: «Моноклональные антитела» [58].
До изобретения моноклональных антител кровь донора и реципиента просто смешивали в пробирке, и если они не агглютинировали, брались за переливание. Впервые такой тест провел в 1907 году нью-йоркский врач Рубен Оттенберг. Он отметил «универсальную» пригодность крови I группы, а спустя пять лет Роджер Ли, врач из Массачусетса, показал, что пациентам с IV группой подходит любая другая [10]. Группу крови же определяли, сливая кровь неизвестной группы с несколькими образцами крови известной группы, и по протекающим реакциям делали вывод о ее антигенном составе. Таблица 1 иллюстрирует, какие группы крови и резус-факторы в целом совместимы и относительно редко вызывают побочные эффекты при переливании.
| Группа крови | Донор для людей с. | Реципиент для людей с. |
|---|---|---|
| A+ | A+, AB+ | A+, A–, 0+, 0– |
| 0+ | 0+, A+, B+, AB+ | 0+, 0– |
| B+ | B+, AB+ | B+, B–, 0+, 0– |
| AB+ | AB+ | Любая группа |
| A– | A+, A–, AB+, AB– | A–, 0– |
| 0– | Любая группа | 0– |
| B– | B+, B–, AB+, AB– | B–, 0– |
| AB– | AB+, AB– | AB–, A–, B–, 0– |
Довольно своеобразной системой групп крови является резус. Как оказалось в ходе исследований второй половины XX века, резус крови — это сложная система, включающая целых 49 антигенов, обозначаемых разными символами. Однако все мы знаем, что резус может быть положительным или отрицательным (Rh+\Rh–). Так вот, это определяется наличием на эритроцитах одного из резус-белков, который обладает самой сильной активностью — антигена D (RhD). Система резус-факторов отдаленно напоминает систему AB0 — тут тоже есть антигены и антитела к ним. Разница лишь в том, что, в отличие от агглютининов, с самого рождения антител к чужому резус-фактору в организме нет. Они начинают вырабатываться после того, как организм встретит и как следует «обнюхает» чужой резус (это пример аллоиммунизации — процесса, когда иммунитет «знакомится» с антигенами другого человека, а атаку начинает, если встретит их еще раз). И потому проблемы чаще возникают при повторных переливаниях не совпадающей по резусу крови.
Наследование резус-фактора
Резус наследуется по такому же принципу, что и группы AB0. Положительный резус — доминантный признак и обозначает наличие белка D; отрицательный — рецессивный, поскольку за него отвечает испорченный ген положительного резуса, который кодирует белок, неспособный встроиться в мембрану красных клеток крови. Так как отрицательный резус — рецессивный признак, а возможных аллеля всего два, то резус-отрицательных людей намного меньше: около 15% европейцев, 1% азиатов и 7% африканцев. С группами крови AB0 должно бы быть то же самое, ведь первая группа крови — подавляемый признак, однако же сам аллель первой группы встречается намного чаще, причем люди со второй и третьей группами могут быть «носителями» первой — то есть, наследование групп AB0 несколько сложнее за счет наличия целых трех возможных вариантов гена, хоть и механизм такой же, как и в случае наследования резус-фактора [22], [23].
Другие группы крови
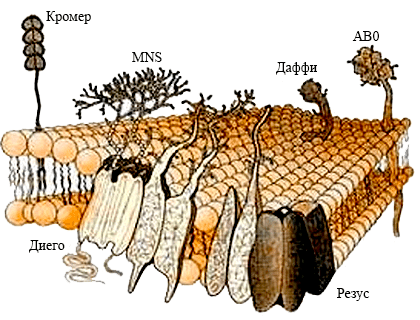
Рисунок 12. Антигены разных систем групп крови в мембране. Чаще всего антигены разных групповых систем наследуются независимо друг от друга, и существует множество их комбинаций, которые иногда приходится учитывать при переливаниях крови. Каждый из этих антигенов имеет свое собственное строение — это могут быть белки, углеводы, липопротеины и гликопротеины.
Системы антигенов АВ0 и резус являются для трансфузиологии и трансплантологии важнейшими, но далеко не единственными (рис. 12). Помимо этих антигенов наружная мембрана эритроцита, как мы уже сказали, несет на себе огромное число других антигенов (более 300!), причем набор таких молекул у разных людей различен ввиду большого генетического разнообразия человеческой популяции — именно поэтому их и используют, как «молекулярные отпечатки пальцев». Всего международным обществом трансфузиологии (International Society of Blood Transfusion, ISBT) утверждено 36 систем групп крови, несовпадение некоторых из которых у донора и реципиента также может вызвать нежелательные реакции. Обычно такие реакции случаются при повторных переливаниях несовместимой по этим системам крови или если раньше были несовместимые беременности. Выработка антител на отсутствующие у него антигены — это общебиологическое свойство иммунитета человека, характерное и для других животных. Поэтому в трансфузиологии, особенно при многократных переливаниях, учитывают сегодня и менее известные антигены, нежели АВ0 и резус, — Келл, Кидд, Даффи, MNSs и др. Проблема лишь в том, что далеко не все они изучены [23]. В таблице на сайте ISBT указаны все эти системы и их особенности.
Впервые ученые поняли, что системы групп крови не ограничиваются лишь AB0, в 1927 году, когда уже знакомыми нам исследователями К. Ландштейнером и Ф. Левиным была открыта система MN, включающая в себя два антигена — M и N. Тогда оказалось, что системы AB0 и MN независимы, и человек может обладать любыми сочетаниями этих двух классов антигенов. Затем ученые открыли остальные антигены системы MN (их оказалось около 40 штук), кодируемые двумя очень изменчивыми генами — GYPA и GYPB, и переименовали эту групповую систему в MNSs. Из нового названия следует, что система состоит из двух пар наиболее часто встречающихся кодоминантных аллелей, обозначенных М и N (они были открыты в 1927 году) и S и s (открыты в 1947 и 1951 годах). И если аллели М и N, редко вызывающие реакции несовместимости, распределяются в популяциях с одинаковой частотой, то аллели S и s, вызывающие эти самые реакции, имеют разные частоты [24].
Келл-антигены очень хитрые: иногда они могут не выявляться при лабораторных тестах, и при этом вытворять свои «темные делишки», провоцируя гемолитическую желтуху новорожденных и реакции несовместимости. Это состояние называют фенотипом МакЛеода по фамилии первого человека, студента из Гарварда, у кого он был открыт.
С открытием еще одной малоизвестной системы групп, системы VEL, связан один интересный случай из медицинской практики.
В начале 1950-х годов у страдающей раком толстой кишки пациентки, которую в статье, описывающей этот загадочный случай, называли миссис Вел, после повторного переливания крови началась тяжелейшая реакция отторжения крови. Ученые сначала не поняли, в чем дело (ведь кровь имеет ту же группу крови и резус, что и у пациентки). В дальнейшем было установлено, что после первого переливания крови у пациентки выработались антитела против неизвестной молекулы, которую только предстояло открыть. Вызвавшее реакцию вещество никак не удавалось определить, а новую группу крови назвали Вел-отрицательной. Согласно статистике, такая группа встречается у одного человека из 5000. В 2013 году ученым из Университета Вермонта, наконец, удалось разрешить загадку 60-летней давности и идентифицировать вещество. Самым сложным в этом исследовании было то, что антитела вел-отрицательного человека при переливании ему крови вел-положительного донора вызывают реакцию отторжения лишь в самом организме пациента, а вне него их активность ничтожна. Между тем, потребность в методике, позволяющей выявлять вел-отрицательных реципиентов и вел-отрицательных доноров до того, как дело дошло до тяжелых гемотрансфузионных осложнений, весьма велика. Работать с ними в лаборатории чрезвычайно трудно, поэтому ученые прибегли к методам биоинформатики. Выяснилось, что загадочным веществом, вызывающим отторжение крови, является белок SMIM1. Результат стал неожиданностью для исследователей: «Этот белок оказался самым простым из всех, какие только можно себе представить. И он почти целиком погружен в мембрану, так что наружу выглядывает лишь кончик молекулы. Тут мы имеем дело с эффектом бабочки: сущая, казалось бы, мелочь может вызвать весьма серьезные последствия». Вскоре французско-американская группа ученых разработала два экспресс-теста, способных за считанные часы выявлять вел-отрицательную кровь на основе анализа ДНК. А значит, вскоре донорскую кровь вел-отрицательной группы будут выявлять непосредственно при сдаче и сразу же маркировать. Тогда в случае необходимости она будет наготове, и пациентам не придется с трепетом ждать, успеют ли биохимики найти спасительную для них порцию подходящей крови. А это довольно актуально — ведь вел-отрицательных людей всего 0,04%, и найти подходящего донора для такого человека катастрофически трудно [27].
Группы крови с точки зрения биохимика
А как устроены антигены групп крови и антитела к ним? Какие у них свойства? Давайте взглянем на все эти антигены и антитела чуть подробнее и обратим внимание на биохимическую сторону этого вопроса. Рассмотрим эти антигены мы на примере наиболее часто учитываемых при переливаниях крови систем AB0 и резус, так как они обладают наиболее выраженными свойствами, из-за чего и вызывают посттрансфузионные осложнения настолько часто.
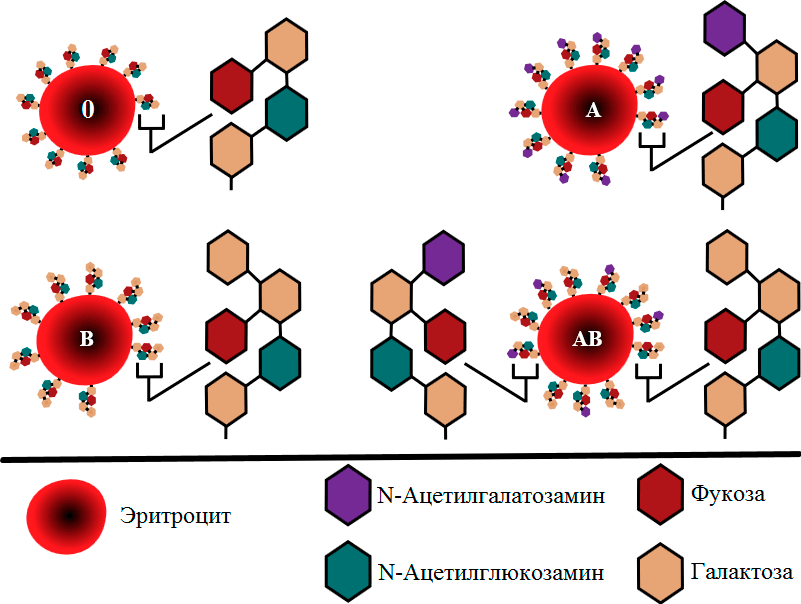
В ходе плотных исследований структуры мембраны эритроцитов, продолжающихся с середины XX века, выяснилось, что агглютиногены, антигены AB0, — это длинные цепочки углеводов, прицепленные к белкам и жирам в мембране. Их структура (рис. 13) и определяет, будут ли они связываться специфическими антителами, и если да, то какими.
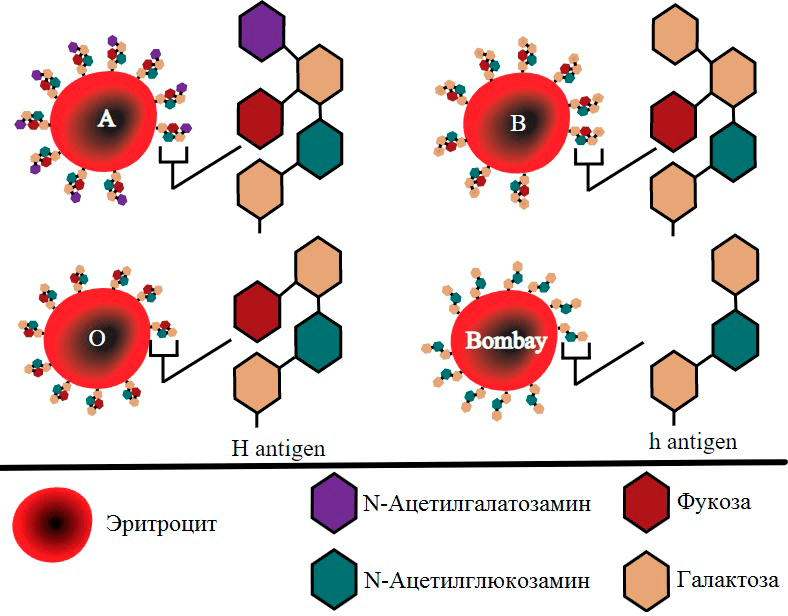
Рисунок 13. Строение антигенов групповой системы AB0. У людей I (0) группы крови на мембране эритроцитов есть только H-антигены, состоящие из самых разных сахаров. Ген A кодирует фермент, добавляющий к H-антигену N-ацетилгалактозамин, в результате чего он превращается в антиген A. Аналогичным образом ген B превращает антиген H в антиген B. Именно эти небольшие различия между антигенами A, B и H (каждый характерен только для определенной группы крови) и определяют специфичность связывания с антителами.
Антигенная дифференцировка наблюдается в большинстве тканей человека на самых ранних стадиях эмбриогенеза — антигены А и Н, например, можно найти в крови плода уже в возрасте пяти недель!
Существуют разные подвиды агглютиногенов — A1, A2, A3, B1, B2, B3 и так далее, но они различаются совсем незначительно и лишь по тому, насколько охотно агглютинируют с несовместимыми антителами, однако на эти различия можно закрыть глаза, переливая, например, человеку с антигеном A1 кровь с антигеном A2.
Оба типа антигена (и A, и B) происходят от одного-единственного предшественника — антигена H. Антиген H превращается в A и B при помощи специальных ферментов гликозилтрансфераз A и B (GTA и/или GTB, то есть glycosyltransferase A или B). Гены соответствующих гликозилтрансфераз — это те самые аллели A и B, которые отвечают за то, какой именно группы крови будет человек. Третий вариант этого гена, отвечающий за первую группу, не кодирует никаких функциональных белков.
Так вот, если у человека ген ABO кодирует белок GTA, то этот белок добавляет на конец всех Н-антигенов в мембране еще один углевод — N-ацетилгалактозамин, в результате чего получается A-антиген. Аналогично если этот ген кодирует GTB, этот фермент добавляет к H-антигенам другой углевод, галактозу, образуя B-антиген. Если же у человека нет ни аллеля A, ни аллеля B, то, ясное дело, никакие белки ничего к H-антигену не добавляют, и это значит, что у людей первой группы крови он так и остается H-антигеном. Эта небольшая разница меняет форму антигенов, из-за чего антитела могут узнавать свои антигены (рис. 13) [28], [29]. У людей же четвертой группы крови, у которых есть как вариант A, так и вариант B гена АВ0, примерно половина всех H-антигенов на мембране превращается в A, а остальные — в B.
Сам антиген H создается на мембране эритроцитов тремя другими белками, фукозил- и гликозилтрансферазами, которые последовательно включают в полисахаридную цепь некоторых гликопротеинов поверхности эритроцитов все новые и новые моносахариды. И еще одно важное замечание: после синтеза антигены A и B могут меняться путем незначительной модификации его углеводной цепи с образованием подвидов антигенов A и B (A1, A2, A3, B1, B2, B3 и др.).
Но ведь H-антиген тоже собирается определенными белками. Часто ли бывает так, что какой-то из этих белков оказывается сломан (как гликозилтрансферазы у людей первой группы крови), и H-антиген не собирается? Удивительно, но нет — естественный отбор почему-то не стремится закреплять эти мутации.
Феномен из Бомбея
Такую ситуацию, когда H-антиген синтезируется не полностью, называют бомбейским феноменом (рис. 14). У таких людей гликозилтрансферазам буквально некуда добавлять еще один сахар, превращающий H-антиген в A или B, и поэтому антигены групп крови AB0 отсутствуют на эритроцитах вне зависимости от наличия генов ферментов-модификаторов. Носители такого типа крови — универсальные доноры, а вот им самим может переливаться исключительно кровь людей с таким же феноменом (так как у них мало того, что есть антитела анти-A и анти-B, так еще у них есть антитела анти-H), иначе может возникнуть посттрансфузионный шок. А еще у «небомбейских» детей «бомбейских» матерей может развиться гемолитическая желтуха, по аналогии с резус-конфликтом. По этим двум причинам даже выделяют систему групп крови H, и важно перед переливаниями диагностировать бомбейский феномен, так как стандартные лабораторные тесты показывают «бомбейские» эритроциты как эритроциты первой группы крови. Люди с бомбейским феноменом в экстренных ситуациях рискуют получить донорскую кровь слишком поздно, так как таких людей всего 0,0004%, и иногда даже приходится завозить бомбейскую кровь из других стран.
Рисунок 14. Строение поверхностного антигена эритроцитов с бомбейским феноменом по сравнению со строением антигенов AB0. Бомбейский антиген (h) отличается от антигена H (0) отсутствием на конце фукозы и вызван мутацией гена фукозилтрансферазы, которая навешивает эту фукозу на антиген. Без этой фукозы, которую распознают ферменты синтеза антигенов A и B, невозможен дальнейший синтез антигенов AB0, и поэтому люди с такой мутацией не носят антигены A, B и H (0) даже если имеют соответствующие гены.
Открытие этого феномена было совершено в 1952 году во время исследований, связанных со случаями массовой малярии в Индии (в районе города Бомбей (Мумбаи) — отсюда и название), после того, как у трех пациентов установили отсутствие антигенов, по которым определяют принадлежность крови к той или иной группе. Есть предположение, что распространение такого феномена (а в Индии бомбейский феномен имеет уже 0,01% людей) связано с частыми близкородственными браками, разносящими рецессивную мутацию по всей популяции, которые в этой части земного шара традиционны [25].
Групповая система резус состоит из большого числа разных антигенов, самым активным из которых является Rho(D). Интересный факт: антиген Rho(D) является самым иммуногенным антигеном групп крови. Сам антиген Rho(D), как и остальные 50 резус-антигенов, является белком (а именно трансмембранным ионным каналом) и состоит из нескольких субъединиц: RhA, RhB, RhC, RhD. При определении резус-фактора доноров, кроме Rho(D) определяют наличие еще двух антигенов — rh'(C) и rh»(E). Rh– донором считаются только те, у кого отсутствуют и эти антигены, так как они хоть в менее выраженной степени, но тоже способны вызывать посттрансфузионные осложнения [31].
Антигены других групповых систем имеют совершенно разнообразное строение. Они могут быть белками, липопротеинами, углеводами и гликопротеинами. Подробнее со строением и функциями каждого конкретного типа антигена можно ознакомиться в статье Blood groups systems 2014 года [31].
Хорошо, с антигенами примерно все понятно. А что можно сказать об антителах к ним? Они по строению ничем не отличаются от обычных антител. Они, как и обычные антитела, которые синтезируются в ответ на попадание в организм чужеродных антигенов, представляют собой относительно крупные белки-иммуноглобулины (Ig). Обычные иммуноглобулины бывают пяти типов, тогда как антитела, определяющие принадлежность к той или иной группе крови (их называют агглютинины), представлены только двумя типами — либо IgM, либо IgG. Антитела IgM появляются первыми при иммунизации (например, при переливании несовместимой крови или при резус-конфликтной беременности) и нужны для обороны «здесь и сейчас». Затем вместо них или одновременно с ними начинают синтезироваться осуществляющие постоянную защиту IgG, которые отличаются тем, что из-за несколько меньших размеров могут переходить сквозь плацентарный барьер из матери в плод и вызывать резус-конфликт.
Конфликт крови матери и ребенка
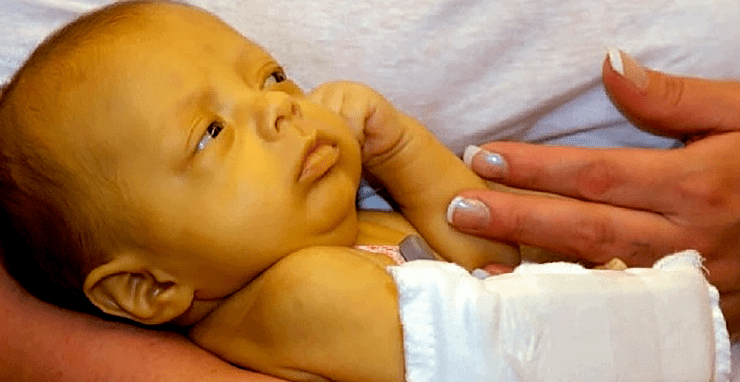
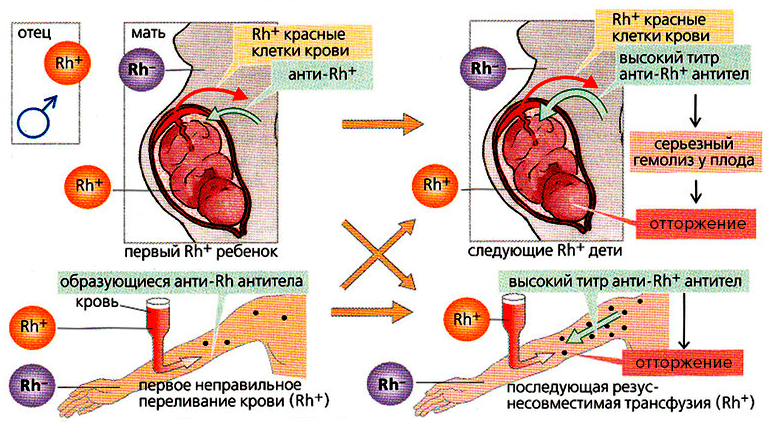
Во введении мы уже коснулись того, что в естественных условиях кровь разных людей никогда не смешивается, так что природе проблема совместимости ее групп в принципе не знакома. Кроме одного случая — резус-конфликта плода и матери. Резус-конфликтная беременность представляет собой особую проблему, с которой столкнулись еще лекари XVII века (разумеется, не понимая ни причины этого состояния, ни последствий). Нет, естественно, кровеносные системы матери и растущего в ее утробе плода разделены плацентой и ни о каком смешении крови говорить нельзя. Однако во время родов некоторое — пусть и небольшое — количество крови плода может попасть в материнскую и наоборот. Изредка такой сценарий разворачивается и при несовпадении групп матери и плода по системе АВ0. Но гораздо чаще он сопровождает конфликт по резус-фактору. Если мать резус-отрицательна, а будущий ребенок резус-положителен, материнская иммунная система распознает его резус как чужеродный антиген и начнет выработку антител к нему. Даже небольшая доза эритроцитов такого плода может стать достаточной для иммунизации матери. Ей (и, как правило, первому ребенку) это ничем не грозит, но для следующих детей может оказаться опасным, если они тоже будут резус-положительными, уже «опытный» иммунитет будет им вредить — антитела, проходя через плаценту, будут атаковать эритроциты плода. Облепленные материнскими антителами эритроциты плода начнут уничтожаться клетками уже его иммунной системы (это явление называется гемолизом), что в итоге приводит к очень неприятным последствиям, а иногда даже к смерти плода. Мало того, продукты распада эритроцитов плода остаются в организме и окрашивают его кожу в желтоватый цвет [32]. Сегодня гемолитическую желтуху новорожденных (так называется это состояние) можно предотвратить путем введения женщине в роддоме сразу же после первых (и каждых последующих) родов специального препарата, содержащего антирезус-антитела и быстро разрушающего попавшие в ее организм резус-положительные эритроциты плода (рис. 15 и 16). Тем самым предотвращается выработка антирезус-антител у матери, что спасает жизнь и здоровье ее будущих детей [33].
Рисунок 15. Ребенок с такой же желтухой, как и у загадочного пациента Филиппа Левина
Рисунок 16. Возникновение резус-конфликта. Когда резус-отрицательный человек в первый раз сталкивается с резус-антигенами (например, при переливаниях несовместимой крови или резус-конфликтной беременности), у него начинают вырабатываться анти-резус антитела. Поэтому при следующей встрече с такими антигенами начинается реакция отторжения.
Антигены и антитела групп крови выполняют, в основном, четыре биохимические функции [31]:
Помимо этого, антигены групп крови могут выполнять и другие, пока что неизвестные науке функции. Например, разнообразие групп крови порождает различия в выживаемости разных людей от сердечно-сосудистых заболеваний (механизм этого явления пока непонятен). Так, бóльшую предрасположенность к тромбозу, согласно результатам исследований 2012 года, имеют люди, у которых группа крови любая, кроме первой, — оказалось, что кровь первой группы свертывается хуже, чем кровь других групп [38].
Защита от инфекций. Почему групп крови несколько?
Ну а зачем же нам целых 36 систем групп крови, несовместимость по которым регулярно вызывает осложнения? Природе ведь не знакомы переливание крови и проблемы совместимости ее групп, поэтому кажется, что их пестрое многообразие не имеет значения для выживания и могло появиться по вине случайности. Однако недавние исследования показали, что все же у групп крови есть смысл, причем они важны не только на уровне организма, но и на уровне популяции.
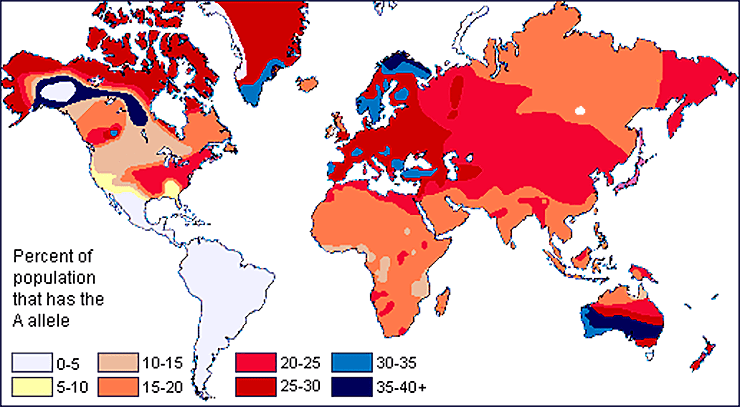
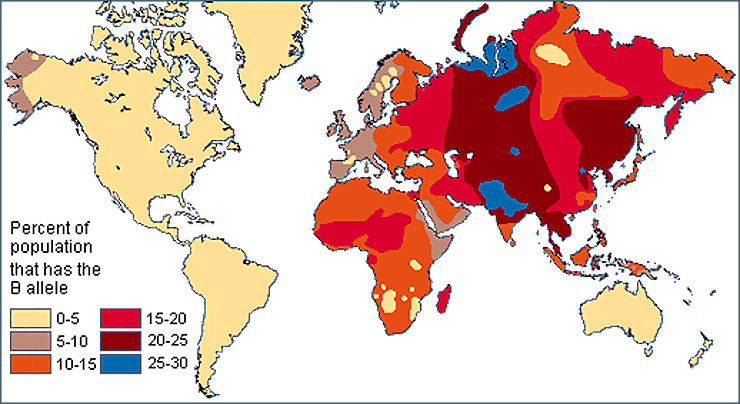
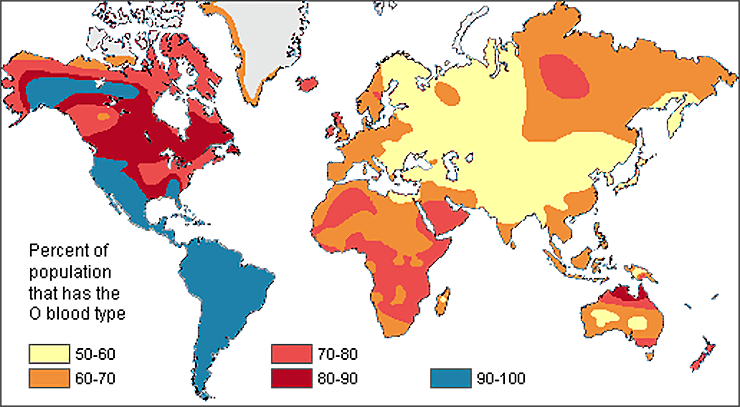
Проводимые с начала прошлого века исследования показали, что разные группы крови встречаются во всех популяциях, но неравномерно распределены по всему миру (рис. 17). Так, I группа распространена повсеместно, но особенно широко — у африканцев и южноамериканцев, а антигены A и B распространены в Европе и Азии соответственно [39]. Феномен Бомбея редок везде, но чаще встречается в Индии, где распространяется исключительно благодаря родственным бракам. Следовательно, организму невыгодно, чтобы у него не было даже H-антигена. Другие групповые системы тоже отличаются разнородным распределением по миру — так, китайцы вовсе не проводят анализы на резус-фактор при переливаниях, так как они почти все резус-положительные, зато у них трансфузионное значение имеет система MNSs, которая не учитывается, в свою очередь, в Европе [40].
Рисунок 17а. Частота встречаемости аллеля A. Разными цветами показано процентное распределение аллеля по территории планеты.
Рисунок 17б. Частота встречаемости аллеля В. Разными цветами показано процентное распределение аллеля по территории планеты.
Рисунок 17в. Частота встречаемости аллеля 0. Разными цветами показано процентное распределение аллеля по территории планеты.
Эта привязка к географии говорит о том, что существуют своеобразные изолированные популяции, которые размножаются на своей территории и тем самым закрепляют возникшие тысячи лет назад мутации, приведшие к созданию тех или иных групп крови. А такое неравномерное распределение, наверняка, имеет под собой причину, заключающуюся в разной выживаемости людей той или иной группы крови на той или иной территории.
Антигенный состав эритроцитов — это маленькая толика во всем разнообразии людей, как, например, цвет глаз или рост — нельзя найти двух одинаковых людей. Это разнообразие предопределено природой и поддерживается эволюцией — чем разнообразнее представители вида, тем сам вид более живуч. Разные люди лучше адаптированы к разным условиям, и в условиях, непригодных для одного человека, хорошо другому. То есть человечество явно что-то выигрывает благодаря тому, что групп крови несколько. Современные исследования приоткрыли завесу тайны, показав, что же именно является движущей силой эволюции групп крови.
Согласно этим исследованиям, существование нескольких групп крови, скорее всего, могло привести к следующим преимуществам: 1) повышение устойчивости популяции к различным заболеваниям; 2) регуляция взаимодействия с симбиотическими организмами, населяющими наше тело. Это подкрепляет и тот факт, что антигены AB0 чаще всего встречаются в частях организма, либо занятых симбиотическими микроорганизмами, либо считающимися «входными воротами» всех инфекций. Местонахождение этих антигенов не ограничивается одними лишь эритроцитами, и эволюционировали они сначала в других тканях организма — слюнных железах, желудочно-кишечном тракте (и там их намного больше, чем в крови), а уже потом в крови. Ведь гликопротеиды, подобные антигенам групп крови, а также антитела к ним, чрезвычайно распространены в живой природе, и поэтому человеку надо либо приспосабливаться к этой полисахаридной среде и быть в ней «своим», либо же иметь средства защиты, либо как-то это совмещать. Однако точные механизмы этого еще не ясны [41–43]. Рассмотрим концепцию на конкретных примерах.
Так, антигены групп крови могут входить в состав оболочек некоторых вирусов, бактерий (например E. coli) и простейших, которые отпочковываются от клеток в случае инфицирования. В случае вируса это является средством молекулярной мимикрии: вирус имитирует клетку крови человека и таким образом не уничтожается клетками инфицированного организма. Так поступает, например, вирус иммунодефицита человека. Отделяясь от уже зараженного Т-лимфоцита (антигены группы крови на них тоже есть) для заражения других лимфоцитов и других людей, ВИЧ размещает на своей оболочке многие антигены этого лимфоцита. Попав в кровь другого человека с такой же кровью, у вируса получается обойти нападки иммунитета и быстро заразить человека. Если же вирус попадает в кровь человека с другой группой крови, он будет с какой-то вероятностью атакован антителами нового хозяина к чужеродным антигенам на вирусе. Поэтому получается, что заразиться ВИЧ от несовместимого по группе крови человека немного тяжелее (но обольщаться не стоит — этого все же слишком мало) [44]. В общем, врожденный иммунитет во всей своей красе. Если подобная инфекция поражает популяцию, для выживания становится полезно иметь редкую группу крови, причем чем больше групповых систем в этом замешано, тем лучше. Поскольку регулярно возникают новые вирусы, «мода» на группу крови будет постоянно меняться, их разнообразие — поддерживаться, а распространенность — колебаться. Кроме того, поддерживается равновесие как в популяции организмов-хозяев, так в и популяции паразитов, и обе популяции выживают, пусть и с незначительными потерями.
Это природное «этническое оружие», которое в разных популяциях убивало людей строго определенных групп крови — тех, под которых они маскируются. Например, черная оспа в Европе до изобретения вакцин убивала в первую очередь людей со второй группой крови, что повысило количество людей с первой и третьей группами. А чума в Средневековье убивала в первую очередь людей с первой группой крови. Поэтому людям в ходе эпидемий выгоднее иметь антигены, с которыми патогенным микроорганизмам сложнее «работать», чтобы понизить вероятность заразиться или же хоть немного облегчить течение болезни.
Теперь, зная это, можно легко сказать, зачем организм отторгает кровь несовместимой группы. Переливание такой крови для организма равноценно инфекции такого «замаскированного» микроорганизма, и, пытаясь этот микроорганизм истребить, иммунитет запускает посттрансфузионную реакцию.
Но это далеко не единственный механизм, защищающий популяцию от инфекций.
Частным случаем селекции групп крови в природе под влиянием болезней является малярия. Дело в том, что это болезнь, в которой самым непосредственным образом участвуют эритроциты, на чьей поверхности и находятся те самые антигены, — логично, что они принимают непосредственное участие в инфекции. Так антигены Даффи (а их всего шесть типов) участвуют в инфекциях Plasmodium vivax, который вызывает одну из форм малярии. Мутации гена FY, приводящие к формированию эритроцитов без антигенов Даффи, защищают от заражения этим штаммом плазмодия, так как плазмодию буквально не за что зацепиться, чтобы инфицировать клетку [45]. Еще одна система групп крови, система Кнопса, которая имеет девять типов антигенов, аналогичным образом играет роль в тяжести инфекции P. falciparum, возбудителя самой опасной и распространенной в тропиках малярии [46]. Тяжесть малярии P. falciparum напрямую связана и с наличием антигенов А и В: люди I группы крови, у которых этих антигенов нет, как правило, менее подвержены малярии. Это — основной фактор, обусловливающий распределение населения с I группой крови в тех уголках мира, где распространена малярия. Корреляция между тяжестью малярии и группой крови вызвана тем, что малярийный паразит, заражая человека, «цепляется» за определенные антигены эритроцитов, в результате чего проникает внутрь и начинает их пожирать (из-за этого болезнь и прогрессирует). Мало того, эти антигены могут под действием веществ паразитов помогать «слеплять» эритроциты, и плазмодию тогда становится очень легко перебраться из одного эритроцита в другой. Соответственно, если этих антигенов нет, то плазмодию становится тяжко (банально не за что «ухватиться», чтобы проникнуть в эритроцит), и болезнь протекает не так активно, как могла бы [47].
Такой же механизм селекции групп крови можно проследить и на примере, относящемся к бактерии Helicobacter pylori. Эта бактерия в первую очередь вызывает такие очень распространенные желудочные болезни, как гастрит и язва. Хеликобактер лучше связывается с H-антигеном (антигеном 0 (I) группы крови), чем с антигенами A и B, в связи с чем люди с первой группой крови более подвержены гастродуоденальным заболеваниям, чем все остальные [48]. Поэтому в регионах, где процветает H. pylori, довольно часто встречаются люди с 0 (I) группой крови. В таблице 2 указаны другие примеры корреляции групп крови и инфекций, связанные с разным сродством их возбудителей к антигенам AB0.
| Микроорганизмы | Группы крови | Патологические эффекты |
|---|---|---|
| Хеликобактер | 0 | Язва желудка, гастрит |
| Кишечная палочка | B | Кишечные инфекции |
| Холерный вибрион | 0 | Холера |
| Сальмонелла | B | Брюшной тиф |
| Пневмококк | A, 0 | Пневмония |
| Вирус гриппа A | 0 | Грипп |
| Микобактерии туберкулеза | 0 | Туберкулез |
| Чумная палочка | 0 | Бубонная чума |
| Вирус оспы | A | Черная оспа |
От группы крови, таким образом, зависит, в частности, вероятность развития некоторых инфекционных (и неинфекционных) заболеваний, характер течения заболевания (острое или хроническое), распространенность патологического процесса, возраст, в котором вероятнее всего разовьется неинфекционная патология и результаты лечения.
Новые исследования, в том числе связанные с новыми методами «-омик» [59], могут помочь еще лучше понять взаимосвязь этих антигенов с микроорганизмами и средой, способствовать нашему пониманию эволюции, которая создала и поддерживает высокую изменчивость групп крови у людей. Совершенствуется постоянно и система донорства крови, призванная избавиться абсолютно от всех рисков при трансфузии. О том, что мы имеем сейчас и куда стремимся в этой области, мы и посвятим последнюю главу статьи.
Современная трансфузиология
Область знаний, история которой началась более века назад с хаотичных разовых опытов гениального Карла Ландштейнера, сегодня является серьезной наукой, охватывающей широкий круг проблем — от обеспечения безопасности трансфузий до выяснения тонких молекулярных механизмов регуляции экспрессии генов. В своей статье 1900 года Ландштейнер написал, что его наблюдение «возможно, пригодится человечеству». Теперь уже ясно, что именно так и произошло. Появилась высокоразвитая система донорства крови, благодаря которой врачи спасают жизни тысяч пациентов.
Одним из основных направлений современной трансфузиологии является стимулирование увеличения количества донаций, чтобы в банках крови было больше разнообразной крови, подходящей разным людям. Чтобы стимулировать увеличение количества донаций, в Советском Союзе учредили звание «Почетный донор СССР» для людей, сдавших больше 20 литров крови, а когда Союз распался, появилось звание «Почетный донор России», обладателям которого полагаются ежегодные выплаты, оплачиваемый отпуск, внеочередное лечение и другие приятные бонусы.
Вторым основным направлением является минимизация рисков нежелательных посттрансфузионных осложнений. Сегодня для этого созданы особые критерии, по которым «отбираются» доноры крови. С ними можно ознакомиться на сайте российской «Службы крови», созданной в 2007 году. Однако это не дает стопроцентной гарантии безопасности, и это направление остается одним из передовых.
Несовместимость крови по разным групповым системам, открытым Ландштейнером, его коллегами и последователями, вызывает самые разные осложнения. Сейчас именно эти реакции служат основным стимулом к развитию трансфузиологии.
Сегодня понятия «универсальный донор» и «универсальный реципиент» уже устарели, и по современной доктрине переливать иногруппную кровь уже запрещено во избежание осложнений — переливания между людьми разных групп крови допустимы лишь в безвыходных ситуациях, но и то в разумных пределах (не более 500 мл).
Идеальным вариантом избежать эти осложнения считается консервирование своей собственной крови — эта стратегия называется аутодонорством. Хотя это сложно в финансовом плане, это идеально, например, в военных условиях в горячих точках — солдаты могут заготавливать в холодильниках свою собственную кровь на случай ранений, и если ранение все же случилось, то такую кровь сразу же можно использовать.
Уже сейчас выяснилось, что в классификацию посттрансфузионных осложнений входит не только гемолиз, вызванный несовпадением групп крови, но и, например, несовместимость антигенов тромбоцитов, лейкоцитов и гранулоцитов и антител к ним. В том числе поэтому до переливания крови от тромбоцитов, лейкоцитов и гранулоцитов чаще всего избавляются при помощи специальных фильтров, и переливают кровь по компонентам. Кроме того, переливание не цельной крови, а ее компонентов по отдельности, помогает удовлетворить потребности сразу нескольких пациентов — кому-то нужны эритроциты, кому-то — тромбоциты, а кому-то — плазма.
Пока что неизвестен точный механизм почти всех посттрансфузионных реакций, и на современном этапе эти механизмы выясняются, чтобы обходить подобные реакции. Все эти и другие возможные посттрансфузионные реакции отражены в таблице 3.
Подробнее о механизме возникновения аллергических реакций и борьбе ученых с ними читайте в статье «Как победить аллергию за четыре инъекции?» на «Биомолекуле» [62].
Подробнее о механизме, по которому осуществляются иммунные реакции с участием лимфоцитов, а также о биологическом смысле HLA читайте в статье «Иммунитет: борьба с чужими и. своими» на «Биомолекуле» [63].
Гемолиз на пальцах
Сегодня в медицинской практике чаще всего встречаются гемолитические реакции на переливания крови. Давайте на примере эритроцитов рассмотрим, каков механизм таких реакций. Надо заметить, что подобные случаи происходят и при несовместимости с кровью реципиента антигенов тромбоцитов и гранулоцитов.
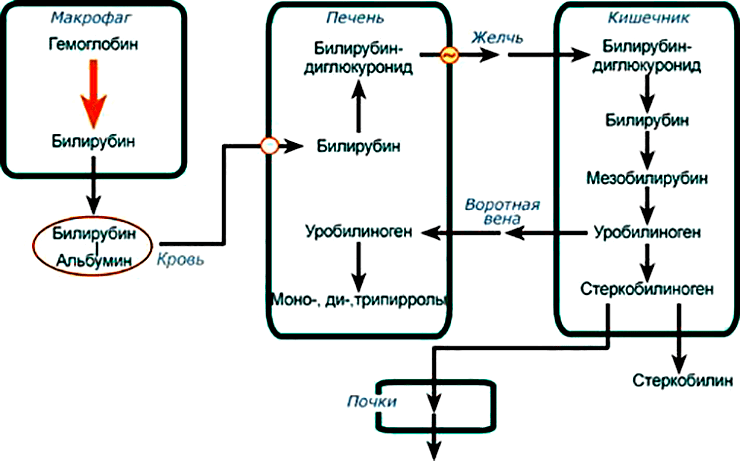
Реакция начинается с того, что антитела узнают несовместимые антигены и «облепляют» их, сгоняя в кучу. Затем с этими комками связывается специальный белок пропердин и запускает реакцию разложения и выведения эритроцитов с мочой, из-за чего и наступает анемия. Гемолиз может происходить как прямо в сосудах и называться внутрисосудистым, так и в печени под действием макрофагов, поедающих красные клетки крови и называться внесосудистым. При внутрисосудистом гемолизе продукты распада компонентов эритроцитов, в частности билирубин (то, во что превращается гемоглобин), накапливаются во всех тканях организма, окрашивая их в характерный желтоватый цвет. Именно поэтому гемолитическая болезнь проявляется желтухой. При внесосудистом же гемолизе билирубин обрабатывается печенью, и поэтому желтуха возникает редко (рис. 18) [25].
Рисунок 18. Гемолитическая реакция на переливание несовместимой крови. В макрофагах, которые уничтожают слепленные антителами эритроциты, происходит расщепление их составляющих, в том числе гемоглобина. Гемоглобин превращается в билирубин, который затем связывается с транспортными белками плазмы крови и переносится в печень. В дальнейшем билирубин превращается в другие вещества, которые легко вывести с мочой или калом. Часто, однако, билирубин не проходит все эти стадии и накапливается в тканях организма, окрашивая их в желтоватый цвет.
Помимо тщательного подбора крови или аутодонорства, возможен и другой способ достижения безопасности трансфузии — использование кровезамещающих веществ, которые совместимы с кровью любого реципиента, при этом стабильны и безропотно выполняют свои функции.
Такой препарат особо нужен пациентам, нуждающимся в постоянных переливаниях крови. Например, больные талассемией, нарушением структуры и транспортной функции гемоглобина, получают в год в среднем 14,5 л крови, то есть за жизнь такому человеку нужно перелить около тонны чужой крови! Таким количеством крови обеспечить всех больных талассемией очень трудно, да и от рисков никто не застрахован, поэтому они нуждаются в заменителе крови [54].
Первым в истории кровезамещающим веществом стал физраствор, который имеет такую же, как у крови, концентрацию хлорида натрия, что позволяет избежать потери организмом жидкости и полного скукоживания эритроцитов. Однако физраствор плох тем, что выполняет только механические функции крови, но не транспортные. Поэтому нужен препарат получше, который может заменить не только плазму, но и клетки крови. Работы последних лет вселяют надежду на создание такого препарата.
Значительно преуспели в этом деле российские химики под руководством профессора Феликса Белоярцева. В конце 70-х годов прошлого столетия были открыты и начали активно изучаться перфторуглеродные соединения, положенные в основу нового поколения кровезаменителей с функцией переноса кислорода — эти кровезаменители в СМИ часто называют голубой кровью. Перфторуглеродные соединения, применяемые в медицине, представляют собой жидкие производные других органических соединений, в которых все атомы водорода заменены на атомы фтора. Характерной особенностью таких веществ является их аномально высокая способность обратимо связывать газы за счет наличия в таких жидкостях многочисленных крупных пустот. Препарат перфторана (рис. 19) представляет собой искусственный эритроцит (жировую каплю), внутри которого находится само соединение, которое может осуществлять газообмен, как и обычный гемоглобин. Сегодня такие кровезаменители уже используются на некоторых станциях переливания крови в России, Украине и некоторых других странах СНГ, где их хранят в замороженном виде при –17 °C [55].
Рисунок 19. Перфторан
Продолжается работа по изобретению искусственных заменителей гемоглобина, которые выведут трансфузиологию на новый уровень. Это один из наиболее вероятных путей развития этой науки — ведь необходимо уходить от избыточного донорства, так как мало того, что никто не застрахован от несовместимости антигенов донора и антител реципиента, так еще и через кровь передаются многие инфекции.
Еще одним популярным направлением является использование крови крупного рогатого скота. Перед использованием этой крови, ее надо обработать, чтобы снять с эритроцитов видовые антигены. У коров тоже есть системы групп крови, отличающиеся от человеческих, и именно их антигены необходимо ликвидировать с эритроцита. В результате останется лишь «голый» эритроцит — та же самая капля жира с гемоглобином внутри, только естественного происхождения. Создавать раствор гемоглобина без клетки нерентабельно, так как в чистом виде он токсичен, а вот использование кровезаменителей на основе гемоглобина в голых эритроцитах — это бурно развивающаяся область.
Использование кровезаменителей на основе перфторана и гемоглобина — основное направление исследований нашего, Санкт-Петербургского Института переливания крови.
Ну и последним направлением трансфузиологии является использование натуральных эритроцитов человеков, которые претерпели определенную модификацию.
Так, оказывается, можно прикрыть антигены на поверхности эритроцита с помощью полимера полиэтиленгликоля так, чтобы эритроциты стали «невидимы» для антител. Выяснилось, что это даже не нарушает никакие характеристики эритроцитов — их строение, срок жизни, способность выполнять свою транспортную функцию [30].
Недавно ученые обнаружили, модифицировали и стали культивировать в E. coli специальные ферменты, которые способны избавлять антигены на эритроцитах от сахарных остатков, определяющих II и III группы крови, «очищая» кровь до I группы — «универсальной». Эти ферменты ученые называют CAZymes (Cell Adhesive enZymes). В природе они есть у симбиотических бактерий, которые контактируют со слизистой кишечника, и для этого должны расщеплять сахара, ну очень похожие на антигены эритроцитов. Это тоже может быть полезно, когда в банке крови нет подходящей крови [53].
Начавшаяся революция в области использования стволовых клеток и генной инженерии, вероятно, создаст в будущем возможность производить универсальные (или же, используя стволовые клетки потенциального реципиента, идентичные его эритроцитам) эритроциты путем культивирования клеток-предшественников эритроцитов, у которых вырезаны гены ненужных групп крови.
Предстоит еще много исследований (а старые исследования будут усовершенствованы и в таком виде введены в практику), чтобы полностью понять структуру, функцию и взаимодействия всех этих антигенов, а также создать подходящие кровезаменители, чтобы окончательно исключить все осложнения при трансфузиях, которые хоть и редко, но встречаются. Кроме того, наука нуждается в изобретении чрезвычайно чувствительных средств диагностики инфекций, которые могут передаваться путем переливаний крови.
Заключение
Трансфузиология — это очень сложная область, тесно связанная с иммунологией, которая не ограничивается лишь слепым учетом группы крови и резус-фактора. В последние полвека произошло множество открытий, показавших, что «уровней защиты» организма от случайных переливаний очень много — тут и несколько групповых систем, и антигены других клеток крови. Уже сейчас во многих станциях переливания крови учитывается более чем две системы групп крови, что неумолимо уменьшает риск осложнений при переливаниях.
Когда люди узнали, что кровь бывает разной, они начали задумываться о биологическом смысле этого многообразия. Долгое время было непонятно, зачем природа так исхитрилась, создавая разные маркеры крови. И только недавно стало ясно — это сложный механизм иммунитета, стоящий на благо нашей защиты от самых разных болезней и. вымирания всего вида. Когда только человек стал распространяться по планете и сталкиваться со всё новыми болезнями, разнообразие групп крови под действием естественного отбора неумолимо росло, чтобы обеспечить устойчивость вида к самым разным болезням, распространенным на разных территориях. Так как появляются все новые болезни, а старые мутируют и изменяются, антигены группы крови становятся по-разному эффективными против них, и поэтому их комбинации очень изменчивы.
Открытие Ландштейнера — поистине величайшее открытие, с которого началась безопасность в медицине. Сегодня мы располагаем отличной базой и техникой для этого, можем предупреждать возможность передачи инфекций с кровью, пропагандируем безвозмездное сознательное донорство, при этом пытаемся уйти от избыточного донорства к более оптимальным стратегиям во имя исключения абсолютно всех имеющихся рисков этой процедуры, совершенствуя ту базу, которую мы уже имеем. Эта сложная система должна находить поддержку общества и государства, что ведет к большей эффективности клинической работы и к излечению многих неизлечимых болезней. Сегодня мы достигли благодаря этому в гематологии немыслимого прогресса в лечении многих болезней — талассемии, гемофилии, лимфосарком, лимфом, некоторых форм рака, которые требуют обязательной трансфузионной поддержки. А это все невозможно без ученых, которые это все осуществляют, и без сознательных людей, которые жертвуют свою кровь на доброе дело.