в чем смысл теплового баланса
Тепловое равновесие и уравнение теплового баланса
Тела, температура которых отличается, могут обмениваться тепловой энергией. То есть, между телами будет происходить теплообмен. Самостоятельно тепловая энергия переходит от более нагретых тел к менее нагретым.
Что такое теплообмен и при каких условиях он происходит
Тела, имеющие различные температуры, будут обмениваться тепловой энергией. Этот процесс называется теплообменом.
Теплообмен – процесс обмена тепловой энергией между телами, имеющими различные температуры.
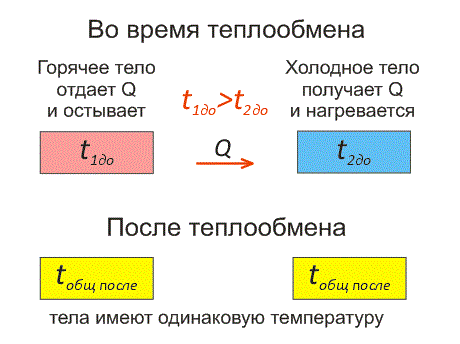
Рассмотрим два тела, имеющие различные температуры (рис. 1).
Тело, имеющее более высокую температуру, будет остывать и отдавать тепловую энергию телу, имеющему низкую температуру. А тело с низкой температурой будет получать количество теплоты и нагреваться.
На рисунке, горячее тело имеет розовый оттенок, а холодное изображено голубым цветом.
Когда температуры тел выравниваются, теплообмен прекращается.
Чтобы теплообмен происходил, нужно, чтобы тела имели различные температуры.
Когда температура тел выравняется, теплообмен прекратится.
Тепловое равновесие — это состояние, при котором тела имеют одинаковую температуру.
Уравнение теплового баланса и сохранение тепловой энергии
Когда тело остывает, оно отдает тепловую энергию (теплоту). Утерянное количество теплоты Q имеет знак «минус».
А когда тело нагревается – оно получает тепловую энергию. Приобретенное количество теплоты Q имеет знак «плюс».
Эти факты отражены на рисунке 2.
Закон сохранения тепловой энергии: Количество теплоты, отданное горячим телом равно количеству теплоты, полученному холодным телом.
Примечание: Существует и другая формулировка закона сохранения энергии: Энергия не появляется сама собой и не исчезает бесследно. Она переходит из одного вида в другой.
Уравнение теплового баланса
Тот факт, что тепловая энергия сохраняется, можно записать с помощью математики в виде уравнения. Такую запись называют уравнением теплового баланса.
Запишем уравнение теплового баланса для двух тел, обменивающихся тепловой энергией:
\(\large Q_<\text<остывания горяч>> \left( \text <Дж>\right) \) – это количество теплоты горячее тело теряет.
\(\large Q_<\text<нагревания холод>> \left( \text <Дж>\right) \) – это количество теплоты холодное тело получает.
В левой части уравнения складываем количество теплоты каждого из тел, участвующих в теплообмене.
Записываем ноль в правой части уравнения, когда теплообмен с окружающей средой отсутствует. То есть, теплообмен происходит только между рассматриваемыми телами.
В некоторых учебниках применяют сокращения:
Примечание: Складывая два числа мы получим ноль, когда эти числа будут:
Если несколько тел участвуют в процессе теплообмена
Иногда в процессе теплообмена участвуют несколько тел. Тогда, для каждого тела нужно записать формулу количества теплоты Q. А потом все количества теплоты подставить в уравнение для теплового баланса:
\[\large \boxed < Q_<1>+ Q_ <2>+ Q_ <3>+ \ldots + Q_
Пример расчетов для теплообмена между холодным и горячим телом
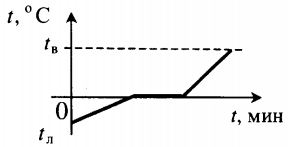
К горячей воде, массой 200 грамм, имеющей температуру +80 градусов Цельсия, добавили холодную воду, в количестве 100 грамм при температуре +15 градусов Цельсия. Какую температуру будет иметь смесь после установления теплового равновесия? Считать, что окружающая среда в теплообмене не участвует.
Примечание: Здесь мы рассматриваем упрощенную задачу, для того, чтобы облегчить понимание закона сохранения энергии. Мы не учитываем в этой задаче, что вода содержится в емкости. И часть тепловой энергии будет затрачиваться на то, чтобы изменить температуру емкости.
При решении других задач обязательно учитывайте, что емкость, в которой будет содержаться вещество, имеет массу. И часть тепловой энергии будет затрачиваться на то, чтобы изменить температуру емкости.
Решение:
В условии сказано, что окружающая среда в теплообмене не участвует. Поэтому, будем считать рассматриваемую систему замкнутой. А в замкнутых системах выполняются законы сохранения. Например, закон сохранения энергии.
Иными словами, с сосудом и окружающим воздухом теплообмен не происходит и, все тепловая энергия, отданная горячей водой, будет получена холодной водой.
1). Запишем уравнение теплового баланса, в правой части которого можно записать ноль:
2). Теперь запишем формулу для каждого количества теплоты:
Примечания:
3). Подставим выражения для каждого Q в уравнение баланса:
4). Для удобства, заменим символы числами:
\[\large 4200 \cdot 0,2 \cdot (t_<\text<общ>> — 80 ) + 4200 \cdot 0,1 \cdot (t_<\text<общ>> — 15 ) = 0 \]
\[\large 840 \cdot (t_<\text<общ>> — 80 ) + 420 \cdot (t_<\text<общ>> — 15 ) = 0 \]
Раскрыв скобки и решив это уравнение, получим ответ:
Ответ: Температура смеси после прекращения теплообмена будет равна 58,33 градуса Цельсия.
Задача для самостоятельного решения:
В алюминиевом калориметре массой 100 грамм находится керосин массой 250 грамм при температуре +80 градусов Цельсия. В керосин поместили свинцовый шарик, массой 300 грамм. Начальная температура шарика +20 градусов Цельсия. Найдите температуру тел после установления теплового равновесия. Внешняя среда в теплообмене не участвует.
Примечание к решению: В левой части уравнения теплового баланса теперь будут находиться три слагаемых. Потому, что мы учитываем три количества теплоты:
А справа в уравнение теплового баланса запишем ноль. Так как внешняя среда в теплообмене не участвует.
В чем смысл теплового баланса
Ключевые слова конспекта: количество теплоты, уравнение теплового баланса, закон сохранения энергии в тепловых процессах.
Для механических явлений при определённых условиях выполняется закон сохранения механической энергии: полная механическая энергия системы тел сохраняется, если они взаимодействуют силами тяготения или упругости. Если действуют силы трения, то полная механическая энергия тел не сохраняется, часть её (или вся) превращается в их внутреннюю энергию.
При изменении состояния тела (системы) меняется его внутренняя энергия. Состояние тела и соответственно его внутреннюю энергию можно изменить двумя способами: в процессе теплопередачи или путём совершения внешними силами работы над телом (работа, например, силы трения). Мерой изменения внутренней энергии тела в процессе теплообмена выступает количество теплоты (Q).
Уравнение теплового баланса
Qотданное + Qполученное = 0
Записанное равенство называется уравнением теплового баланса (эта формула и уравнение, используемое в 8 классе!). Определение: суммарное количества теплоты, которое выделяется в теплоизолированной системе равно суммарному количеству теплоты, которое в этой системе поглощается.
Уравнение теплового баланса связывает количество теплоты, полученное одним телом, и количество теплоты, отданное другим телом при теплообмене. При этом в теплообмене могут участвовать не два тела, а три и более: Q1 + Q2 + Q3 + … = 0
Уравнение теплового баланса – это закон сохранения энергии для процессов теплообмена в термоизолированных системах. Оно даёт возможность определить те или иные величины. В частности, значения удельной теплоёмкости веществ определяют из уравнения теплового баланса.
◊◊◊ Обратите внимание! В более старших классах используется следующее определение «уравнения теплового баланса»: Если в изолированной системе тел не происходит никаких превращений энергии кроме теплообмена, то количество теплоты, отданное телами, внутренняя энергия которых уменьшается, равно количеству теплоты, полученному телами, внутренняя энергия которых увеличивается. При этом суммарная энергия системы не изменяется«. А также используется другая формула уравнения (с учетом интегральной формы Первого начала термодинамики):
Закон сохранения энергии в тепловых процессах
Закон сохранения энергии в тепловых процессах выполняется при нагревании тел за счёт энергии, выделяющейся при сгорании топлива. Топливо — это природный газ, дрова, уголь, нефть. При его сгорании происходит химическая реакция окисления — атомы углерода соединяются с атомами кислорода, содержащимися в воздухе, и образуется молекула оксида углерода (углекислого газа) С02. При этом выделяется энергия.
При сгорании различного топлива одинаковой массы выделяется разное количество теплоты. Например, хорошо известно, что природный газ является энергетически более выгодным топливом, чем дрова. Это значит, что для получения одного и того же количества теплоты, масса дров, которые нужно сжечь, должна быть существенно больше массы природного газа. Следовательно, различные виды топлива с энергетической точки зрения характеризуются величиной, называемой удельной теплотой сгорания топлива.
Конспект урока «Уравнение теплового баланса».
Уравнение теплового баланса
Теплообмен в системе — в чем смысл в физике
Все тела в замкнутой системе «взаимодействуют» друг с другом путем отдачи либо получения энергии. При этом начальная температура каждого из них меняется: более горячие отдают «градусы» менее нагретым, и наоборот: холодные нагреваются до средней по системе температуры.
Такая теплопередача может осуществляться как непосредственно от тела к телу, так и путем перегородок, заключенных внутрь системы. Говоря языком физики, устанавливается термодинамическое равновесие.
Теплообмен (теплопередача) — определенный физический процесс, при котором тепловая энергия переходит от тела, имеющего более высокую температуру, к телу, менее нагретому.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Он протекает до тех пор, пока в системе установится термодинамическое равновесие.
Термодинамическое равновесие — состояние замкнутой системы тел с неизменными параметрами: температурой, давлением, объемом, энтропией.
На основании закона сохранения энергии получается, что для замкнутой системы та теплота, которая теряется телами, более нагретыми, равна тому количеству, которое приобретают менее холодные.
Когда в результате такого обмена теплом внутренняя энергия нагревающегося тела (и, соответственно, его температура) меняется, имеет значение еще один параметр. Это теплоемкость вещества. Она показывает, сколько нужно энергии, чтобы нагреть 1 кг вещества на 1 Кулон. Рассчитать можно по формуле:
\(Q=c\times m\times(t2-t1)=c\times m\times\Delta t\)
Единицы измерения температуры в данной формуле не имеют значения, поскольку выражение затрагивает разницу градусов.
Из математического выражения видно, если температура второго тела (t2) выше первого, то Q положительное. Если t2 меньше, чем t1, то количество теплоты отрицательно, следовательно, тепло отдается.
Способность тела передавать либо принимать энергию (тепло) определяется удельной теплоемкостью вещества, из которого оно изготовлено. Если эту величину умножить на конкретную массу тела, то получится высчитать теплоемкость тела. Для этого существует формула:
Зная теплоемкость тела, можно рассчитать получаемое либо отдаваемое количество теплоты, если тело войдет в замкнутую систему. Формула имеет следующий вид:
Нельзя путать эти два обозначения: буква с — удельная теплоемкость, С — теплоемоксть.
Уравнение теплового баланса
Когда система тел замкнута, никакого движения энергии, кроме обмена между участниками, не происходит. При этом то тепло, которое одни тела отдают, равняется тому, которые получают более холодные. Теплообмен перестает происходить на том этапе, когда температуры участников изолированной системы уравниваются, т.е. наступает термодинамическое равновесие. Это есть пояснение уравнения теплового баланса, математическая запись которого имеет следующий вид:
Для замкнутой системы сумма модулей количества теплоты, которые отдаются одними телами и сумма модулей количества теплоты, которые получаются другими, являющимися полноправными участниками теплообмена, равна 0.
Поскольку в формуле заложены значения параметров по модулю, всегда из большего вычитается меньшее. Вид уравнения, записанного без модулей, подразумевает вычитание из конечной температуры первичной.
Примеры решения задач
Использование уравнения теплового баланса необходимо при решении задач как для тел, поглощающих тепло (нагревание, парообразование, плавление), так и отдающих его другим телам замкнутой системы (кристаллизация, конденсация, сгорание топлива, охлаждение).
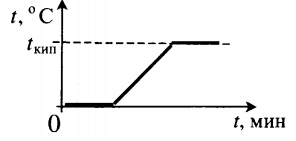
Какую минимальную массу льда нужно положить в калориметр с 0,5 кг воды с температурой 20°C, чтобы охладить ее до 0°C?
Известно, что удельная теплоемкость воды равна 4200 Дж/кг×оС, =3,3×10 5 Дж⁄кг.
Принимается условие, что система тел, о которой идет речь, замкнутая.
Исходя из уравнения теплового баланса,
То тепло, которое отдает вода, можно измерить по формуле:
Лед, плавясь от нагревания, получает следующее количество теплоты:
\(Q_л=\lambda_ л\times m_л\)
Зная, что сумма этих двух выражений равна нулю, получаем формулу для нахождения искомого значение:
\(\lambda _л\times m_л=-c\times m_в\times(t_<2в>-t_<1в>)\)
\(\lambda_л\times m_л=c\times m_в\times(t_<1в>-t_<2в>)\)
Подставив в формулу значения, получаем ответ.
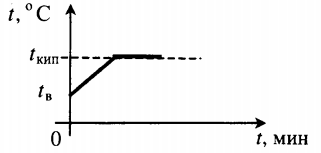
В стакан с водой при температуре 20°C, заполненный на одну четверть объема, долили три четверти кипятка. Какая температура воды стала, если условно рассматривать систему замкнутой, т.е. тепловое излучение, идущее на нагревание стекла не учитывать.
В основе решения лежит уравнение теплового баланса:
Объем горячей воды по условии равен три четверти стакана, холодной — одна четверть. Зная ρ воды, по формуле можно найти соответствующую массу:
Теперь, используя формулы теплового равновесия, выводим конечную формулу для решения задачи:
\(1/4\times V\times\rho\times c\times(t_2\times c\times m-t_1\times x)=3/4V\times\rho\times c_в\times(t_<1г>-t_2\times c\times m)\)
Обработав формулу математически, выводится следующее отношение:
\(4t_<2cm>=3t_<1г>+t_<1x>\)
Подставляя имеющиеся значения, легко находится искомая величина.
Тепловой баланс
Полезное
Смотреть что такое «Тепловой баланс» в других словарях:
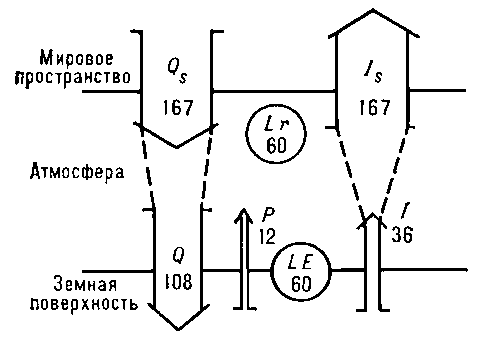
ТЕПЛОВОЙ БАЛАНС — земной поверхности алгебраическая сумма потоков тепла, приходящих на земную поверхность и уходящих от нее. Выражается уравнением : R + P + LE + B=0, где R радиационный баланс земной поверхности; P турбулентный поток тепла между земной… … Экологический словарь
ТЕПЛОВОЙ БАЛАНС — сопоставление прихода и расхода тепловой энергии при анализе тепловых процессов. Составляется как при изучении природных процессов (тепловой баланс атмосферы, океана, земной поверхности и Земли в целом и др.), так и в технике в различных тепловых … Большой Энциклопедический словарь
ТЕПЛОВОЙ БАЛАНС — ТЕПЛОВОЙ БАЛАНС, баланс между теплом, полученным земной атмосферой от солнца, и теплом, возвращаемым назад в космос. Около двух третей солнечного изучения поглощается облаками, атмосферой и поверхностью Земли и, примерно одна треть, отражается, в … Научно-технический энциклопедический словарь
ТЕПЛОВОЙ БАЛАНС — сопоставление прихода и расхода тепловой энергии при анализе тепловых процессов … Российская энциклопедия по охране труда
ТЕПЛОВОЙ БАЛАНС — сопоставление количества тепла затраченного, полезно использованного и потерянного. Т. Б. часто составляется в процентах от затраченного тепла, тогда полезно использованное тепло численно равняется коэффициенту полезного действия. В Т. Б.… … Морской словарь
тепловой баланс — Количественная характеристика производства, потребления и потерь тепла. [ГОСТ 26691 85] Тематики теплоэнергетика в целом … Справочник технического переводчика
тепловой баланс — сопоставление прихода и расхода тепловой энергии при анализе тепловых процессов. Составляется как при изучении природных процессов (тепловой баланс атмосферы, океана, земной поверхности и Земли в целом и др.), так и в технике в различных тепловых … Энциклопедический словарь
тепловой баланс — [heat balance] количественное равенство прихода и расхода теплоты в каком либо тепловом процессе. В основе уравнений теплового баланса любого металлургического агрегата лежит закон сохранения энергии, согласно которому количество теплоты,… … Энциклопедический словарь по металлургии
тепловой баланс — rus тепловой баланс (м) eng thermal balance, heat balance fra bilan (m) thermique, bilan (m) calorifique deu Wärmebilanz (f) spa balance (m) térmico, equilibrio (m) térmico … Безопасность и гигиена труда. Перевод на английский, французский, немецкий, испанский языки
тепловой баланс — šilumos balansas statusas T sritis fizika atitikmenys: angl. heat balance; thermal balance vok. Wärmebilanz, f rus. тепловой баланс, m pranc. bilan calorifique, m; bilan thermique, m … Fizikos terminų žodynas
Фазовые переходы и уравнение теплового баланса
теория по физике 🧲 термодинамика
Фазовые переходы — это термодинамические процессы, приводящие к изменению агрегатного состояния вещества.
Плавление и отвердевание
Для расчета количества теплоты, необходимого для процесса плавления, следует применять формулу:
m — масса вещества, λ (Дж/кг) — удельная теплота плавления.
Плавление каждого вещества происходит при определенной температуре, которую называют температурой плавления. Все проводимое тепло идет на разрушение кристаллической решетки, при этом увеличивается потенциальная энергия молекул. Кинетическая энергия остается без изменения и температура в процессе плавления не изменяется.
Удельная теплота плавления показывает, какое количество теплоты необходимо сообщить 1 кг данного вещества, чтобы перевести его из твердого состояния в жидкое при условии, что оно уже нагрето до температуры плавления. В процессе отвердевания 1 кг данной жидкости, охлажденной до температуры отвердевания, выделится такое же количество теплоты.
Внимание! Удельная теплота плавления — табличная величина.
Определение Отвердевание, или кристаллизация — переход состояния из жидкого состояния в твердое (это процесс, обратный плавлению).
Отвердевание происходит при той же температуре, что и плавление. В процессе отвердевания температура также не изменяется. Количество теплоты, выделяемое в процессе отвердевания:
Парообразование и конденсация
Количество теплоты, необходимое для процесса кипения, вычисляют по формуле:
m — масса вещества, r (Дж/кг) — удельная теплота парообразования.
Парообразование происходит при определенной температуре, которую называют температурой кипения. В отличие от испарения, процесс парообразования идет со всего объема жидкости. Несмотря на то, что к кипящему веществу подводят тепло, температура не изменяется. Все затраты энергии идут на увеличение промежутком между молекулами. Температура кипения зависит от рода вещества и внешнего атмосферного давления.
Удельная теплота парообразования показывает, какое количество теплоты необходимо затратить, чтобы перевести в пар 1 кг жидкости, нагретой до температуры кипения. Такое же количество теплоты выделится в процессе конденсации 1 кг пара, охлажденного до температуры конденсации.
Внимание! Удельная теплота парообразования — табличная величина.
Определение Конденсация — процесс, обратный кипению. Это переход вещества из газообразного состояния в жидкое.
Конденсация происходит при температуре кипения, которая также не изменяется во время всего процесса. Количество теплоты, выделяемое в процессе конденсации:
Тепловые процессы при нагревании и охлаждении
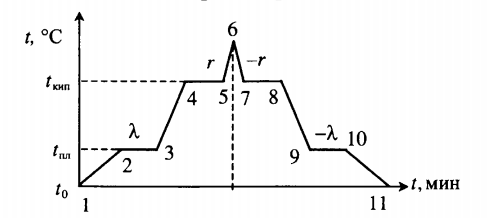
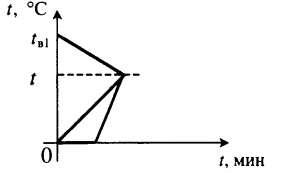
Все фазовые переходы, а также процессы нагревания и остывания вещества можно отобразить графически. Посмотрите на график фазовых переходов вещества:
Он показывает зависимость температуры вещества от времени в процессе его нагревания и остывания. Опишем процессы, отображаемые на графике, в таблице.





 Уравнение теплового баланса:
Уравнение теплового баланса: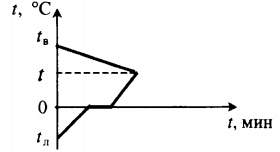 Уравнение теплового баланса:
Уравнение теплового баланса: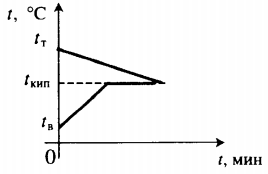 Уравнение теплового баланса:
Уравнение теплового баланса: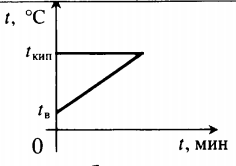 Уравнение теплового баланса:
Уравнение теплового баланса: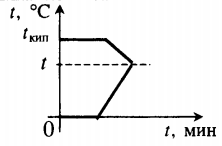 Уравнение теплового баланса:
Уравнение теплового баланса: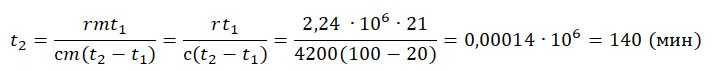
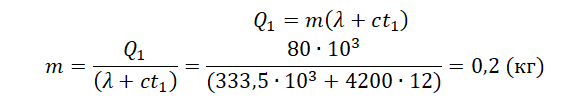
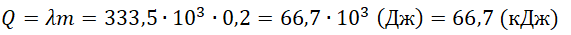
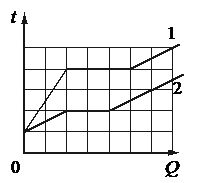 На рисунке представлены графики зависимости температуры t двух тел одинаковой массы от сообщённого им количества теплоты Q. Первоначально тела находились в твёрдом агрегатном состоянии.
На рисунке представлены графики зависимости температуры t двух тел одинаковой массы от сообщённого им количества теплоты Q. Первоначально тела находились в твёрдом агрегатном состоянии.